猪伪狂犬病基因缺失灭活疫苗(JS-2012-△gI/gE株)的制备及免疫效力评价
2016-03-03李国新曹艳云武吉强郑旭晨单同领童光志
童 武,李国新,郑 浩,刘 飞,梁 超,李 林,田 青,曹艳云,武吉强,王 涛,郑旭晨,单同领,童光志
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
·研究论文·
猪伪狂犬病基因缺失灭活疫苗(JS-2012-△gI/gE株)的制备及免疫效力评价
童 武1,2,李国新1,2,郑 浩1,2,刘 飞1,梁 超1,李 林1,田 青1,曹艳云1,武吉强1,王 涛1,郑旭晨1,单同领1,2,童光志1,2
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
本研究将猪伪狂犬病毒双基因缺失毒株(JS-2012-△gI/gE株)用0.15%的甲醛灭活后,与赛彼科公司 MONTANIDE ISA 201VG 佐剂进行乳化,制备成猪伪狂犬病灭活疫苗。为了评价灭活疫苗的免疫效力,15头14日龄的健康仔猪(猪伪狂犬病毒、猪繁殖与呼吸综合征病毒、猪瘟病毒和猪圆环病毒Ⅱ型抗原和抗体均为阴性)随机分成3组,每组5头。第一组猪颈部肌肉接种猪伪狂犬病灭活疫苗 (JS-2012-△gI/gE株)每头2 mL,接种后28 d,第一组和第二组同样方式同等剂量接种猪伪狂犬病灭活疫苗(JS-2012-△gI/gE株),第三组猪作为对照。第二次免疫后d 28,三组实验猪均滴鼻接种PRV JS-2012第5代强毒,每头105.0TCID50/2 mL。攻毒后0~14 d,每日测量体温并记录临床症状。通过抗体检测和保护效率来评价猪伪狂犬病灭活疫苗 (JS-2012-△gI/gE株)免疫效力。结果表明,两次免疫(第一组)PRV gB 抗体水平明显高于一次免疫(第二组),两次免疫提供了更好的保护效力。
伪狂犬病毒;灭活疫苗;制备;效力评价
猪伪狂犬病是由伪狂犬病毒(Pseudorabies virus,PRV)引起的高死亡率的急性传染病,该病以发热、奇痒、脑脊髓炎为主要特征[1]。PRV属于疱疹病毒科、α疱疹病毒亚科、水痘病毒属,其基因组为线状双链DNA,长约150 kb,由长独特区(unique long region,UL)、短独特区(unique short region,US)及US两侧的内部重复序列与末端重复序列组成,编码70多种蛋白[2-5]。PRV能感染多种宿主,但猪是其主要的天然宿主、贮存者和传播者。不同年龄段的猪都可感染,主要引起妊娠母猪流产、死胎、木乃伊胎,哺乳仔猪高死亡率,及种猪不育[1,6,7]。我国于20世纪40年代末在猫中首次发现PRV,60年代初在猪群中也出现了PRV流行,至今该病毒仍在我国猪群中广泛流行,严重威胁着我国猪群的健康[8],并造成了严重经济损失[9]。对猪伪狂犬病的防控与净化最有效的手段是接种基因缺失疫苗并配合血清学检测来完成[10,11]。自20世纪90年代我国使用伪狂犬病活疫苗Bartha k61株对猪伪狂犬病进行防控,使其得到了有效的控制。2011年,由伪狂犬病毒变异株引起的猪伪狂犬病在我国大面积爆发,造成母猪繁殖障碍和初生乳猪死亡,给我国养猪业造成了巨大的经济损失。童武等[7]研究表明,该变异株病毒与经典的伪狂犬病毒强毒株相比,其许多基因发生了较大的变异;且该变异株病毒对小鼠和猪的致病力较经典的伪狂犬病毒强毒株也明显增强;同时免疫保护性试验结果表明,Bartha k61疫苗已经不能有效的为免疫猪群提供保护[12-17]。目前猪伪狂犬病毒变异株已经在全国范围内流行,疫病防控形势严峻,国内很多研究学者都在研制针对伪狂犬病毒变异株的疫苗[18-23]。本实验室运用同源重组的方法成功构建出了伪狂犬病疫苗候选株JS-2012-△gI/gE,以JS-2012-△gI/gE毒株为种毒研制猪伪狂犬病灭活疫苗[24],现将猪伪狂犬病灭活疫苗(JS-2012-△gI/gE株)的制备方法及其免疫效力研究结果报告如下。
1 材料与方法
1.1 种毒、细胞、佐剂 伪狂犬病毒双基因缺失毒株(JS-2012-△gI/gE株)由中国农业科学院上海兽医研究所猪病研究室构建[24],制苗用伪狂犬病毒液(JS-2012-△gI/gE株,107.0TCID50/mL)和Vero细胞由中国农业科学院上海兽医研究所猪病研究室(本研究室)制备并保存;佐剂MONTANIDE ISA 201VG购于赛彼克(上海)特殊化学品有限公司。
1.2 实验猪、实验试剂及耗材 本实验所使用的阴性实验猪购自南京某猪场;伪狂犬病毒gB和gE抗体检测试剂盒购自IDEXX公司;动物实验所用的注射器、采血器、防护服、体温计等均购自上海基音生物科技有限公司;胎牛血清、胰酶和DMEN为Invitrogen公司产品;细胞培养耗材购自上海百赛生物科技有限公司。
1.3 病毒的灭活 将制苗用病毒液分为2组,每组分别加入终浓度为0.15%或0.2%的甲醛溶液,37℃灭活,灭活期间每隔4~6 h摇匀病毒液1次。在灭活后24 h和36 h每组各取出一部分病毒液,用于灭活检验。
1.4 灭活检验 取灭活后的病毒液,用含2%小牛血清的DMEM做50倍稀释,然后按合适的体积比用含2%小牛血清的DMEM细胞维持液稀释后,接种T150细胞培养瓶中的长成良好单层Vero细胞的T150细胞培养瓶(用前弃去培养液),置37℃、5%CO2培养箱中培养72 h,冻融1次,取上清液,按合适的体积比用含2%小牛血清的DMEM细胞维持液稀释后,按上述方法再盲传2次,观察并记录细胞病变。如无细胞病变,则病毒灭活完全。
1.5 灭活疫苗制备 先将疫苗佐剂(赛彼科公司201水包油包水佐剂)输入乳化罐中低速(80 r/min)搅拌,按照质量比再缓慢加入经无菌检验和灭活检验合格的病毒液。当温度达到31℃时,加速(330 r/ min)乳化40 min,然后把转速慢慢降到150 r/min,再把温度降到20℃以下,分装。取一部分用于性状检验,其余保存于2℃~8℃备用。
1.6 免疫效力试验 将15头14日龄猪伪狂犬病毒、猪繁殖与呼吸综合征病毒、猪瘟病毒、猪圆环病毒Ⅱ型抗原、抗体阴性的健康仔猪随机分成5组,每组3头。第一组猪接种猪伪狂犬病灭活疫苗(JS-2012-△gI/gE株)2 mL/头,免疫后28 d第一组和第二组猪接种猪伪狂犬病灭活疫苗(JS-2012-△gI/gE株)2 mL/头,第三组实验猪不做处理作为对照。待第二次免疫后28 d,3组实验猪均滴鼻接种PRV JS-2012第5代强毒2 mL,含105.0TCID50/头,并观察临床表现(体温、呼吸症状、食欲、生长状态和神经症状等)。分别在免疫后0、7、14、21、28、35、42、49、56 d,以及攻毒后1~14 d采集血液并分离血清。攻毒后14 d剖杀剩余实验猪,进行组织病理学观察。
1.7 PRV抗体检测 将攻毒前不同时间点采集的猪血清,用IDEXX公司 PRV gB和gE抗体检测试剂盒来检测针对PRV的特异性gB和gE抗体。
1.8 临床及组织病理变化观察 对攻毒试验中发病死亡或试验结束迫杀的仔猪,进行病理剖检。取脑、心脏、肝脏、脾脏、肺脏、肾脏、腹股沟淋巴结等组织进行眼观病变观察并拍照。对上述所取的各组猪的组织脏器用10%中性福尔马林固定,制作病理切片,在显微镜下观察病理变化。
2 结果
2.1 制苗用病毒液的灭活效果 对收获的病毒液(JS-2012-△gI/gE)株进行灭活,灭活效果显示,在收获的病毒液中加入终浓度为0.15%和0.2%的甲醛,作用24 h和36 h,都能使病毒完全灭活,病毒液在Vero细胞上盲传3代均未出现细胞病变。
2.2 灭活疫苗的制备及检验 将灭活后的病毒液与佐剂MONTANIDE ISA 201VG进行乳化。性状检验:外观,乳化好的灭活疫苗为均匀的淡粉红色乳剂,符合规定要求;剂型,取一清洁吸管,吸取少量疫苗滴于清洁冷水表面,呈云雾状扩散,符合规定要求;粘度,用旋转式黏度计检测,为81 cP,符合规定要求;稳定性,吸取疫苗10 mL加入离心管中,以1811×g离心15 min,无析出,符合规定要求。无菌检验,按现行《中国兽药典》进行检验,无菌生长。
2.3 临床症状 各疫苗免疫组的实验猪在接种疫苗后均无过敏反应,接种部位无炎性反应。疫苗接种后除个别仔猪出现短暂的厌食外,其余试验猪均无异常表现。攻毒后,第一组(免疫2次)实验猪有短暂的发热,无任何其他异常临床表现,保护率为100%;第二组(免疫1次),有2头猪d3开始发病,表现精神沉郁、厌食和身体持续性颤栗,其余3头实验猪有发热,但无任何其他异常临床表现,保护率为60%;第三组,在攻毒后48 h,5头实验猪体温均迅速上升到41℃以上,并表现为明显的精神沉郁、厌食、呼吸困难和神经症状,并在攻毒后的d6死亡2头仔猪,d7死亡1头仔猪,发病率为100%,死亡率为60%。详见表1、图1和图2。
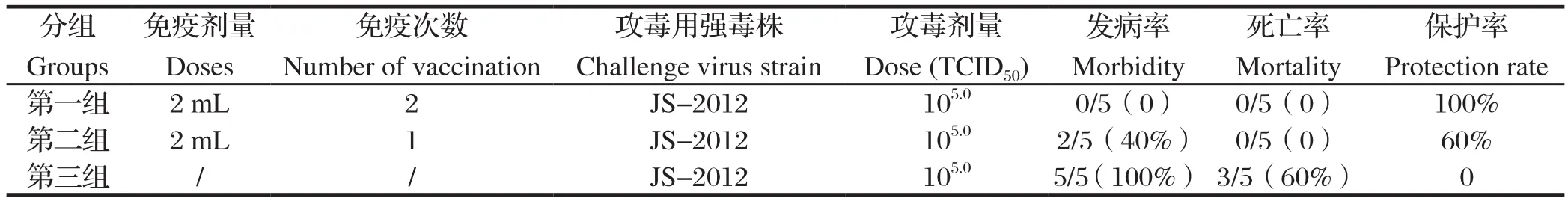
表1 猪伪狂犬病灭活疫苗(JS-2012-△gI/gE株)的免疫效果Table 1 Protective eff cacy of inactivated swine Pseudorabies vaccines (JS-2012-△gI/gE strain)
2.4 PRV的特异性抗体检测 第一组在攻毒前gB抗体均呈强阳性,S/N值均在0.05左右且离散度小;第二组在攻毒前gB抗体虽均呈阳性,但S/N值均在0.12与 0.42之间且离散度大;第三组在对应的各时间点PRV gB抗体均为阴性。各组全部试验猪PRV gE抗体在攻毒前的各个时间点均为阴性(图3)。
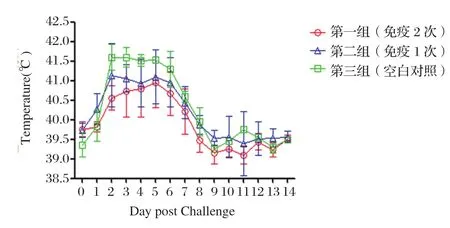
图1 攻毒后猪的体温变化Fig.1 Body temperature changes of piglets at 0-14 days post challenged with PRV JS-2012

图2 攻毒后各组猪不同时间的存活情况Fig.2 Survival of piglets at 0-14 days post challenged with PRV JS-2012
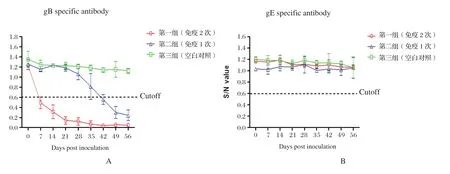
图3 免疫猪PRV特异性抗体动态变化Fig. 3 PRV specif c antibody responses in piglets of different groups after immunization
2.5 临床眼观病理变化 对本实验中攻毒后死亡或实验结束迫杀的仔猪进行解剖。取脑、心脏、肝脏、脾脏、肺脏、肾脏、腹股沟淋巴结等组织进行眼观病变观察并拍照。第一组所有实验猪的脑、心脏、肝脏、脾脏、肺脏、肾脏、腹股沟淋巴结等组织脏器均未见明显眼观病理变化。第二组,2头发病的猪脑脊液明显增多,脑膜肿胀增厚,血管扩张,并伴随少量出血;肺脏轻度气肿,并伴有出血、坏死、肉实变;腹股沟淋巴结轻微充血肿胀;脾脏边缘轻微淤血且肿大;肾脏可见少量点状出血;肝脏边缘淤血坏死。第三组,病死或最终存活的仔猪大都体型消瘦且被毛粗乱,剖检见脑脊液明显增多,脑膜肿胀且明显增厚、血管扩张,并伴随严重出血;肺脏气肿,并伴有出血,坏死,大面积肉实变;腹股沟淋巴结明显充血肿胀;脾脏边缘明显淤血且肿大;肾脏可见大量点状出血;肝脏边缘严重淤血坏死(图4)。
2.6 组织病理学观察 对攻毒后死亡或实验结束迫杀的仔猪进行解剖。每头猪取脑、心脏、肝脏、脾脏、肺脏、肾脏、腹股沟淋巴结组织,用10% 中性福尔马林固定,选取脑、肺脏、肝脏进行病理切片制作。病理切片显示,第一组实验猪脑、肺脏、肝脏、肾脏、腹股沟淋巴结、脾脏、心脏等组织均未见明显病理变化。第二组发病猪脑膜表面血管扩张、炎性细胞浸润;肺脏组织未见明显病理变化;肝细胞空泡样变性;肾脏多发性肾组织坏死,炎性细胞浸润;腹股沟淋巴结、脾脏、心脏均未见明显病理变化。第三组实验猪脑珠网膜下血管高度扩张充血、出血,脓性渗出,大脑皮层脑水肿,充血,大量炎细胞浸润;肺脏淤血水肿;肝脏淤血;肾脏肾小管上皮细胞空泡变性;腹股沟淋巴结淋巴细胞减少;脾脏淋巴细胞减少,脾脏萎缩;心脏未见明显病理变化(图5)。
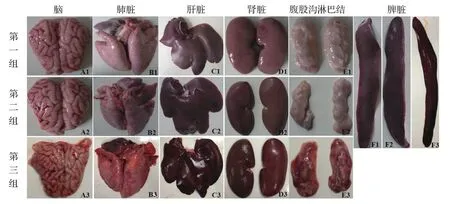
图4 免疫后攻毒猪剖解的眼观病变F i g . 4 T h e a u t o p s y l e s i o n s o f p i g l e t s a f t e r i m m u n i z a t i o n a g a i n s t p o i s o n

图5 攻毒组及空白对照组不同组织的病理切片观察(H E , 2 0 0 ×)F i g . 5 P a t h o l o g i c a l s e c t i o n o b s e r v a t i o n o f d i f f e r e n t t i s s u e s i n p i g s a f t e r c h a l l e n g e(H E , 2 0 0 ×)
3 讨论
2011年以来,由伪狂犬病毒变异株引起的猪伪狂犬病在我国大面积爆发,造成母猪繁殖障碍和初生乳猪死亡,给我国养猪业造成了巨大的经济损失。对于新出现的伪狂犬病毒变异毒株的侵袭,传统的伪狂犬病疫苗已不能提供完全的保护。
本实验室对新出现的伪狂犬病毒变异株运用同源重组的方法成功构建出了伪狂犬病疫苗候选株JS-2012-△gI/gE,并以JS-2012-△gI/gE毒株为种毒研制了猪伪狂犬病灭活。本研究主要是探讨猪伪狂犬病基因缺失灭活疫苗的制备及其免疫效力评价,结果显示,第一组免疫后能产生高水平的gB抗体,攻毒后试验猪除了短暂发热外,未见其他临床症状,且剖解眼观病变与组织病理切片显示也均良好。第二组免疫后能产生gB抗体但抗体滴度及整齐度均不佳,攻毒后有两头实验猪发病,剖解眼观病变与组织病理切片显示发病猪的组织脏器也均有病理变化。第三组攻毒后实验猪全部发病,死亡率60%,剖解眼观病变与组织病理切片显示发病猪及死亡猪的组织脏器也均有严重病理损伤。根据本研究结果,我们确定猪伪狂犬病灭活疫苗(PRV JS-2012-△gI/gE株)的免疫次数为2次,免疫间隔28 d。
猪伪狂犬病基因缺失灭活疫苗具备常规灭活疫苗的安全性,不会存在散毒及毒力返强的风险,且该灭活疫苗具有很好的免疫原性,同时该灭活疫苗缺失的gE基因能够作为分子标记来区分疫苗接种动物与野毒感染动物。本研究将为伪狂犬病毒变异株的防控及净化提供理论基础和科学依据。
[1] 殷震, 刘景华. 动物病毒学[M] 2版. 北京∶ 科学出版社, 1997∶ 700-713.
[2] Ben-Porat T, Kaplan A S. Molecular biology of pseudorabies virus[M] //Roizman B. The Herpesviruses, Plenum press. 1985∶ 105-173.
[3] Klupp B G, Hengartner C J, Mettenleiter T C, et al. Complete, annotated sequence of the pseudorabies virus genome[J]. J Virology, 2004,78(1)∶ 424-440.
[4] Granzow H, Klupp B G, Fuchs W, et al. Egress of alphaherpesviruses∶ comparative ultrastructural study[J]. J Virol, 2001, 75∶ 3675-3684.
[5] Mettenleiter T C. Aujeszky’s disease (pseudorabies) virus∶ the virus and molecular pathogenesis-State of the art, June 1999[J]. Vet Res, 2000, 31(1)∶ 99-115.
[6] 斯特劳 B E, 阿莱尔 S D , 蒙加林 W L, 等. 猪病学[M]. 8版. 北京∶ 中国农业大学出版社, 2000∶ 195-196.
[7] 童 武, 郑浩, 单同领, 等. 伪狂犬病毒变异株(JS-2012)对仔猪的致病性研究[J].中国动物传染病学报, 2014, 22(5)∶ 10-14.
[8] 邓仕伟, 汪勇, 薛春芳. 我国伪狂犬病流行现状及新特点[J]. 动物医学进展, 2006, 27(9)∶ 105-107.
[9] Tamba M, Calabrese R, Finelli E, et al . Risk factors for Aujeszky's-disease seropositivity of swine herds of aregion of northern Italy[J]. Prev Vet Med, 2002, 54(3)∶203-212.
[10] Pomeranz L E, Reynolds A E, Hengartner C J. Molecular biology of pseudorabies virus∶ impact on neurovirology and veterinary medicine[J]. Microbiol Mol Biol Rev, 2005, 69∶ 462-500.
[11] Schoenbaum M A, Beran G W, Murphy D P. Pseudorabies virus latency and reactivation in vaccinated swine[J]. Am J Vet Res, 1990, 51(3)∶ 334-338.
[12] 童 武, 张青占, 郑 浩, 等. 免疫后发病仔猪中伪狂犬病毒的分离和鉴定[J].中国动物传染病学报, 2013, 21(3)∶1-7.
[13] Tong W, Liu F, Zheng H, et al . Emergence of a Pseudorabies virus variant with increased virulence to piglets[J]. Vet Microbiol, 2015,181∶ 236-240.
[14] 彭金美, 安同庆, 赵鸿远, 等. 猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J].中国预防兽医学报, 2013, 35(1)∶ 1-4.
[15] An T Q, Peng J M, Tian Z J, et al. Pseudorabies virus variant in Bartha-K61-Vaccinated pigs, China, 2012[J]. Emerg Infect Dis, 2013, 19(11)∶1749-1755.
[16] Wu R, Bai C Y, Sun J Z, et al. Emergence of virulent pseudorabies virus infection in Northern China[J]. J Vet Sci, 2013, 14(3)∶ 363-365.
[17] Yu X L, Zhou Z, Hu D M, et al. Pathogenic Pseudorabies Virus, China, 2012[J]. Emerg Infect Dis,2014, 20 (1)∶102-104.
[18] Wang C H, Yuan J, Qin H Y, et al. A novel gE-deleted pseudorabies virus (PRV) provides rapid and complete protection from lethal challenge with the PRV variant emerging in Bartha-K61-vaccinated swine population inChina[J]. Vaccine, 2014, 32∶ 3379-3385.
[19] Cong X, Lei J L, Xia S L, et al. Pathogenicity and immunogenicity of a gE/gI/TK gene-deleted pseudorabies virus variant in susceptible animals[J].Vet Microbiol, 2016, 182∶ 170-177.
[20] Zhang C, Guo L, Jia X, et al. Construction of a triple gene-deleted Chinese Pseudorabies virus variant and its efficacy study as a vaccine candidate on suckling piglets[J]. Vaccine, 2015, 33(21)∶ 2432-2437.
[21] Hu R M, Zhou Q, Song W B, et al. Novel pseudorabies virus variant with defects in TK, gE and gI protects growing pigs against lethal challenge[J]. Vaccine, 2015, 33(43)∶ 5733-5740.
[22] Wang T, Xiao Y, Yang Q, et al. Construction of a gEDeleted Pseudorabies Virus and Its Efficacy to the New-Emerging Variant PRV Challenge in the Form of Killed Vaccine[J]. Biomed Res Int, 2015, 2015∶ 684945.
[23] Gu Z, Dong J, Wang J, et al. A novel inactivated gE/ gI deleted pseudorabies virus (PRV) vaccine completely protects pigs from an emerged variant PRV challenge[J]. Virus Res, 2015, 195∶ 57-63.
[24] Tong W, Li G X, Liang C, et al. A live, attenuated pseudorabies virus strain JS-2012 deleted for gE/gI protects against both classical and emerging strains[J]. Antiviral Res, 2016,130∶ 110-117.
PREPARATION AND IMMUNE EFFICACY EVALUATION OF INACTIVATED SWINE PSEUDORABIES VACCINE (JS-2012-△gI/gE STRAIN)
TONG Wu1,2, LI Guo-xin1,2, ZHENG Hao1,2, LIU Fei1, LIANG Chao1, LI Lin1, TIAN Qing1, CAO Yanyun1, WU Ji-qiang1, WANG Tao1, ZHENG Xu-chen1, SHAN Tong-ling1,2, TONG Guang-zhi1,2
(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
The Pseudorabies virus (PRV, JS-2012-△gI/gE strain) inactivated with 0.15% formalin was homogenized with MONTANIDE ISA 201 VG (SEPPIC) to prepare the inactivated swine PR vaccine. In order to evaluate the protective effcacy of the inactivated swine PR vaccine, fifteen 2-week-old piglets which were free of PRV, porcine reproductive and respiratory syndrome virus (PRRSV), porcine circovirus (PCV2) and classical swine fever virus (CSFV)) were selected randomly and divided equally into three groups. Group 1 were inoculated intramuscularly (i.m.) with 2 mL of inactivated swine Pseudorabies vaccines (JS-2012-△gI/gE strain). At 28 dayspost-frst inoculation, group 1 and group 2 were inoculated intramuscularly. with the inactivated vaccines at the same dosage. group 3served as uninoculated control. At 28 days post-inoculation (DPI), all piglets were challenged intranasally with 105.0TCID50of PRV (JS-2012 strain). Following the challenge, clinical signs and rectal temperatures were recorded daily for 14 days. The results showed PRV g B antibody levels of piglets vaccinated twice (Group 1) was higher than those vaccinated once (Group 2), The protective eff cacy of the inactivated swine PR vaccine against PRV after double inoculation(Group 1) was better than that after single inoculation (Group 2).
Pseudorablies virus; inactivated vaccine; preparation; immune eff cacy evaluation
S852.659.1
A
1674-6422(2016)06-0012-07
2016-04-21
上海市自然科学基金项目(14ZR1448900);上海市科技兴农重点攻关项目(沪农科攻字(2015)第1-7号);国家生猪现代产业技术体系项目(CARS-36);公益性行业(农业)科研专项(201203039)
童武,男,硕士,助理研究员,主要从事猪伪狂犬病毒及其疫苗的研究
童光志,E-mail:gztong@shvri.ac.cn
