典型城市屠宰及销售猪肉中弓形虫的分子检测研究
2016-03-03詹婷婷米荣升贾海燕韩先干陈兆国
詹婷婷,米荣升,黄 燕,陆 珂,程 龙,贾海燕,胡 盼,宋 悦,韩先干,赵 权,陈兆国
(1.吉林农业大学动物科学技术学院,长春 130118;2.中国农业科学院上海兽医研究所 农业部动物产品质量安全生物性危害因子风险评估实验室(上海) 农业部动物寄生虫学重点实验室,上海200241;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
·研究论文·
典型城市屠宰及销售猪肉中弓形虫的分子检测研究
詹婷婷1,2,米荣升2,3,黄 燕2,3,陆 珂2,3,程 龙2,贾海燕2,胡 盼2,宋 悦1,2,韩先干2,赵 权1,陈兆国2,3
(1.吉林农业大学动物科学技术学院,长春 130118;2.中国农业科学院上海兽医研究所 农业部动物产品质量安全生物性危害因子风险评估实验室(上海) 农业部动物寄生虫学重点实验室,上海200241;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
为了解我国重庆市、广州市和上海市3个典型城市屠宰环节和销售环节猪肉中弓形虫的携带情况,在这3个城市共采集猪膈肌样品393份,分别进行胃蛋白酶消化并提取基因组DNA,以弓形虫529 bp重复序列为目的基因,进行PCR扩增。结果显示,3个城市猪膈肌肉中弓形虫的阳性率为5.34%,其中重庆市的阳性率最高,达9.83%;其次是上海市,为3.17%;而广州市则未检出阳性样品。夏季和秋季间、屠宰环节和销售环节间的阳性率差异均不具备显著统计学意义。本研究结果为减少弓形虫对上述地区人群的危害,预防和控制弓形虫病流行,指导猪群的饲养管理以及提高畜牧业经济效益提供了有益指导。
弓形虫; PCR;膈肌;猪
刚地弓形虫(Toxoplasma gondii)是隶属于孢子虫纲、弓形虫属的一种世界性分布的食源性寄生原虫,可感染包括人在内的大多数哺乳动物[1]。猪感染弓形虫后,体温升高,食欲减退,呼吸困难甚至死亡[2]。近年来,该病在猪场广泛流行,但是绝大部分呈隐性感染。据报道,全球猪弓形虫感染率为0~92.7%[2],我国猪弓形虫感染率高达10.4%~75.95%[2、3]。通过生食或食用未煮熟的猪肉等途径,人类也可感染弓形虫[1]。调查显示,全球约30%的人感染弓形虫[4],我国人弓形虫感染率为7.88%[5]。猪肉在我国居民食物构成中占据重要地位,是肉类消费的主体[6],猪肉中存在的弓形虫对人类健康构成很大威胁,保证猪肉食品的安全尤为重要。
猪的弓形虫感染检测以血清学方法为主[7]。然而,血清学检测方法不能区分既往感染和现症感染,也无法对猪肉进行检测。近年来发展起来的分子生物学检测方法,能够检测猪肉等组织中存在的弓形虫,具有良好的敏感性和特异性[7,8]。分子生物学检测方法包括常规PCR[7]、套式PCR[9]、实时荧光定量PCR[10]等,检测对象包括SAG2[9]、529 bp重复序列[8,10]、B1基因[11]等,其中后两者最常使用[7]。研究人员选取不同基因对猪肉中的弓形虫感染情况进行检测,发现弓形虫529 bp重复序列的敏感性最高[8、12]。在我国,利用分子生物学技术检测猪肉中弓形虫感染的应用还非常少,仅有极少数报道[13]。本研究利用分子生物学检测方法,以弓形虫529 bp重复序列作为目的基因,检测重庆、广州和上海市部分地区销售环节和屠宰环节猪膈肌中弓形虫携带情况,为减少弓形虫对上述地区人群的危害,预防和控制弓形虫病流行;同时,对指导猪群的饲养管理,减少猪群弓形虫感染,奠定坚实的理论基础。
1 材料和方法
1.1 弓形虫虫株及试剂 弓形虫PRU株由中国农业科学院上海兽医研究所动物源性病原生物学及食品安全团队传代保存;EX Taq酶、dNTP Mixture、动物组织基因组提取试剂盒TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0、DL2 000 DNA分子量标准、pMD18-T载体、T4 DNA连接酶为宝生物工程(大连)有限公司产品;AxyPrep DNA凝胶回收试剂盒为Axygen公司产品;Trans1-T1 Phage Resistant化学感受态细胞购于北京全式金生物技术有限公司;胃蛋白酶1∶3000为生工生物工程(上海)股份有限公司产品;其他试剂均为国产分析纯。
1.2 样品采集 2015年夏季和秋季,在重庆、广州和上海3个城市的8个区进行猪膈肌样品采集。其中重庆市3个区,包括大渡口区、九龙坡区、渝北区;广州市2个区:白云区和花都区;上海市3个区:奉贤区、嘉定区和松江区。采样环节包括屠宰环节和销售环节,每份样品约100 g。共采集猪膈肌样品393份,样品来源于3个市的12个屠宰场、6个农贸市场和5个超市。每份样品分别装在无菌的密封袋中,置于低温保存箱中,带回实验室4℃保存。
1.3 样品处理 所有样品均先进行胃蛋白酶消化,具体方法如下:取样品10 g,用均质仪研碎,按照1∶10的比例加入胃蛋白酶消化液(胃蛋白酶25 g、36%浓盐酸 8 mL、生理盐水1 L),37℃消化过夜,中间混匀数次。将消化后的溶液用40目铜筛网过滤,然后加蒸馏水混匀,静置30 min,倒掉部分上清,重新加蒸馏水混匀静置,重复2~3次。将最后一次静置的溶液500×g离心10 min,弃上清,收集沉淀,-20℃保存,用于DNA提取。
1.4 样品DNA提取 取胃蛋白酶处理好的样品,用动物组织基因组提取试剂盒TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0 进行DNA提取,提取后的DNA于-20℃保存备用。
1.5 引物合成 根据文献[15],选取弓形虫529 bp重复序列(Toxo-529)作为检测的目的基因,上游:5'-CTGCAGGGAGGAAGACGAAAGTTG-3';下游:5'-CTGCAGACACAGTGCATCTGGATT-3'。引物由英潍捷基(上海)贸易有限公司合成。
1.6 样品检测 以提取的样品DNA为模板,进行PCR扩增,反应体系:ddH2O 37 μL、10×PCR Buffer 5 μL、2.5 mmol/L dNTP mixture 4 μL、TaKaRa Ex Taq 1 μL、100 μmol/mL上下游引物各0.5 μL、样品DNA 2 μL。反应条件:94℃预变性7 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min, 35个循环;72℃再延伸10 min。扩增产物用1.0%琼脂糖凝胶进行电泳检测。
1.7 阳性样品序列分析 将扩增的PCR产物用AxyPrep DNA凝胶回收试剂盒进行回收,与pMD18-T载体进行连接,连接产物转入Trans1-T1 Phage Resistant化学感受态细胞,经PCR鉴定为阳性的连接产物转化菌液被送至英潍捷基(上海)贸易有限公司进行重复测序。用BLAST软件(http∶//blast.ncbi.nlm.nih. gov/Blast.cgi)在GenBank数据库上进行同源性搜索,用DNAMAN version 5.2.2软件进行序列相似性分析。
1.8 数据统计和分析 利用Microsoft Excel 2007、SPSS 21.0软件对获得的数据进行统计分析,采用χ2检验分析差异的显著性,当P≤0.05时,判定为差异具有显著统计学意义;当P≤0.01时,判定为差异具有极显著统计学意义。
2 结果
2.1 样品PCR扩增结果 以提取的猪膈肌样品DNA为模板,进行弓形虫529 bp重复序列扩增,结果阳性对照组和部分样品成功地扩增出了特异性片段,约为530 bp,与预期大小相符(图1)。

图1 弓形虫529 bp重复序列基因PCR扩增结果Fig.1 PCR amplif cation of 529 bp repetitive fragment of T. gondii
2.2 3个典型城市猪膈肌弓形虫携带情况 对来自重庆、广州和上海3个城市393份猪膈肌样品进行弓形虫检测,结果显示,共有21份样品阳性,阳性率为5.34%。其中重庆市的阳性率最高,为9.83%(17/173);其次是上海市,为3.17%(4/126);而广州市则未检出(表1)。显著性分析结果显示,不同城市间屠宰和市售猪肉中弓形虫阳性率差异具有极显著统计学意义(χ2=13.35,P<0.01)。
在调查的8个区中,有3个区猪膈肌样品存在弓形虫携带。其中重庆市九龙坡区阳性率最高,达到27.27%(12/44),其次是重庆市大渡口区和上海市奉贤区,分别为11.63%(5/43)和11.76%(4/34),其余5个区则未检出阳性样品(表1),不同区之间的携带情况差异具有极显著统计学意义(χ2=64.11,P<0.01)。
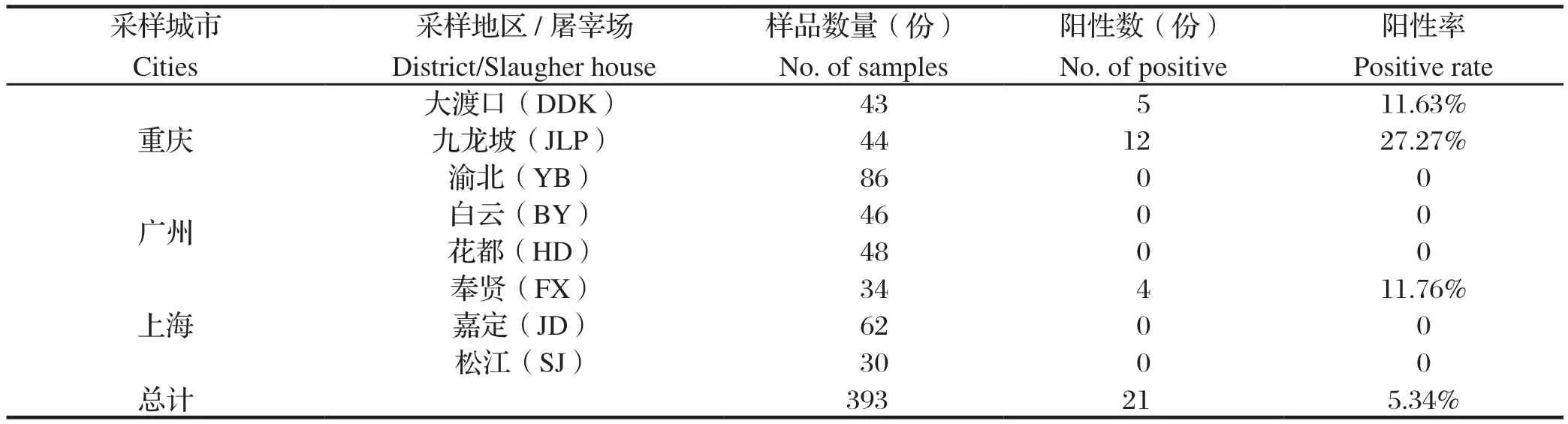
表1 不同城市和地区猪膈肌弓形虫检测Table 1 Detection of T. gondii in pig diaphragmatic muscles collected from different cities and districts
从不同季节看,夏季和秋季猪膈肌样品中均检出弓形虫阳性样品,其中夏季的阳性率为4.17%(4/96),秋季的阳性率为5.72%(17/297),夏季和秋季的阳性率差异不具备显著统计学意义(χ2=0.35,P>0.05)(表2)。
从采样环节看,3个城市在销售环节(超市与农贸市场)、屠宰环节采集的样品均检出弓形虫,其中销售环节的阳性率为7.81%(5/64),屠宰环节的阳性率为4.86%(16/329),不同的采样环节阳性率差异不具备显著统计学意义(χ2=0.92,P>0.05)(表3)。
2.3 阳性样品弓形虫529 bp重复片段序列同源性和系统发育分析 随机选择其中 16个阳性样品PCR产物进行测序,获得的序列与GenBank公布的弓形虫529 bp重复序列(登录号:KC607824)进行核苷酸比对。结果发现,所获得序列与GenBank登录序列同源性为98.0%~100.0%(图2),系统发育分析结果表明,3个城市猪膈肌中携带的弓形虫序列与GenBank中序列在同一个分枝上。
3 讨论
弓形虫是一种世界流行的人兽共患寄生虫,猪、牛、羊等多种家畜都是其中间宿主。对国内家畜弓形虫的感染情况调查发现,猪的感染率最高[14],但是这些报道绝大多数是基于血清学检测方法,对于猪肉中弓形虫感染情况报道的比较少。白明强等[15]用间接血凝试验(infect hemagglutination test,IHA)对重庆市14个区县674份猪血清进行检测,阳性率为55.34%。谭其军等[16]从重庆市合川、万州、北碚等17 个区县采集猪血样,检出率为60.42%(171/283);徐斌等[3,17]2004~2011年从重庆市巴南、荣昌等39个区县采集11 700份猪血清样品,检测结果为75.95%,其中2011年分3个季节进行检测,阳性率为71.85%(2522/3510)。Wu等[18]对重庆市8个区县的猪血清样品进行检测,感染率为30.6%(278/908)。薛霞等[19]于2002~2007年对上海8个区县的规模化猪场进行了跟踪监测,共采集1377份血清样本,每年的感染率变化差异非常大,变化规律也不明显,检出率最高的年份达到66.7%,检出率最低的年份为零感染。Yan等[20]对广州市3个地区猪血清进行的检测,阳性率为6.98%(9/129)。
分子生物学检测方法具有敏感、特异等优点,目前已经逐渐在猪的弓形虫感染检测方面得到应用[7,13,21]。李亚丽等[13]从河南省漯河地区6个不同规模菜市场采集200份猪后腿瘦肉样品,PCR检测结果发现猪肉弓形虫的总阳性率为4.0%。邵晓冬等[21]对采自河南科技大学动物医院接诊的54头病死猪,以及洛阳某食品公司的105头屠宰猪肺门淋巴结进行了PCR检测,结果发现病死猪弓形虫的检测阳性率为18.5%,屠宰猪的阳性率为6.7%。本试验采用针对弓形虫529 bp重复序列设计的特异性引物建立的PCR方法,首次对重庆、广州和上海3个城市部分地区的猪膈肌进行了检测。共检测样品393份,总的感染率为5.34%,其中重庆市的感染率最高,为9.83%,其次为上海市3.17%,而广州市未检出阳性样品。这可能与广州市采集的样品数量较少有关,有待进一步检测证实。这些阳性率数据尽管普遍低于血清学检测结果,但两者的变化趋势完全一致。重庆市猪弓形虫阳性率较高,需要引起人们的高度重视,平时要注意饮食习惯,不生食或食用未煮熟的猪肉,砧板生熟分开;同时养殖场应该加强管理,尽量杜绝啮齿类和猫接触饲料及饮水,减少弓形虫感染的可能性。上海市也存在一定阳性率,亦应引起注意。
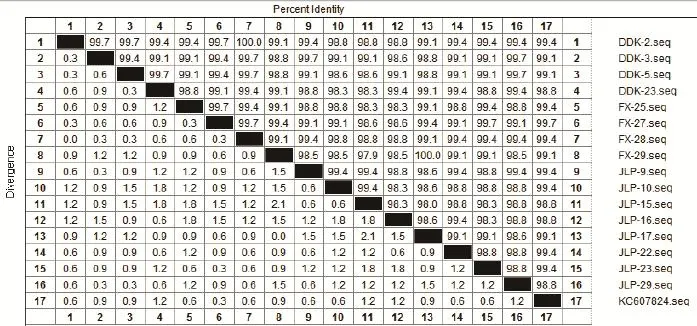
图2 3 城市猪膈肌弓形虫529 bp重复序列核苷酸相似性分析Fig.2 Nucleotide sequence similarity analysis of 529 bp repetitive fragment of T. gondii in pig diaphragmatic muscles collected from 3 cities
从不同季节采集样本的检测结果来看,秋季的感染率(5.72%)高于夏季(4.17%),但是差异不具备显著统计学意义,这与徐斌等[19]报道夏季是猪弓形虫高发季节不一致,可能与本次调查采取的检测方法不同有关。对销售环节和屠宰环节的取样结果表明,猪肉中存在的弓形虫在贮存、运输环节中污染的可能性比较小。
本研究采用分子生物学检测方法,首次对我国城市人口比较密集的3个城市进行了猪肉中弓形虫的检测,发现重庆市和上海市猪肉存在弓形虫感染,而广州市未发现弓形虫感染。调查结果对减少弓形虫对上述地区人群的危害,预防和控制弓形虫病流行有重要意义。同时,也为指导猪群合理地进行饲养管理,减少猪群弓形虫感染奠定坚实理论基础。
[1] Wyrosdick H M, Schaefer J J. Toxoplasma gondii∶ history and diagnostic test development[J]. Anim Health Res Rev, 2015, 16(2)∶ 150-162.
[2] Dubey J P. Toxoplasmosis in pigs-The last 20 years[J]. Vet Parasitol, 2009, 164(2-4)∶ 89-103.
[3] 徐斌,张夏兰,董春霞,等. 重庆地区猪弓形虫病流行病学调查研究[J]. 动物医学进展, 2013, 34(3)∶ 37-40.
[4] Hide G. Role of vertical transmission of Toxoplasma gondii in prevalence of infection[J]. Expert Rev AntiInfect Ther, 2016, 14(3)∶ 335-344.
[5] 全国人体重要寄生虫病现状调查办公室. 全国人体重要寄生虫病现状调查报告[J]. 中国寄生虫学与寄生虫病杂志,2005, 23(增刊)∶ 332-340.
[6] 杨红杰, 彭华, 王林云. 从我国猪肉消费趋势展望地方猪种发展前景[J]. 中国畜牧杂志, 2014, 50(16)∶6-10.
[7] Wyrosdick H M, Schaefer J J. Toxoplasma gondii∶ history and diagnostic test development[J]. Anim Health Res Rev, 2015, 16(2)∶ 150-162.
[8] 余莉, 朱新伊, 胡元生, 等. 敏感性PCR 检测猪肉弓形虫方法的建立与应用[J].中国人兽共患病学报, 2010, 26(10)∶ 895-899.
[9] 傅斌, 刘克义, 韩广东, 等. 巢式PCR 法检测弓形虫的应用研究[J]. 中国热带医学, 2005, 5(5)∶ 929-931.
[10] 候照峰, 王尚尚, 贾红, 等. 弓形虫荧光定量PCR检测方法的建立与初步应用[J]. 中国兽医杂志, 2015, 51(1)∶3-6.
[11] Burg J L, Grover C M, Pouletty P, et al. Direct and sensitive detection of a pathogenic protozoan, Toxoplasma gondii, by polymerase chain-reaction[J]. J Clin Microbiol, 1989, 8, 27(8)∶1787-92.
[12] Homan W L, Vercammen M, de Braekeleer J, et al. Identification of a 200- to 300-fold repetitive 529 bp DNA fragment in Toxoplasma gondii, and its use for diagnostic and quantitative PCR[J]. Int J Parasitol, 2000, 30(1)∶ 69-75.
[13] 李亚丽, 栗亚琼, 张明玉. 漯河市猪肉弓形虫病的流行病学调查[J]. 农产品加工(学刊), 2014(9)∶ 69-70.
[14] 张居作, 陈汉忠, 徐君飞. 我国弓形虫的感染现状[J]. 动物医学进展, 2008, 29(7)∶ 101-104.
[15] 白明强,程建国,汪德珍, 等. 猪弓形虫病的血清学调查报告[J]. 动物检疫, 1990(4)∶ 25-26.
[16] 谭其军, 李艳, 聂奎, 等. 重庆地区猪弓形虫血清流行病学调查[J]. 动物医学进展, 2008, 29(7)∶ 109-110, 115.
[17] 徐斌, 张夏兰, 曾政, 等. 重庆地区猪弓形虫病的血清学调查与分析[J]. 中国兽医科学, 2013, 43(01)∶ 98-102.
[18] Wu D,Lv R,Sun X, et al. Seroprevalence of Toxoplasma gondii antibodies from slaughter pigs in Chongqing, China[J].Trop Anim Health Prod, 2012, 44∶ 685-687.
[19] 薛霞, 李凯航, 邓波, 等. 上海地区规模化猪场弓形虫病的血清学调查[J]. 动物医学进展, 2009, 30(3)∶ 28-31.
[20] Yan C, Yue C, Qiu S, et al. Seroprevalence of Toxoplasma gondii infection in domestic pigeons (Columba livia) in Guangdong Province of southern China[J]. Vet Parasitol, 2011, 177∶ 371-373.
[21] 邵晓冬, 袁林, 翟凯. 洛阳地区猪弓形虫病血清流行病学调查和PCR检测[J]. 黑龙江畜牧兽医, 2014 (8)∶ 75-77.
MOLECULAR DETECTION OF TOXOPLASMA GONDII INFECTION IN SLAUGHTERED AND MARKETING PORK PRODUCTS IN LARGE CITIES
ZHAN Ting-ting1,2, MI Rong-sheng2,3, HUANG Yan2,3, LU Ke2,3, CHENG Long2, JIA Hai-yan2, HU Pan2, SONG Yue1,2, HAN Xian-gan2, ZHAO Quan1, CHEN Zhao-guo2,3
(1. Animal Science and Technology College, Jilin Agricultural University, Changchun 130118, China; 2. Laboratory of Quality and Safety Risk Assessment for Animal Products on Biohazards (Shanghai) of Ministry of Agriculture, Key Laboratory of Animal Parasitology of Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 3. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
Abstract: In order to investigate the presence of Toxoplasma gondii infection in pork products in slaughter houses and markets in large cities Chongqing, Guangzhou and Shanghai, 393 pig diaphragmatic muscle samples were collected and treated with pepsin digestion. Genomic DNA of the treated samples were extracted and detected in PCR using a pair of specif c primers based on a 529 bp repetitive fragment gene of T. gondii. The results showed that the overall positive rate of T. gondii in these 3 cities was 5.34% with the highest in Chongqing (9.83%), followed by Shanghai (3.17%) but no positive samples in Guangzhou. There was no signif cant difference in positive rates between summer and autumn, or slaughter houses and markets. These results indicated that T. gondii infection occured in pigs in Chongqing and Shanghai. Therefore, comprehensive measures should be implemented to reduce Toxoplasma infection in human and pigs and increase prof t of animal industry.
Key words:Toxoplasma gondii; PCR; pig; diaphragmatic muscle
S852.723
A
1674-6422(2016)06-0030-06
2016-02-24
国家自然科学基金项目(31302083);国家农产品质量安全风险评估重大专项(GJFP201600703);中央级公益性科研院所基本科研业务费(2016JB13);闵行区高层次人才科研项目团队资助
詹婷婷,女,硕士研究生,临床兽医学专业
赵权, E-mail∶ zhaoquan0825@163.com;陈兆国, E-mail∶ zhaoguochen@shvri.ac.cn
