氧化苦参碱与奈达铂联用对人胶质母细胞瘤U87 MG细胞增殖的影响
2016-01-31郭冰玉张婷婷苏静缘王凯文李晓明
郭冰玉,张婷婷,苏静缘,王凯文,李晓明
氧化苦参碱与奈达铂联用对人胶质母细胞瘤U87 MG细胞增殖的影响
郭冰玉,张婷婷,苏静缘,王凯文,李晓明*
[摘要]目的观察氧化苦参碱与奈达铂联用抑制人胶质母细胞瘤U87 MG细胞增殖的效果。方法将传代的U87 MG细胞分为对照组、奈达铂单药处理组(NDP组)、氧化苦参碱单药处理组(OXY组)和两种药物联合处理组(联合组),分别在不同时间点,使用不同浓度的药物,用MTT方法检测U87 MG细胞光密度值(OD490),观察细胞增殖情况;用流式细胞仪检测不同处理对各组细胞周期的作用。结果对细胞处理48 h 后,OXY组、NDP组及联合组U87 MG细胞的增殖抑制率分别为18.74%±2.66%、27.66%±0.87%、75.87%±1.19%。两种药物联合使用对U87 MG细胞的抑制作用显著高于各单药组相同剂量药物对细胞的抑制率,各组抑制率比较差异有统计学意义(P<0.01)。对照组、OXY组、NDP组、联合组细胞周期G1期的百分比分别为67.81%±0.55%、71.87%±1.64%、78.01%±2.06%、84.75%±0.72%。两药联合应用对细胞G1期的阻滞作用增强,组间比较差异有统计学意义(P<0.01)。结论氧化苦参碱与奈达铂联合使用对抑制胶质母细胞瘤细胞增殖有协同效果,可以降低奈达铂的使用浓度,进而减轻治疗时化疗药物的毒副作用。
[关键词]氧化苦参碱;奈达铂;U87 MG;胶质母细胞瘤
[Abstract]ObjectiveTo observe the effect of oxymatrine combined with nedaplatin on the proliferation of human glioblastoma U87 MG cells.MethodsU87 MG cells were divided into control group,nedaplatin treatment group (NDP group),oxymatrine treatment group (OXY group) and nedaplatin combined with oxymatrine treatment group (combination group).The proliferation rate of U87 MG cells at different time points treated by different concentrations of drugs were tested by MTT and the cells cycle was tested by flow cytometry.ResultsThe inhibition rate of cell proliferation in OXY group,NDP group and combination group were 18.74%±2.66%,27.66%±0.87% and 75.87%±1.19% after 48 h.The inhibition rate in combination group was higher than those of single drug groups,and there were significant differences among the groups (P<0.01).The percentages of cells in G1phase of cell cycle in control group,OXY group,NDP group and combination group were 67.81%±0.55%,71.87%±1.64%,78.01%±2.06% and 84.75%±0.72%.ConclusionOxymatrine combined with nedaplatin has synergistic effects on the inhibition of the proliferation of glioblastoma cells,it can reduce the concentration of and reduce the side effects of nedaplatin.
doi[1]Hiroyuki M,Ogino J,Takahashi A,et al.Rhabd glioblastoma:an aggressive variaty of astrocytic tumor[J].Nagoya J Med Sci,2015,77(1-2):321-328. 10.14053/j.cnki.ppcr.201512003
收稿日期:2015-10-09
基金项目:国家自然科学基金(81171793);盛京自由研究者计划
通信作者*
Effect of oxymatrine combined with nedaplatin on the proliferation of human glioblastoma U87 MG cellsGUO Bing-yu,ZHANG Ting-ting,SU Jing-yuan,WANG Kai-wen,LI Xiao-ming*(Institute of Neurology,General Hospital of Shenyang Military Command,Shenyang 110016,China)
Key words:Oxymatrine;Nedaplatin;U87 MG;Glioblastoma
0引言
胶质母细胞瘤(Glioblastoma multiforme,GBM)是中枢神经系统中常见的恶性肿瘤,其恶性程度和复发率极高,患者的中位生存期平均为6~14个月[1]。目前常规的治疗手段是术后放化疗,以提高患者的生存期。但是由于化疗药物本身的毒副作用以及血脑屏障的影响,使得化疗对该种肿瘤的治疗效果达不到理想的效果[2]。寻找新的药物及化疗方案,减少药物的毒副作用,对患者的生存质量和生存期具有重要的意义。
氧化苦参碱(Oxymatrine)是苦参的主要有效成分,不仅具有抑制肿瘤的作用[3],还能够增强机体免疫力[4],降低放化疗毒副反应[5]。已有研究表明,氧化苦参碱具有开放血脑屏障的作用[6],并能够抑制大鼠胶质瘤细胞C6的增殖[7]。顺铂的同类药物奈达铂(Nedaplatin)在临床上已用于多种肿瘤的治疗。Takakura等[8]的研究发现,奈达铂在胶质母细胞瘤的治疗上有一定效果。但目前尚未发现有这两种药物联合治疗胶质瘤的报道。
本研究以人胶质母细胞瘤U87 MG细胞为研究对象,观察氧化苦参碱联合奈达铂对U87 MG细胞增殖的抑制效果,以及对细胞周期的阻滞作用,为临床治疗胶质瘤提供理论基础。
1材料与方法
1.1材料与仪器人脑胶质母细胞瘤U87 MG细胞株(实验室冻存),DMEM培养基(Invitrogen),胎牛血清(天津灏洋),氧化苦参碱(Selleck),奈达铂注射液(辉瑞),四甲基偶氮唑蓝(MTT),PI染料(碧云天)。酶标仪(美国Bio-Rad),流式细胞仪(美国Bio-Rad)。
1.2细胞培养将U87 MG细胞株用含10%胎牛血清的DMEM培养基(含50 IU/mL青霉素,50 IU/mL链霉素)培养,置37 ℃、5% CO2培养箱中培养至对数生长期。
1.3药物处理浓度奈达铂为临床常用的化疗药物,根据linburg公式 C=20D [C单位为μg/mL,D为临床剂量单位mg/(kg·d)]和体表面积计算公式S=1.15+(m-30)×0.1×5-1(其中m>30 kg)计算出MTT所需药物浓度,奈达铂设高[10×PPC(Peak plasma concentration)]、中(1×PPC)、低(0.1×PPC) 3个浓度。氧化苦参碱取10、20、40 μg/mL 3个浓度。空白对照组为NaCl处理组。
1.4MTT实验取对数生长期U87 MG细胞以2×104/mL浓度接种于96孔培养板中,终体积为200 μL,细胞培养12 h贴壁后更换培养基,加入不同浓度药物,各剂量组及对照组(NaCl处理组)分设3个复孔。处理后的细胞于0、12、24、36、48 h分别加入5 mg/mL MTT溶液10 μL,37 ℃湿润环境中温育4 h,弃去孔中的培养基和MTT,在孔中各加入200 μL DMSO,以溶解残留的MTT-甲臜结晶,置回37 ℃ CO2细胞培养箱中。15 min后,立即在490 nm处记录吸光值。药物对细胞的抑制率计算公式:抑制率=1-(剂量组平均OD值/对照组平均OD值)× 100%。
1.5细胞周期分析将对数生长期的U87 MG细胞用胰酶消化后制成1×106/L浓度的细胞悬液,接种于6孔板中,贴壁培养24 h后,加入不同浓度药物。药物作用24 h后收集细胞,PBS洗涤后胰酶消化,制成单细胞悬液。用70%的冰乙醇4 ℃固定1 h,用PI染液[配方:0.5 mL PI原液(1 mg/mL),20 μL RNase (10 mg/mL),0.1 mL TritonX-100(1%),20 μL EDTA,加PBS至10 mL,调pH至7.2~7.6]避光染色30 min,用流式细胞仪测定细胞周期。
1.6数据统计分析采用SPSS 18.0软件进行统计学分析,计量资料比较使用非配对t检验分析,P<0.05为差异有统计学意义。
2结果
2.1不同处理对U87 MG细胞增殖的影响
2.1.1氧化苦参碱组采用不同浓度的氧化苦参碱分别对U87 MG细胞作用0、12、24、36、48 h后,细胞增殖情况见图1、表1。结果显示,不同浓度的氧化苦参碱均可以抑制U87 MG细胞的增殖,其细胞增殖抑制率与对照组比较差异有统计学意义(P<0.01),氧化苦参碱对细胞的增殖抑制作用与剂量、作用时间呈正比关系。
2.1.2奈达铂组采用不同浓度的奈达铂分别对U87 MG细胞作用0、12、24、36、48 h后,细胞增殖情况见图2、表2。结果显示,奈达铂能够显著抑制U87 MG细胞的增殖,增殖抑制率与对照组比较差异有统计学意义(P<0.01),奈达铂对细胞的增殖抑制作用与剂量和作用时间呈正比关系。

图1 不同剂量氧化苦参碱作用下U87 MG细胞的增殖情况

时间(h)NaCl氧化苦参碱(μg/mL)10204000.00-4.55-2.58-2.77120.0011.55**15.84**23.71**240.0013.20**16.73**26.06**360.0015.88**22.75**34.33**480.0019.44**24.93**35.37**
注:与NaCl组比较,**P<0.01
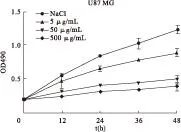
图2 不同剂量奈达铂作用下U87 MG细胞的增殖情况
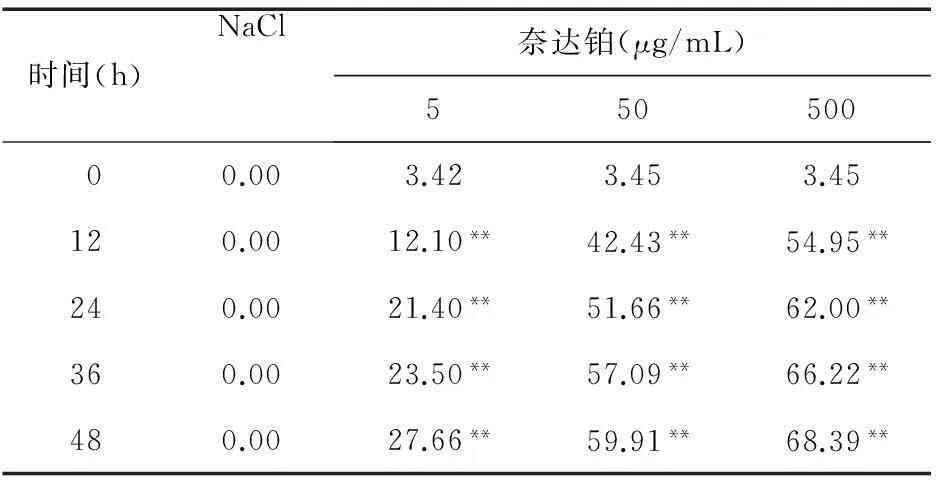
时间(h)NaCl奈达铂(μg/mL)55050000.003.423.453.45120.0012.10**42.43**54.95**240.0021.40**51.66**62.00**360.0023.50**57.09**66.22**480.0027.66**59.91**68.39**
注:与NaCl组比较,**P<0.01
2.1.3氧化苦参碱与奈达铂联合处理组采用各单药处理组的最低使用浓度联合处理细胞,见图3、表3。结果显示,5 μg/mL奈达铂与10 μg/mL氧化苦参碱联合使用对U87 MG细胞增殖的抑制有协同作用,氧化苦参碱能够显著提高奈达铂对U87 MG细胞增殖的抑制作用,与对照组比较差异有统计学意义(P<0.01)。
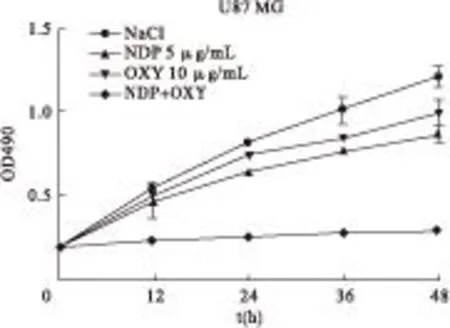
图3 奈达铂、氧化苦参碱单独使用及联合应用时细胞的增殖情况

时间(h)NaCl奈达铂(5μg/mL)氧化苦参碱(10μg/mL)联合组00.003.423.453.45120.0012.10**6.84**56.93**240.0021.40**9.52**68.79**360.0023.50**15.62**71.69**480.0027.66**18.74**75.87**
注:与NaCl组比较,**P<0.01
2.2不同处理对U87 MG细胞周期的影响见图4。不同药物处理时,U87 MG细胞的G1-S期转化受到了不同程度的抑制,其中两药联合应用时,细胞周期G1-S期被阻滞的程度增强。
3讨论
胶质母细胞瘤通常呈浸润性生长,手术难以彻底清除,患者生存期短,病死率高,5年生存率低于5.5%[9]。术后化疗是治疗胶质母细胞瘤的重要环节,但是由于血脑屏障和耐药机制的存在,胶质母细胞瘤的化疗效果并不理想[10]。因此,寻找与化疗药物协同作用的药物以提高治疗效果,对提高患者生存率具有积极意义。
本研究显示,低浓度氧化苦参碱(10 μg/mL)与奈达铂(0.1×PPC)联合应用时,对U87 MG细胞增殖的抑制率高于两者单独使用的抑制率之和,起到了协同作用的效果。流式分析也显示当氧化苦参碱与奈达铂联合作用24 h时细胞周期G1-S期的阻滞作用增强。推断氧化苦参碱可以增强奈达铂对U87 MG细胞增殖的抑制效果。

图4 不同药物作用下细胞周期的变化
氧化苦参碱是传统中药苦参的主要生物活性成分,具有广泛的药理学活性,近年来其抗肿瘤作用受到研究者的关注。已有研究表明,氧化苦参碱联合环磷酰胺(Cyclophosphamide,CTX)可明显增强CTX的抗肿瘤效果[11]。对于HNE-1细胞,氧化苦参碱可以增强VCR、平阳霉素、5-FU的化疗效果[12]。刘秀均等[13]也通过体内、体外实验证实,氧化苦参碱与顺铂联合作用可以显著提高顺铂对肝癌的抑制率。表明氧化苦参碱具有增强化疗药物敏感性的作用。同时,氧化苦参碱与化疗药物联合应用,可以降低化疗药物导致的骨髓抑制,缓解化疗引起的胃肠道反应,改善患者食欲,减轻疼痛,提高化疗耐受性和患者的生存质量[14-15]。Zhang等[16]研究证实,氧化苦参碱可以通过降低血脑屏障的紧密连接,开放血脑屏障,提高化疗药物进入脑组织的比例,因此,氧化苦参碱还可以作为胶质瘤化疗的辅助药物。
综上所述,氧化苦参碱与奈达铂联合应用,可以降低奈达铂治疗胶质母细胞瘤的使用浓度,进而减少奈达铂化疗的毒副作用,对提高胶质瘤的治疗效果有一定的意义,是一种极具优势和潜力的化疗辅助药物。
参考文献:
[2]Kamiya-Matsuoka C,Gilbert MR.Treating recurrent glioblastoma:an update[J].CNS Oncol,2015,4(2):91-104.
[3]Guo B,Zhang T,Su J,et al.Oxymatrine targets EGFR (p-Tyr845) and inhibits EGFR-related signaling pathways to suppress the proliferation and invasion of gastric cancer cells[J].Cancer Chemother Pharmacol,2015,75(2):353-363.
[4]陈晓峡,向小庆,叶红.苦参碱及氧化苦参碱抗肿瘤作用的研究进展[J].中国实验方剂学杂志,2013,19(11):361-364.
[5]马玲娣,张彦,文世宏,等.苦参碱对TIM2转基因小鼠肝癌细胞的作用研究[J].中国中药杂志,2008,33(10):1175.
[6]Wang Z,Wu Y,Wang Y,et al.Matrine inhibits the invasive properties of human glioma cells by regulating epithelial to mesenchymal transition[J].Mol Med Rep,2015,11(5):3682-3686.
[7]Zhang S,Qi J,Sun L,et al.Matrine induces programmed cell death and regulates expression of relevant genes based on PCR array analysis in C6 glioma cells[J].Mol Biol Rep,2009,36(4):791-799.
[8]Takakura K,Shitara N,Kohno T.Adjuvant immunotherapy with levamisole for malignant glioma[J].No To Shinkei,1983,35(3):299-303.
[9]杨劲松,陆雪官.高分级脑胶质瘤综合治疗循证医学研究进展[J].中华肿瘤防治杂志,2007,14(13):1025-1028.
[10]Söderberg-Nauclér C,Johnsen JI.Cytomegalovirus in human brain tumors:Role in pathogenesis and potential treatment options[J].World J Exp Med,2015,5(1):1-10.
[11]王锐,姜小军,郑婕,等.氧化苦参碱增强环磷酰胺对小鼠LEWIS肺癌生长的抑制作用[J].第二军医大学学报,2008,29(4):399-403.
[12]王驰,叶琳,沈娜,等.氧化苦参碱与常见肿瘤药物相互作用对HNE-1、HNE-1(200)细胞周期的影响[J].肿瘤学杂志,2009,15(7):622-624.
[13]刘秀均,刘婷.苦参碱联合顺铂抗肝癌[J].中国实验方剂学杂志,2007,13(6):37.
[14]杨泽松,陈建斌,张红宾,等.苦参碱葡萄糖注射液联合CHOP方案治疗非霍奇金淋巴瘤的临床研究[J].中成药,2007,29(12):1728-1730.
[15]邢晓静,张丽红,蔡玉文,等.苦参碱联合化疗治疗进展期胃癌疗效分析[J].辽宁中医杂志,2007,34(12):1742.
[16]Zhang S,Kan QC,Xu Y,et al.Inhibitory effect of matrine on blood-brain barrier disruption for the treatment of experimental autoimmune encephalomyelitis[J].Mediators Inflamm,2013:736085.
作者单位:中国医科大学附属盛京医院a.急诊科,b.社会服务部,沈阳 110004
