盐酸法舒地尔通过活化Akt与抑制PTEN减轻顺铂导致的肾小管上皮细胞凋亡*
2016-01-31孔德阳郝建兵叶向梅包娜娜侯冬华
孔德阳, 郝建兵, 叶向梅, 唐 杰, 包娜娜, 侯冬华
(哈尔滨医科大学附属第一医院肾内科,黑龙江 哈尔滨 150081)
盐酸法舒地尔通过活化Akt与抑制PTEN减轻顺铂导致的肾小管上皮细胞凋亡*
孔德阳△,郝建兵,叶向梅,唐杰,包娜娜,侯冬华
(哈尔滨医科大学附属第一医院肾内科,黑龙江 哈尔滨 150081)
[摘要]目的: 探讨盐酸法舒地尔(fasudil)能否通过活化Akt并抑制PTEN减轻顺铂(CP)导致的肾小管上皮细胞凋亡。方法: 健康雄性SD大鼠随机分为3组(每组12只),包括正常对照(control)组、CP组及CP+fasudil组。生理盐水或顺铂腹腔注射96 h后处死SD 大鼠,留取血液和肾脏组织,检测血尿素氮(BUN)、血清肌酐(sCr)水平。PAS染色光镜观察肾脏形态结构的变化;TUNEL染色检测肾小管上皮细胞凋亡;分别采用Western blotting法和/或免疫组化技术检测Rho蛋白激酶1(ROCK1)、PTEN、Akt 蛋白表达变化及磷酸化Akt(p-Akt)水平。结果: 与control组比较,CP组与CP+fasudil组大鼠的BUN及sCr水平、凋亡细胞阳性率、ROCK1及PTEN蛋白表达均显著升高(P<0.05),而p-Akt表达则显著减少(P<0.05);PAS染色光镜示CP组肾脏组织结构出现明显损伤性变化;与CP组比较,CP+fasudil组的sCr水平、凋亡细胞阳性率、ROCK1及PTEN蛋白表达均显著下调(P<0.05),而p-Akt水平则显著增高(P<0.05);此外,肾脏病理损伤减轻。 结论: 盐酸法舒地尔可以减轻顺铂引起肾小管上皮细胞凋亡,其机制可能与活化Akt及抑制PTEN蛋白表达相关。
[关键词]盐酸法舒地尔; 顺铂; 急性肾损伤; 细胞凋亡; Rho蛋白激酶1
抗癌药物顺铂(cisplatin,CP)肾毒性的主要靶位是肾小管上皮细胞,CP导致急性肾损伤(acute kidney injury,AKI)关键发病机制之一是诱导肾小管上皮细胞凋亡。如何减轻CP引起的肾小管上皮细胞凋亡是防治CP相关AKI的重要治疗手段。
Rho蛋白是小G蛋白家族成员,是所有真核细胞内调控多个信号转导通路的分子开关。RhoA是Rho家族的主要成员,RhoA的主要功能是通过与下游的效应蛋白Rho/Rho激酶 (Rho-associated protein kinase,ROCK)相互作用来实现的。 Rho激酶可以通过激活其特异性底物人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)从而使Akt失活,进而促进细胞凋亡。研究表明,多种AKI动物模型中存在Rho 激酶活化,抑制Rho激酶活化能够改善AKI[1]; 同时,Rho激酶信号途径参与了CP诱导的肾小管上皮细胞凋亡,应用其特异性抑制剂盐酸法舒地尔(fasudil)能够有效改善CP导致的肾小管上皮细胞凋亡[2]。然而,Rho激酶信号途径参与的CP-AKI发病机制及盐酸法舒地尔改善CP-AKI具体作用机制仍未得到深入研究。因此,本研究即采用CP-AKI模型进行了如下研究。
材料和方法
1动物
SPF级SD大鼠,雄性,6~8周龄,200~250 g,由哈尔滨医科大学实验动物中心提供。
2主要试剂
盐酸法舒地尔由天津红日药业股份有限公司提供;顺铂(山东齐鲁制药);TUNEL染色试剂盒 (Promega);兔抗ROCK1、Akt及p-Akt多克隆抗体和小鼠抗PTEN抗体(Santa Cruz);小鼠β-actin单克隆抗体(Sigma);辣根过氧化物酶标记的山羊抗兔、小鼠IgG(中国广州碧云天公司)。
3主要方法
3.1实验SD大鼠分组36只SPF级健康SD雄性大鼠,随机分为3组,每组12只:正常对照(control)组,单纯腹腔注射0.9%生理盐水(5 mL/kg);CP组,单纯腹腔注射CP(10 mg/kg),CP+fasudil组:fasudil(20 mg/kg)于CP注射前72 h开始注射(每天1次,连续7 d[3])。
3.2肾脏组织标本的留取将control组、CP组及CP+fasudil组大鼠于生理盐水或CP注射后96 h,用2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉大鼠,腹正中切口,取出双肾,分别分离肾周围脂肪囊和肾筋膜后,用动脉夹夹闭肾脏动静脉,切除整个肾,用冰盐水冲洗后迅速沿冠状面切成薄片,部分置于4%多聚甲醛液中固定48 h,用于制备石蜡切片;部分液氮冷冻后-80 ℃冻存,用于提取蛋白质,用Western blotting等分析。
3.3血清标本的留取大鼠处死时采取腹主动脉穿刺取血,取血后室温静置4 h后,3 000 r/min4 ℃离心15 min分离血清,-20 ℃冰箱保存备用。
3.4血清肌酐(serum creatinine,sCr)及尿素氮(blood urea nitrogen,BUN)的测定全自动生化分析仪(HITACHI)进行测定血清肌酐及血尿素氮水平。
3.5碘酸-希夫氏(periodic acid-Schiff,PAS)染色肾组织标本用4%多聚甲醛溶液固定48 h,常规脱水、透明、石蜡包埋、2 μm切片、脱蜡、用过PAS染色观察肾组织病理变化。
3.6TUNEL与半定量分析石蜡包埋的肾脏组织,按试剂盒说明采用TUNEL检测。结果根据凋亡阳性细胞分布情况,每个肾脏观察2~3张切片,每张切片随机摄取6~8个不重叠视野。计数每个视野中TUNEL阳性细胞数及细胞总数,细胞凋亡程度以TUNEL阳性细胞数所占百分比表示[4]。
3.7Western blotting实验组织提取蛋白:组织中加入预冷后RIPA细胞裂解液30 μL~200 μL,超声破碎仪组织溶解,冰浴,离心,提取上清,-80 ℃保存;使用Bradford法进行蛋白质定量。蛋白样本在100 ℃下变性5 min,用SDS-PAGE分离蛋白,转膜,立春红染色后去离子水冲洗膜,放入封闭袋内加封闭液封闭约4 h;加入多克隆兔抗ROCK1(1∶500)、Akt(1∶500)及p-Akt(1∶500) I 抗,小鼠抗PTEN(1∶200)I 抗4 ℃过夜;以 β-actin为内参照,用ImageJ凝胶图像分析软件进行半定量分析。
3.8免疫组化肾组织标本用4%多聚甲醛溶液固定48 h,常规脱水、透明、石蜡包埋、2 μm切片;二甲苯脱蜡;于保湿盒内3% H2O2室温浸30 min,PBS洗涤;微波法抗原修复:切片浸于枸橼酸钾溶液微波至微沸腾,暂停3~4 min,再加热至微沸腾,反复4次;室温放置30 min,自然冷却;室温下,将抗原在保湿盒内血清封闭30 min;滴加1∶500稀释的ROCK1抗体,4 ℃过夜;第2天将保湿盒取出,于室温放置30 min,PBS洗涤;滴加 II 抗(生物素标记),于室温放置50 min,PBS洗涤;滴加VECTASTAIN®R.T.U.ABC Reagent,室温放置30 min,PBS洗涤;普通光镜下DAB显色1~10 min,边显色边观察;自来水冲洗,PBS浸5 min;复染:应用苏木素染液,PBS冲洗返蓝;乙醇梯度脱水;树胶封片;于高倍镜下观察(×400)。由一位独立观察者随机选取5个视野/切片(×100),对免疫组化结果进行评价。按阳性所占比例进行评分,标准如下:0,阴性;1,1%~20%; 2,21%~50%;3,51%~80%;4,81%~100%[5]。
4统计学处理
用SPSS 13.0软件进行统计学处理。计量资料采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q方法,以P<0.05为差异有统计学意义。
结果
1盐酸法舒地尔治疗可以降低顺铂诱导AKI大鼠的BUN、sCr水平,改善肾小管损伤
与control组比较,顺铂注射96 h,CP组与CP+fasudil组的sCr、BUN水平明显升高(P<0.05);注射盐酸法舒地尔可以显著减低SD大鼠的sCr水平(P<0.05)。顺铂注射96 h,近端肾小管刷状缘脱落,管型堵塞肾小管,肾小管基底膜裸露。提前注射盐酸法舒地尔可减少CP注射后96 h肾脏中坏死肾小管数量,肾小管损伤减轻,见图1。
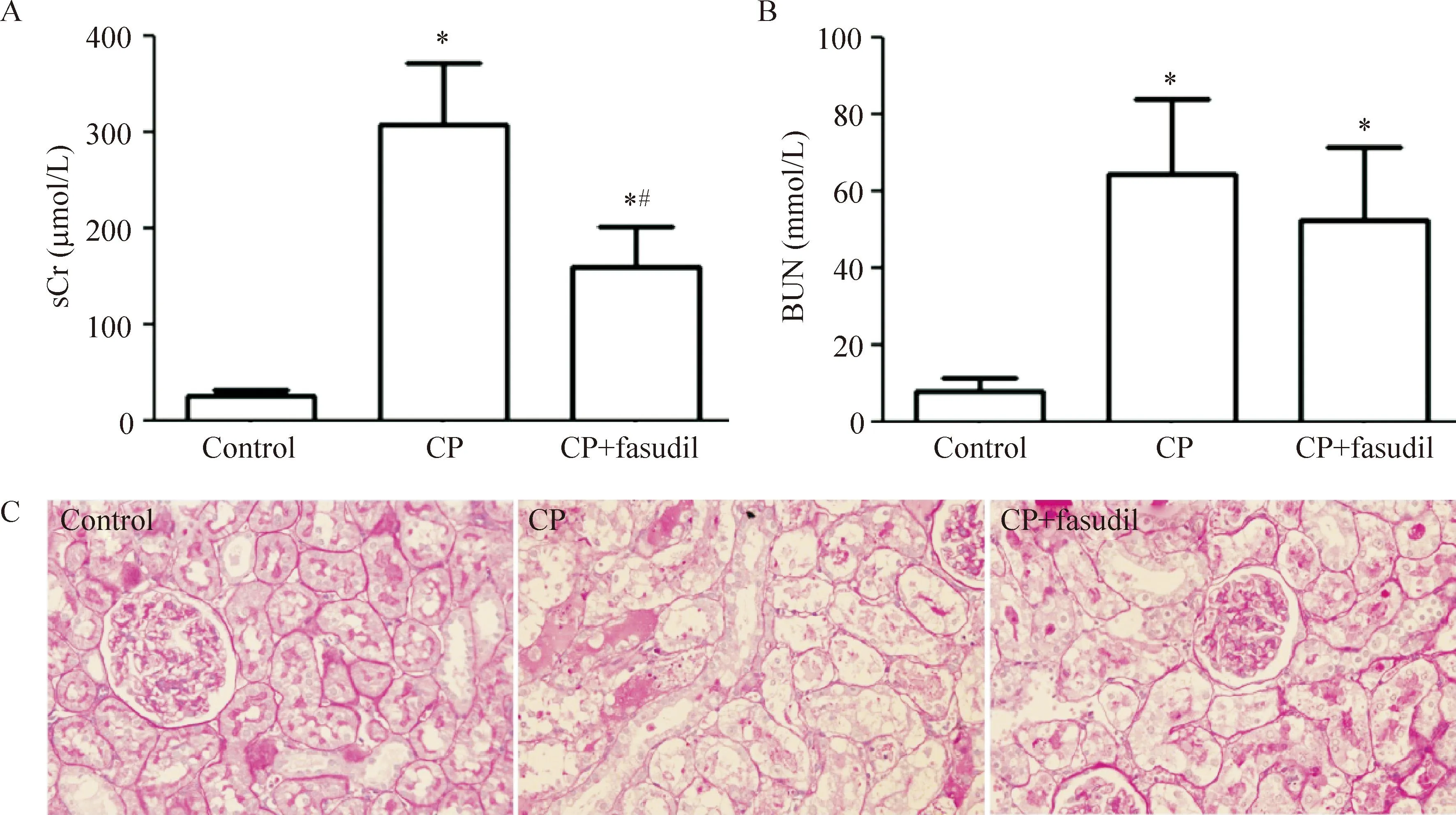
Figure 1.The levels of sCr (A), BUN (B) and morphological changes of the rat renal tissues (C) in the rats with different treatments (PAS staining, ×400 ). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsCP group.
图1各组血清sCr、BUN水平及肾脏的病理改变
2盐酸法舒地尔治疗抑制了ROCK1活化
2.1免疫组化结果在顺铂或生理盐水经腹腔注射入大鼠体内后96 h,用免疫组化结果显示:与control组相比,CP组及CP+fasudil组ROCK1蛋白表达明显增加(P<0.05);与CP组相比较,CP+fasudil组ROCK1蛋白表达明显减少(P<0.05),见图2。
2.2Western blotting结果与control组比较,CP组及CP+fasudil组ROCK1蛋白表达水平明显上调(P<0.05)。与CP组比较,CP+fasudil组ROCK1蛋白表达水平明显下调(P<0.05),见图2。
Figure 2.The expression of ROCK1 was detected by immunohistochemistry (A, ×400) and Western blotting (B). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsCP group.
图2免疫组化法及Western blotting法检测各组ROCK1蛋白的表达
3盐酸法舒地尔治疗可以减轻顺铂诱导AKI大鼠肾小管上皮细胞的凋亡
3.1TUNEL染色结果CP组见TUNEL阳性细胞(核呈榕褐色)大部分位于肾脏皮髓交界处的肾小管管壁和管腔内;control组几乎未见TUNEL阳性细胞;CP+fasudil组可见少量TUNEL阳性细胞,见图3。
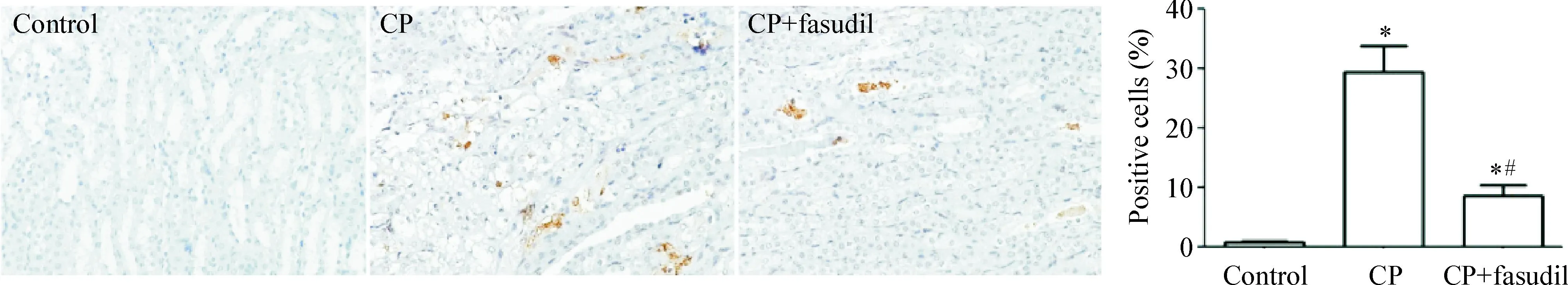
Figure 3.TUNEL-staining of renal tubular epithelium cells apoptosis in each group (×400). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsCP group.
图3TUNEL染色检测各组肾小管上皮细胞的凋亡状况
3.2凋亡评分结果CP组和CP+fasudil组凋亡程度显著高于control组(P<0.05);与CP组比较,CP+fasudil组凋亡阳性细胞比例降低(P<0.05),见图3。
4盐酸法舒地尔通过活化Akt及抑制PTEN改善顺铂诱导AKI大鼠肾小管上皮细胞凋亡
与control组比较,CP组及CP+fasudil组PTEN蛋白质表达水平明显上调,而p-Akt蛋白水平显著减少(P<0.05)。与CP组比较,CP+fasudil组PTEN蛋白质表达水平明显下调, p-Akt蛋白水平显著增加(P<0.05);各组Akt无显著差异,见图4。
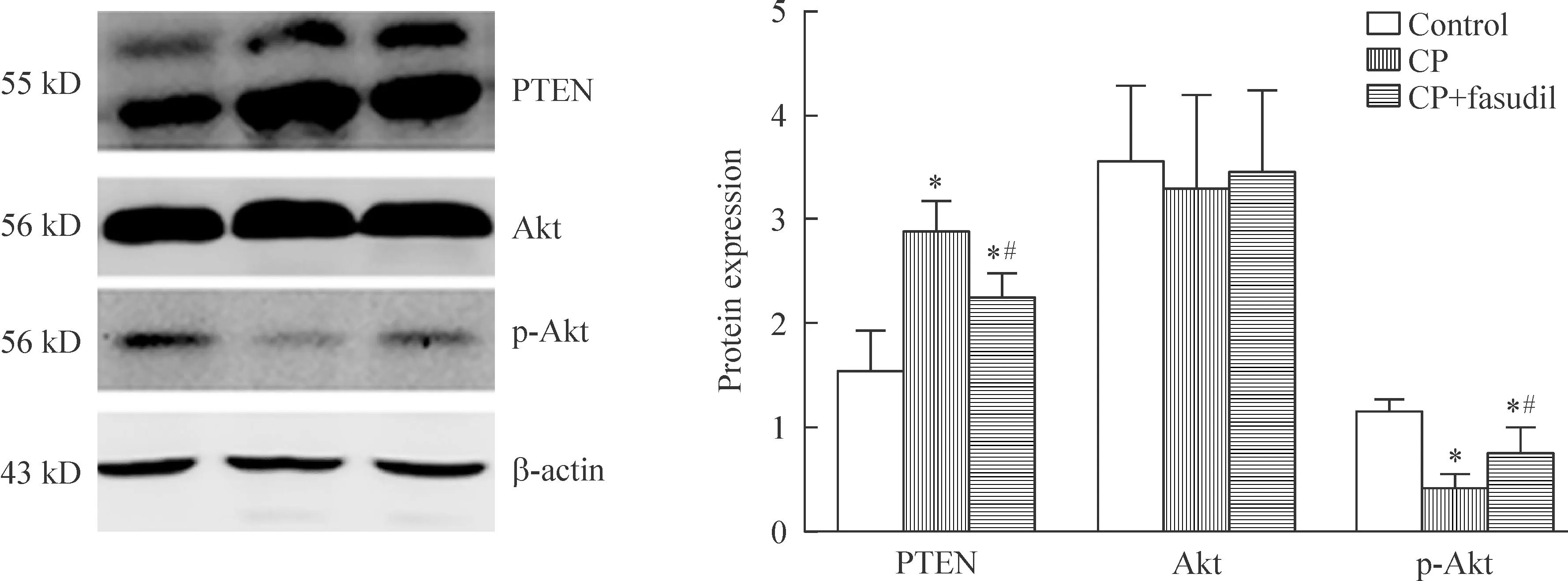
Figure 4.Fasudil hydrochloride prevented CP-induced renal tubular epithelial cells apoptosis via the Akt activation and PTEN inhibition. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsCP group.
图4盐酸法舒地尔通过活化Akt及抑制PTEN减轻CP诱导的肾小管上皮细胞凋亡
讨论
CP易于在肾脏外髓的近端小管上皮细胞,特别是S3段蓄积,从而引起AKI,主要表现为肾小管上皮细胞凋亡[6]。Rho激酶信号转导通路是机体组织中普遍存在的一条信号通路,它参与许多细胞功能(如细胞迁移、细胞因子产生及细胞凋亡等)的调节,Rho激酶信号转导途径是否参与了CP-AKI时肾小管上皮细胞的凋亡尚未明了。探究Rho激酶信号转导途径同CP-AKI时肾小管上皮细胞凋亡的关系,并对CP-AKI大鼠模型进行Rho激酶特异性抑制剂盐酸法舒地尔干预,观察阻断Rho激酶信号通路对CP-AKI时肾小管上皮细胞凋亡的影响,探究具体的作用机制,能够为针对CP-AKI诱导的肾小管上皮凋亡寻找新靶点药物治疗提供思路。
ROCK是参与细胞有丝分裂、骨架调整及肌肉细胞收缩等一系列生命现象重要的酶[7]。ROCK底物参与了细胞凋亡的调节: ROCK可以直接磷酸化激活PTEN,从而抑制Akt活性[8-9]。Akt能通过抑制内、外源性凋亡途径在促进细胞存活中起重要作用。
盐酸法舒地尔作为目前临床唯一可用的Rho激酶抑制剂,能够强效扩血管,保护缺血脑组织,且已经在多种AKI模型中证实发挥了肾脏保护作用[1]。
肾小管上皮细胞凋亡是CP-AKI的重要发病机制之一。在我们的研究中,TUNEL染色显示CP组肾小管有大量的凋亡细胞,然而,CP+fasudil组肾小管中凋亡细胞的数量明显减少;表明Rho激酶抑制剂明显减轻CP诱导的肾小管上皮细胞凋亡。ROCK分为ROCK1及ROCK2,前者主要存在于非神经组织如肝脏、睾丸与肾脏等,后者主要存在于中枢神经系统,如大脑皮质及小脑浦肯野细胞等[6]。研究中,我们同时测定了ROCK1与PTEN蛋白表达水平。研究结果证实了ROCK1调节凋亡的重要性:Rho激酶活化使PTEN表达上调,从而抑制Akt活性,凋亡增加。PTEN在调节Akt活性方面发挥着重要作用,研究表明,PTEN蛋白表达下调能够减轻肾脏小管上皮细胞的凋亡进而改善横纹肌溶解大鼠的肾脏损伤[3]。本研究中,CP注射后的大鼠PTEN蛋白表达增加,经法舒地尔干预治疗的模型鼠PTEN蛋白表达明显下降。因而,我们推测法舒地尔调节肾脏保护主要是通过抑制PTEN蛋白表达进而促进Akt磷酸化增加凋亡减少。PTEN与ROCK1活性改变的一致性,使我们推断法舒地尔对PI3K/Akt信号途径的影响似乎是由于通过抑制ROCK活性进而抑制PTEN蛋白表达而实现的。
PI3K/Akt信号通路是重要的生存信号途径,作为生存因子, Akt活化能够改善细胞凋亡。相反,抑制了PI3K/Akt途径,能够导致细胞凋亡,这种原理已经开始在肾脏肿瘤的治疗方面应用[10]。研究表明,PI3K敲除的大鼠肾脏细胞凋亡和CP-AKI明显恶化[11]。在正常细胞中,PTEN具有磷酸酶活性,可以使PIP3脱磷酸形成PIP2,使其丧失信使功能,从而抑制PI3K/Akt通路,活化的Akt是PI3K/Akt通路发挥作用的关键。 Rho激酶能够通过上调PTEN蛋白表达,抑制PI3K/Akt通路的活化进而促进凋亡。众所周知,Akt活化是预防CP诱导的肾小管上皮细胞凋亡的主要因素之一。Nozaki等[2]表明ROCK抑制能够预防CP诱导的肾小管上皮细胞凋亡,然而,未对参与的具体信号通路进行阐明。Kentrup等[12]亦报道了抑制ROCK通路能够增加Akt的活性,改善缺血再灌注肾脏的损伤。Kong等[13]指出维持Akt活性能够减轻肾脏小管上皮细胞CP毒性。本研究中,我们观察到法舒地尔治疗明显使注射CP大鼠降低的Akt磷酸化水平增加,表明ROCK抑制剂能够通过抑制PTEN蛋白表达,活化PI3K/Akt通路。
综上所述,从本研究可以认为法舒地尔能够有效地抑制CP-AKI时的肾小管上皮细胞凋亡,其机制可能与抑制PTEN表达进而活化Akt相关。然而,应用PI3K/Akt途径特异性抑制剂进行深入研究,证实该分子机制在法舒地尔肾脏保护方面的重要性仍是不可缺少的。
[参考文献]
[1]Wakino S, Kanda T, Hayashi K. Rho/Rho kinase as a potential target for the treatment of renal disease[J]. Drug News Perspect, 2005, 18(10): 639-643.
[2]Nozaki Y, Kinoshita K, Hino S, et al. Signaling Rho-kinase mediates inflammation and apoptosis on T-cell and renal tubules in nephrotoxicity[J]. Am J Physiol Renal Physiol, 2015, 308(8):F899-F909.
[3]Wang YD, Zhang L, Cai GY, et al. Fasudil ameliorates rhabdomyolysis-induced acute kidney injury via inhibition of apoptosis[J]. Ren Fail, 2011, 33(8):811-818.
[4]李春媚,阮颖新,刘素雁,等. 卡维地洛减轻顺铂的肾损害[J]. 中国病理生理杂志,2008, 24(1):179-181.
[5]Wang N, Li QG, Zhang L, et al. Mesenchymal stem cells attenuate peritoneal injury through secretion of TSG-6[J]. PLoS One, 2012, 7(8): e43768.
[6]Endo T, Kimura O, Sakata M. Carrier-mediated uptake of cisplatin by the OK renal epithelial cell line[J]. Toxico-logy, 2000, 146(2-3):187-195.
[7]段为刚,袁胜涛,廖红,等. Rho激酶及其抑制剂的研究进展[J]. 药学学报,2007, 42(10):1013-1022.
[8]Li Z, Dong X, Wang Z, et al. Regulation of PTEN by Rho small GTPases[J]. Nat Cell Biol, 2005,7(4):399-404.
[9]Di Cristofano A, Pandolfi PP. The multiple roles of PTEN in tumor suppression[J]. Cell, 2000, 100(4):387-390.
[10]Sourbier C, Lindner V, Lang H, et al. The phosphoinosi-tide 3-kinase/Akt pathway: A new target in human renal cell carcinoma therapy[J]. Cancer Res, 2006, 66(10): 5130-5142.
[11]Kuwana H, Terada Y, Kobayashi T, et al. The phosphoinositide-3 kinase gamma-Akt pathway mediates renal tubular injury in cisplatin nephrotoxicity[J]. Kidney Int, 2008, 73(4):430-445.
[12]Kentrup D, Reuter S, Schnockel U, et al. Hydroxyfasudil-mediated inhibition of ROCK1 and ROCK2 improves kidney function in rat renal acute ischemia-reperfusion injury[J]. PLoS One, 200, 6(10):1-13.
[13]Kong DY, Zhuo L, Gao CL, et al. Erythropoietin protects against cisplatin-induced nephrotoxicity by attenuating endoplasmic reticulum stress-induced apoptosis[J]. J Nephrol, 2013, 26(1):219-227.

*[基金项目]广西自然科学基金资助项目(No. 2011GXNSFA018177);广东省泌尿外科重点实验室(No. 2010A060801016)资助
Fasudil hydrochloride prevents cisplatin-induced renal tubular epithelial cell apoptosis via Akt activation and PTEN inhibitionKONG De-yang, HAO Jian-bing, YE Xiang-mei, TANG Jie, BAO Na-na, HOU Dong-hua
(DepartmentofNephrology,FirstAffiliatedHospitalofHarbinMedicalUniversity,Harbin150081,China.E-mail:cangsang01@tom.com)
[ABSTRACT]AIM: To explore the protective effect of fasudil hydrochloride against cisplatin(CP)-induced renal tubular epithelial cell apoptosis via Akt activation and PTEN inhibition. METHODS: Healthy male Sprague-Dawley (SD) rats were randomly divided into control group, CP group and CP+ fasudil group. All animals were sacrificed 96 h after injection of 0.9% saline or CP. Blood samples and kidney tissues were collected to evaluate levels of blood urea nitrogen (BUN), serum creatinine (sCr) and morphological alteration of the kidneys, respectively. The apoptosis of renal tubular epithelium cells was detected by TUNEL. Protein levels of Rho-associated protein kinase 1 (ROCK1), PTEN and Akt were measured by Western blotting and immunohistochemistry. The protein level of p-Akt was analyzed by Western blotting. RESULTS: Compared with control group, the sCr and BUN levels, the expression of ROCK1 and PTEN and TUNEL-positive cells were increased, while the level of p-Akt was decreased in CP group and CP+fasudil group. The histological structure of the kidneys observed by PAS staining was developed marked structural damage in CP group(P<0.05). Compared with CP group, sCr level, the expression of ROCK1 and PTEN and TUNEL-positive cells were decreased, while the level of p-Akt was increased in CP+fasudil group (P<0.05). Very little structural damage was detected in fasudil-treated groups. CONCLUSION: Fasudil hydrochloride has a protective effect on CP-induced renal tubular epithelial cell apoptosis via Akt activation and PTEN inhibition 1.
[KEY WORDS]Fasudil hydrochloride; Cisplatin; Acute kidney injury; Apoptosis; Rho-associated protein kinase 1
通讯作者△Tel: 0771-5356516; E-mail: assheep@163.com
[收稿日期]2015- 04- 28[修回日期] 2015- 10- 16
[文章编号](责任编辑: 陈妙玲, 余小慧)1000- 4718(2015)12- 2259- 06
doi:10.3969/j.issn.1000- 4718.2015.12.024
[中图分类号]R363.2
[文献标志码]A
