白花丹醌对人肝星状细胞Nox4/ROS及α-SMA生成的影响*
2016-01-31杨成芳李勇文钟毓娟熊美丽方舒萍
杨成芳, 李 丽, 李勇文, 钟毓娟, 熊美丽, 方舒萍
(桂林医学院,广西 桂林 541004)
白花丹醌对人肝星状细胞Nox4/ROS及α-SMA生成的影响*
杨成芳,李丽△,李勇文,钟毓娟,熊美丽,方舒萍
(桂林医学院,广西 桂林 541004)
[摘要]目的: 研究白花丹醌(plumbagin)对转化生长因子β1(TGF-β1)刺激的体外培养人肝星状细胞(HSC-LX2)NADPH氧化酶4(Nox4 )的mRNA和蛋白表达、活性氧簇(ROS)水平及α-平滑肌肌动蛋白(α-SMA)蛋白表达的影响。方法: 体外培养HSC-LX2,随机设立空白组、TGF-β1刺激的模型组、TGF-β1+ plumbagin (2 μmol/L、1.5 μmol/L及1 μmol/L)组;细胞与各药物共同孵育72 h后,采用RT-PCR检测细胞Nox4 mRNA的表达;原位装载探针法测定细胞内ROS的水平;Western blot检测细胞内Nox4和α-SMA的蛋白含量。结果: 与模型组比较,白花丹醌作用72 h后,2 μmol/L和1.5 μmol/L plumbagin能明显降低HSC-LX2细胞Nox4 mRNA和蛋白的表达(P<0.01),下调ROS水平,降低α-SMA的蛋白表达(P<0.01)。结论: Plumbagin可能是通过下调Nox4的表达进而降低ROS生成从而发挥其抑制HSC-LX2细胞活化的作用。
[关键词]白花丹醌; 转化生长因子β1; HSC-LX2细胞; NADPH氧化酶4; 活性氧簇; α-平滑肌肌动蛋白
研究显示氧化应激可以诱导人肝星状细胞(hepatic stellate cells,HSCs)的活化,其中活性氧簇(reactive oxygen species,ROS)与HSCs的活化密切相关,其活化后高表达的α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)具有调节、分泌细胞因子和基质金属蛋白酶并产生大量的细胞外基质,这些是肝纤维化的细胞学基础[1-2]。NADPH氧化酶(NADPH oxidase,Nox)、一氧化氮合酶、环氧合酶、细胞色素P450氧化酶和黄嘌呤氧化酶等所催化的反应过程中均伴有ROS的产生[3]。 Nox至少有7种亚型,在肝脏中Nox4是介导ROS产生的最主要的Nox亚型,在肝细胞、肝星状细胞和肌纤维母细胞内Nox4的表达远远高于其它亚型[4-5]。由Nox4产生的ROS可介导丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)和磷脂酰肌醇3/蛋白激酶B(phosphoinositide 3-kinase/protein kinase B,PI3K/Akt)信号通路激活,促进HSCs的激活并抑制其凋亡,最终导致肝纤维化的形成[4,6-7]。本课题组前期研究发现白花丹醌能抑制HSC的增殖与活化,国内也有相关的研究,但其通过抗氧化应激作用抑制HSC-LX2细胞株的增殖与活化尚未有文献报道。转化生长因子β1(transforming growth factor β1,TGF-β1)是作用最强的促肝纤维化因子[8-9]。本研究拟用TGF-β1刺激HSC-LX2细胞建立活化的HSC-LX2细胞模型,旨在探讨白花丹醌抑制HSC-LX2细胞活化的分子机制。
材料和方法
1实验材料
1.1细胞来源人肝星状细胞株HSC-LX2(博慧斯生物医药科技有限公司)。
1.2药物与试剂白花丹醌、维生素E(vitamin E,Vit E)和LY364947(TGF-β1受体抑制剂)均购自Sigma;高糖DMEM培养基和胎牛血清(HyClone);TGF-β1、novoprotein、RNApure高纯总RNA快速提取试剂盒和2×Taq PCR Master Mix(北京艾德莱生物);TIANScript cDNA 第1链合成试剂盒(TIANGEN);兔抗人Nox4单克隆抗体(上海生工);鼠抗人GAPDH/α-SMA单克隆抗体(Aidlab Biotechnologies); HRP 标记山羊抗兔/兔抗鼠 II 抗(北京中杉金桥生物技术有限公司); ROS探针(Cayman)。
1.3主要仪器CO2培养箱(Thermo);高速冷冻离心机(Eppendorf);PTC-220多通道PCR仪(MJ);核酸蛋白测定仪(Shimadzu);倒置相差显微镜(Zeiss);DYY-6D凝胶电泳仪/电泳槽(北京赛因坦科技有限公司);JS-780全自动凝胶成像分析系统(上海培清科技);蛋白电泳仪/电转膜仪(JY600C,上海生工)。
2实验方法
2.1细胞培养将人肝星状细胞系HSC-LX2置于10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的高糖DMEM培养液,37 ℃、5% CO2条件下培养,隔天换液,待细胞长至70%~80%密度时用0.25%的EDTA胰蛋白酶消化,每2~3 d传代1次,每次实验均取呈指数生长的细胞进行。
2.2MTT法检测白花丹醌对TGF-β1+LY364947作用后HSC-LX2细胞活力的影响MTT操作步骤参照文献[10]进行。对照组加入含终浓度为5 μg/L 的TGF-β1+终浓度为1 μmol/L的LY364947,各给药组在对照组的基础上加入含各浓度的药物作用72 h,各组白花丹醌终浓度分别为0.25、0.5、1、2、4、8、16和32 μmol/L,每组设6个复孔。计算细胞活力抑制率。细胞活力抑制率=(A对照组-A给药组)/A对照组×100%。
2.3RT-PCR和Western blot实验的细胞分组及处理空白对照组:加入胎牛血清的DMEM高糖培养液;模型组:加入含TGF-β1终浓度为5 μg/L胎牛血清DMEM高糖培养液;白花丹醌高、中、低浓度组:在加入终浓度为5 μg/L TGF-β1刺激24 h基础上加入白花丹醌作用72 h,终浓度分别为2 μmol/L、1.5 μmol/L和1 μmol/L[11]。
2.4RT-PCR检测HSC-LX2细胞 Nox4的mRNA表达采用TRIzol法抽提细胞中总RNA。用核酸蛋白测定仪测定RNA含量和纯度,A260/A280均在1.8~2.0之间;取总RNA 5 μg,采用M-MuLV 逆转录酶将其逆转录成cDNA;用Primer Premier 5.0自行设计引物,Nox4的上游引物序列为5’-CCGAACACTCTTGGCTTACC-3’,下游引物序列为5’-CACTGAGAAGTTGAGGGCATT-3’;β-actin的上游引物序列为5’-CACTCTTCCAGCCTTCCTTCC-3’,下游引物序列为5’-CGTACAGGTCTTTGCGGATGTC-3’。所得cDNA按2×Taq PCR Master Mix试剂盒说明,加2 μL cDNA模板扩增基因片段,PCR反应参数为:94 ℃ 3 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃ 5 min。反应结束后取10 μL RT-PCR产物及8 μL DNA marker进行2%琼脂糖凝胶电泳,结果经培清JS-780全自动凝胶成像分析系统进行分析,样本Nox4的mRNA PCR产物条带的光密度与内参照β-actin的mRNA PCR产物条带的光密度(A)比值作半定量分析。实验重复3次。
2.5原位装载探针法检测HSC-LX2细胞内ROS的生成将呈指数生长的HSC-LX2细胞以每孔5×103的密度接种于6孔板,分为空白对照组、TGF-β1模型组、Vit E(200 mg/L)组[12]以及白花丹醌2 μmol/L、1.5 μmol/L和1 μmol/L组。药物与细胞共孵育72 h后,弃培养基,除正常组外,各组加含TGF-β1终浓度为5 μg/L的培养基,置37 ℃孵育30 min,弃培养基,加入含ROS探针终浓度为10 μmol/L的培养基,37 ℃避光孵育25 min,PBS洗3次,荧光显微镜下观察、拍照。实验重复3次。
2.6Western blot检测细胞内Nox4和α-SMA的蛋白含量低温提取细胞总蛋白,改良BCA法测定蛋白浓度,每孔上样50 μg蛋白,12% SDS-PAGE分离蛋白,转膜,5%脱脂奶粉封闭1 h,分别滴加GAPDH、Nox4和α-SMA(1∶500) I 抗,4 ℃摇床过夜,洗膜,加 II 抗(1∶5 000)室温孵育1 h,洗膜后将超敏ECL发光液滴加到膜上,当条带充分显色后,压X光片,暗室曝光5~10 s,将X胶片进行显影、定影后可见到清晰条带。所得胶片经JS-780全自动凝胶成像分析系统进行灰度值分析。实验重复3次。
3统计学处理
采用SPSS 17.0统计软件分析数据,计量资料采用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,各组均数间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1白花丹醌对TGF-β1+LY364947作用后HSC-LX2细胞活力的影响
如图1所示,HSC-LX2细胞经过TGF-β1+LY364947处理后,白花丹醌在0.25~ 2 μmol/L之间对细胞活力的抑制率小于10%,说明白花丹醌在这个范围内对正常的HSC-LX2细胞的毒性较小。
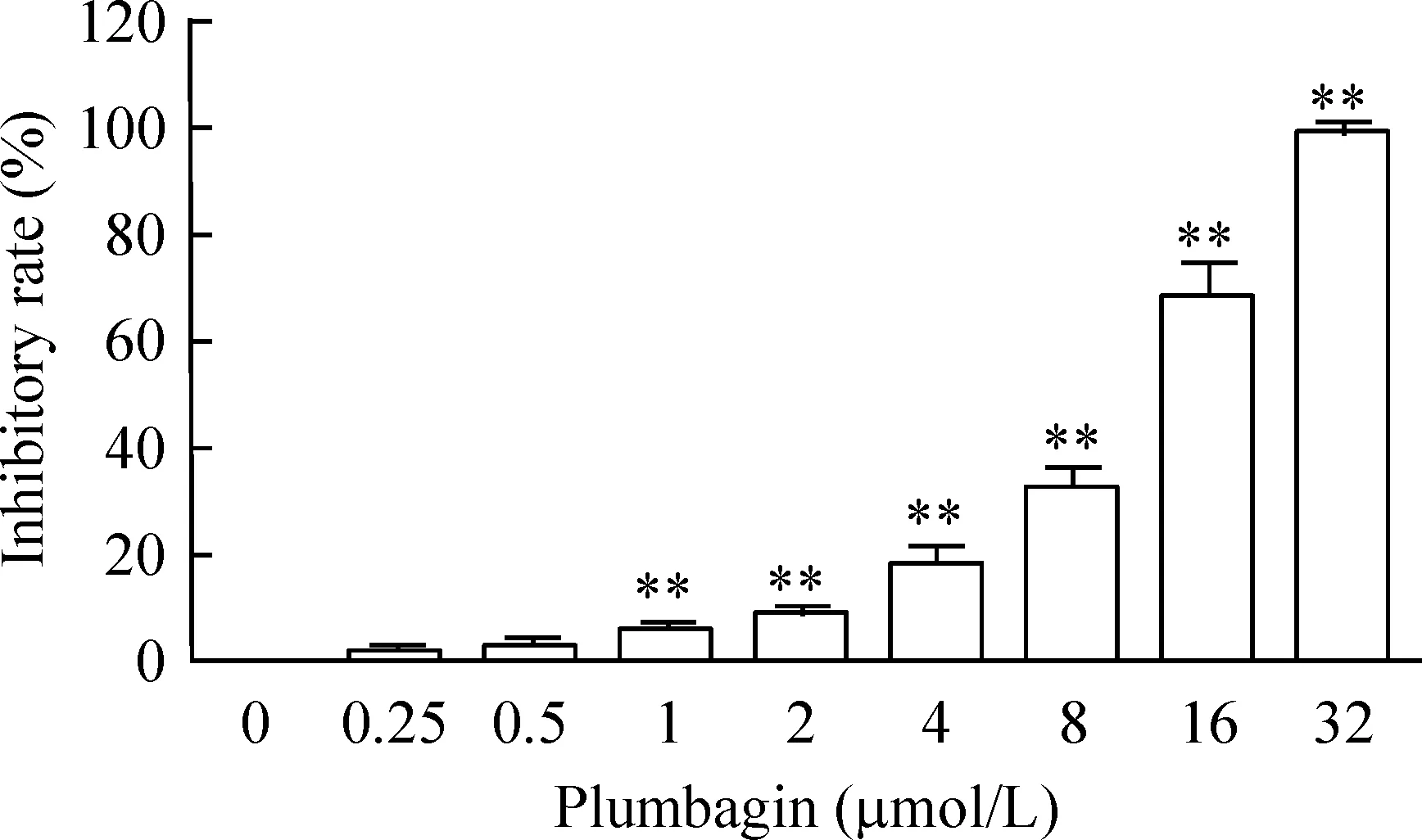
Figure 1.The effect of plumbagin on the HSC-LX2 cells after treated with TGF-β1 and LY364947. Mean±SD.n=6.**P<0.01vs0 μmol/L.
图1白花丹醌对经TGF-β1及LY364947作用后HSC-LX2细胞活力的影响
2白花丹醌对HSC-LX2细胞Nox4 mRNA表达的影响
RT-PCR结果显示,与空白对照组比较,模型组HSC-LX2细胞中Nox4 mRNA的表达明显增强(P<0.01);与模型组相比,2 μmol/L组和1.5 μmol/L白花丹醌作用72 h后,HSC-LX2细胞Nox4 mRNA的表达明显下降(P<0.01),见图2。
3白花丹醌对HSC-LX2细胞内ROS水平的影响
原位装载探针法检测结果显示,与空白对照组相比,模型组HSC-LX2细胞内绿色荧光明显增强,表明ROS水平明显升高。与模型组相比,Vit E组细胞内绿色荧光信号明显减弱;白花丹醌各浓度组可不同程度下调ROS的表达,随着白花丹醌浓度的增加,HSC-LX2细胞内荧光强度明显减弱且发绿色荧光的细胞数明显减少,白花丹醌2 μmol/L组与Vit E组细胞内的荧光信号强度相当,见图3。
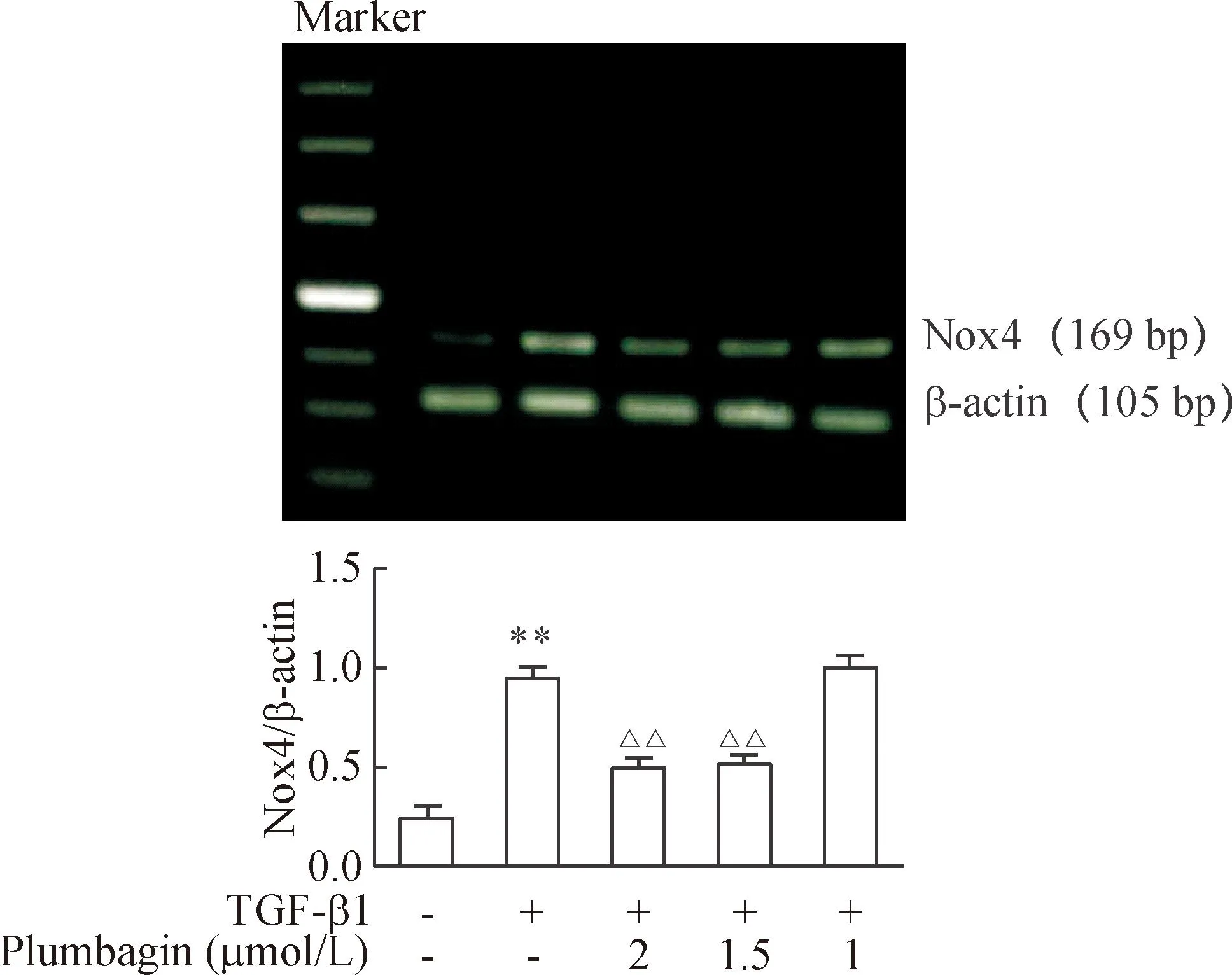
Figure 2.The effect of plumbagin on the mRNA expression of Nox4 in the HSC-LX2 cells.Mean±SD.n=3.**P<0.01vsblank control;△△P<0.01vsTGF-β1.
图2白花丹醌对HSC-LX2细胞Nox4 mRNA表达的影响
4白花丹醌对HSC-LX2细胞Nox4和α-SMA蛋白表达的影响
Western blot检测结果显示,与空白对照组相比,TGF-β1刺激后,HSC-LX2细胞内Nox4和α-SMA的蛋白表达显著增加(P<0.01)。与模型组相比,2 μmol/L和1.5 μmol/L浓度白花丹醌作用72 h后,Nox4和α-SMA的蛋白表达减少,差异有统计学意义(P<0.01),见图4。
讨论
肝星状细胞是肝纤维化时产生过量细胞外基质(extracellular matrix,ECM)的主要来源细胞,其活化增殖是肝纤维化形成的关键。逆转肝纤维化关键在于减少活化的HSCs数量[13-14]。HSCs活化时具有高度增殖活性并能转化为高表达α-SMA的肌成纤维细胞,合成大量ECM,故α-SMA的表达被认为是HSCs活化的显著特征之一[15]
研究显示,在各种炎症刺激因子、生长因子和促纤维化因子中,TGF-β1是作用最强的促肝纤维化因子[8-9],它除了能促进HSCs的增殖与活化,还能通过自分泌机制产生扩增效应。据报道[4,16],Nox在肝纤维化进程中发挥着重要作用,在肝纤维化动物模型及肝纤维化病人病程中均伴随Nox4的增加,其通过调节肝细胞的凋亡和肝星状细胞的活化促进肝纤维化的发展。现已证明,由Nox4产生的ROS是细胞内信号转导的第二信使[17],介导了各种促肝纤维化因子在细胞内信号转导。研究表明,ROS可直接刺激HSCs的增殖与活化,促进肝纤维化的发生[1,18-19]。本研究结果显示,TGF-β1刺激后模型组HSC-LX2中Nox4 mRNA及蛋白表达明显增强、ROS水平明显升高、α-SMA蛋白呈现强表达,表明活化的HSC-LX2细胞模型建立成功。
Figure 3.The effect of plumbagin on ROS production in the HSC-LX2 cells.Mean±SD.n=3.**P<0.01vsblank control;△△P<0.01vsTGF-β1.
图3白花丹醌对HSC-LX2细胞ROS生成的影响
本课题组前期研究显示白花丹醌能明显抑制TGF-β1刺激的HSC-LX2细胞的增殖和活化,IC50为1.72 μmol/L,呈剂量依赖性[11]。本研究结果显示HSC-LX2细胞经过TGF-β1+LY364947处理后,白花丹醌在0.25~2 μmol/L之间对细胞活力的抑制率小于10%,说明白花丹醌在0.25~2 μmol/L范围内对正常HSC-LX2细胞的毒性较小,而对TGF-β1刺激的活化型HSC-LX2的生长具有明显的抑制作用。TGF-β1刺激后模型复制成功后,给予白花丹醌作用72 h,HSCs中Nox4 mRNA及蛋白表达、ROS水平及α-SMA蛋白明显减少,提示白花丹醌抑制HSCs增殖和活化功能的机制之一可能与抑制Nox4及ROS的表达等抗氧化功能有关,关于其抑制Nox4后ROS生成减少介导的细胞内信号通路的改变有待进一步研究。
Figure 4.The effect of plumbagin on the protein expression of Nox4 and α-SMA in the HSC-LX2 cells detected by Western blot.Mean±SD.n=3.**P<0.01vsblank control;△△P<0.01vsTGF-β1.
图4白花丹醌对HSC-LX2细胞中Nox4和α-SMA蛋白表达的影响
[参考文献]
[1]Sanchez-Valle V, Chavez-Tapia NC, Uribe M, et al. Role of oxidative stress and molecular changes in liver fibrosis: a review[J]. Curr Med Chem, 2012, 19(28):4850-4860.
[2]李博,何文华,刘戈云,等. 活性氧簇与肝纤维化发病的研究进展[J]. 国际消化杂志, 2009, 29(2):89-91.
[3]张晓岚,王占魁,姜慧卿. 氧化应激与肝纤维化[J]. 临床肝胆病杂志,2007,23(3):226-229.
[4]Sancho P, Mainez J, Crosas-Molist E, et al. NADPH oxidase 4 mediates stellate cell activation and hepatocyte cell death during liver fibrosis development[J]. PLoS One, 2012, 7(9):e45285.
[5]Ikeda R, Ishhii K, Hoshikawa Y, et al. Reactive oxygen species and NAPDH oxidase 4 induced by transforming growth factor beta1 are the therapeutic targets of polyenylphosphatidylcholine in the suppression of human hepatic stellate cell activation[J]. Inflamm Res, 2011, 60(6):597-604.
[6]De Minicis S, Brenner DA. NOX in liver fibrosis[J]. Arch Biochem Biophys, 2007, 462(2):266-272.
[7]Ikeda R, Ishii K, Hoshikawa Y, et al. Reactive oxygen species and NADPH oxidase 4 induced by transforming growth factor β1 are the therapeutic targets of polyenylphosphatidylcholine in the suppression of human hepatic stellate cell activation[J]. Inflamm Res, 2011, 60(6):597-604.
[8]郭锐芳,杨少奇. 以 TGF-β 为靶点的抗肝纤维化治疗[J]. 实用肝脏病杂志,2008, 11(5):341-343.
[9]Cheng K, Yang N, Mahato RI.TGF-β1 gene silencing for treating liver fibrosis[J]. Mol Pharm, 2009, 6(3):772-779.
[10]张新华,何文华,朱宣,等. 熊果酸对活化型肝星状细胞NAPDH氧化酶亚基p47phox表达及ERK1/2信号通路活化的影响[J]. 第二军医大学学报,2012, 33(6):590-594.
[11]杨成芳,李勇文,钟毓娟,等. 白花丹醌对TGF-β1刺激人肝星状细胞α-SMA表达的影响[J]. 中国实验方剂学杂志, 2015, 21(13):139-142.
[12]郝冉冉,王晨静,仲伟珍,等. 熊果酸对ox-LDL诱导的人脐静脉内皮细胞氧化损伤的保护作用[J]. 中药药理与临床, 2014, 30(4):29-32.
[13]Shu JC, He YJ, Lv X, et al. Curcumin prevents liver fibrosis by inducing apoptosis and suppressing activation of hepatic stellate cells[J]. J Nat Med, 2009, 63(4):415-420.
[14]Suh YG, Jeong WI. Hepatic stellate cells and innate immunity in alcoholic liver disease[J]. World J Gastroenterol, 2011, 17(20):2543-2551.
[15]Svegliati-Baroni G, DeMinicis S, Marzioni M. Hepatic fibrogenes is in response to chronic liver injury: novel insights on the role of cell-to-cell interation and transition[J]. Liver Int, 2008, 28(8):1052-1064.
[16]Paik YH, Kim J, Aoyama T, et al. Role of NADPH oxidases in liver fibrosis[J]. Antioxid Redox Signal, 2014, 20(17):2854-2872.
[17]Forman HJ, Fukuto JM, Torres M. Redox signaling: thiol chemistry defines which reactive oxygen and nitrogen species can act as second messengers[J]. Am J Physiol Cell Physiol, 2004, 287(2):C246-C256.
[18]Nieto N, Friedman SL, Cederbaum AI. Stimulation and proliferation of primary rat hepatic stellate cells by cytochrome P450 2E1-derived reactive oxygen species[J]. Hepatology, 2002, 35(1):62-73.
[19]Friedman SL. Evolving challenges in hepatic fibrosis[J]. Nat Rev Gastroenterol Hepatol, 2010, 7(8):425-436.

*[基金项目]哈医大一院科研基金(No. 2013Y01)
Effect of plumbagin on levels of Nox4/ROS and α-SMA in human hepatic stellate cellsYANG Cheng-fang, LI Li, LI Yong-wen, ZHONG Yu-juan, XIONG Mei-li, FANG Shu-ping
(GuilinMedicalUniversity,Guilin541004,China.E-mail: 31910753@qq.com)
[ABSTRACT]AIM: To observe the effect of plumbagin on the mRNA and protein expression of nicotinamide adenine dinucleotidephosphate oxidase 4 (Nox4), reactive oxygen species (ROS) level and protein expression of α-smooth muscle actin (α-SMA) in the HSC-LX2 cells stimulated with transforming growth factor β1 (TGF-β1) in vitro. METHODS: HSC-LX2 cells were cultured in vitro and divided into blank group, model group, high-, medium- and low-dose (2, 1.5 and 1 μmol/L) plumbagin groups. After incubated with each drug for 72 h, the mRNA expression of Nox4 was detected by RT-PCR. ROS levels were tested by in situ loading probe method. The protein contents of Nox4 and α-SMA were measured by Western blot. RESULTS: Compared with model group, after treated with plumbagin for 72 h, the mRNA expression of Nox4, ROS level and α-SMA protein were significantly decreased in high-and medium-dose plumbagin groups (P<0.01). CONCLUSION: Plumbagin inhibits the activation of HSC-LX2 cells via decreasing the expression of Nox4, thus decreasing ROS levels.
[KEY WORDS]Plumbagin; Transforming growth factor-β1; HSC-LX2 cells; Nicotinamide adenine dinucleotidephosphate oxidase 4; Reactive oxygen species; α-Smooth muscle actin
通讯作者△Tel: 0451-85555208; E-mail: cangsang01@tom.com
[收稿日期]2015- 05- 11[修回日期] 2015- 10- 09
[文章编号](责任编辑: 陈妙玲, 余小慧)1000- 4718(2015)12- 2254- 05
doi:10.3969/j.issn.1000- 4718.2015.12.023
[中图分类号]R363.1
[文献标志码]A
