趋化素通过上调磷酸化JNK促进小鼠血管平滑肌细胞的增殖*
2016-01-31董少红李江华廖碧红庞新利罗林杰
熊 玮, 董少红△, 张 键, 李江华, 廖碧红, 庞新利, 罗林杰
(1暨南大学第二临床医学院/深圳市人民医院心内科,广东 深圳 518020;2中国科学院深圳先进技术研究院,广东 深圳 518055)
趋化素通过上调磷酸化JNK促进小鼠血管平滑肌细胞的增殖*
熊玮1,董少红1△,张键2,李江华1,廖碧红1,庞新利1,罗林杰1
(1暨南大学第二临床医学院/深圳市人民医院心内科,广东 深圳 518020;2中国科学院深圳先进技术研究院,广东 深圳 518055)
[摘要]目的: 利用慢病毒构建趋化素基因缺陷性小鼠血管平滑肌细胞株,观察沉默趋化素基因后血管平滑肌细胞的增殖情况并探讨其机制。方法: 将正常血管平滑肌细胞、趋化素基因干扰对照血管平滑肌细胞株和趋化素基因缺陷性血管平滑肌细胞株分成正常组、增殖组、对照组和沉默组,增殖组加入血小板源性生长因子BB促进增殖,采用细胞计数和BrdU法检测血管平滑肌细胞增殖,采用Western blot检测丝裂原激活蛋白激酶( MAPK)信号通路的蛋白水平。结果: 增殖组血管平滑肌细胞的细胞数目和BrdU的A值显著高于正常组(P<0.05);与正常组相比,沉默组的血管平滑肌细胞数目和BrdU的A值显著降低(P<0.05);与此同时,对照组与正常组之间的血管平滑肌细胞增殖情况无明显差异。各组血管平滑肌细胞之间的p-ERK1/2、ERK1/2、p-p38 MAPK和p38 MAPK水平无明显变化,增殖组血管平滑肌细胞的p-JNK蛋白表达增加,而沉默组血管平滑肌细胞的p-JNK水平下降。结论: 趋化素具有促进小鼠血管平滑肌细胞增殖的作用,该作用可能与p-JNK表达上调相关。
[关键词]血管平滑肌细胞; 趋化素; 细胞增殖; c-Jun氨基末端激酶
再狭窄是冠状动脉介入治疗之后的主要并发症,其发生是由于介入损伤和血管局部炎症反应导致血管平滑肌细胞(vascular smooth muscle cells,VSMCs)增殖和迁移到内膜下、分泌细胞外基质的结果[1]。趋化素(chemerin)是一种新发现的脂肪因子,是孤独G蛋白偶联受体CMKLR1的内源性配体[2]。研究发现,人冠状动脉周围的脂肪组织及冠状动脉病变部位的VSMCs和泡沫细胞均可高表达趋化素,冠心病患者血浆中的趋化素水平亦明显升高,表明趋化素可能与冠状动脉粥样硬化的发生相关[3- 4]。我们在前期实验中利用慢病毒构建了趋化素基因缺陷性VSMC株,在本研究中我们检测沉默趋化素基因后VSMCs的增殖情况并探讨其机制。
材料和方法
1试剂和耗材
SPF级NIH小鼠购自广东省实验动物中心;DMEM培养基、0.25%胰酶和FBS购自Gibco;小鼠α-SMA抗体购自博士德公司;Lipofectamine 2000购自Invitrogen;BamHⅠ和EcoRⅠ限制性内切酶购自Thermo;T4DNA ligase购自NEB;MinElute Reaction Cleanup Kit、Endo-free Plasmid Max Kit购自Omega;PrimeScript RT reBamHnt Kit和Lenti-X Lentiviral Expression Systems购自TaKaRa;趋化素抗体、p-ERK1/2抗体、磷酸化p38丝裂原激活的蛋白激酶(phosphorylation p38 mitogen- activated protein kinase,p-p38 MAPK)抗体和p-JNK抗体购自Abcam;ERK1/2抗体和p38 MAPK抗体购自Santa Cruz; BrdU抗体购自Biovision。引物由生工公司合成。
2趋化素基因缺陷性VSMC株构建和鉴定
按照我们之前建立的方法[5]培养小鼠VSMCs,培养成功后分别将携带趋化素shRNA和趋化素shRNAc对照基因的慢病毒感染VSMCs,用嘌呤霉素对细胞进行筛选,筛选完成后提取细胞中RNA和蛋白,分别用real-time PCR和Western blot检测VSMCs中趋化素的mRNA和蛋白。
实验分成正常(normal)组、增殖(PDGF)组、对照(control)组和沉默(knockdown)组,normal和PDGF为正常VSMCs,control为趋化素shRNAc对照慢病毒VSMC株,knockdown为趋化素基因缺陷性VSMC株。PDGF组细胞在传代后加入终浓度为20 μg/L的血小板源性生长因子BB(platelet-derived growth factor-BB,PDGF-BB)刺激VSMCs增殖;normal组、control组和knockdown组VSMCs加入同等体积的PBS。
3实验方法
3.1VSMCs增殖实验细胞消化离心后以每孔1×104个细胞接种到96孔板,每组设6个复孔,24 h后进行转染,4~6 h后换成100 μL完全培养基。在加入PDGF-BB后48 h时吸尽培养板中的培养基,用0.25%含EDTA的胰酶30 μL充分消化,加入70 μL培养基,充分吹打以使消化下来的细胞完全混匀,吸取10 μL细胞悬液,用计数板在显微镜下计算各组VSMCs数目的变化。
另行BrdU ELISA实验。在加入PDGF-BB后48 h时分别在每孔加入BrdU标记溶液10 μL,轻柔混合均匀,在37 ℃、5%CO2培养箱中继续培养10 h,加入FixDenant溶液200 μL,室温孵育30 min后,1 500 r/min离心5 min,移除上清液,之后加入anti-BrdU-POD 工作液100 μL,室温孵育90 min,1 500 r/min离心5 min,移除上清液,用冲洗缓冲液 250 μL反复冲洗3遍后,移除上清液;加入底物溶液100 μL,室温孵育20 min;加入1 mol/L H2SO4溶液25 μL,300 r/min离心1 min,在15 min内用酶联免疫检测仪测定450 nm波长(参考波长690 nm)的吸光度(A)值。
3.2Western blot实验细胞传代生长48 h后常规提取总蛋白,每孔加入20 μL蛋白溶液,在10%的SDS-PAGE中80V、30 min及120V、1 h进行电泳分离,半干转液38 mA、90 min转入PVDF膜,5%牛奶封闭2 h,加入兔抗小鼠的I 抗(p-ERK1/2稀释比例为1∶200,ERK1/2为1∶100,p-p38 MAPK为1∶200,p38 MAPK为1∶100,p-JNK为1∶200,GAPDH为1∶1 000),4 ℃孵育过夜,1‰ TBST洗10 min 3次,加入羊抗兔 II 抗(1∶6 000)孵育1 h,1‰ TBST洗10 min 3次,加入ECL发光液100 μL在ImageQuant RT ECL冷CCD成像系统进行显影,用ImageQuant TL软件进行半定量分析。
4统计学处理
所有数据以均数±标准差(mean±SD)表示,使用SPSS 12.0统计学软件分析,各组间比较采用单因素方差分析,各组均数间的两两比较用SNK-q检验,以P<0.05表示差异有统计学意义。
结果
1VMSCs培养及鉴定
用免疫荧光鉴定小鼠血管平滑肌细胞中α-SMA表达,在胞浆见到大量阳性荧光颗粒,与细胞核融合,表明血管平滑肌细胞培养成功,见图1。

Figure 1.The immunofluorescence staining of mouse VSMCs (×100).
图1小鼠血管平滑肌细胞免疫荧光染色
2趋化素基因缺陷性VMSC株构建和鉴定
采用real-time PCR检测3种细胞株中趋化素的mRNA,Western bolt检测趋化素蛋白,结果显示,空白对照组的VSMCs (normal)和转染shRNAc的VSMCs (control)之间趋化素mRNA和蛋白无明显差异,而转染pLVX- Chn1 shRNA的基因缺陷性VMSCs(knockdown)的趋化素mRNA和蛋白水平明显下降(P<0.01),见图2,表明趋化素基因缺陷性VSMC株构建成功。
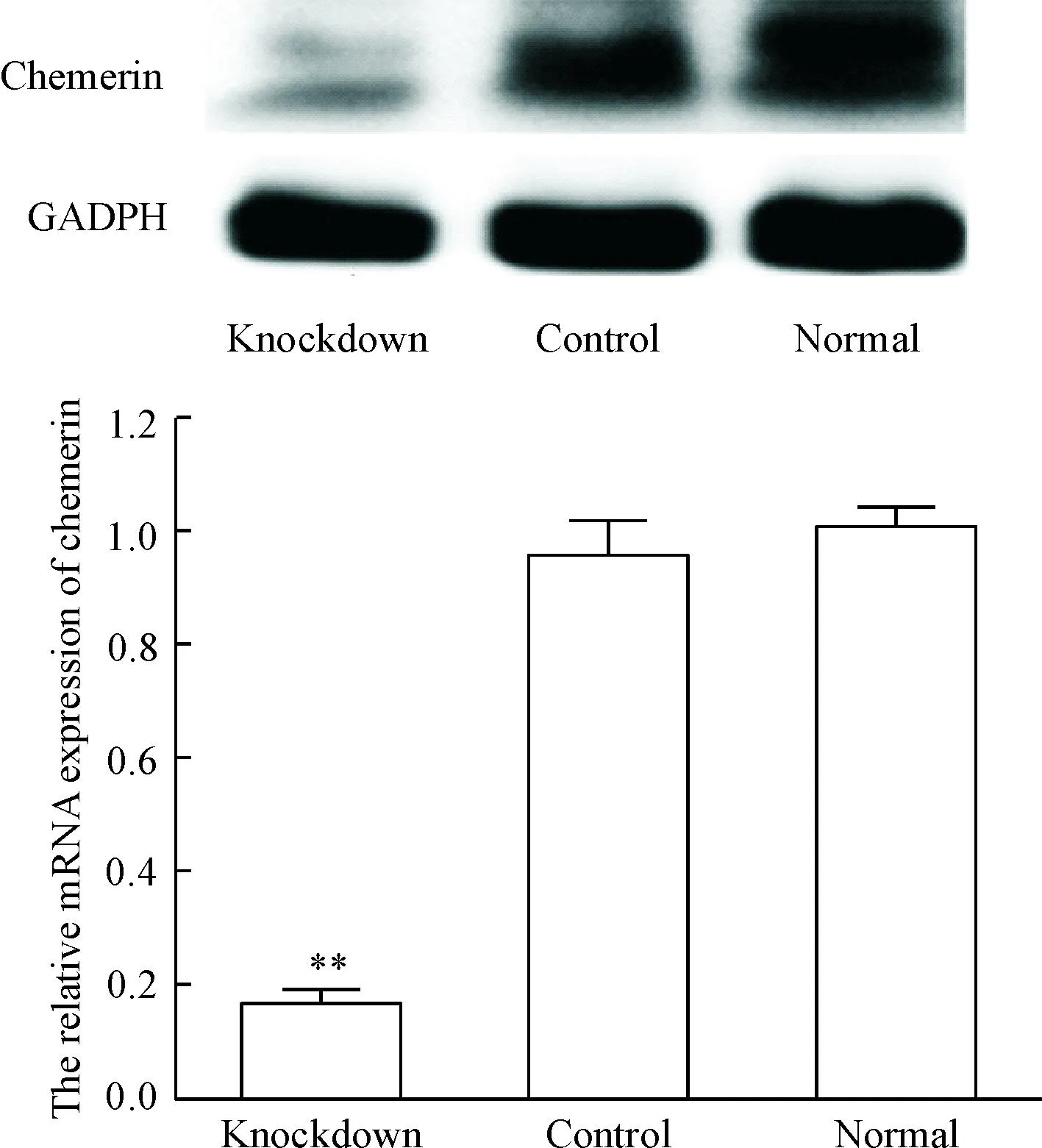
Figure 2.The mRNA and protein levels of chemerin in the VSMCs with different treatments were measured by real-time PCR and Western blot. Mean±SD.n=6.**P<0.01vsnormal.
图2Real-time PCR和Western blot检测VSMC株的趋化素mRNA和蛋白水平
3趋化素对血管平滑肌细胞增殖的影响
分别采用BrdU和细胞计数2种方法检测沉默趋化素基因后VSMCs的增殖情况。结果显示PDGF组的VSMCs数目和BrdU的A值显著高于正常VSMCs(P<0.05),表明PDGF-BB促进了VSMCs的增殖;与normal组相比,趋化素基因缺陷性VSMC株的细胞数目和BrdU的A值显著降低(P<0.05);与此同时,作为对照的趋化素shRNAc慢病毒VSMC株与normal组之间的VSMCs增殖情况无明显差异,见图3、4。以上结果表明趋化素具有促进VSMCs增殖的作用。
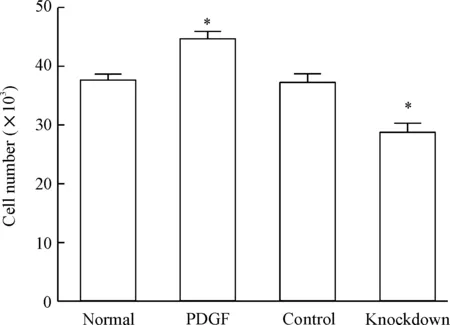
Figure 3.The number of VSMCs was measured by cell counting. Mean±SD.n=6.*P<0.05vsnormal.
图3细胞计数法检测VSMCs增殖
4Western blot实验结果
细胞生长48 h后测定各组VSMCs的蛋白,各组细胞p-ERK1/2、ERK1/2、p-p38 MAPK和p38 MAPK的蛋白水平无明显差异;与normal组VSMCs相比,PDGF组VSMCs的p-JNK水平增加,而knockdown组VSMCs的p-JNK蛋白水平下降(P<0.05),见图5。

Figure 4.The BrdU absorbance of the VSMCs with different treatments. Mean±SD.n=6.*P<0.05vsnormal.
图4BrdU法检测VSMCs的增殖
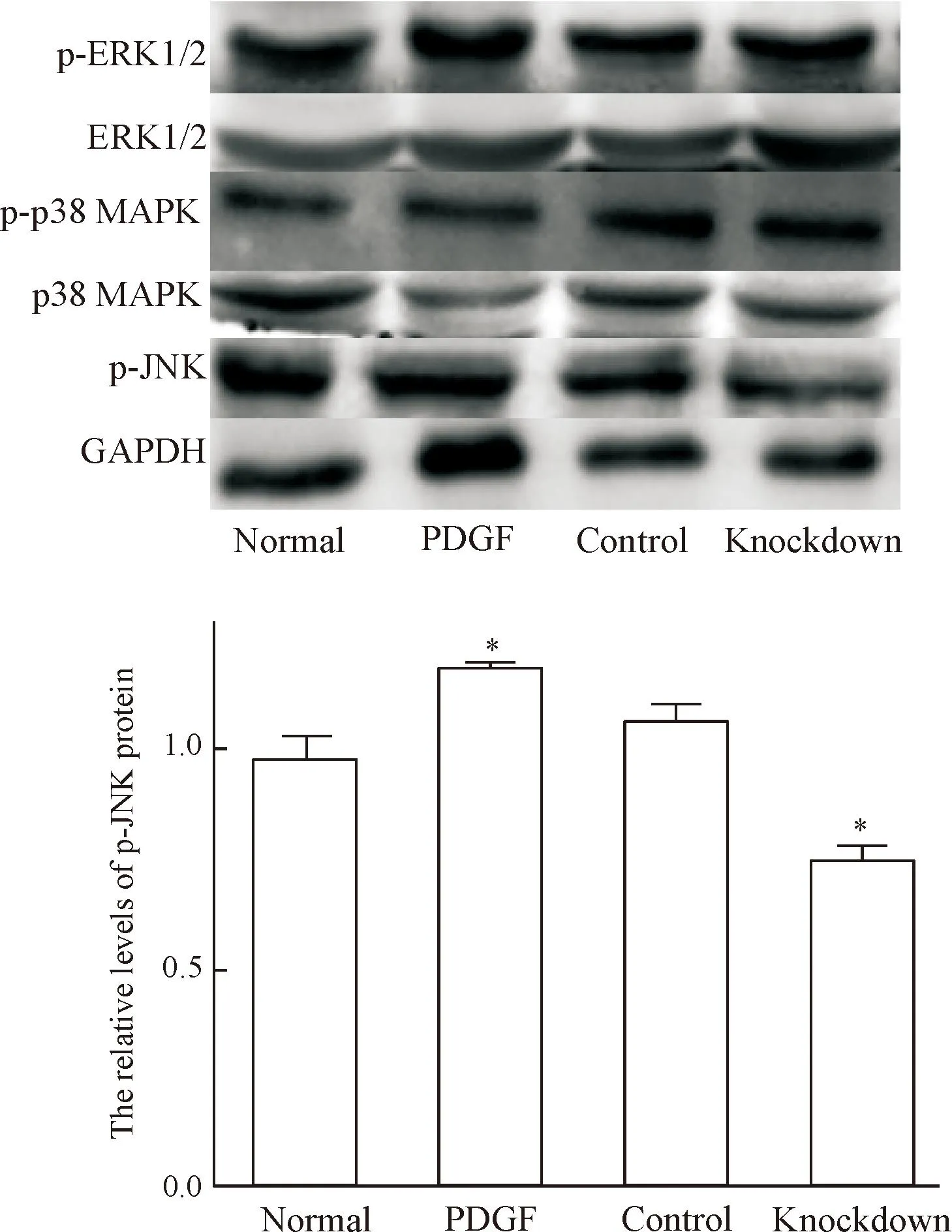
Figure 5.The proteins levels of MAPK pathway-related molecules were measured by Western blot.Mean±SD.n=3.*P<0.05vsnormal.
图5Western blot检测MAPK通路相关蛋白的水平
讨论
研究表明,趋化素具有调节脂肪细胞分化、促进脂质代谢、调节炎症和免疫反应等生物学效应,被认为是代谢综合征的标志物。在2型糖尿病患者中发现其血清趋化素水平明显升高,在进行减肥手术后趋化素水平明显下降[6]。关于趋化素的研究主要集中在代谢综合征和2型糖尿病。最近,Spiroglou等[3]研究发现,人冠状动脉周围的脂肪组织及冠状动脉病变部位的VSMCs和泡沫细胞均可高表达趋化素,且冠状动脉粥样硬化病变的严重程度与趋化素的水平呈正相关;在猝死患者的尸体解剖中也发现,冠状动脉不稳定斑块中的泡沫细胞和内皮细胞均存在趋化素高表达。Kaur等[7]发现人血管内皮细胞存在趋化素受体CMKLR1,TNF-α、IL-1β、IL- 6等促炎症因子可使其表达上调;趋化素与CMKLR1受体结合后可通过活化p42/44 MEK信号通路,诱导血管内皮细胞增殖和新生血管形成。Yoo等[8]检测了58例肥胖患者的血清趋化素,发现趋化素与踝肱指数、体重指数、胰岛素抵抗、低密度脂蛋白、甘油三酯、超敏C反应蛋白等呈正相关,与颈动脉内膜厚度不相关,认为循环趋化素水平升高是动脉粥样硬化的独立危险因素。研究[4]还发现,冠心病患者血浆趋化素显著升高,与冠状动脉病变支数、心率、血压、白细胞数量、中性粒细胞比例、纤维蛋白原、空腹血糖和肌酐水平等密切相关。最近,Watts等[9]发现趋化素在血管周围的脂肪组织中高表达,而CMKLR1则在血管中膜及内膜均有表达,用CMKLR1受体的激动剂chemerin-9可以呈浓度依赖地促进胸主动脉收缩,相反CMKLR1受体的拮抗剂CCX832可以抑制去甲肾上腺素和前列腺素 F2α诱导的胸主动脉收缩。以上研究均表明趋化素可能与动脉粥样硬化的发生和进展相关,但目前对于趋化素在动脉粥样硬化中的作用存在争议,如Lehrke等[10]认为血清趋化素水平虽与血糖、血脂水平呈正相关,但不能预测冠脉病变的发生。
MAPK是将信号从细胞表面转导至细胞内的重要传递者,在细胞增殖、迁移、凋亡、机体生长发育以及免疫应答等多种细胞生物过程中发挥着重要作用[11]。在自发性高血压大鼠中,MAPK的活化可促进VSMCs的增殖[12],氧化性低密度脂蛋白促进VSMCs分泌趋化因子也与MAPK活化有关[13],而且阻断MAPK信号通路可以抑制动脉损伤后的内膜增生和血管平滑肌细胞增殖[14]。在本研究中,我们采用RNA干扰的方法,利用慢病毒载体构建了趋化素基因缺陷性血管平滑肌细胞系,用real-time PCR检测细胞系中趋化素的mRNA水平,与正常组和对照组VSMCs相比,该细胞系的趋化素mRNA水平显著降低,表明趋化素基因缺陷性VSMC系构建成功;采用细胞计数和BrdU法检测血管平滑肌细胞增殖,与正常VSMCs相比,趋化素基因缺陷性VSMCs系的细胞数目和BrdU的A值均明显下降,表明趋化素具有促进VSMCs增殖的作用。对MAPK信号通路的关键分子检测发现,各组VSMCs的p-ERK1/2、ERK1/2、p-p38 MAPK和p38 MAPK水平无明显变化,增殖组血管平滑肌细胞的p-JNK蛋白表达增加,而沉默组血管平滑肌细胞的p-JNK水平下降。
综上所述,我们首次发现趋化素具有促进血管平滑肌细胞增殖的作用,该作用可能与磷酸化JNK被活化相关。
[参考文献]
[1]Curcio A, Torella D, Indolfi C.Mechanisms of smooth muscle cell proliferation and endothelial regeneration after vascular injury and stenting: approach to therapy[J].Circ J, 2011, 75(6):1287-1296.
[2]Ernst MC, Sinal CJ. Chemerin: at the crossroads of inflammation and obesity[J]. Trends Endocrinol Metab, 2010, 21(11):660- 667.
[3]Spiroglou SG, Kostopoulos CG, Varakis JN, et al. Adipokines in periaortic and epicardial adipose tissue: differential expression and relation to atherosclerosis[J]. J Atheroscler Thromb, 2010, 17(2):115-130.
[4]Dong B, Ji W, Zhang Y. Elevated serum chemerin levels are associated with the presence of coronary artery disease in patients with metabolic syndrome[J]. Intern Med,2011, 50(10):1093-1097.
[5]Dong S, Xiong W, Yuan J, et al.MiRNA-146a regulates the maturation and differentiation of vascular smooth muscle cells by targeting NF-κB expression[J].Mol Med Rep, 2013, 8(2):407- 412.
[6]Weigert J, Neumeier M, Wanninger J, et al. Systemic chemerin is related to inflammation rather than obesity in type 2 diabetes[J]. Clin Endocrinol, 2010, 72(3):342-348.
[7]Kaur J, Adya R, Tan BK, et al. Identification of chemerin receptor (ChemR23) in human endothelial cells: chemerin-induced endothelial angiogenesis[J]. Biochem Biophys Res Commun, 2010, 391(4):1762-1768.
[8]Yoo HJ, Choi HY, Yang SJ, et al. Circulating chemerin level is independently correlated with arterial stiffness[J]. J Atheroscler Thromb,2012, 19(1):59- 68.
[9]Watts SW, Dorrance AM, Penfold ME,et al. Chemerin connects fat to arterial contraction[J]. Arterioscler Thromb Vasc Biol, 2013, 33(6):1320-1328.
[10]Lehrke M, Becker A, Greif M, et al. Chemerin is asso-ciated with markers of inflammation and components of the metabolic syndrome but does not predict coronary atherosclerosis[J]. Eur J Endocrinol, 2009, 161(2):339-344.
[11]Burotto M, Chiou VL, Lee JM,et al. The MAPK pathway across different malignancies: a new perspective[J].Cancer, 2014, 120(22):3446-3456.
[12]王旭开,王燕,何作云,等.丝裂原活化蛋白激酶参与胰岛素对自发性高血压大鼠血管平滑肌细胞的增殖研究[J].中国病理生理杂志, 2000, 16(7):596-599.
[13]徐斌,张延斌,许旭光,等.TLR4/MAPKs信号通路在ox-LDL诱导的血管平滑肌细胞分泌MCP-1中的作用[J].中国病理生理杂志, 2010, 26(5):848- 852.
[14]Ohashi N,Matsumori A,Furukawa Y,et al.Role of p38 mitogen-activated protein kinase in neointimal hyperplasia after vascular injury[J].Arterioscler Thromb Vasc Biol, 2000, 20(12):2521- 2526.
(责任编辑: 卢萍, 罗森)

*[基金项目]卫生部公益性行业科研专项(No. 200802173)
Chemerin promotes proliferation of mouse vascular smooth muscle cells by up-regulating p-JNKXIONG Wei1, DONG Shao-hong1, ZHANG Jian2, LI Jiang-hua1, LIAO Bi-hong1, PANG Xin-li1, LUO Lin-jie1
(1DepartmentofCardiology,SecondClinicalMedicalCollegeofJinanUniversity,ShenzhenPeople’sHospital,Shenzhen518020,China;2ShenzhenInstitutesofAdvancedTechnology,ChineseAcademyofSciences,Shenzhen518055,China.E-mail:dsh266@medmail.com.cn)
[ABSTRACT]AIM: To investigate the proliferation property of stable chemerin gene knockdown vascular smooth muscle cells (VSMCs) and to explore its mechanism. METHODS: The normal VSMCs, chemerin gene interfering control VSMCs and stable chemerin gene knockdown VSMCs were divided into normal group, PDGF group, control group and knockdown group. The VSMCs in PDGF group were given platelet-derived growth factor-BB (PDGF-BB) to initiate proli-feration. The cell counting and BrdU assay were employed to investigate the proliferation property of VSMCs. The mitogen-activated protein kinase (MAPK) signal pathway was determined by Western blot. RESULTS: The cell number and BrdU A value in PDGF-BB-treated VSMCs significantly increased as compared with the normal VSMCs(P<0.05).Compared with the normal VSMCs, the chemerin knockdown VSMCs showed obviously decreased cell number and BrdU A value (P<0.05).Simultaneously, no significant difference in the proliferation of VSMCs between the normal VSMCs and the control VSMCs was observed. No significant difference of the protein levels of p-ERK1/2, ERK1/2, p-p38 MAPK and p38 MAPK among 4 kinds of VSMCs was found. The protein level of p-JNK in PDGF-BB-treated VSMCs was up-regulated, while it was down-regulated in chemerin knockdown VSMCs compared with the normal VSMCs. CONCLUSION: Chemerin promotes the proliferation of mouse vascular smooth muscle cells by up-regulating p-JNK production.
[KEY WORDS]Vascular smooth muscle cells; Chemerin; Cell proliferation; c-Jun N-terminal kinase
通讯作者△Tel: 0851-28609838; E-mail: zyyutian@126.com
[收稿日期]2015- 07- 01[修回日期] 2015- 09- 25
[文章编号]1000- 4718(2015)12- 2287- 05
doi:10.3969/j.issn.1000- 4718.2015.12.029
[中图分类号]R363
[文献标志码]A
