体外诱导人肾间质成纤维细胞成骨分化*
2016-01-31严一杰黎承杨邓耀良曾国华陶芝伟刘云龙
严一杰, 黎承杨△, 邓耀良, 曾国华, 陶芝伟, 刘云龙, 孙 春, 王 扬
(1广西医科大学第一附属医院泌尿外科,广西 南宁 530021; 2广州医科大学第一附属医院泌尿外科,广东 广州 510120)
体外诱导人肾间质成纤维细胞成骨分化*
严一杰1,黎承杨1△,邓耀良1,曾国华2,陶芝伟1,刘云龙1,孙春1,王扬1
(1广西医科大学第一附属医院泌尿外科,广西 南宁 530021;2广州医科大学第一附属医院泌尿外科,广东 广州 510120)
[摘要]目的: 观察在体外培养条件下,使用成骨诱导培养液或不同浓度钙离子诱导人肾间质成纤维细胞发生成骨分化的效果,初步探讨肾脏Randall斑形成可能的细胞机制。方法: 体外培养人肾间质成纤维细胞,实验分为5组:成骨诱导组(加成骨诱导液)、CaⅠ组(加0.5 mmol/L Ca2+液)、CaⅡ组(加1.5 mmol/L Ca2+液)、Ca Ⅲ 组(加2.5 mmol/L Ca2+液)和对照组(加PBS)。各组细胞分别培养至第1、3、6、9天时,采用MTT法检测细胞活力;诱导至第9天时,用细胞钙茜素红染色液和钙钴法磷酸酶染色液对各组细胞进行染色,观察钙结节形成和碱性磷酸酶的表达情况。另外,分别采用real-time PCR和Western blot检测各组细胞不同时间点Runt相关转录因子2(Runx2)的 mRNA和蛋白表达水平。 结果: 在1.5 mmol/L 和2.5 mmol/L Ca2+浓度条件下细胞的活力明显受抑制。细胞染色结果证实成骨诱导液组和钙离子组均可以见到典型的红色钙结节和黑色块状的硫化钴沉淀物。成骨诱导组细胞Runx2的mRNA和蛋白相对表达量(0~9 d)逐渐升高(P<0.05);诱导至第9天时,3个钙离子组细胞Runx2的mRNA和蛋白表达呈浓度依赖性升高(P<0.05)。结论: 在体外培养环境下,人肾成纤维细胞可以在成骨诱导培养液的刺激作用下发生成骨分化;另外,在高钙离子环境,人肾成纤维细胞也发生了类似的成骨分化。肾乳头组织中的成纤维细胞在高钙离子等因素的作用下发生成骨分化,这可能是肾脏Randall斑形成的细胞学基础。
[关键词]人肾成纤维细胞; 成骨分化; 肾乳头钙化斑; 高钙尿症; 肾结石
肾结石的起源问题是当前结石研究的重要问题。根据临床病例观察和肾脏标本病理分析的研究结果,肾乳头钙化斑块Randall斑的形成被认为是结石形成最可能的起点,在诱导结石晶体异质成核并最终形成结石的过程中起重要的作用[1-3]。Randall斑形成的机制目前尚未明确,高钙尿、尿液的酸化和水的浓缩都被推断在Randall斑的形成中发挥作用,其中,高钙尿的作用特别值得关注[4-5]。另外,有研究发现,肾间质组织钙化形成可能与肾组织细胞成分发生成骨分化有关[1, 6-8]。我们推测,作为肾间质主要细胞成分之一的成纤维细胞可能存在成骨分化的潜能,并在高钙离子等病理因素的作用下发生成骨分化,这可能是肾间质组织Randall斑形成的细胞基础。本研究建立体外细胞培养体系,使用成骨诱导培养基或不同浓度的钙离子诱导人肾间质成纤维细胞,观察成骨分化的效果。
材料和方法
1主要材料
人肾成纤维细胞(上海齐阴生物科技有限公司);细胞茜素红钙染色试剂盒和碱性磷酸酶染色液试剂盒(Jason); I 抗Runt相关转录因子2(Runt-related transcription factor 2, Runx2) 抗体( Sigma);逆转录试剂盒和real-time PCR 相关试剂、人Runx2、β-actin引物(TaKaRa)。
2成骨诱导液和含钙离子培养液的配制
传统成骨诱导液[9]包含DMEM/F12、10% 胎牛血清、1%双抗、1% β甘油酸磷酸钠、0.1%地塞米松、0.5%维生素 C。
高钙离子培养液:取二水氯化钙(CaCl2·2H2O)粉剂用生理盐水分别稀释为5、15、25 mmol/L,高压灭菌后于-20 ℃保存。使用时,用DMEM/F12稀释10倍。
3实验分组
实验分为5个组:① 成骨诱导组(加成骨诱导液); ② CaⅠ组(加0.5 mmol/L Ca2+液);③ CaⅡ组(加1.5 mmol/L Ca2+液);④ Ca Ⅲ 组(加2.5 mmol/L Ca2+液);⑤ 对照组(加PBS)。各组细胞分别培养至第1、3、6、9天时,采用MTT法检测细胞活力。诱导至第9天时,用细胞钙茜素红染色液和钙钴法磷酸酶染色液对各组细胞进行染色,观察钙结节形成和碱性磷酸酶的表达情况。另外,成骨诱导组在成骨诱导的第0、3、6和9天,3个钙离子组在成骨诱导的第9天时,分别采用real-time PCR和Western blot检测各组细胞Runx2的mRNA和蛋白表达水平。
4实验方法
4.1MTT实验检测各组的细胞活力取生长良好的第 4 代的人肾成纤维细胞,以 2×107/L 的密度接种于 96 孔板,细胞融合后,按分组情况更换含 10% 胎牛血清 的不同诱导培养基。每组设 10 个孔,每 2 d换液,在第1、3、6、9、10天分别取出各组相应孔板,每孔加入 20 μL 的 MTT 溶液,37 ℃孵育 4 h 后,弃上清液,每孔加入 150 μL DMSO,混匀。用酶联免疫检测仪于 490 nm 波长下,测定吸光度(A)值。以时间为横轴,以A值为纵轴绘制细胞生长曲线。
4.2细胞钙茜素红染色对诱导至第9天的成骨诱导组、CaⅠ~Ⅲ组和对照组行细胞茜素红钙染色,染色过程按说明书进行。茜素红和钙离子以鳌和方式形成复合物,用以识别组织细胞的钙盐成分。钙盐变化是骨细胞增殖分化和骨组织成骨潜能的标志之一。通过茜红素染色,有钙盐成份则产生桔红色沉积。
4.3碱性磷酸酶Gomori改良钙钴法染色CaⅠ~Ⅲ诱导组和对照组培养至第9天时,行碱性磷酸酶Gomori改良钙钴法染色:取出细胞爬片,PBS缓冲液冲洗2次后冰乙醇固定10 min,双蒸水冲洗3次。于孵育底液中37 °C孵育5 h后,蒸馏水冲洗1 min。2%硝酸钴中浸5 min后,蒸馏水冲洗3次。1%的硫化铵浸洗1 min ,自来水冲洗,自然干燥,封固。倒置显微镜下观察拍照,酶所在阳性部位为黑色硫化钴沉淀。
4.4Real-time PCR检测各组细胞Runx2 mRNA的表达水平单层培养细胞,直接在培养板中加入TRIzol裂解细胞,按总RNA提取试剂盒操作说明步骤提取总RNA,紫外分光光度仪测定RNA的浓度。反转录cDNA合成采用20 μL体系(含待测RNA 1.0 μg,oligo dT Primer 1 μL,Random 6 Primers 1 μL,PrimeScriptTMRT enzyme Mix I 1 μL,5×PrimeScriptTMbuffer 4 μL),37 ℃ 15 min,85 ℃ 5 s。SYBR Green 染料法进行PCR定量检测。采用20 μL体系[含待测cDNA 1 μL,上、下游引物各0.6 μL(10 μmol/L),2×SYBR Premix Ex TaqTM10 μL,dH2O 7.8 μL],95 ℃ 10 s,95 ℃ 10 s、60 ℃ 20 s 共40个循环扩增反应。引物由TaKaRa合成:Runx2的上游引物为5’-ATGTGTGTTTGTGTAGCAGCA-3’, 下游引物为5’-TCCCTAAAGTCTCTCGGTATGTGTA-3’,产物大小为199 bp; β-actin的上游引物为5’-CATGTACGTAGCTATCCAGGC-3’,下游引物为5’-CTCCTTAATGTGACGCACGAT-3’,产物大小为250 bp。采用2-ΔΔCt法求得目的基因的相对表达量,2-ΔΔCt代表实验组目的基因相对于对照组的变化倍数。ΔΔCt=实验组(目的基因Ct值-管家基因Ct值)-对照组(目的基因Ct值-管家基因Ct值)。
4.5Western blot法检测各组细胞Runx2蛋白的表达水平向培养皿中加入裂解液,用勺子刮下细胞,加RIPA裂解液提取总蛋白,采用BCA法测定蛋白质浓度,每孔取50 μg上样,在12%的SDS凝胶中进行电泳分离,电转移法将蛋白质转移至PVDF膜上,在含5%脱脂奶粉的TBST中室温封闭60 min,加入Runx2 I抗或GAPDH抗体,4 ℃孵育过夜,1×TBST充分漂洗(10 min 3次),加入辣根过氧化物酶标记的IgG,室温60 min,1×TTBS充分漂洗(10 min 3次),ECL法显色,阳性条带以Gelpro4 凝胶光密度分析软件进行分析,测其光密度(IA)值,结果以目的蛋白IA/GAPDHIA作相对定量值进行比较。
5统计学处理
使用SPSS 11.0软件包完成统计分析。数据均以均数±标准差(mean±SD)表示。正态资料均数比较用方差分析,组间差异做组间两两比较时,方差齐用SNK法,方差不齐用Games-Howell法。非正态性资料用秩和检验Kruskal-Wallis分析。当存在组间差异时,行变量转换后,再用SNK法行两两比较。相关性用Spearman秩相关分析,以P<0.05为差异有统计学意义。
结果
1MTT结果
与对照组相比较,CaⅡ和Ca Ⅲ诱导组在第1、3、6、9天细胞活力均受抑制,差异均有统计学意义(P<0.05);成骨诱导组细胞活力在第1、3、6、9天分别与对照组相比较,差异均无统计学意义。CaⅠ组仅在第9天时,细胞生长较对照组受到抑制(P<0.05),见图1。
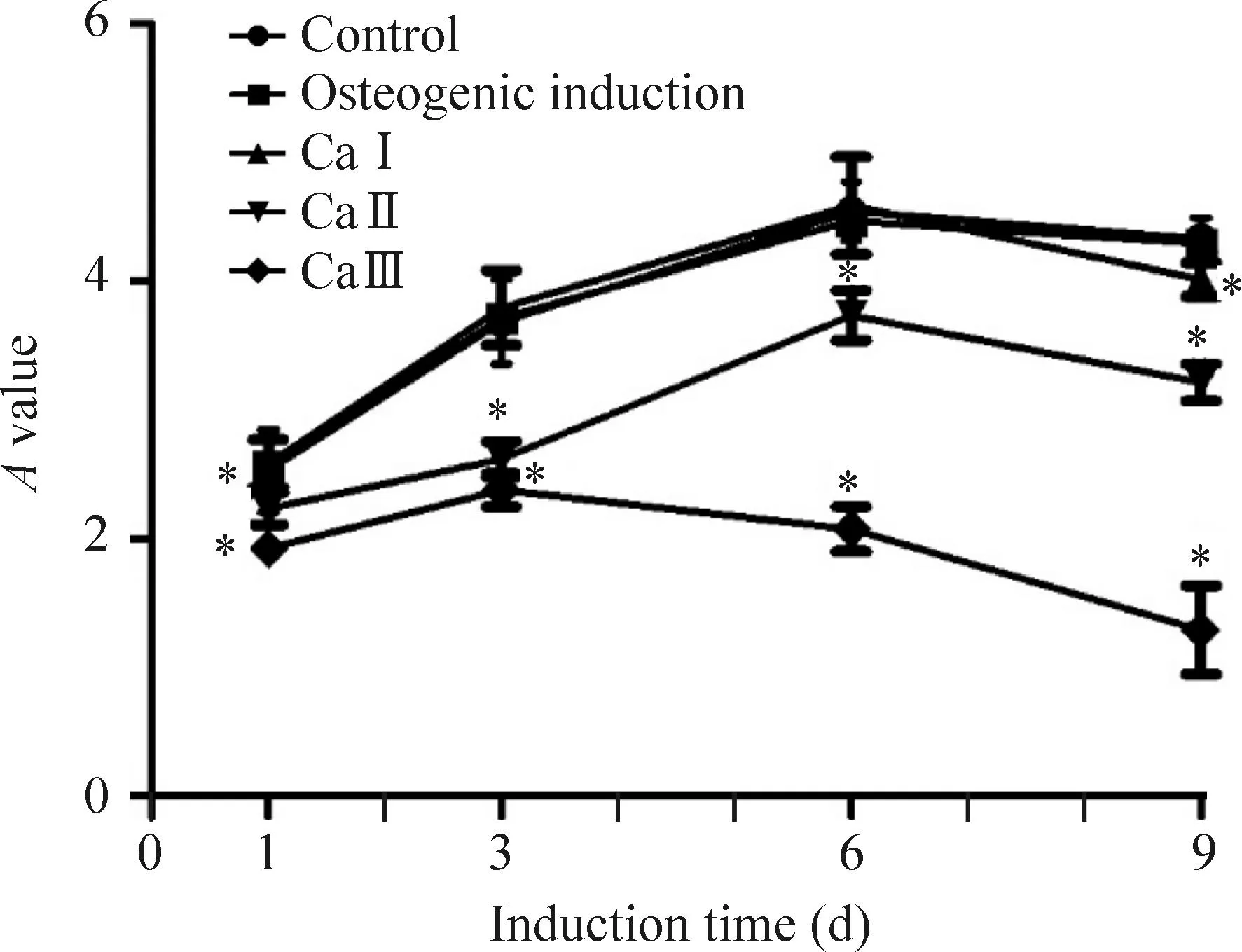
Figure 1.The cell viability was measured by MTT assay. Mean±SD.n=4.*P<0.05vscontrol.
图1MTT法检测各组细胞不同时点细胞存活率
2细胞钙茜素红染色结果
成骨诱导第9天实验组细胞钙茜素红染色出现钙结节阳性,而对照组为钙结节染色阴性,见图2。3个钙离子组诱导至第9天时细胞钙茜素红染色结果显示钙离子诱导成纤维细胞组随着钙离子浓度增加,细胞钙茜素红染色钙结节的数量、密度逐渐增加,且染色逐渐变深,见图3。
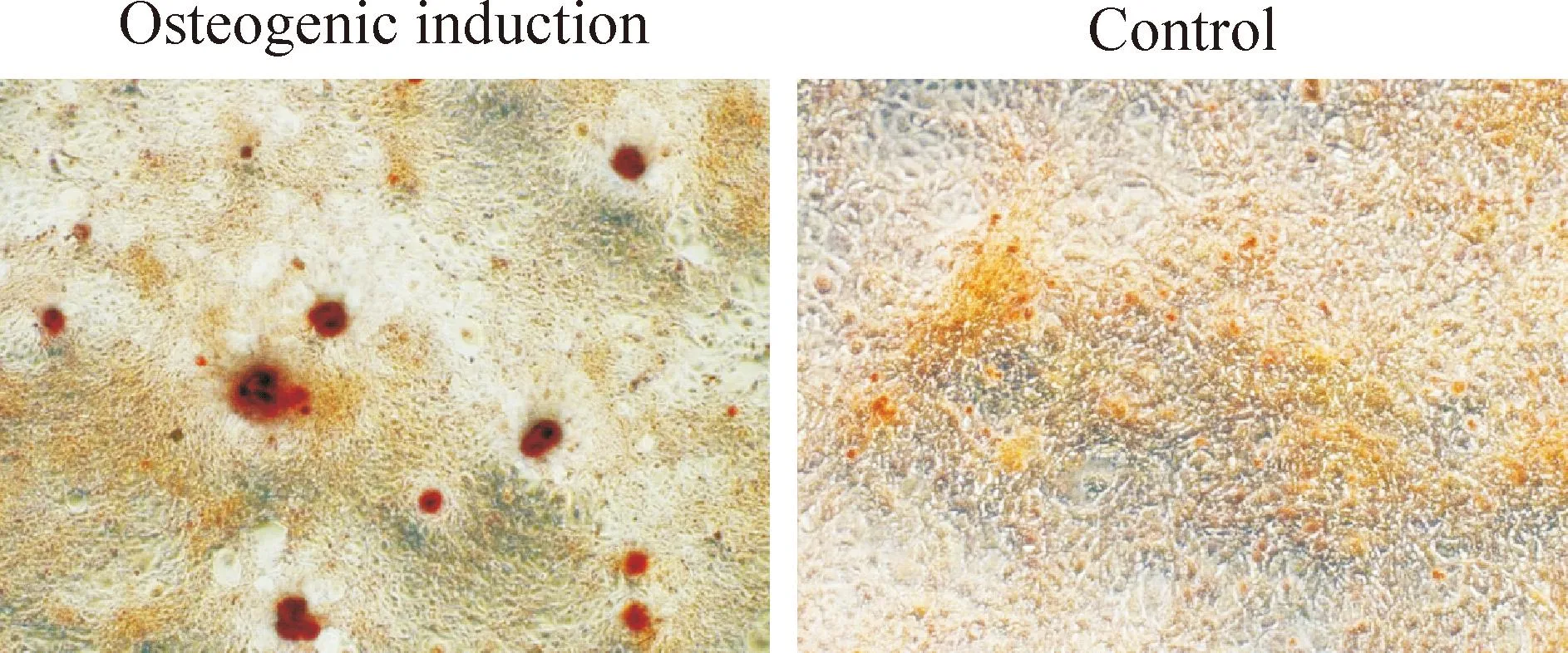
Figure 2.The cell Alizarin red S staining of human renal fibroblasts in the osteogenic induction group (×200).
图2成骨诱导组细胞钙茜素红染色结果
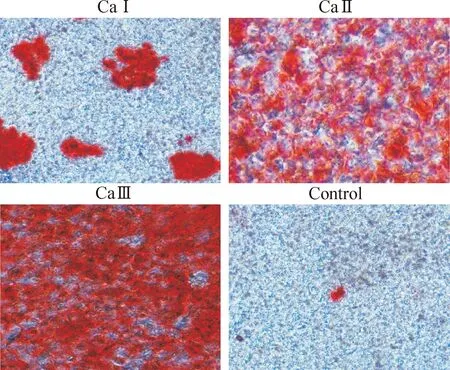
Figure 3.The cell Alizarin red S staining of human renal fibroblasts in the three calcium groups (×200).
图33个钙离子组细胞钙茜素红染色结果
3碱性磷酸酶染色结果
3个钙离子组诱导至第9天时对成纤维细胞行碱性磷酸酶染色,钙离子诱导各组均出现黑色沉淀,且黑色沉淀的数量、密度随着钙离子浓度的增加而增加。对照组未见黑色沉定,见图4。
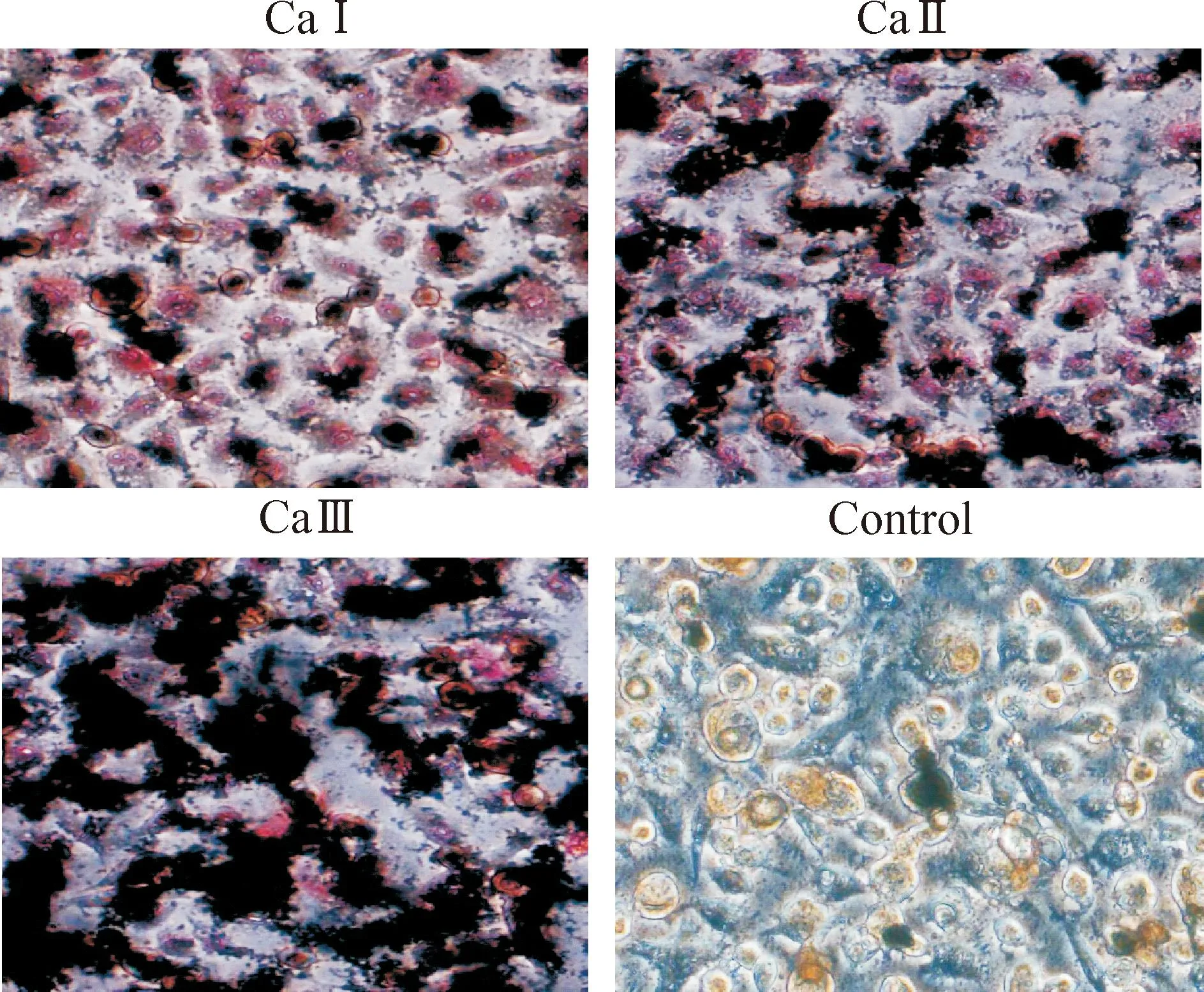
Figure 4.The cell alkaline phosphatase staining of human renal fibroblasts in the three calcium groups (×200).
图43个钙离子组细胞碱性磷酸酶染色结果
4各诱导组细胞Runx2 mRNA的表达水平
成骨诱导组不同诱导时点与正常对照组比较,Runx2 mRNA的表达水平均增高(P<0.05)。成骨诱导组培养第3、6、9天组Runx2 mRNA的表达水平分别是对照组的1.52倍、2.23倍和3.07倍,见图5。
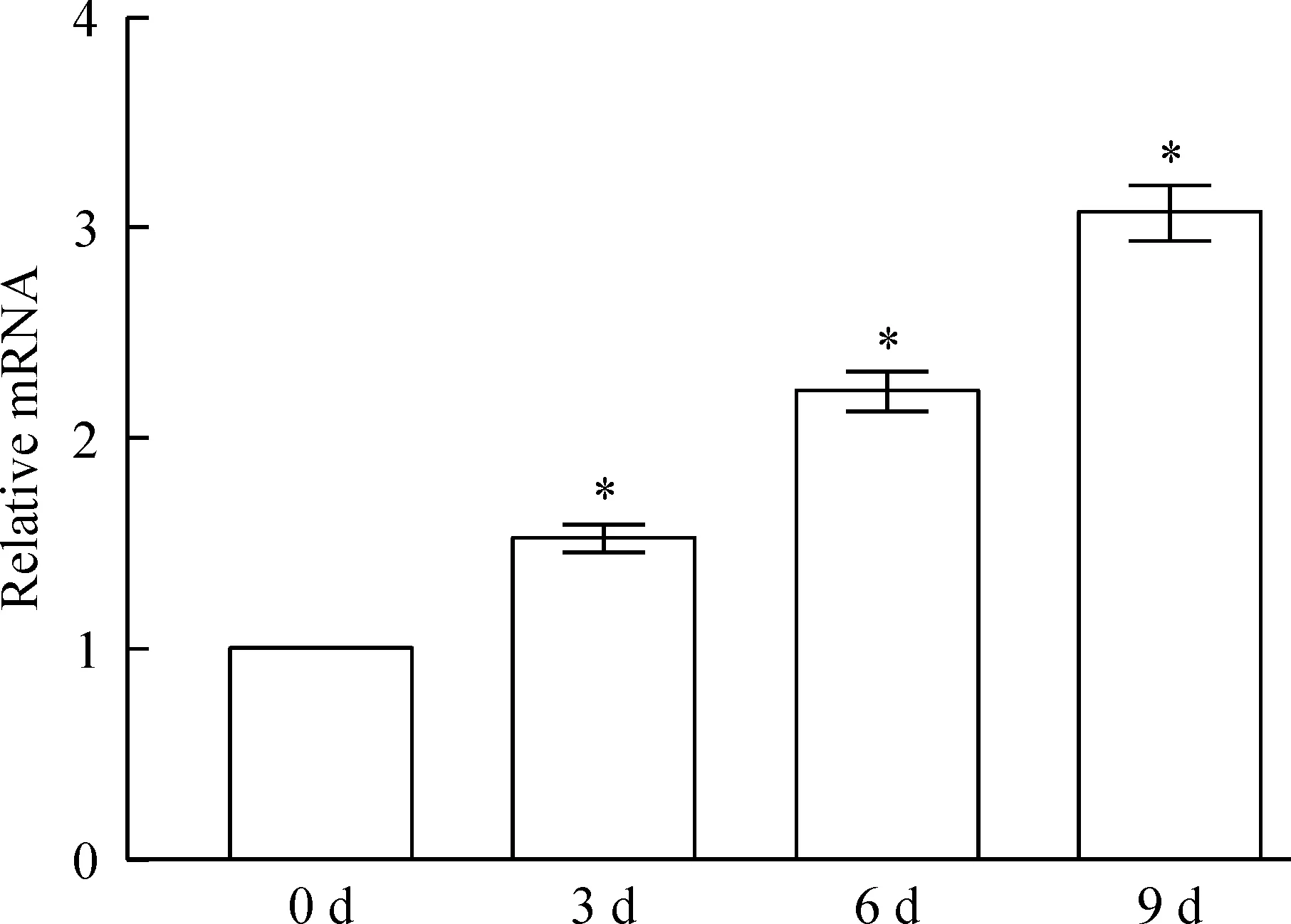
Figure 5.The mRNA expression of Runx2 in the human renal fibroblast cells in osteogenic induction groups. Mean±SD.n=4.*P<0.05vs0 d.
图5成骨诱导组细胞Runx2 mRNA的表达情况
CaⅠ、CaⅡ、CaⅢ诱导第9天组细胞Runx2 mRNA的表达水平与对照组比较均升高(P<0.05)。CaⅠ组、CaⅡ组、CaⅢ组分别是对照组的1.68倍、2.87倍和3.92倍。正常培养液组各时点细胞Runx2 mRNA的表达水平差异无统计学意义,见图6。
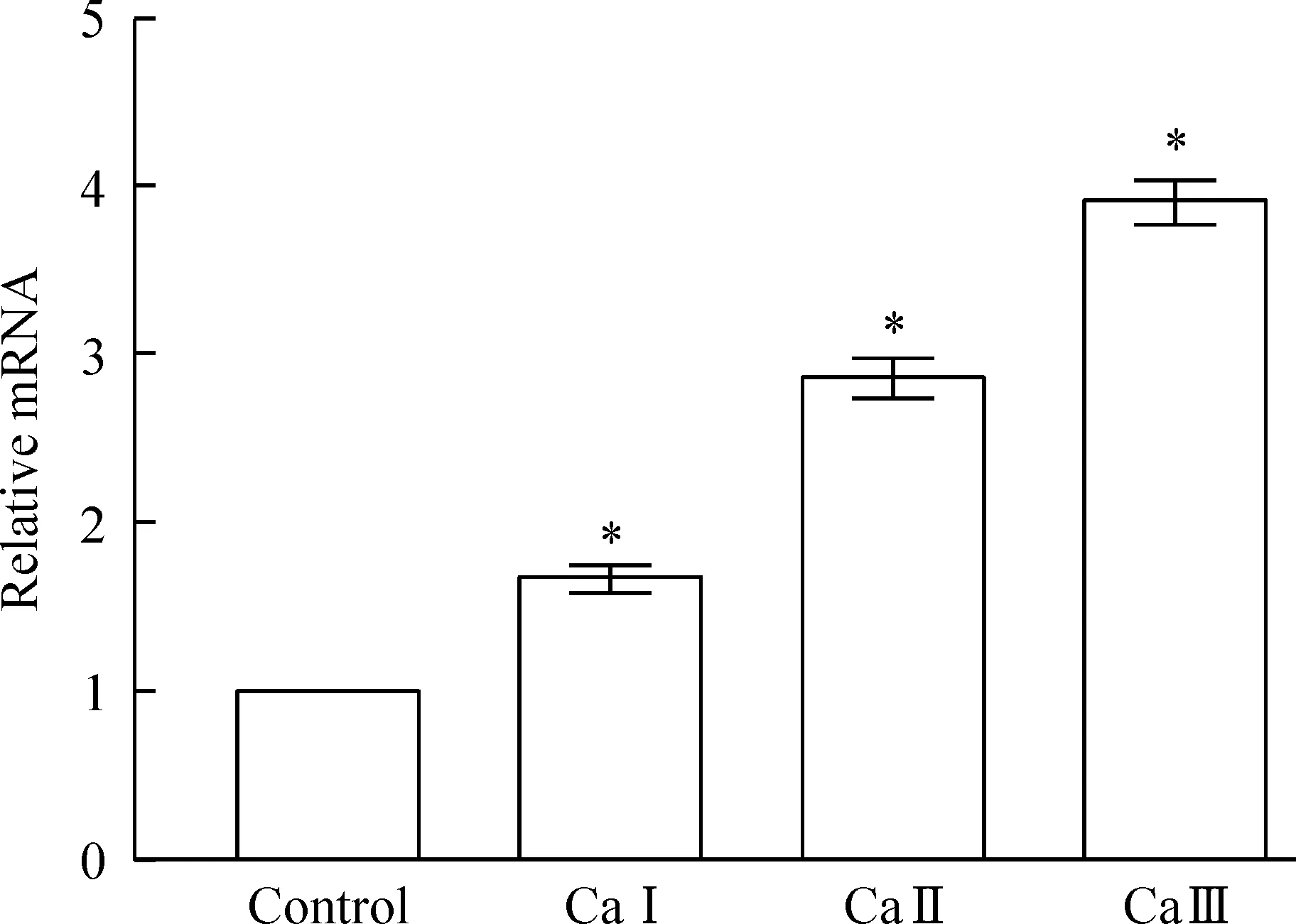
Figure 6.The mRNA expression of Runx2 in the human renal fibroblasts in control and CaⅠ~Ⅲ groups (all induced for 9 days). Mean±SD.n=4.*P<0.05vscontrol.
图63个钙离子组细胞Runx2 mRNA的表达情况
5各诱导组细胞Runx2蛋白的表达水平
Western blot 检测发现,与正常对照组(0 d)比较,成骨诱导组不同诱导时点(3、6、9 d)细胞Runx2的蛋白相对表达水平均增高,差异有统计学意义(P<0.05),见图7。
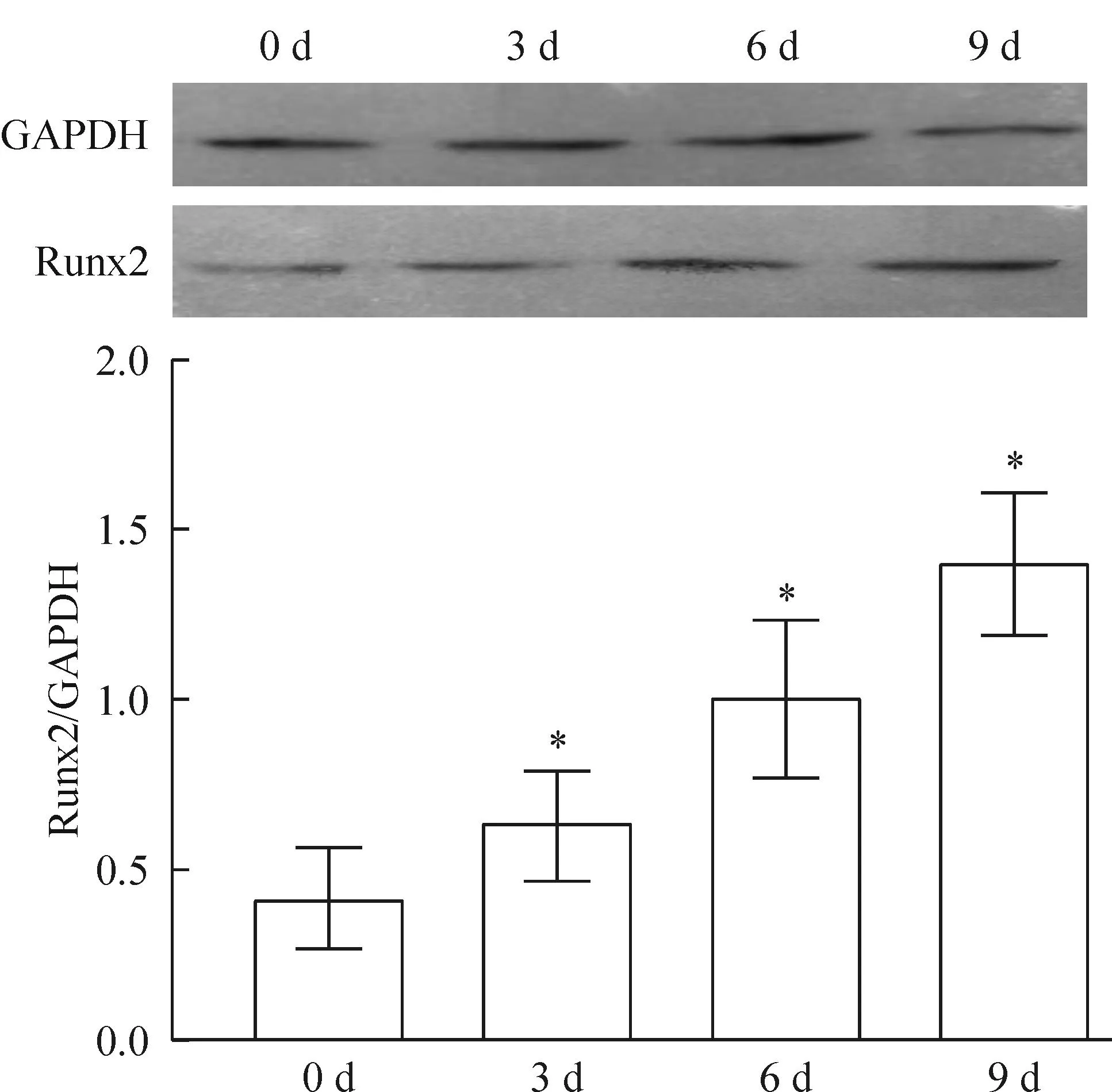
Figure 7.The protein expression of Runx2 in the human renal fibroblasts in osteogenic induction groups. Mean±SD.n=4.*P<0.05vs0 d.
图7成骨诱导组细胞Runx2蛋白的表达情况
诱导至第9天时, CaⅠ、CaⅡ、CaⅢ 各组细胞Runx2 蛋白表达量较对照组均升高,差异有统计学意义(P<0.05)。同时,各组间差异有统计学意义(P<0.05),见图8。
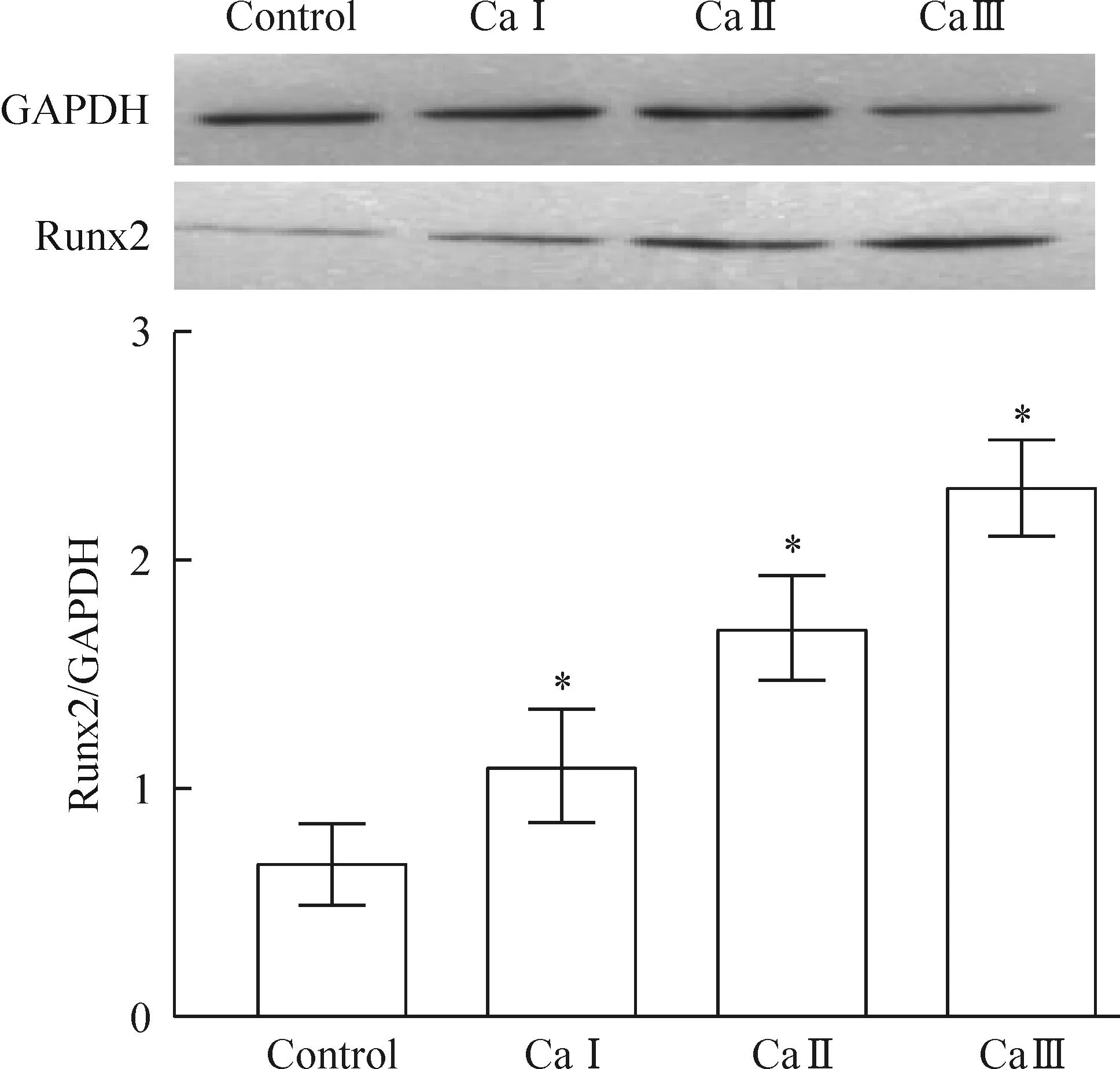
Figure 8.The protein expression of Runx2 in human renal fibroblasts in control and CaⅠ~Ⅲ groups (all induced for 9 days ). Mean±SD.n=4.*P<0.05vscontrol.
图83个钙离子组细胞Runx2 蛋白的表达情况
讨论
Randall斑是肾乳头部位的钙化斑块,为肾乳头表面与上皮下斑块相关的损伤部位,出现在74%的结石患者和43%的结石无关疾病的患者中,其中,含钙结石出现的比率最高(草酸钙88%,磷酸钙100%)[10]。Evan等[11]认为Randall斑是草酸钙结石形成的起始点,草酸钙成核并附着于Randall斑上,进一步发展形成结石。临床研究发现,Randall斑覆盖的面积与高钙尿和结石的数量呈正相关[12-13]。因此,Randall斑与高钙尿和结石形成关系密切,值得深入研究。
已经发现高钙尿可导致细胞损伤和炎症反应[14-15],但有学者对肾脏内Randall斑进行组织活检研究,发现Randall斑组织及其周围组织无明显的细胞损伤和炎症反应[5]。这提示我们Randall斑的形成与细胞损伤和炎症反应无关,可能另有其它不同的机制。根据最近的研究发现[6],在特发性高钙尿模型大鼠肾组织中,与组织钙化相关的蛋白如骨形态发生蛋白2(bone morphogenetic protein 2, BMP2)、Runx2、锌指结构转录因子(osterix,OSX)、骨桥蛋白(osteopontin,OPN)较正常组表达显著升高。随后又有临床研究证实,特发性高钙尿症患者肾乳头组织异常表达Runx2、Osterix、BMP2、MSX2,研究结果提示高钙尿症患者肾间质的钙化可能和正常骨形成的生理机制相似[7-8]。这些研究发现提示高钙尿可能通过刺激肾组织发生成骨分化而诱导了Randall斑的形成。
已经发现生物体内异位组织成骨作用似乎普遍存在。例如,近年来发现,血管的钙化是一种类似于骨质矿化主动且可以调控的过程,该过程表达骨形成相关蛋白如碱性磷酸酶(alkaline phosphatase,ALP)、OPN、骨钙蛋白(osteocalcin,OCN)等[16]。Mohler等[17]发现,提取钙化的主动脉瓣膜间质组织细胞于体外培养的条件下可以向成骨细胞转分化,该特征与血管平滑肌细胞一致,均可形成钙结节。这提示主动脉瓣钙化的细胞学基础可能为瓣膜间质细胞向成骨细胞表型转化。肾乳头部位钙化斑块的形成也可能是肾组织发生成骨分化的过程。众所周知,肾乳头间质钙盐沉积成分羟基磷灰石本质上类似正常骨组织的钙盐成分。目前有关肾乳头成骨分化的研究仍缺乏,肾组织中哪些细胞参与了成骨分化仍需要深入研究。
成纤维细胞同成骨细胞一样来源于中胚叶的间充质细胞,从细胞的来源来说,两者有着相同的来源,并与成骨细胞一样具备新骨形成所必需的所有条件,成纤维细胞能够提供基质钙化所必需的 Ca2+,合成、分泌可钙化的胶原纤丝Ⅰ、Ⅱ型,分泌形成可钙化的基质小泡[18]。研究发现,某些组织源成纤维细胞(如啮齿动物和人皮肤成纤维细胞和支气管壁成纤维细胞)具有间充质干细胞表面抗原免疫表型,展现出成脂、成骨、成软骨等多向分化潜能[19-20]。国内有人总结表明人体多种组织源成纤维细胞在体内外特殊环境下均能向成骨细胞转分化[21]。但是,肾组织源成纤维细胞是否存在成骨分化的潜能,目前国内外鲜有报道。根据以上研究结果,我们推测:肾乳头组织内的成纤维细胞可能具有成骨分化的潜能,在特定条件下(如高钙尿环境),其可向成骨细胞转分化,导致Randall斑的形成,这可能是Randall斑形成重要机制,对此,国内外尚缺乏相关研究。
本研究发现,肾间质成纤维细胞在含有地塞米松等成分的传统成骨诱导培养基的刺激作用下,展现出成骨分化潜能。成骨诱导至第9天时样本细胞染色呈现典型阳性,而对照组染色阴性,这提示人肾成纤维细胞存在成骨分化能力。此外,根据real-time PCR和Western blot结果,我们发现随着成骨诱导培养基培养时间的延长,Runx2的表达水平逐渐升高。Runx2是细胞发生成骨分化的早期最具特异性的标志物,它可以调控成骨前体细胞分化为成熟成骨细胞,并启动下游成骨标志性蛋白诸如OCN、OPN、Ⅰ型胶原等的表达,被认为是成骨发生的关键因子,为成骨分化和成熟所必需[22-23]。因此,本研究结果提示肾间质成纤维细胞在成骨培养液的诱导下发生了成骨分化,人肾成纤维细胞具备成骨分化的潜能。
高钙尿是否具有诱导人肾成纤维细胞发生成骨分化作用是本研究主要关注的问题。研究发现,在高钙离子环境下,样本细胞出现典型的钙结节, 类似于成骨诱导培养基的刺激作用结果。诱导至第9天时,3个钙离子组与对照组相比其细胞表达Runx2的mRNA和蛋白呈浓度依赖性升高,细胞Runx2蛋白的表达水平与mRNA表达的趋势基本一致。另外本研究发现,诱导至第9天时3个钙离子组样本明显表达碱性磷酸酶,而对照组则为阴性。因此可以认为,高钙离子诱导人肾成纤维细胞发生了成骨分化。由于Runx2只是细胞成骨分化的早期标记物,为了确定成骨分化的最终形成,需要进一步的研究,包括分析有关成骨分化过程中的各种信号通路以及检测成骨分化晚期的特异标志性蛋白如OCN和OPN等。
归纳起来,本研究结果提示,在体外培养环境下,人肾成纤维细胞可以在成骨诱导培养液的刺激作用下发生成骨分化;另外,在高钙离子环境,人肾成纤维细胞也发生了类似的成骨分化。肾乳头组织中的成纤维细胞在高钙离子等因素的作用下发生成骨分化,这可能是肾脏Randall斑形成的细胞学基础。
[参考文献]
[1]Khan SR. Reactive oxygen species, inflammation and calcium oxalate nephrolithiasis[J]. Transl Androl Urol, 2014, 3(3):256-276.
[2]Miller NL, Williams JC, Evan AP, et al. In idiopathic calcium oxalate stone-formers, unattached stones show evidence of having originated as attached stones on Randall's plaque[J]. BJU Int, 2010, 105(2):242-245.
[3]Miller NL, Gillen DL, Williams JC Jr, et al. A formal test of the hypothesis that idiopathic calcium oxalate stones grow on Randall's plaque[J]. BJU Int, 2009, 103(7):966-971.
[4]Tiselius HG. A hypothesis of calcium stone formation: an interpretation of stone research during the past decades[J]. Urol Res, 2011, 39:231-243.
[5]Coe FL, Evan AP, Worcester EM, et al. Three pathways for human kidney stone formation[J]. Urol Res, 2010, 38(3):147-160.
[6]Jia Z, Wang S, Tang J, et al. Does crystal deposition in genetic hypercalciuric rat kidney tissue share similarities with bone formation? [J]. Urology, 2014, 83(2):509.e7-e14
[7]何登,王少刚,唐锦辉,等. BMP2和MSX2在特发性高钙尿肾结石患者肾乳头组织表达的研究[J]. 临床泌尿外科杂志, 2012, 27(12):881-885.
[8]何登,王少刚,唐锦辉,等. 特发性高钙尿肾结石患者肾乳头组织中Runx2、Osterix的表达[J]. 华中科技大学学报, 2013, 42(2):172-175.
[9]刘玉峰,戴景兴,杨春,等. 维甲酸对成纤维细胞及脂肪源干细胞成骨诱导的影响[J]. 中国临床解剖学杂志, 2013, 31(3):303-307.
[10]Low RK, Stoller ML. Endoscopic mapping of renal papillae for Randall’s plaques in patients with urinary stone disease[J]. J Urol, 1997, 158(6):2062-2064.
[11]Evan AP, Lingeman JE, Coe FL, et al. Randall’s plaque of patients with nephrolithiasis begins in basement membranes of thin loops of Henle[J]. J Clin Invest, 2003, 111(5):607-616.
[12]Kuo RL, Lingenan JE, Evan AP, et al. Urine calcium and volume predict coverage of renal papilla by Randall’s plaque[J]. Kidney Int, 2003, 64(6):2150-2154.
[13]Kim SC, Coe FL, Tinmouth WW, et al. Stone formation is proportional to papillary surface coverage by Randall’s plaque[J]. J Urol, 2005, 173(1):117-119.
[14]Santos AC Jr, Lima EM, Penido MG, et al. Plasma and urinary levels of cytokines in patients with idiopathic hypercalciuria[J]. Pediatr Nephrol, 2012, 27(6):941-948.
[15]熊燕祥,黎承杨,邓耀良,等. 尿钙水平对草酸钙结石患者尿液MCP-1和MDA生成的影响[J]. 临床泌尿外科杂志, 2013, 28(9):685-689.
[16]Valdivielso JM. Vascular calcification: types and mechanisms[J]. Nefrologia, 2011, 31(2):142-147.
[17]Mohler ER, Wang H, Medenilla E, et al. Effect of statin treatment on aortic valve and coronary artery calcification[J]. J Heart Valve Dis, 2007, 16(4):378-386.
[18]李秀兰,张扬,师宜健,等. 体外诱导成纤维细胞成骨活性表达的研究[J]. 中国修复重建外科杂志, 2006, 20(2):107-111.
[19]Lorenz K, Sicker M, Schmelzer E, et al. Multilineage differentiation potential of human dermal skin-derived fibroblasts[J]. Exp Dermatol, 2008, 17(11):925-932.
[20]Sabatini F, Petecchia L, Tavian M, et al. Human bronchial fibroblasts exhibit a mesenchymal stem cell phenotype and multilineage differentiating potentialities[J]. Lab Invest, 2005, 85(8):962-971.
[21]毕军花,朱太咏,石印玉. 成纤维细胞的成骨能力[J]. 中国组织工程临床研究与康复, 2007, 11(14):2733-2736.
[22]Ducy P, Schinke T, Karsenty G. The osteoblast: a sophisticated fibroblast under central surveillance[J]. Science, 2000, 289(5484):1501-1504.
[23]Seki K, Fujimori T, Savagner P, et al. Mouse snail family transcription repressors regulate chondrocyte, extracellular matrix, type II collagen, and aggrecan[J]. J Biol Chem, 2003, 278(43):41862-41870.
(责任编辑: 陈妙玲, 余小慧)

*[基金项目]浙江省自然科学基金资助项目(No. LY13H060003);浙江省中医药科学研究基金计划(No. 2012ZB161)
Induction of osteogenic differentiation of human renal fibroblastsinvitroYAN Yi-jie1, LI Cheng-yang1, DENG Yao-liang1, ZENG Guo-hua2, TAO Zhi-wei1, LIU Yun-long1, SUN Chun1, WANG Yang1
(1DepartmentofUrology,TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China;2DepartmentofUrology,TheFirstAffiliatedHospitalofGuangzhouMedicalUniversity,Guangzhou510120,China.E-mail:assheep@163.com)
[ABSTRACT]AIM: To investigate the effects of osteogenic induction media and the medias containing different concentration of calcium on the induction of osteogenic differentiation of human renal fibroblasts in vitro. METHODS: Cultured human renal fibroblasts were divided into 5 groups in this experiment: osteogenic induction group (osteogenic induction media), CaⅠgroup (0.5 mmol/L Ca2+media), CaⅡgroup (1.5 mmol/L Ca2+media), Ca Ⅲ group (2.5 mmol/L Ca2+media) and control group (PBS). The cell activity in each groups was measured by MTT assay. At 9th day, the cell calcium Alizarin red S staining and alkaline phosphatase (ALP) Gomori calcium cobalt staining were performed respectively to observe the formation of calcium nidus and the expression of ALP. In addition, the expression of Runt-related transcription factor 2 (Runx2) at mRNA and protein levels was determined by real-time PCR and Western blot, respectively. RESULTS: The remarkable positive signs which represented the formation of calcium nidus and the deposit of calcium objects in all experiment groups were observed. The mRNA and protein expression of Runx2 in osteogenic induction group increased in accordance with the induction time. Compared with control group, the mRNA and protein expression of Runx2 in the CaⅠ~Ⅲ groups increased gradually in a calcium concentration dependent manner at the 9th induction day. CONCLUSION: Human renal interstitial fibroblasts show the potential activity in osteogenic differentiation induced by osteogenic induction media or high level calcium in vitro, which may be account for the cytological formation of the Randall’s plaque in the kidney.
[KEY WORDS]Human renal interstitial fibroblasts; Osteogenic differentiation; Randall’s plaque; Hypercalciuria; Renal calculi
通讯作者△Tel: 0575-88345836; E-mail: zhangyunbme@126.com
[收稿日期]2015- 05- 19[修回日期] 2015- 08- 31
[文章编号]1000- 4718(2015)12- 2265- 06
doi:10.3969/j.issn.1000- 4718.2015.12.025
[中图分类号]R363
[文献标志码]A
