参麦注射液改善3T3-L1细胞的胰岛素抵抗*
2016-01-31毛玉山陈轶尘赵亚荣车晓航叶小磊
毛玉山, 陈轶尘, 赵亚荣, 车晓航, 陶 金, 叶小磊△
(1宁波大学医学院附属医院内分泌科, 2宁波市医学科学研究所药物与药理研究室,浙江 宁波 315020)
参麦注射液改善3T3-L1细胞的胰岛素抵抗*
毛玉山1▲,陈轶尘2▲,赵亚荣2,车晓航2,陶金2,叶小磊2△
(1宁波大学医学院附属医院内分泌科,2宁波市医学科学研究所药物与药理研究室,浙江 宁波 315020)
[摘要]目的: 探讨参麦注射液改善3T3-L1脂肪前体细胞胰岛素抵抗模型的效果及其作用机制。方法:使用地塞米松等将3T3-L1前脂肪细胞诱导分化为成熟脂肪细胞,使用油红O染色法检测脂肪细胞分化情况;用胰岛素诱导3T3-L1脂肪细胞以建立胰岛素抵抗模型,并使用葡萄糖氧化酶法检测细胞上清液中葡萄糖浓度,以评价模型建立情况。将建立胰岛素抵抗的细胞分为空白对照组、10 μmol/L罗格列酮阳性对照组、25 g/L参麦组和50 g/L参麦组。MTT检测各组药物作用8、16、24和36 h后的细胞活力。药物作用8、16和24 h后测定细胞上清液葡萄糖浓度。免疫印迹检测葡萄糖转运蛋白4(GLUT4)、磷脂酰肌醇3-激酶(PI3K)、AKT和磷酸化AKT(p-AKT)在各组中的蛋白水平。结果:成功建立3T3-L1脂肪细胞胰岛素抵抗模型,葡萄糖浓度数据显示参麦注射液(25、50 g/L)可以改善胰岛素抵抗并可以明显增加3T3-L1细胞GLUT4、PI3K及p-AKT的蛋白水平。结论:参麦注射液可以改善3T3-L1胰岛素抵抗细胞的葡萄糖利用,并且与增加GLUT4、PI3K及p-AKT的蛋白水平有关。
[关键词]胰岛素抵抗; 参麦注射液; 3T3-L1前脂肪细胞
糖尿病是一种以高血糖为特征的代谢性疾病,分为1型糖尿病(type 1 diabetes mellitus,T1DM)和2型糖尿病(type 2 diabetes mellitus,T2DM),我国糖尿病人口已超过1亿人,其中2型糖尿病占90%~95%。2型糖尿病是由多种因素共同作用所引发的,包括遗传和多种环境的综合作用,其中胰岛素抵抗(insulin resistance,IR)是T2DM发病的主要原因[1]。胰岛素抵抗是指胰岛素的靶器官对胰岛素的敏感性下降,即正常剂量的胰岛素不能产生正常生物学效应的一种状态。糖尿病的治疗以有效控制血糖、预防和减少并发症、改善患者生活质量以及延长寿命为目标。在2型糖尿病的治疗中,要针对其发病机制,改善患者的胰岛素抵抗,增加患者对胰岛素的敏感性[2]。鉴于西药治疗存在副作用以及耐药问题,从传统中医药中寻找解决的途径具有重要意义[3]。
参麦注射液是由中药人参、麦冬等经化学提取精制而成的中药注射液,其主要活性成分为Rb1、Rb2、Rc、Rd、Re、Rg1以及麦冬皂苷D,具有抗休克、抗心衰、抗炎等作用[4]。其中,人参作为参麦注射液的主要成分,其可以影响糖脂代谢通路,增加能量消耗,调节过氧化物酶体增殖物活化受体γ(peroxisome proliferator-activated receptor γ,PPARγ)的活性和表达,改善胰岛素抵抗并促进胰岛素合成和释放[5]。人参皂苷Rb1能够通过上调脂肪组织周脂素(perilipin)的表达,减少游离脂肪酸的释放和甘油三酯的沉积,进而改善胰岛素抵抗和糖代谢异常[6]。另有研究表明,参麦注射液中的麦冬成分可以减少大鼠胰岛β细胞凋亡[7]。参麦注射液在用于糖尿病时,可以改善患者胰岛素抵抗的状况[8]。但是目前参麦注射液改善IR的机制尚未明确,而且缺少合适的IR细胞药理模型。在本实验中使用3T3-L1前脂肪细胞诱导分化为脂肪细胞,构建胰岛素抵抗模型,对IR相关蛋白进行检测。本研究对于参麦注射液改善胰岛素抵抗机制的探索不仅有利于明确参麦注射液改善胰岛素抵抗的具体作用因素,而且为挖掘我国传统中药的新用途和新价值,提供具体案例。
材料和方法
1材料
3T3-L1前脂肪细胞(ATCC);DMEM培养液(Gibco);胎牛血清(浙江天杭生物科技有限公司);罗格列酮(rosiglitazone)、胰岛素和3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)购自Sigma;参麦注射液(正大青春宝药业有限公司);24孔培养板及T25培养瓶(Corning);葡萄糖氧化酶试剂盒(Invitrogen);PI3K、GLUT4、AKT和p-AKT等抗体、β-actin抗体、特异性 II 抗(Abcam)。
2方法
参考文献2.13T3-L1前脂肪细胞的培养和分化 3T3-L1前脂肪细胞的分化中所用方法[9]。先将3T3-L1细胞复苏,用含有10% 胎牛血清的DMEM细胞培养液重悬于T25培养瓶中,于37 ℃、5% CO2培养箱中培养,2 d换液1次。将3T3-L1前脂肪细胞分至24孔板中,待细胞融合度达到80%,加入含有IBMX(0.5 mmol/L)、胰岛素(1 g/L)、地塞米松(1 μmol/L)的DMEM培养液培养48 h。弃去上清,加入含有胰岛素的DMEM培养液培养48 h。弃去上清,换成DMEM培养液继续培养至第8天。细胞使用4%多聚甲醛室温固定10 min,用0.5%油红O染液染色10 min,用PBS洗2遍。倒置显微镜下拍照,有红色油滴产生即证明脂肪细胞分化成功。
2.2胰岛素抵抗模型的建立3T3-L1分化完成后,分别用1 μmol/L、100 nmol/L、10 nmol/L和1 nmol/L胰岛素诱导脂肪细胞。各组加胰岛素后分别在8、16和24 h时,用葡萄糖氧化酶法分别测定各组的细胞上清葡萄糖水平,同时在显微镜下观察细胞的形态学变化。最后计算不同胰岛素浓度和时间点下各组与正常对照组中上清液葡萄糖浓度的差值,差值越大,胰岛素抵抗越明显。
2.3不同浓度参麦注射液对细胞活力的测定将IR细胞于实验前24 h,以每孔1×104个接种于96孔培养板中。实验时,将IR细胞分为空白组、10 μmol/L罗格列酮组、25 g/L参麦注射液组和50 g/L参麦注射液组,每组3个复孔。按照上述分组,通过MTT方法分别检测IR细胞在8、16、24和36 h时570 nm处的吸光度值。
2.4葡萄糖浓度测定将最佳造模条件下获得的IR细胞分为空白组、10 μmol/L罗格列酮组、25 g/L参麦注射液组和50 g/L参麦注射液组,每组3个复孔。按照上述分组,分别收取各组不同药物在作用细胞8、16和24 h的上清液。细胞上清液葡萄糖浓度使用试剂盒进行检测,简述如下:配制0、10、20、40、80、160和200 μmol/L葡萄糖溶液。将各实验组上清用试剂盒自带1×reaction buffer 稀释1倍。配制葡萄糖浓度测定所需反应液。将葡萄糖标准液、空白对照上清液和各实验组上清液各取50 μL至96孔板中,再加入50 μL反应液,室温避光反应30 min。用酶标仪测定560 nm处吸光度。
2.5免疫印迹检测取出CO2培养箱中的细胞,弃去培养液后将培养皿放置于冰上,使用冷的PBS淋洗细胞2遍,吸干净残留的PBS,在RIPA裂解液中冰上裂解细胞,用枪头或者细胞刮刮下细胞后,用1 mL注射器吹打细胞使DNA断裂,100 ℃孵育5~10 min后,取3 μL用于BCA定量。煮沸后的蛋白-20 ℃保存备用。制备10%的SDS-PAGE胶,蛋白样品加入上样buffer后,电泳分离蛋白。小心分离SDS-PAGE胶,恒流1.5 h电转移到PVDF膜,使用含5%脱脂牛奶的封闭液封闭1 h,与特异性抗体室温孵育1 h或者4 ℃过夜后,加入内参照抗体β-actin室温孵育1 h,加入HRP标记 II 抗室温孵育1 h,TBST洗膜3次,取出膜后加入ECL发光液,暗室中压片显影。使用ImageJ软件对条带灰度值进行量化分析。
3统计学处理
计量资料数据符合正态分布且方差齐性的均以均数±标准差(means±SD)表示。多组间比较使用单因素方差分析(one-way ANOVA),两两比较采用Bonferroni校正的t检验;如果方差不齐,采用Dunnett’s T3方法分析。使用GraphPad Prism 5.0进行作图,以P<0.05为差异有统计学意义。
结果
1前脂肪细胞分化
3T3-L1细胞通过IBMX、地塞米松和胰岛素诱导后细胞逐渐变圆,并有脂滴出现。油红O染色显示细胞中已经产生红色的圆形脂肪滴,提示脂肪细胞诱导成功,见图1。
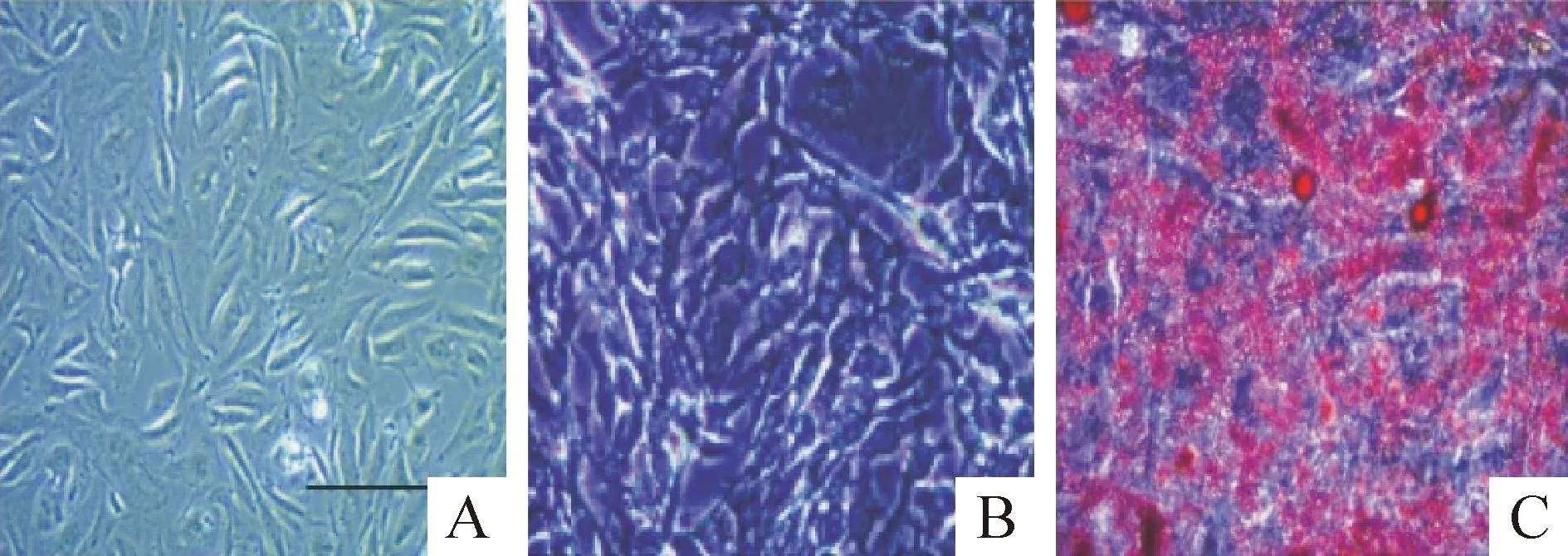
Figure 1.3T3-L1 cells before and after differentiation into adipocytes (×200). The scale bar is 50 μm. A: 3T3-L1 preadipocytes; B: 3T3-L1 adipocytes; C: 3T3-L1 adipocytes after red oil O staining.
图13T3-L1细胞诱导成脂肪细胞前后的镜下对比
2胰岛素抵抗模型的建立
在脂肪细胞中加入不同浓度的胰岛素,然后在8、16和24 h时收取细胞上清。用葡萄糖氧化酶法测定葡萄糖浓度。计算得到葡萄糖标准曲线为y=0.002 7x+0.0114,R2=0.995。然后计算得出各组经过胰岛素诱导后细胞上清液葡萄糖浓度。与空白对照比较,1 μmol/L胰岛素作用16 h时细胞上清液葡萄糖浓度与正常组相差最大,说明建立细胞胰岛素模型效果为最好,相比于其它胰岛素诱导组差异具有统计学意义(P<0.05),见图2。
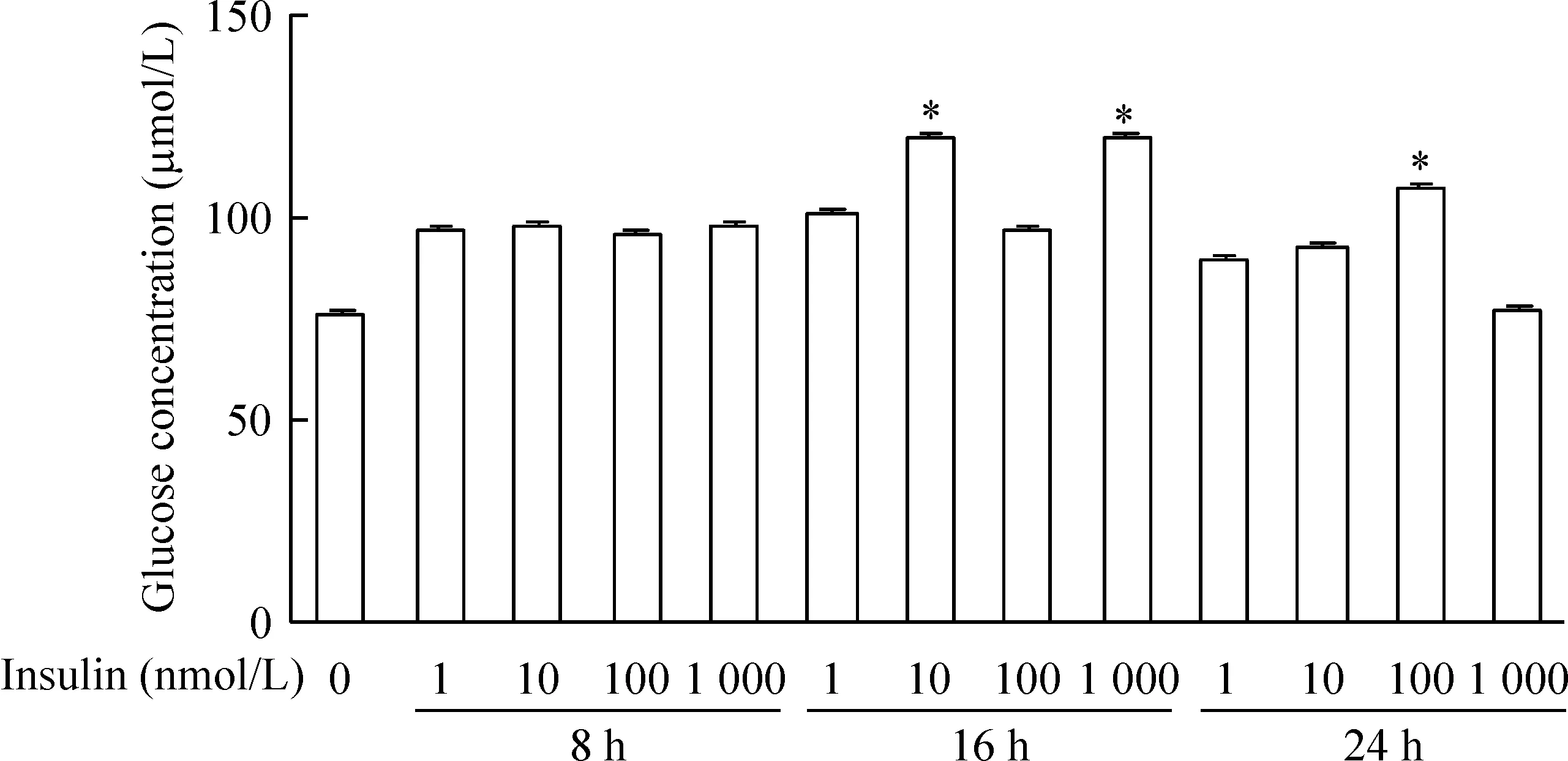
Figure 2.The effects of insulin concentration and treatment time on glucose concentration in supernatant of adipocytes. Comparison with control group, the 1 μmol/L insulin 16 h group showed the highest concentration of glucose. Mean±SD.n=3.*P<0.05vscontrol.
图2不同浓度胰岛素作用于脂肪细胞不同时间后的葡萄糖浓度
3不同浓度药物对细胞活力的影响
10 μmol/L的罗格列酮组及 25 g/L参麦注射液作用于IR细胞 36 h 以内,其吸光度值与正常对照组相比差异无统计学意义,对细胞活力没有抑制作用。50 g/L的参麦注射液36 h 时其吸光度值与正常对照组相比差异有统计学意义(P<0.05),对细胞活力产生抑制作用,见表1。

表1 不同药物对IR细胞活力的影响
*P<0.05vscontrol.
4参麦注射液对葡萄糖利用的效果
检测空白对照组、10 μmol/L罗格列酮组、25 g/L参麦注射液组和50 g/L参麦注射液组8、16和24 h时的细胞上清中葡萄糖的浓度。结果显示,10 μmol/L罗格列酮24 h作用后上清葡萄糖浓度与空白对照组的差值最小,说明罗格列酮能增加葡萄糖的摄取量,并接近于正常细胞水平。其次是50 g/L参麦注射液24 h组,上述结果显示罗格列酮改善胰岛素抵抗的效果最好,其次为50 g/L参麦注射液组,相比于其它给药组差异具有统计学意义(P<0.05),见图3。
5胰岛素抵抗相关蛋白的检测
免疫印迹检法测定4组药物作用IR细胞48 h后的蛋白样品可见,以IR作为空白对照组的样品中,PI3K和GLUT4呈现低表达,但在加入不同浓度的参麦和罗格列酮后,这2个蛋白的表达量均较对照组表达增加。同时,高浓度参麦实验组中,GLUT4和PI3K表达量最高(P<0.05),见图4。同时,我们也检测了AKT及p-AKT蛋白,发现3个实验组AKT的蛋白水平与空白对照组相比无明显变化,但高浓度的参麦组中p-AKT的蛋白水平明显上升,与空白对照组相比,差异有统计学意义(P<0.05),见图5。

Figure 3.The effects of Shenmai injection and rosiglitazone on glucose concentration in 3T3-L1 IR model cells. The concentration of glucose in 10 μmol/L rosiglitazone group and high concentration of Shenmai group were decreased after 24 h and almost close to the normal level. Mean±SD.n=3.*P<0.05vscontrol.
图3不用浓度参麦注射液及罗格列酮作用IR模型细胞不同时间后的葡萄糖浓度变化
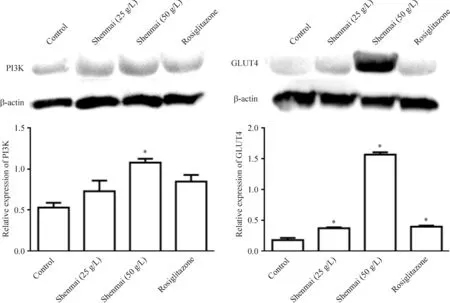
Figure 4.The protein expression of GLUT4 and PI3K after treatment with Shenmai injection. Mean±SD.n=5.*P<0.05vscontrol.
图4GLUT4及PI3K蛋白表达的变化

Figure 5.The protein levels of AKT and p-AKT after treatment with Shenmai injection. Mean±SD.n=5.*P<0.05vscontrol.
图5 AKT总蛋白水平及p-AKT蛋白的变化情况
讨论
合适的胰岛素抵抗细胞模型将有助于从细胞水平研究胰岛素抵抗的作用机制,可以辅助体外筛选改善胰岛素抵抗的药物[9-10]。3T3-L1前脂肪细胞是Swiss小鼠胚胎成纤维细胞,能在诱导剂作用下分化为脂肪细胞,被广泛应用于糖、脂代谢相关的基础和实验研究及胰岛素增敏剂药物作用的评价中[11]。而且有研究证明完全分化的3T3-L1前脂肪细胞中胰岛素可通过增加葡萄糖摄取、脂质分解和糖原的合成充分发挥作用,因此3T3-L1前脂肪细胞可作为涵盖上述3种降糖途径的细胞模型[12]。因此本实验采用不同浓度胰岛素诱导3T3-L1脂肪细胞建立IR模型,观察参麦注射液对IR的影响。
脂肪的代谢和胰岛素抵抗有密切的关系,脂肪组织是胰岛素抵抗发生的最主要靶组织[13],有研究显示,内脏脂肪性肥胖在胰岛素抵抗方面起着特别重要的作用,其与2型糖尿病人胰岛素介导的葡萄糖利用率显著相关[14]。目前胰岛素模型主要分为脂肪细胞、肝细胞和骨骼肌细胞IR模型[15]。构建3T3-L1 IR细胞模型的方法,除了有采用高糖、高胰岛素联合诱导建模;还有采用IL-6[16]、地塞米松[17]、游离脂肪酸等诱导细胞IR模型[18]。体内高浓度胰岛素的刺激是脂肪细胞产生胰岛素抵抗的主要因素之一[19]。本实验中将3T3-L1完全分化后,使用在1 μmol/L胰岛素作用16 h时,IR诱导效果最好。葡萄糖浓度的经典检测方法是通过[3H]或[14C]标记的葡萄糖摄取实验来检测葡萄糖的摄取,需要特殊的工作环境和仪器,而在本研究中验证模型时使用商品化试剂盒,检测方便,无需特殊仪器,整体而言,诱导条件简单,检测便捷,可以作为较稳定的IR细胞模型用于研究。
胰岛素通过与受体特异性结合后发挥生物学作用,最后激活AKT,引起细胞对葡萄糖摄取的增加以及GLUT4向胞膜的移位,PI3K/AKT是胰岛素主要信号转导通路[19]。在本实验中,高浓度的参麦注射液作用后,PI3K、GLUT4和p-AKT的表达均高于罗格列酮组。说明参麦注射液可以改善胰岛素抵抗,高浓度时可能优于罗格列酮的降糖效果。当AKT表达下调时,小鼠胰岛素刺激后的肝糖异生明显减弱[20],相反,当AKT过度表达时,可使3T3-L1脂肪细胞葡萄糖摄取量以及GLUT4向胞膜的转位[21]。有研究显示,人参提取物如人参皂苷Rg1等有效成分,能通过抑制胰岛素信号转导过程中JNK 和NF-κB等的活性,而激活AMPK途径,活化胰岛素受体亚单位1,促进葡萄糖转运体4的移位,提高脂肪、肌肉等外周组织对葡萄糖的摄取利用,从而改善胰岛素抵抗[22]。另外,人参皂苷能促进胰岛素抵抗大鼠模型GLUT4和PI3K的表达[23]。因此在本实验中我们比较了参麦注射液给药前后PI3K、GLUT4、AKT及p-AKT的蛋白水平,相比于对照组,两个基因表达增加说明参麦注射液存在改善IR的药理作用。
目前研究显示,不少中药单体能够影响糖代谢,如黄芪对醛糖还原酶有明显抑制作用[24]。另外,葛根[25]、西洋参[26]和小檗碱[27]可以有效改善胰岛素抵抗,增加胰岛素的敏感性。有研究显示,参麦注射液短期治疗对2型糖尿病患者有改善胰岛素抵抗作用。另外,参麦汤可能通过上调大鼠骨骼肌GLUT4 mRNA来改善胰岛素抵抗[28]。在本实验中,使用3T3-L1前脂肪细胞构建同时涵盖脂肪和葡萄糖利用的IR模型,并给与参麦注射液,实验结果显示,参麦注射液可以明显改善胰岛素抵抗,并且高浓度参麦注射液改善IR的效果可以接近罗格列酮。罗格列酮是临床常用的抗糖尿病药物,可以明显改善胰岛素抵抗。但在近年来的临床应用中,罗格列酮也可导致部分患者的液体潴留和充血性心力衰竭,其心血管的安全性也引起了国内外药品监管部门的高度警惕,欧盟将其作为二线治疗药使用,美国也多次修改产品说明书,将心衰风险加入了黑框警告[29]。而对传统中药而言,由于经历了无数代人的论证而沿用至今,部分药方被证明具有一定的安全性,如参麦注射液在临床广泛用于多种原因引起的心衰治疗[30-31],且罕见发生不良反应[32]。传统中药在改善IR方面的应用和研究尚处于起步阶段,对中药组分中部分活性成分的深入探索,可以弥补现有临床抗糖尿病药物的不足。
[1]Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA, 2013, 310(9):948-959.
[2]Altaf QA, Barnett AH, Tahrani AA. Novel therapeutics for type 2 diabetes: insulin resistance[J]. Diabetes Obes Metab, 2015, 17(4):319-334.
[3]Li WL, Zheng HC, Bukuru J, et al. Natural medicines used in the traditional Chinese medical system for therapy of diabetes mellitus[J]. J Ethnopharmacol, 2004, 92(1):1-21.
[4]余健,辛艳飞,宣尧仙.参麦注射液药理作用的物质基础研究进展[J]. 医药导报,2013, 32(4):497-500.
[5]尚文斌,杨颖,陈名道. 人参及其主要成分抗糖尿病作用机制[J].国际内分泌代谢杂志,2007, 27(2):115-117.
[6]尚文斌,于希忠,王国强,等. 人参皂苷Rb1改善高脂喂养肥胖小鼠胰岛素抵抗和脂肪异位沉积[J]. 中国中药杂志, 2013, 38(23):4119-4123.
[7]沙建平,马红英,陈晓文,等.麦冬对糖尿病大鼠胰岛β细胞的保护作用[J]. 成都中医药大学学报, 2014, 37(3):23-24,40.
[8]尚文斌,杨颖,陈名道. 人参及其主要成分抗糖尿病作用机制[J]. 国际内分泌代谢杂志, 2007, 27(2):115-117.
[9]Montagut G, Blade C, Blay M, et al. Effects of a grapeseed procyanidin extract (GSPE) on insulin resistance[J]. J Nutr Biochem, 2010, 21(10):961-967.
[10]Yan J, Zhao Y, Zhao B. Green tea catechins prevent obesity through modulation of peroxisome proliferator-activated receptors[J]. Sci China Life Sci, 2013, 56(9):804-810.
[11]Knutson VP, Balba Y. 3T3-L1 adipocytes as a cell culture model of insulin resistance[J]. In Vitro Cell Dev Biol Anim, 1997, 33(2):77-81.
[12]刘晓华,江湖,李海星,等.胰岛素诱导3T3-L1脂肪细胞胰岛素抵抗模型的建立[J]. 食品科学, 2012, 33(19):249-253.
[13]任颖,刘伟,陆广华,等.2型糖尿病病人的内脏脂肪性肥胖和胰岛素抵抗[J]. 中国糖尿病杂志, 2003, 11(2):84-87.
[14]董莹, 刘伟, 任颖, 等. 2型糖尿病患者胰岛素抵抗与血脂的相关性探讨[J]. 诊断学理论与实践, 2005, 4(3):216-218.
[15]陈梦云,江国荣.胰岛素抵抗细胞模型研究进展[J]. 安徽医药, 2012, 16(2):141-143.
[16]曾天舒,潘世秀,陈璐璐.白细胞介素6导致脂肪细胞胰岛素抵抗机制的初步探讨[J]. 中国病理生理杂志, 2007, 23(7):1331-1334.
[17]杨桂枝,高小平,晏菊芳,等. 地塞米松和胰岛素诱导3T3-L1脂肪细胞胰岛素抵抗的分子机理[J]. 西南师范大学学报:自然科学版, 2003, 28(3):460-464.
[18]张静,王秋月,姜雅秋,等. 游离脂肪酸诱导3T3-L1细胞胰岛素抵抗模型的建立[J].解剖科学进展, 2008, 14(2):126-129,132.
[19]Hotamisligil GS. Molecular mechanisms of insulin resistance and the role of the adipocyte[J]. Int J Obes Relat Metab Disord, 2000, 24(Suppl 4):S23-S27.
[20]Katome T, Obata T, Matsushima R, et al. Use of RNA interference-mediated gene silencing and adenoviral overexpression to elucidate the roles of AKT/protein kinase B isoforms in insulin actions[J]. J Biol Chem, 2003, 278(30):28312-28323.
[21]Garofalo RS, Orena SJ, Rafidi K, et al. Severe diabetes, age-dependent loss of adipose tissue, and mild growth deficiency in mice lacking Akt2/PKB β[J]. J Clin Invest, 2003, 112(2):197-208.
[22]Lee HM, Lee OH, Kim KJ, et al. Ginsenoside Rg1 promotes glucose uptake through activated AMPK pathway in insulin-resistant muscle cells[J]. Phytother Res, 2012, 26(7):1017-1022.
[23]王雨秾,孙佳犄,刘毓敏. 人参皂苷对胰岛素抵抗大鼠模型中GLUT4和P13K表达的影响[J]. 辽宁中医药大学学报, 2009, 11(6):234-237.
[24]高成. 银杏叶与黄芪治疗早期糖尿病肾病的临床观察[J]. 中原医刊, 2003, 30(22):37-38.
[25]邹文俊, 白红艳,高小平. 中药葛根改善胰岛素抵抗作用的实验研究[J]. 中国药理学通报, 2004, 20(6):715-716.
[26]殷惠军, 张颖, 杨领海, 等. 西洋参茎叶总皂苷对胰岛素抵抗脂肪细胞葡萄糖转运、GLUT-4转位和CAP基因表达的影响[J]. 中国药理学通报, 2007, 23(10):1332-1337.
[27]余海,郑娜,卢芙蓉,等. 小檗碱改善胰岛素抵抗机制研究新进展[J]. 中西医结合研究, 2012, 4(4):203-205,209.
[28]柴可夫,孙炜,马纲,等. 参麦汤对糖耐量异常大鼠骨骼肌GLUT4 mRNA基因表达的影响[J]. 中华中医药学刊, 2011, 29(2):231-234.
[29]欧美贤,卢金淼. “明星药物”罗格列酮的衰落[J]. 上海医药, 2011, 32(3):121-122.
[30]饶朝鹏. 参麦注射治疗肺心病心衰患者20例的疗效观察[J]. 时珍国医国药, 2010, 21(5):1295-1296.
[31]陈淑玲. 参麦注射液治疗心梗后心衰的疗效观察[J]. 吉林中医药, 2006, 26(4):19-20.
[32]王丽,尹桃,朱敏文. 参麦注射液不良反应回顾性研究[J]. 中南药学, 2007, 5(3):273-276.

*[基金项目]国家自然科学基金资助项目(No. 81460001)
Shenmai injection improves insulin resistance in 3T3-L1 cellsMAO Yu-shan1, CHEN Yi-chen2, ZHAO Ya-rong2, CHE Xiao-hang2, TAO Jin2, YE Xiao-lei2
(1DepartmentofEndocrinology,TheAffiliatedHospitalofNingboUniversitySchoolofMedicine,2DepartmentofDrugsandPharmacology,NingboInstituteofMedicalSciences,Ningbo315020,China.E-mail:yexiaolei@gmail.com)
[ABSTRACT]AIM: To discuss the effect of Shenmai injection on insulin resistance (IR) in 3T3-L1 cells and its mechanisms. METHODS: 3T3-L1 preadipocytes were induced by chemical reagents to differentiate into fully differentiated adipocytes. Oil red O staining was used to detect the differentiation level of the adipocytes. The insulin-resistant 3T3-L1 cell model was demonstrated using insulin, which was confirmed by glucose concentration in cell supernatant. The IR cell model was given 10 μmol/L rosiglitazone, 25 and 50 g/L Shenmai injection and normal saline for comparison. MTT assay was used to assess the cell activity of 3T3-L1 cells which was treated with drugs for 8, 16, 24 and 36 h. Glucose oxidase method was used to detect the glucose concentration in the cell supernatant at 8, 16 and 24 h. The protein levels of glucose transporter-4 (GLUT4), phosphatidylinositol 3-kinase (PI3K), AKT and p-AKT were determined by Western blot. RESULTS: 3T3-L1 adipocytes were successfully induced as shown by the positive oil red O staining. The IR cell model was demonstrated, and glucose concentration in the cell supernatant after treatment with Shenmai injection showed that Shenmai injection reduced the IR in 3T3-L1 cell model. The protein levels of GLUT4, PI3K and p-AKT increased compared to control group. CONCLUSION: Shenmai injection reduces the IR in 3T3-L1 cell model, which functions by increasing the protein levels of GLUT4, PI3K and p-AKT.
[KEY WORDS]Insulin resistance; Shenmai injection; 3T3-L1 preadipocytes
通讯作者△Tel: 0433-2435165; E-mail: cuihong@ybu.edu.cn
[收稿日期]2015- 08- 06[修回日期] 2015- 09- 19
[文章编号](责任编辑: 陈妙玲, 罗森)1000- 4718(2015)12- 2239- 05
doi:10.3969/j.issn.1000- 4718.2015.12.020
[中图分类号]R587; R589; R363
[文献标志码]A
