吡格列酮对大鼠脑出血后炎症因子的影响
2018-03-30韩宁吴丹红黎佳思丁素菊邓本强毕晓莹
韩宁 吴丹红 黎佳思 丁素菊 邓本强 毕晓莹
脑出血是一种致死、致残率较高的疾病,目前认为炎症、自由基以及细胞凋亡是造成脑损伤的重要环节[1-2]。吡格列酮(pioglitazone,Pio)属于噻唑烷二酮类药物,通过激活过氧化小体增殖剂激活型受体γ(peroxisome proliferator-activated receptor gamma,PPAR γ)改善胰岛素抵抗,控制血糖水平,临床上被广泛应用于治疗2型糖尿病[3]。有研究发现,PPARr激动剂可通过抑制组织炎症反应起到神经保护作用[4-6],但其对于脑出血所致脑损伤的影响及相关机制未见报道。本研究采用2次注血/退针法制备大鼠脑出血模型,观察吡格列酮对大鼠脑出血后脑组织炎症反应的影响,探讨吡格列酮在大鼠脑出血性损伤中的保护作用及可能机制。
1 材料及方法
1.1器材与试剂
吡格列酮(sigma公司);肿瘤坏死因子α(tumornecrosisfactor,TNF-α)抗体、肌动蛋白(β-actin)抗体(美国Cell Signaling公司)、TNF-α ELISA试剂盒(晶美生物工程有限公司);石蜡切片机(Leica RM2235);LeicaHI1220水平干式烘干仪;立体定位仪(上海软隆科技发展有限公司);OLYMPUS荧光显微镜;Image Pro Expess分析系统、酶标仪(Bio-TEK公司synergy HT型,美国)。
1.2实验动物
健康SD雄性大鼠72只,体重250~300 g,由上海斯莱克实验动物有限责任公司提供提供(实验动物使用许可证号2007-0005),实验大鼠自由摄取饮水,常规条件饲养。
1.3大鼠模型的制备和分组
大鼠术前8 h禁食,不禁水;60只大鼠参照Deinsberger[7]、周中和等[8]的报道方法采用2次注血/退针法,即缓慢注射自体血100 μL至基底节制成大鼠ICH模型。大鼠模型成功标准:参照Bederson等[9]的方法,即神经功能缺损评分≥2分。以大鼠脑切片中有明显血肿存在为模型制备成功。
将60例造模成功的大鼠随机分为5组,每组各12只。持续吡格列酮组:造模前6h给予胃灌注吡格列酮,造模后维持原剂量;术前吡格列酮组:造模前6 h给予胃灌注吡格列酮,造模后停用;术后吡格列酮组:造模前不给药,造模后给予胃灌注吡格列酮;模型组:造模前后均不给予吡格列酮灌注;假手术组:同一部位进针注血,不给予吡格列酮灌注。另外选取12例未造模的正常大鼠作为正常组。吡格列酮胃灌注15 mg·kg-1·d-1,1次·d-1,持续3 d。
1.4行为学评定
大鼠参照Ohlsson[10]、Garcia[11]和De Ryck[12]等描述的神经行为学评分方法。神经行为学评分于术后72 h处死大鼠前由1名非手术人员盲法进行。评分标准(总分14分,分数越低症状越重)为(1)平衡木试验:将大鼠放在一根长84 cm,宽2.4 cm的木条上,看其能否早过去。0分为掉下来;1分为未掉下来,但不能走;2分为在行走时掉下来;3分为能走过去,但患侧后肢不起作用;4分为能走过去,超过50%的步子打滑;5分为能走过去,偶尔打滑;6分为顺利走过;(2)提尾行走试验:轻提大鼠尾巴末端,使后肢离地行走。0分为无法行走;1分为左前肢稍有伸展,行走时向左打转;2分为左前肢较右前肢伸展少,稍向左倾行走;3分为双前肢对称伸展,沿直线协调行走;(3)四肢协调运动试验:轻提大鼠尾巴末端,使其悬空观察四肢的协调运动。0分为左前肢不移动;1分为左侧肢体很少伸展;2分为左侧肢体较右侧伸展少或慢;3分为四肢协调伸展;(4)四肢放置试验:该试验由De Ryck等[12]加以简化和改良。0分为不能正确放置左侧肢体;1分为不能完全正确或者放置肢体动作缓慢(>2 s);2分为迅速准确的放置。
1.5PPARγ蛋白表达水平测定
每组随机取6只大鼠在脑出血模型建立成功后72 h处死,立即取全脑,用冰生理盐水漂洗,除去血液,滤纸拭干,称取部分脑组织重量,用匀浆器匀浆后放入离心管中,加入100 uL RIPA裂解液,至细胞完全裂解;使用BCA蛋白定量法测定PPARγ蛋白表达水平。蛋白质变性后放置100 g/L SDS-PAGE柱上进行电泳分析;电泳后转移至经甲醇活化的PVDF膜上,并在5%脂肪粉溶液中室温孵育1 h以封闭膜上的非特异结合;弃去封闭液后膜中加入PPARγ抗体、β-actin抗体,4 ℃摇晃过夜,PBST洗膜3次,每次5 min;加入HRP标记的二级抗体以结合一级抗体及HRP标记的抗生物素抗体以结合分子量标准,室温孵育膜1 h;TBS/T洗膜3次,每次5 min;将膜置于pierce化学发光试剂盒中2种试剂等比例混合为反应液中室温孵育1 min,去除过量的溶液,将膜夹在两塑料薄膜之间,以X光胶片曝光对膜进行扫描分析,其表达水平为目标蛋白与内参蛋白灰度值之比。
1.6TNF-α蛋白、NF-κB蛋白表达水平测定
各组剩余6只大鼠于造模成功后72 h用水合氯醛麻醉后开胸经左心室插管至主动脉,依次灌注生理盐水100 mL,4 ℃ 4%多聚甲醛250mL,断头去脑,于4%多聚甲醛固定24 h,然后使用酒精脱水,二甲苯透明、浸蜡、包埋。
用免疫组织化学染色法进行TNF-α蛋白、NF-κB蛋白表达阳性细胞测定。组织切片脱蜡、水化后用磷酸盐缓冲液(Phosphate Buffered Saline,PBS)洗2~3次,每次5 min;3%过氧化氢(hydrogen peroxide,H2O2)(80%甲醇)滴加在肿瘤组织芯片(tissue microarray,TMA)上,室温静置10 min;PBS洗2~3次,每次5 min;进行抗原热修复后PBS洗2~3次,每次5 min;滴加正常山羊血清封闭液,室温20 min,甩去多余液体;滴加TNF-α兔抗鼠多克隆抗体和NF-κB兔抗鼠多克隆抗体50 μL,室温静置1 h;4 ℃过夜后在37 ℃复温45 min;PBS洗3次,每次5 min;滴加Ⅱ抗40~50 μL,室温静置,或37 ℃1 h;PBS洗3次各5 min;DAB显色5~10 min,在显微镜下掌握染色程度;PBS或自来水冲洗10 min;苏木精复染2 min,盐酸酒精分化;自来水冲洗10~15 min;脱水、透明、封片、镜检。
染色成功后每个标本取2张切片,在200倍光镜下随机观察并取血肿周边5个不重复视野,显微图像分析系统采集图像,分析阳性细胞积分光密度,取平均值,单位为积分光密度/每个200倍视野。
1.7血浆TNF-α表达水平测定
各组随机取6只大鼠在造模成功后72 h深度麻醉后打开胸腔,下腔静脉取血2 mL,注入加有抗凝剂的试管中,4 ℃条件下3000 r/min,离心15 min后取上清液;用酶联免疫吸附法(Enzyme-Linked ImmunoSorbent Assay ,ELISA)测定血浆中TNF-α的表达水平。
1.8统计学处理
2 结 果
2.1吡格列酮对大鼠脑出血后行为学评分的影响
6组行为学评分有显著差异(F=12.767,P<0.001);持续吡格列酮组行为学评分显著高于术前吡格列酮组、术后吡格列酮组、模型组,显著低于假手术和正常组(t=2.410、3.879、5.423、9.001、9.101,P=0.037、0.007、0.000、0.000、0.000);术前吡格列酮组、术后吡格列酮组行为学评分显著高于模型组,显著低于假手术和正常组(t1=2.614、10.527、10.608,P1=0.026、0.000、0.000;t2=2.247、13.863、13.992,P2=0.049、0.000、0.000),术前吡格列酮组、术后吡格列酮组行为学评分无明显差异(t=0.613,P=0.554);模型组行为学评分显著低于假手术组和正常组(t=15.404、15.520,P均=0.000)(表1)。
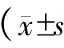
表1 吡格列酮对大鼠脑出血后行为学评分的影响,分)
注:与持续吡格列酮组比较,*P<0.05;与术前吡格列酮组比较,△P<0.05;与术后吡格列酮组比较,▲P<0.05;与模型组比较,#P<0.05
2.2吡格列酮对大鼠脑出血后脑组织NF-κB和TNF-α蛋白表达水平的影响
6组TNF-α、NF-κB表达水平有显著差异(F=11.24,8.91,P均=0.00);持续吡格列酮组TNF-α表达水平显著低于术前吡格列酮组、模型组,显著高于假手术组、正常组(t=2.707、11.233、4.048、4.647,P=0.022、0.000、0.001、0.001);持续吡格列酮组NF-κB表达水平显著低于术前吡格列酮组、术后吡格列酮组、模型组,显著高于假手术组、正常组(t=8.951、3.053、25.855、5.728、9.848,P=0.000、0.012、0.000、0.000、0.000)。术前吡格列酮组TNF-α、NF-κB表达水平显著低于模型组,显著高于术后吡格列酮组、假手术组、正常组(t1=2.424、4.702、5.910、5.689,P1=0.036、0.001、0.000、0.000;t2=7.259、6.778、11.530、13.627,P2=0.000、0.000、0.000、0.000);术后吡格列酮组TNF-α、NF-κB表达水平显著低于模型组,显著高于假手术组、正常组(t1=12.650、7.844、6.976,P1均=0.000;t2=22.183、7.873、11.781,P2均=0.000);模型组TNF-α、NF-κB表达水平显著高于假手术组、正常组(t1=18.930,17.831,P1均=0.000;t2=22.723、26.489,P2均=0.000)。假手术组和正常组TNF-α无明显差异(t=0.270,P=0.792),但假手术组NF-κB蛋白表达水平显著高于正常组(t=3.134,P=0.011)。(表2,图1~2)。
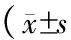
表2 吡格列酮对大鼠脑出血后脑组织NF-κB、 TNF-α蛋白表达水平的影响,%)
注:与持续吡格列酮组比较,*P<0.05;与术前吡格列酮组比较,△P<0.05;与术后吡格列酮组比较,▲P<0.05;与模型组比较,#P<0.05;与假手术组比较,▽P<0.05
2.3吡格列酮对脑出血大鼠血浆中TNF-α表达水平的影响
6组大鼠血浆TNF-α表达水平有显著差异[(0.702±0.013)vs(0.765±0.016)vs(0.787±0.011)vs(0.960±0.028)vs(0.656±0.004)vs(0.643±0.002)ng/dL](F=9.875,P<0.001),其中模型组最高,而正常组最低。持续吡格列酮组TNF-α表达水平显著低于术前吡格列酮组、术后吡格列酮组、模型组(t=7.486、12.226、20.471,P均=0.000),与术前吡格列酮组、术后吡格列酮组TNF-α表达水平显著高于模型组,显著低于假手术组、正常组(t1=14.811、16.189、18.533,P1均=0.000;t2=14.086、27.415、31.545,P2均=0.000),但术前吡格列酮组、术后吡格列酮组TNF-α表达水平无显著差异(t=2.775,P=0.020);假手术组TNF-α表达水平显著高于正常组(t=7.120,P=0.000)。
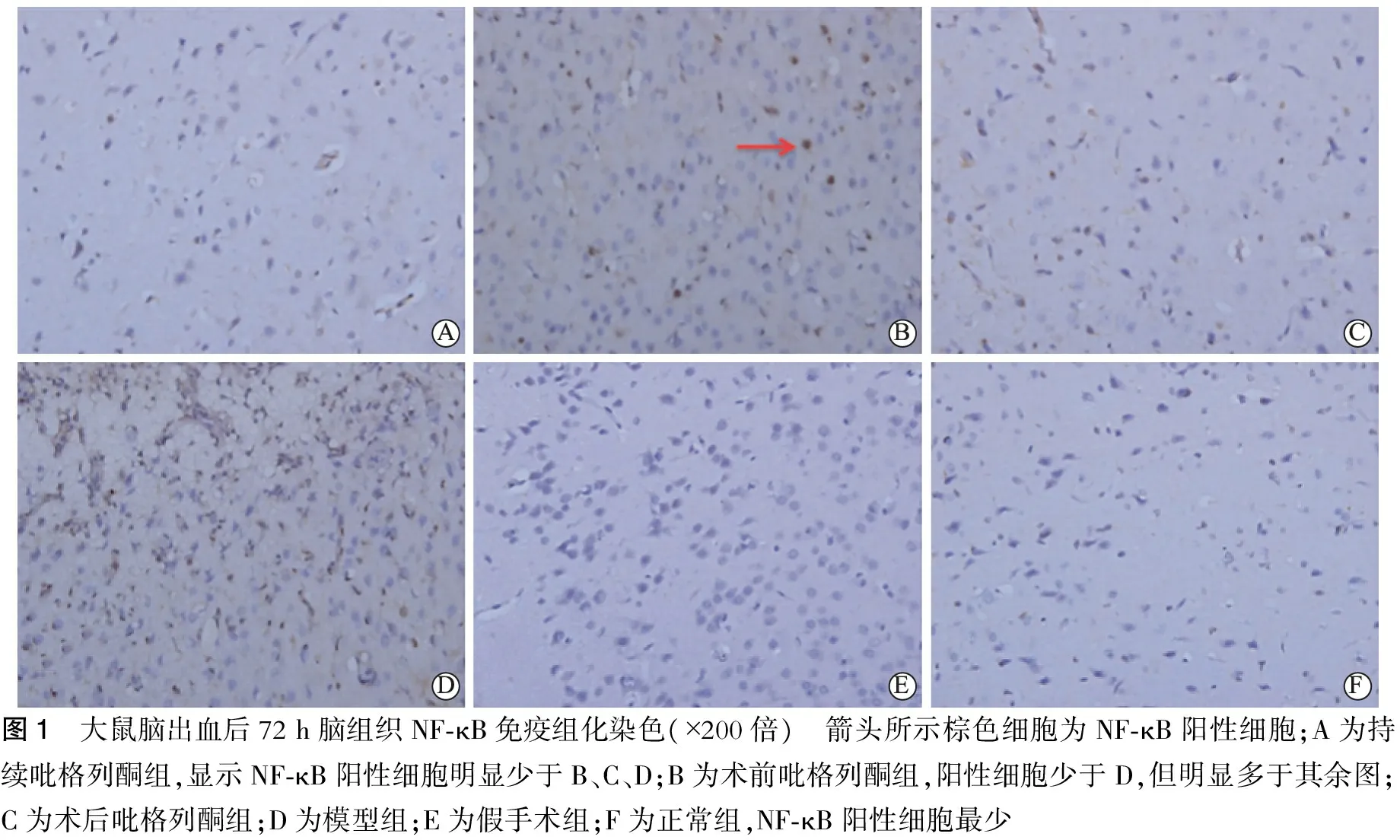
图1 大鼠脑出血后72h脑组织NF⁃κB免疫组化染色(×200倍) 箭头所示棕色细胞为NF⁃κB阳性细胞;A为持续吡格列酮组,显示NF⁃κB阳性细胞明显少于B、C、D;B为术前吡格列酮组,阳性细胞少于D,但明显多于其余图;C为术后吡格列酮组;D为模型组;E为假手术组;F为正常组,NF⁃κB阳性细胞最少
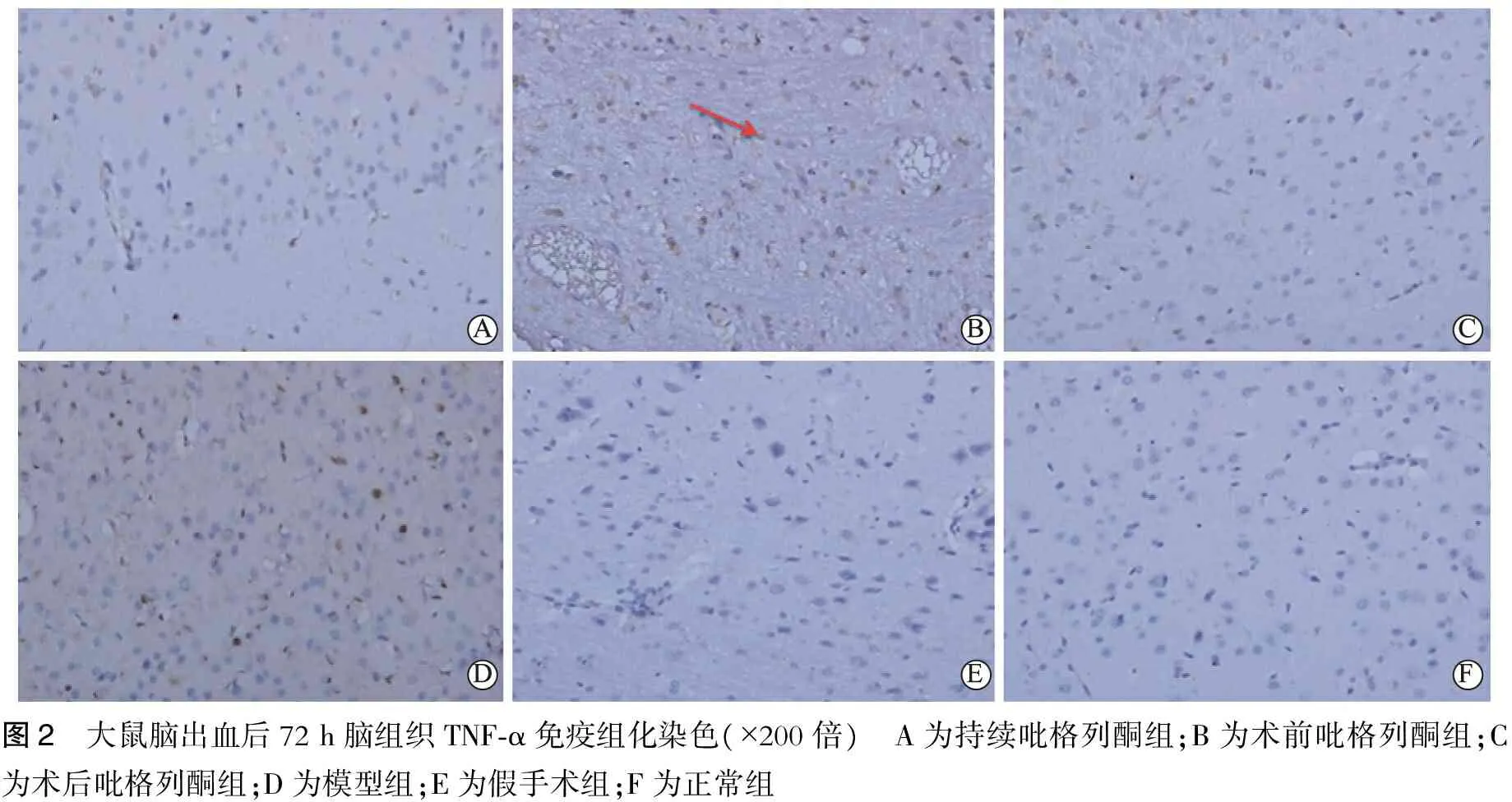
图2 大鼠脑出血后72h脑组织TNF⁃α免疫组化染色(×200倍) A为持续吡格列酮组;B为术前吡格列酮组;C为术后吡格列酮组;D为模型组;E为假手术组;F为正常组
3 讨 论
脑出血后炎症反应、自由基生成、脂质过氧化等多种病理机制导致脑损伤区周围甚至更广泛的脑神经元继发性死亡是引起出血性脑损伤的的重要原因之一[1-2]。
PPARs涉及多种能量代谢及细胞活性物质的调节,其合成配体噻唑烷二酮类药物吡格列酮除改善胰岛素抵抗外,还具有一定抗炎、抗氧化作用[13-15]。国外研究发现,PPARγ激活剂可抑制单核细胞表达白介素-6(interleukin- 6,IL-6)和白介素-1β(interleukin-1β,IL-1β),并可抑制巨噬细胞表达一氧化氮合酶、基质金属蛋白酶-9(matrix metalloprotease-9, MMP-9)和A型清道夫受体,其机制也可能与拮抗NF-κB活性有关[16-17]。Li等[18]的研究显示,在动脉粥样硬化的小鼠模型中格列酮类药物降低了主动脉根部TNF-α和明胶酶B的表达水平。同时张俊峰等[19]发现PPARγ激活剂可以显著抑制人巨噬细胞源泡沫细胞IL-6、TNF-α的分泌,抑制MMP-9的分泌和活性,其机制可能与NF-κB通路有关。
NF-κB信号通路参与炎症反应和细胞凋亡等重要的病理生理过程。已有研究证实脑出血早期即有NF-κB表达,参与脑出血周围组织继发性损伤及脑水肿形成[20];刘兵荣等[21]也发现NF-κB与脑出血后脑水肿有关。目前研究认为NF-κB的激活可能是脑出血后神经细胞凋亡的一个重要原因[22]。本研究发现胃灌注吡格列酮能降低NF-κB 的表达水平,且持续吡格列酮组NF-κB表达水平显著低于术前吡格列酮组、术后吡格列酮组,术前吡格列酮组NF-κB表达水平显著高于术后吡格列酮组(P<0.05),可见持续给药能够增强NF-κB表达,减少对神经细胞的损伤,抑制炎性因子释放;但术前吡格列酮组NF-κB表达水平较高,可能与造模后脑出血大鼠炎性因子维持高水平,而造模后未用药有关。
TNF-α是前炎性细胞因子,主要由激活的单核巨噬细胞产生,是脑出血后引起周围脑组织水肿形成的重要因素之一[23]。TNF-α可直接作用于血管内皮细胞,引起脑组织多核白细胞聚集和激活,释放炎性介质,诱导粘附因子、白介素等合成和释放,进一步加重脑损伤[24]。本研究发现,PPARγ激活剂吡格列酮可有效降低大鼠脑出血72 h血浆和脑组织中TNF-α表达水平,从而减轻全身及脑组织中的炎症反应,并促进了大鼠神经功能的恢复。临床研究发现,脑出血患者脑组织内TNF-α处于高表达水平,直接参与到脑出血损伤中。本研究持续吡格列酮组血浆和脑组织TNF-α表达水平均最低,其中术前吡格列酮组TNF-α表达水平显著高于术后吡格列酮组,但2组血浆TNF-α表达水平无明显差异,故本研究推测吡格列酮能够下降TNF-α的释放能力,负性调节脑组织中的TNF-α表达水平,但造模后脑组织和血清中TNF-α表达水平均明显上升,仅术前给药可能无法达到预期的治疗效果。
综上所述,吡格列酮作为PPARγ激活剂,能降低NF-κB 的表达水平,并抑制TNF-α的表达,促进了大鼠神经功能的恢复,发挥脑出血后的脑保护作用。但本研究仅就PPARγ激活剂吡格列酮对于大鼠炎症相关因子NF-κB、TNF-α表达水平的影响进行了探讨,相关通路及机制尚需要进一步研究。
[1]Xi GH,Keep RF,Hoff JT.Mechanisms of brain injury after intracerebral haemorrhage[J].The Lancet Neurology,2006,5(1):53-63.
[2]Aronowski J,Zhao X.Molecular pathophysiology of cerebral hemorrhage: secondary brain injury[J].Stroke,2011,42(6):1781-1786.
[3]韩宁,吴丹红,黄菲菲,等.吡格列酮对大鼠脑出血后脑组织细胞凋亡及自由基水平的影响[J].中国临床神经科学,2012,20(4):391-396.
[4]Luo Y,Yin W,Signore AP,et al.Neuroprotection against focal ischemic brain injury by the peroxisome proliferator-activated receptor-gamma agonist rosiglitazone[J].J Neurochem,2006,97(2):435-448.
[5]Park SW,Yi JH,Miranpuri G,et al.Thiazolidinedione class of peroxisome proliferator-activated receptor gamma agonists prevents neuronal damage, motor dysfunction, myelin loss, neuropathic pain, and inflammation after spinal cord injury in adult rats[J].J Pharmacol Exp Ther,2007,320(3):1002-1012.
[6]杨璐,宋美情,张秋玲,等.吡格列酮、二甲双胍对2型糖尿病合并非酒精性脂肪肝患者血清视黄醇结合蛋白4、脂联素水平的影响比较[J].中国医学科学院学报,2014,36(3):309-312.
[7]Deinsberger W,Vogel J,Kuschinsky W,et al.Experimental intracerebral hemorrhage: description of a double injection model in rats[J].Neurol Res,1996,18(5):475-477.
[8]周中和,曲方,何祥,等.一种改良大鼠自体血脑出血模型:二次注血/退针法[J].中国临床神经科学,2004,12(4):406-408.
[9]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[10] Ohlsson AL,Johansson BB.Environment influences functional outcome of cerebral infarction in rats[J].Stroke,1995,26(4):644-649.
[11] Garcia JH,Wagner S,Liu KF,et al.Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats. Statistical validation[J].Stroke,1995,26(4):627-634; discussion 635.
[12] Shih AY,Li P,Murphy TH.A small-molecule-inducible Nrf2-mediated antioxidant response provides effective prophylaxis against cerebral ischemia in vivo[J].J Neurosci,2005,25(44):10321-10335.
[13] Park S,Yi J,Miranpuri G,et al.Thiazolidinedione class of peroxisome proliferator-activated receptorgamma agonists prevents neuronal damage,motor dysfunction,myelin loss,neuropathic pain and inflammation after spinal cord injury in adult rats[J].J Pharm Exp Therap,2007,320(3):1002-1012.
[14] Mctigue DM,Tripathi R,Wei P,et al.The PPAR gamma agonist Pioglitazone improves anatomical and locomotor recovery after rodent spinal cord injury[J].Exp Neurol,2007,205(2):396-406.
[15] De Ryck M,Van Reempts J,Borgers M,et al.Photochemical stroke model: flunarizine prevents sensorimotor deficits after neocortical infarcts in rats[J].Stroke,1989,20(10):1383-1390.
[16] Ricote M,Li AC,Willson TM,et al.The peroxisome proliferator-activated receptor-gamma is a negative regulator of macrophage activation[J].Nature,1998,391(6662):79-82.
[17] Jiang C,Ting AT,Seed B.PPAR-gamma agonists inhibit production of monocyte inflammatory cytokines[J].Nature,1998,391(6662):82-86.
[18] Li AC,Brown KK,Silvestre MJ,et al.Peroxisome proliferator-activated receptor gamma ligands inhibit development of atherosclerosis in LDL receptor-deficient mice[J].J Clin Invest,2000,106(4):523-531.
[19] 申琳,王浩,叶平.吡格列酮对大鼠缺血/再灌注心肌过氧化物酶体增殖物受体γ辅激活因子lα表达的影响[J].南方医科大学学报,2014,6(2):197-200.
[20] Aronowski J,Hall CE.New horizons for primary intracerebral hemorrhage treatment: experience from preclinical studies[J].Neurol Res,2005,27(3):268-279.
[21] 李鸿娟,张东辉,刘海津.吡格列酮联合二甲双胍对2型糖尿病患者胰岛素抵抗及脂肪细胞因子水平的影响[J].中国老年学杂志,2014,15(9):2416-2417, 2418.
[22] 吴丹,滕伟禹.大鼠实验性脑出血后脑组织TLR2,NF-B/p65及caspase-3表达变化的研究[J].中风与神经疾病杂志,2010,27(6):484-488.
[23] 王立娜,郑丽娜.芦珊珊等.吡格列酮对多囊卵巢综合征患者血清CRP,IL-6,TNF-α水平的影响[J].山东医药,2015,28(38):58-59.
[24] Bhatia M,Moochhala S.Role of inflammatory mediators in the pathophysiology of acute respiratory distress syndmme[J].Pathol,2004,202(2):145-156.
