重组人对氧磷酶K192亚型对毒死蜱中毒所致肺损伤的保护作用
2016-01-29韩新飞张鹏思
张 娜,韩新飞,张 帆,张鹏思,赵 敏*
重组人对氧磷酶K192亚型对毒死蜱中毒所致肺损伤的保护作用
张娜a,韩新飞a,张帆a,张鹏思b,赵敏a*
[摘要]目的探讨重组人对氧磷酶K192亚型(rHuPON1K192)是否对毒死蜱(CPF)中毒所致Sprague-Dalwey(SD)大鼠急性肺损伤具有保护作用。方法将健康成年SD雄性大鼠30只随机分为对照组、染毒组、预处理组,每组10只。染毒组大鼠应用毒死蜱以330 mg/kg(2倍LD50)灌胃进行染毒,建立有机磷中毒模型;对照组灌胃等量生理盐水;预处理组于染毒前30 min尾静脉注射rHuPON1K192(9 000 U/kg)进行预处理。在造模后8 h处死大鼠,采血清和肺组织标本进行检测,测定血清核转录因子-κB(NF-κB)的浓度、超氧化物歧化酶(SOD)、丙二醛(MDA)、肺系数,并观察肺组织病理及电镜变化。结果预处理组与染毒组相比,血清中SOD活力增强,MDA含量减低,肺组织NF-κB活性降低。光镜和电镜下可见对照组大鼠肺组织表现正常。染毒组光镜下可见肺组织出现较重程度粒细胞浸润,肺水肿、肺泡间隔增厚,肺泡内有红细胞聚集,电镜下可见上皮细胞胞质肿胀、鼓泡、破裂,核染色质凝固、碎裂。预处理组大鼠上述改变较轻。结论rHuPON1K192可以减轻毒死蜱急性中毒大鼠的肺损伤,对肺损伤具有保护作用。
[关键词]有机磷中毒;毒死蜱;重组人对氧磷酶;急性肺损伤;NF-κB
[Abstract]ObjectiveTo explore whether the recombinant human paraoxonase K192(rHuPON1K192)can protect acute lung injury in Sprague-Dalwey(SD)rats induced by chlorpyrifos(CPF) poisoning.MethodsThirty healthy male adult SD rats were randomly divided into control group,infected group and pretreatment group,10 rats in each group.Rats in infected group were given chlorpyrifos by gavage 330 mg/kg(2 LD50) to establish the organophosphate poisoning model,rats in control group received normal saline,and pretreatment group was given caudal intravenously rHuPON1K192(9 000 U/kg) at 30 min before exposure to chlorpyrifos.The blood and lung tissue samples were collected for testing at 8 h after pretreatment.The serum levels of nuclear factor-Kappa B(NF-κB),Super Oxide Dismutase(SOD),malonaldehyde(MDA) and pulmonary coefficient were determined,and the changes of the lung histopathology and electron microscopy were observed.ResultsCompared with infected group,the SOD activity in pretreatment group increased,the MDA content in serum and the NF-κB activity of lung tissue decreased.The lung tissue in control group was normal under light microscope and electron microscope,while the tissue appeared heavier degree of neutrophil infiltration,lung edema,alveolar septal thickening and erythrocyte aggregation in alveolar in infected group under light microscope,with swelling,bubbling,cracking of the cytoplasm of the epithelial cells,chromatin coagulation and fragmentation under electron microscopy.The above changes in rats of pretreatment group was lighter.ConclusionrHuPON1K192can relieve the lung injury of rats with acute chlorpyrifos poisoning,with protective effect on lung injury.
收稿日期:2015-08-28
基金项目:沈阳市科学技术计划项目(F10-205-1-76)
通信作者*
DOI:10.14053/j.cnki.ppcr.201512004
Protective effect of recombinant human paraoxonase K192(rHuPON1K192) on lung injury induced by chlorpyrifos(CPF) poisoningZHANG Naa,HAN Xin-feia,ZHANG Fana,ZHANG Peng-sib,ZHAO Mina*(a.Department of Emergency,b.Local Service Section,Shengjing Hospital of China Medical University,Shenyang 110004,China)
Key words:Organophosphate poisoning;Chlorpyrifos;Recombinant human paraoxonase;Acute lung injury;NF-κB
0引言
有机磷中毒是全球主要的健康问题,据估计每年有超过300万例的有机磷中毒患者,其中有超过25万例的中毒原因为自杀,占全球自杀人数的30%[1]。急性有机磷农药中毒(AOPP)患者发病急骤,常并发肺损伤,呼吸衰竭是重度AOPP 患者最常见的并发症[2],也是重度 AOPP患者最重要的死亡原因。对氧磷酶1(Paraoxonase 1,PON1)是一种重要的参与有机磷农药解毒的羧基酯酶,能催化磷酸酯键的水解,在有机磷代谢中起重要作用。本实验采用对SD大鼠进行急性毒死蜱染毒和rHuPON1K192预处理的方法,测定各组MDA、SOD、肺组织 NF-κB的表达、肺系数及病理、电镜变化,探讨rHuPON1K192亚型对有机磷中毒所致肺损伤的保护作用。
1材料与方法
1.1实验对象选择健康雄性清洁级SD大鼠30只,体重250~350 g,由中国医科大学实验动物中心提供。
1.2主要材料及仪器实验试剂与药品:rHuPON1K192(自行制备),45%毒死蜱乳液购自天津汉邦植物保护剂有限责任公司,MDA、SOD试剂盒购自南京建成生物工程研究所,兔抗NF-κB试剂盒购自英国abcam公司,羊抗兔二抗试剂盒购自北京中杉金桥生物技术公司,其他试剂均由中国医科大学附属盛京医院中心实验室提供。实验仪器均由中国医科大学附属盛京医院中心实验室提供:Mutifuge 3SR+高速低温离心机购自美国Thermo公司,E800型生物光学显微镜照相机购自Nikon公司,FD-1冷冻干燥机购自北京博医康技术公司,HH-2数显恒温水浴箱购自国华电器有限公司。
1.3实验方法
1.3.1动物分组及模型制备将30只成年雄性SD大鼠随机分为3组,对照组、染毒组及预处理组,每组10只。染毒组以330 mg/kg灌胃毒死蜱染毒建立急性AOPP 模型。对照组给予等量生理盐水,预处理组灌胃前予大鼠9 000 U/kg尾静脉注射rHuPON1K192。在造模后8 h即开始取材,剔除死亡个体。
1.3.2留取标本于造模后8 h将各组大鼠分别采血1 mL及肺组织。10%水合氯醛3 mL/kg大鼠腹腔注射麻醉,打开腹腔直接从腹主动脉采血,1 500 r/min离心10 min,提取上清放置 -80 ℃冰箱内备用;另取右上肺组织用中性甲醛及戊二醛浸泡固定,以备组织学光镜及电镜检查。用生理盐水冲去表面血迹后用滤纸擦干并称质量,计算肺系数。对照组行同样处理。每次测定标本均在取样当日或次日,成批检测以减少操作误差。
1.4检测指标
1.4.1测试公式计算肺系数。肺系数=肺重量(g)/体重(kg)×100%。
1.4.2MDA、SOD浓度测定应用TBA法测定各组大鼠血清中MDA浓度,应用羟胺法测定各组大鼠血清中SOD活性,操作均按照试剂盒说明书要求进行。
1.4.3免疫组化用免疫组织化学法测肺组织 NF-κB 水平,用NIS-Elements F 3.0图像采集软件照相并分析。
1.4.4光学显微镜下观察取右上肺组织,经甲醛固定、梯度乙醇脱水、二甲苯透明、浸蜡、包埋、切片后,苏木素-伊红(HE)染色,光镜下观察肺组织病理变化。
1.4.5透射电镜下观察取肺尖部组织切成小块,戊二醛及锇酸固定,磷酸盐缓冲液漂洗,梯度乙醇、环氧丙烷顺序脱水后包埋,超薄切片;醋酸铀-柠檬酸铅双染后透射电镜下观察。
1.5统计学方法采用 SPSS 17.0 软件。计量资料采用±s表示,各组数据首先进行方差齐性检验,然后进行独立样本t检验,比较两组大鼠的血清 MDA、SOD浓度,肺NF-κB 水平,肺系数的差异水平,P<0.05为差异有统计学意义。
2结果
2.1灌胃后三组大鼠的反应对照组大鼠在整个实验过程中无异常反应。染毒组大鼠在毒死蜱灌胃后0.5~4 h开始出现有机磷杀虫剂中毒症状:流涎,肌肉颤动,呼吸急促,步态不稳。染毒组共死亡大鼠6只,死亡大鼠视为造模不成功,剔除实验,随后再补充6只大鼠。预处理组大鼠有机磷中毒症状程度较染毒组轻。
2.2肺系数水平的变化预处理组肺系数高于对照组,并且低于染毒组。各组大鼠肺系数比较,差异均有统计学意义(P<0.05)。 见表1。
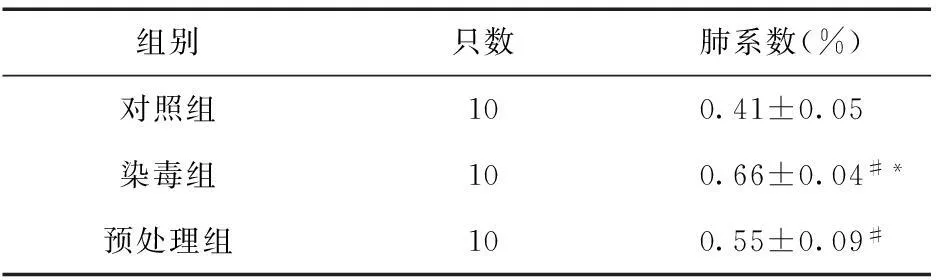
表1 各组大鼠肺系数
注:#与对照组比较,P<0.05;*与预处理组比较,P<0.05
2.3各组血清MDA、SOD浓度变化预处理组血清MDA水平高于对照组,并且低于染毒组;预处理组血清SOD水平低于对照组,并且高于染毒组。各组大鼠SOD、MDA比较,差异均有统计学意义(P<0.05)。 见表2。
2.4各组肺组织NF-κB 水平变化每组选取10张切片,每张切片随机选取5个视界,于 400 倍光学显微镜下拍照,棕黄色代表NF-κB,主要位于细胞核内,细胞质中也有少量表达,肺组织中 NF-κB 越高,着色越深。预处理组肺组织NF-κB水平高于对照组,并且低于染毒组。各组大鼠肺组织NF-κB比较,差异均有统计学意义(P<0.05)。见表3。

表2 各组大鼠MDA、SOD水平
注:#与对照组比较,P<0.05;*与预处理组比较,P<0.05
2.5肺组织光学显微镜下的病理改变对照组大鼠肺组织切片(图1a)正常,光镜下肺泡结构完整,肺泡腔内干净,间隔无增厚,无红细胞及炎性细胞浸润,毛细血管无扩张及充血。染毒组大鼠肺组织(图1b)肺泡间隔增厚、水肿,肺泡腔内可见红细胞聚集,肺泡壁毛细血管充血,伴炎性细胞浸润。预处理组动物(图1c)肺水肿、肺泡间隔肿胀减轻,炎性细胞浸润程度减轻,可见完整的肺泡腔,腔内可见少量红细胞。
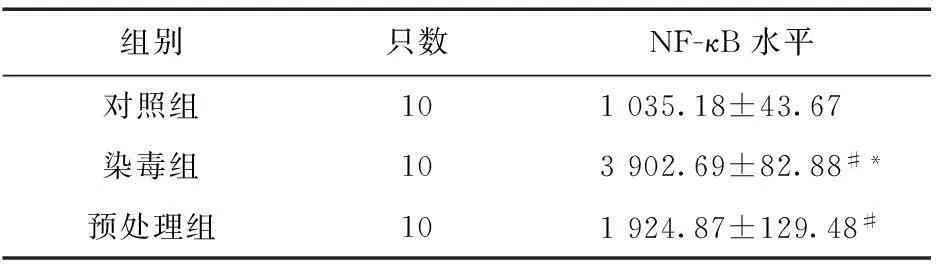
表3 急性毒死蜱中毒大鼠肺组织NF-κB 水平变化
注:#与对照组比较,P<0.05;*与预处理组比较,P<0.05
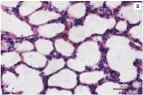
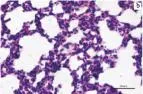
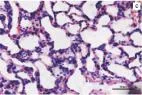
图1各组大鼠光镜下病理改变(HE×400)
2.6肺组织电镜下的病理改变对照组(图2a)肺泡壁完整,Ⅰ型、Ⅱ型上皮细胞结构完整,未见明显改变,肺泡上皮细胞之间紧密连接均保持完好。染毒组(图2b)肺泡壁完整结构被破坏,Ⅰ型上皮细胞胞质肿胀、鼓泡、破裂,甚至可以见到细胞碎裂脱落,基底膜暴露;Ⅱ型上皮细胞中可见胞质减少呈空泡变、微毛减少等现象。预处理组(图2c)肺泡壁和细胞上述改变减轻,Ⅰ型上皮细胞胞质肿胀减轻,Ⅱ型上皮细胞空泡变现象减少。
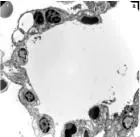
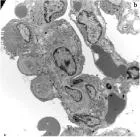
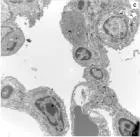
图2各组大鼠电镜下病理改变(×4 000)
3讨论
有机磷杀虫剂可以对各个器官造成损害,肺是最早接触吸入有毒化学物质的器官。有机磷可导致广泛的肺损伤,如肺泡充血、出血,中性粒细胞浸润及肺气肿、肺水肿等变化[3-5]。近年来,许多文献都强调氧化应激在有机磷中毒中的作用[6-8],认为其是引起有机磷中毒的主要原因[9-10]。毒死蜱是一种亲脂性的中度毒类有机磷,可以很容易地通过细胞膜,引起机体的损害程度很高[11]。以往的调查结果表明,毒死蜱可诱导不同组织中的氧化应激以及组织病理学变化[12-13]。
MDA是一种多不饱和脂肪酸过氧化的主要产物,其含量的增加是脂质过氧化反应的重要指标[14]。SOD是体内唯一直接清除氧自由基的酶,若其活性不足或大量消耗可降低组织的抗氧化能力[15]。本实验采用毒死蜱灌胃建立AOPP动物模型,发现染毒组大鼠肺系数、MDA较对照组升高,SOD降低,说明细胞的抗氧化能力下降,脂质过氧化作用增强,造成大鼠肺的氧化损伤,从而验证了氧化应激在毒死蜱致肺损伤中的作用。
NF-κB是参与急性肺损伤进展的一个关键因素[16-18],当机体受到外伤、休克、病毒或细菌等因素刺激时,NF-κB的信号通路被激活,中性粒细胞和巨噬细胞等炎性细胞随后被触发,IL-1β和TNF-α等炎症介质释放,促进氧化应激反应[19-20]。本实验发现染毒组大鼠NF-κB水平较对照组升高,验证了急性肺损伤中NF-κB的作用。
血清PON1是肝脏分泌的一种能够水解多种有机磷的钙离子依赖性酯酶,具有重要的解毒作用[21],可在某些有机磷农药抑制胆碱酯酶之前将其水解,从而预防有机磷中毒[22]。PON1在血液中结合 ApoAⅠ而紧密固定在高密度脂蛋白颗粒上发挥抗氧化作用,抑制低密度脂蛋白氧化修饰以及水解溶血磷酯等具有生物活性的脂质过氧化物,是重要的抗氧化酶[23],可降低机体的氧化应激状态和脂质过氧化[24]。近年来,许多文献研究了PON1对有机磷中毒的保护作用[25-26]。本实验应用rHuPON1K192预处理大鼠,发现预处理组大鼠肺系数、MDA及NF-κB较染毒组降低,SOD较染毒组升高。结果提示rHuPON1K192可以减轻毒死蜱急性中毒大鼠的肺组织损伤,对肺损伤具有保护作用,也验证了抗氧化剂在有机磷中毒中的保护作用[27-28]。
本实验仅为rHuPON1K192对有机磷中毒的肺保护作用提供了实验依据,但是其所需要的最佳剂量仍需要进一步研究。
参考文献:
[1]Gunnell D,Eddleston M,Phillips MR,et al.The global distribution of fatal pesticide self-poisoning:systematic review[J].BMC Public Health,2007,7:357.
[2]Peter JV,Jerobin J,Nair A,et al.Clinical profile and outcome of patients hospitalized with dimethyl and diethyl organophosphate poisoning[J].Clin Toxicol (Phila),2010,48:916-923.
[3]Yurumez Y,Ikizceli I,Sozuer EM,et al.Effect of inteleukin-10 on tissue damage caused by organophosphate poisoning [J].Basic Clin Pharmacol Toxicol,2007,100(5):323-327.
[4]Morowati M.Inhalation toxicity studies of Thimet (Phorate) in the male swiss albino mouse,Mus musculus: II. Lung histopathology,pseudocholinesterase level and haematological studies[J].Environ Pollut,1998,103:309-315.
[5]Yavuz Y,Kaya E,Yurumez Y,et al.Technetium-99m diethylenetriaminepentaacetic acid radioaerosol scintigraphy in organophosphate induced pulmonary toxicity:experimental study[J].Clin Toxicol(Phila),2008,46(8):711-715.
[6]Kovacic P.Mechanism of organophosphates (nerve gases and pesticides) and antidotes:electron transfer and oxidative stress[J].Curr Med Chem,2003,10(24):2705-2709.
[7]Soltaninejad K,Abdollahi M.Current opinion on the science of organophosphate pesticides and toxic stress:a systemic review[J].Med Sci Monit,2009,15(3):RA75-RA90.
[8]Karami-Mohajeri S,Abdollahi M.Toxic influence of organophosphate,carbamate,and organochlorine pesticides on cellular metabolism of lipids,proteins,and carbohydrates:a systematic review[J].Hum Exp Toxicol,2011,30(9):1119-1140.
[9]Shadnia S,Dasgar M,Taghikhani S,et al.Protective effects of alphatocopherol and N-acetylcysteine on diazinon-induced oxidative stress and acetylcholinesterase inhibition in rats[J].Toxicol Mech Methods,2007,17(2):109-115.
[10]Possamai FP,Fortunato JJ,Feier G,et al.Oxidative stress after acute and sub-chronic malathion intoxication in Wistar rats[J].Environ Toxicol Pharmacol,2007,23(2):198-204.
[11]Ncibi S,Ben Othman M,Akacha A,et al.Opuntia ficus indica extract protects against chlorpyrifos-induced damage on mice liver[J].Food Chem Toxicol,2008,46(2):797-802.
[12]Goel A,Dani V,Dhawan DK.Protective effects of zinc on lipid peroxidation,antioxidant enzymes and hepatic histoarchitecture in chlorpyrifos-induced toxicity[J].Chem Biol Interact,2005,156(2-3):131-140.
[13]Joshi SC,Mathur R,Gulati N.Testicular toxicity of chlorpyrifos (an organophosphate pesticide) in albino rat[J].Toxicol Ind Health,2007,23(7):439-444.
[14]Celik I,Suzek H.Effects of subacute exposure of dichlorvos at sublethal dosages on erythrocyte and tissue antioxidant defense systems and lipid peroxidation in rats[J].Ecotoxicol Environ Saf,2009,72(3):905-908.
[15]Helander I,Westerblad H,Katz A.Effects of glucose on contractile function,[Ca2+]i,and glycogen in isolated mouse skeletal muscle[J].Am J Physiol cell Physiol,2002,282(6):C1306-1312.
[16]张艰,李圣青,李焕章,等.NF-κB在大鼠急性肺损伤模型肺组织中的表达及 N-乙酰半胱氨酸的影响[J].细胞与分子免疫学杂志,2004,20(6):712-715.
[17]Chi G,Wei M,Xie X,et al.Suppression of MAPK and NF-κB pathways by limonene contributes to attenuation of lipopolysaccharide induced inflammatory responses in acute lung injury[J].Inflammation,2013,36(2):501-511.
[18]Zhu T,Wang DX,Zhang W,et al.Andrographolide protects against LPS-induced acute lung injury by inactivation of NF-κB[J].PLoS One,2013,8(2):e56407.
[19]Tahir M,Rehman MU,Lateef A,et al.Diosmin protects against ethanol-induced hepatic injury via alleviation of inflammation and regulation of TNF-α and NF-κB activation[J].Alcohol,2013,47(2):131-139.
[20]Scholz CC,Cavadas MA,Tambuwala MM,et al.Regulation of IL-1β-induced NF-κB by hydroxylases links key hypoxic and inflammatory signaling pathways[J].Proc Natl Acad Sci USA,2013,110(46):18490-18495.
[21]Costa LG,Cole TB,Furlong CE. Polymorphisms of Paraoxonase (PONl)and their significance in clinical toxicology organophosphates[J].J Toxicol Clin Toxicol,2003,41(1):37-45.
[22]宁国英.对氧磷酶1基因多态性与有机磷农药中毒易感性[J].中国工业医学杂志,2010,23(5):367-382.
[23]Sozmen EY,Sozmen B,Girgin FK,et al,Antioxidant enzymes and paraoxonase show a co-activity in preserving low-density lipoprotein from oxidant[J].Clin Exp Med,2001,1(4):195-199.
[24]黄凯,李燕.对氧磷酶与慢性肝损伤[J].国际药学研究杂志,2011,38(2):112-117.
[25]Wang NN,Yuan L,Dai H,et al.Effect of PON1 on dichlorvos toxicokinetics[J].Emerg Med J,2011,28(4):313-315.
[26]Wang NN,Dai H,Yuan L,et al.Study of paraoxonase-1 function on tissue damage of dichlorvos[J].Toxicol lett,2010,196(2):125-132.
[27]Hassani S,Sepand MR,Jafari A,et al.Protective effects of curcumin and vitamin E against chlorpyrifos-induced lung oxidative damage[J].Hum Exp Toxicol,2015,34(6):668-676.
[28]Amara IB,Soudani N,Troudi A,et al.dimethoate induced oxidative damage and histopathological changes in lung of adult rats:modulatory effects of selenium and/or vitamin E[J].Biomed Environ Sci,2012,25(3):340-351.
作者单位:中国医科大学附属盛京医院,沈阳 110004
