枯草芽胞杆菌PnbA酯酶选择性拆分制备 l-薄荷醇
2016-01-13陶惟一,徐娴,李霜

枯草芽胞杆菌PnbA酯酶选择性拆分制备l-薄荷醇
陶惟一,徐娴,李霜
(南京工业大学 生物与制药工程学院, 江苏南京211800)
摘要:利用重组大肠杆菌表达来源于枯草芽胞杆菌CICC 20034中的PnbA酯酶,不对称催化水解dl-薄荷醇丙酸酯制备l-薄荷醇。考察助溶剂种类、助溶剂添加浓度、温度、催化剂用量、底物浓度以及pH等对反应的影响。结果表明:添加25%(体积分数)助溶剂乙醇可显著提升该酯酶对l-薄荷醇的立体选择性,对映选择率(E)由2.4提高到99.43,为不加乙醇条件下的40倍。酶催化最佳条件:25%乙醇作为助溶剂,反应温度37 ℃,缓冲液为0.1 mol/L Tris-HCl(pH 8.0)并保持pH 8.0反应条件,底物量50 mmol/L,反应体系中酶的添加量750 U/mL,在此条件下,酶促反应30 min后,l-薄荷醇转化率可达34%,产物光学纯度对映体过量值(e.e.p)达95%。
关键词:PnbA酯酶;对映选择率;l-薄荷醇;助溶剂;选择性拆分
doi:10.3969/j.issn.1672-3678.2015.06.008
收稿日期:2015-03-11
基金项目:国家重点基础研究发展计划(973计划)(2011CB710800);国家自然科学基金青年基金(21406111)
作者简介:陶惟一(1990—),女,江苏南京人,硕士研究生,研究方向:生物化工;李霜(联系人),教授,lishuang@njtech.edu.cn
中图分类号:TQ033
文献标志码:A
文章编号:1672-3678(2015)06-0043-06
Abstract:The PnbA esterase from Bacillus subtilis CICC 20034 was expressed in recombinant Escherichia coli and used to produce l-menthol through enantioselective hydrolysis of dl-menthyl propionate. The effects of co-solvents,temperature,pH,substrate titers and enzyme dosage on the enantioselective hydrolysis reaction were studied. Results showed that ethanol was the most suitable co-solvent; adding 25%(V/V) ethanol could significantly improve the optical purity of l-menthol,enantiomeric selectivity(E) enhanced from 2.4 to 99.43,about 40 times higher than that of the control.The optimized conditions for hydrolysis of dl-menthyl propionate to prepare l-menthol by PnbA were 25%(V/V) ethanol,0.1 mol/L Tris-HCl buffer (pH8.0), 50 mmol/L dl-menthyl piopionate,750 U/mL crude enzyme solution,37 ℃ and pH 8.0. Under these conditions,l-menthol could be obtained with the conversion rate obove 34% and the optical purity above 95% in 30 min reaction.
Keywords:PnbA esterase; enantiomeric selectivity; l-menthol; co-solvent; enantioselective hydrolysis
Enantioselective hydrolysis of dl-menthyl propionate in enzymatic preparation of l-menthol by PnbA esterase from Bacillus subtilis
TAO Weiyi,XU Xian,LI Shuang
(College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
l-薄荷醇是天然薄荷醇的立体构象,具有特有的薄荷香气和清凉效果,已经广泛应用于食品、医药和日用品等行业。目前,薄荷醇的生产主要是天然提取,但受环境、天气等因素影响,天然薄荷醇质量和产量都难以满足日益增长的消费需求。因此,近年来采用脂肪酶或酯酶不对称拆分制备l-薄荷醇成为研究热点。用于拆分制备l-薄荷醇的酯酶或脂肪酶的微生物主要有枯草芽胞杆菌(Bacillussubtilis)、产碱假单胞菌(P ̄s ̄e ̄u ̄d ̄o ̄m ̄o ̄n ̄a ̄salcaligenes)、洋葱布克氏菌(Burkholderiac ̄e ̄p ̄a ̄c ̄i ̄a)等。
在拆分反应中,影响酶立体选择性的因素有温度、pH、助溶剂种类以及添加量等。其中,助溶剂对酶立体选择性的影响较大。Watanabe等发现在酶促水解反应中,可以通过添加二甲基亚砜(DMSO)改变2种构型底物的反应初速度来提高对映选择率。Wu等利用来源Candidarugosa的脂肪酶催化酯化反应时发现,添加的乙醇含量可以显著影响对映选择率以及反应初速度。
但是,目前针对有机溶剂是如何影响酶立体选择性的机制探究还没有定论。本文中,笔者重点考察PnbA酯酶不对称水解生产l-薄荷醇反应中各因素的影响,期望能为进一步探究有机溶剂含量对酶立体选择性的研究机制打下基础。
1材料与方法
1.1 菌体培养
利用载体为pET22b重组表达枯草芽胞杆菌PnbA酯酶(带His Tag标签),宿主为E.coliBL21(DE3)。重组菌以2%(体积分数)接种量接入装有50 mL 无菌LB培养基的250 mL 摇瓶中,加入终质量浓度100 mg/L的氨苄青霉素,在37 ℃和200 r/min条件下培养2 h后,加入终浓度1 mmol/L的诱导剂IPTG,继续培养4 h。
1.2 PnbA酯酶的制备
培养结束后于8 000 r/min下离心10 min,收集菌体,用0.1 mol/L Tris-HCl 缓冲液(pH 7.0)洗涤2次后重悬菌体,超声波破碎菌体,离心(8 000 r/min、4 ℃、15 min) 除去细胞碎片,收集上清液(即粗酶液)。粗酶液使用镍柱亲和纯化,得到PnbA酯酶纯酶,用于电泳验证。
1.3 蛋白质含量及酶活力测定
采用考马斯亮蓝法测定蛋白质含量。
以对硝基苯酚丁酸酯(p-nitrophenol butyrate,pNPB)为底物的分光光度法测定反应过程中生成对硝基苯酚的微摩尔数来确定酯酶活力。酶活单位的定义:在40 ℃、pH 7.0条件下,每分钟催化pNPB水解生成1 μmolpNP所需的酶量,U。
1.4 PnbA酯酶不对称水解 dl-薄荷醇丙酸酯
反应体系(2 mL)包括:底物dl-薄荷醇丙酸酯(浙江大学杨立荣教授实验室成员合成),0.1 mol/L Tris-HCl缓冲液(pH 7.0),PnbA粗酶液,有机溶剂;于37 ℃下振荡反应一定时间,加入2 mL正己烷终止反应,并旋涡振荡5 min萃取产物以及残留底物,再将获得的有机相用无水MgSO4干燥后进行气相色谱分析。文中所有试验均重复3次取其平均值。
气相分析在FULIGC979O型气相色谱仪上进行分析,FID检测器,CP- cyclodextrin-β-2,3,6-M-19手性柱(0.25 mm×0.25 mm×50 mm,β-环糊精,安捷伦公司)。柱温130 ℃,总压0.14 MPa,空气0.03 MPa,H20.1 MPa,N20.01 MPa,进样温度260 ℃,检测温度250 ℃,进样量5 μL。
底物转化率和产物的对映体过量值的计算见式(1)~(3)。
转化率(C)= e.e.s/(e.e.s+e.e.p) ×100%
(1)
产物光学纯度(e.e.p)=
[(Cl-Cd)/(Cl+Cd)×100%]
(2)
对映选择率(E)=ln[1-C(1+e.e.p)]/
ln[1-C(1-e.e.p)]
(3)
式中:e.e.s为底物对映体过量值;e.e.p为产物对映体过量值;Cl为l-构型对映体的峰面积;Cd为d-构型对映体的峰面积。
1.5 助溶剂乙醇对pnbA酯酶的影响
考察助溶剂种类、助溶剂浓度对PnbA酯酶不对称水解dl-薄荷醇丙酸酯的影响,并在反应体系中加入不同浓度乙醇,考察PnbA酯酶对乙醇的耐受能力,测量加入乙醇后,在不同时间内PnbA酯酶的活性。
1.6 荧光光谱分析
使用纯化后的PnbA酯酶,用Perkin-Elmer LS55型荧光光谱仪测定不同乙醇浓度下酶的荧光光谱(λex=280),测量时扫描范围为260~400 nm。
1.7 反应条件优化
考察助溶剂种类、反应温度、助溶剂浓度、底物浓度、催化剂用量以及反应体系 pH对 PnbA酯酶不对称水解dl-薄荷醇丙酸酯的影响。
2结果与讨论
2.1 枯草芽胞杆菌PnbA酯酶的制备
重组菌PnbA粗酶水解pNPB体积活力达110 000 U/L,比酶活为430 U/mg,经镍柱亲和纯化后,比酶活达1 668 U/mg,纯化3.9倍,回收率32%。重组菌表达的PnbA酯酶及其纯化品进行电泳鉴定的结果如图1所示,其理论相对分子质量约为5.6×104。由图1可知,泳道1的PnbA的相对分子质量与理论值相符,镍柱亲和纯化PnbA酯酶达到电泳纯。
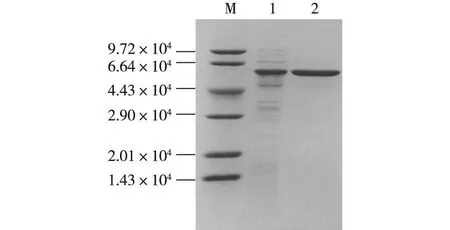
M—标准蛋白;1—重组大肠杆菌诱导后的 全蛋白;2—纯化后的PnbA酯酶 图1 重组PnbA酯酶的表达与纯化 Fig.1 Expression and purification of recombinant esterase PnbA
2.2 枯草芽胞杆菌PnbA酯酶的同源性分析
来自枯草芽胞杆菌CICC20034的PnbA酯酶(GenBank:KJ939251.1)与解淀粉芽胞杆菌Bacillusamyloliquifacienspara-nitrobenzyl中未表征的酯酶(GenBank:WP_021495235)一级结构同源性为99%,与已表征的BacillussubtilisChain A, PnbA酯
酶(PDB:1QE3_A)的一级结构同源性为63%。
已报道用于薄荷酯不对称拆分的酯酶/脂肪酶如表1所示。与表1中的数据对比可以发现,笔者所用的PnbA酯酶与BacillussubtilisECU0554脂肪酶(GenBank:BSU_34390)同源性最高为64%,与PseudomonasalcaligenesX1脂肪酶同源性为35%,表明该PnbA酯酶具备用于薄荷拆分反应的潜力。
2.3 助溶剂对PnbA酯酶水解 dl-薄荷醇丙酸酯选择性的影响
水溶性有机溶剂往往会显著影响酶的立体选择性和催化活性。一方面,由于促进了水不溶底物在反应体系中的分散,从而提高对映选择性和产物的光学纯度[11];另一方面,有机溶剂直接影响酶的构象,改变酶反应活性通道,从而影响酶的催化性质。此外,有机溶剂往往会夺去酶分子表面的水化层,引起酶分子构象改变,进而影响酶的催化活性。添加10%(体积分数)的DMSO、丙酮、乙醇和二甲基甲酰胺(DMF)等亲水溶剂作为反应体系的助溶剂,2 mL 反应体系中含有2 mL助溶剂、25 mmol/Ldl-薄荷醇丙酸酯和500 U/mL PnbA粗酶液,37 ℃、pH 7.0条件下反应2 h,结果如图2所示。由图2可知:乙醇和DMF可以显著提升PnbA酯酶水解反应的选择性,产物e.e.p值由35.1增加至47,反应的E值也相应增加,且与e.e.p值的变化呈正相关。这可能是由于底物在不同的有机溶剂中分散系数不同,因此e.e.p值较高[12]。后续反应选择乙醇作为助溶剂。

表1 已表征的不对称水解 l-薄荷酯的酯酶/脂肪酶

图2 有机溶剂对PnbA酯酶不对称水解 dl-薄荷醇丙酸酯的影响 Fig.2 Effects of organic solvents on the asymmetric hydrolysis of dl-menthyl propionate catalyzed by PnbA crude enzyme
2.4 助溶剂乙醇浓度对PnbA酯酶不对称水解 dl-薄荷醇丙酸酯的影响
通常低浓度的助溶剂有助于提高酶活力,但当溶剂浓度增加时往往会对酶有毒害作用。考察助溶剂乙醇浓度对PnbA酯酶不对称水解dl-薄荷醇丙酸酯的影响,2 mL反应体系中含有不同浓度乙醇、25 mmol/Ldl-薄荷醇丙酸酯和500 U/mL PnbA粗酶液,37 ℃、pH 7.0条件下反应2 h,结果见图3。

图3 助溶剂乙醇浓度对PnbA酯酶不对称水解 dl-薄荷醇丙酸酯的影响 Fig.3 Effects of concentration of alcohol on the asymmetric hydrolysis of dl-menthyl propionate catalyzed by PnbA crude enzyme
由图3可以看出:随助溶剂乙醇浓度的增加,水解反应E值呈现先增高后降低的趋势,在乙醇添加量为25%时达到最大值99.43,比不加助溶剂条件下高了近40倍;同样的,反应转化率(C)也呈现出先增高再降低的趋势,从32.9%到47.95%,但是当乙醇体积分数大于25%后,转化率出现快速下降。值得注意的是,产物的光学纯度随着乙醇浓度的增加而增加,乙醇添加量为25%时,产物的光学纯度大于95.4%,即使乙醇体积分数超过25%,产物的光学纯度仍未降低。这表明助溶剂乙醇的最适添加量为25%(体积分数),该酯酶对l-薄荷醇酯的选择性提高了近40倍,实现了从几乎无对映选择性到对映选择性大于99.43,这一显著的变化引起了笔者的注意。
Wehbi等[13]证明助溶剂可以通过改变酶活性部位的极性以及部分构象从而激活磷脂酶。Watanabe等研究了DMSO可以引起脂肪酶构象变化或提高其疏水性。对此,为了进一步探究乙醇是如何影响PnbA酯酶不对称水解dl-薄荷醇酯的机制,就有必要探究乙醇添加量对PnbA酯酶耐受性的影响以及不同添加量条件下该酯酶的荧光光谱的变化。
2.5 乙醇添加量对PnbA酯酶耐受性的影响
考察添加不同乙醇浓度对PnbA酯酶活性的影响,结果如图4所示。由图4可以看出:将初始酶活力设定为100%, 随着添加乙醇含量的增加,高于25%时,该酯酶活力迅速丧失,在添加量为15%~25%时,10 min内酶活力下降至初始酶活的1/10,说明该酯酶对乙醇的耐受性很差,也可以进一步说明当添加乙醇体积分数高于25%时,不对称水解反应转化率剧烈下降,与酶的失活密切相关。
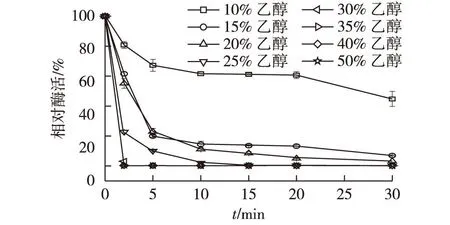
图4 乙醇添加量对PnbA酯酶耐受性的影响 Fig.4 Effects of concentration of alcohol on the activity of PnbA crude enzyme
2.6 利用荧光光谱法探究乙醇对PnbA酯酶二级结构的影响
荧光光谱法是研究蛋白质分子构象的方法之一,在蛋白质分子中,能发射荧光的氨基酸有色氨酸(Trp)、酪氨酸(Tyr)以及苯丙氨酸(Phe)。蛋白质的荧光通常在280 nm 或更长的波长被激发,其内源荧光主要由Trp和Tyr产生。Tyr荧光光谱最大发射波长一般位于303 nm 处,而Trp的荧光光谱对微环境的变化很敏感,其峰位一般在325~352 nm 波长之间变动,当蛋白质逐步解折叠,内源色氨酸相应的逐步暴露于溶剂中,荧光谱不断红移,直至达到352 nm(自由色氨酸在水溶液中的最大发射波长)。Trp与Tyr残基作为高度疏水的基团,常常位于蛋白质分子内部。而酶分子构象改变时往往会引起某些疏水集团的暴露,因此,可以通过Trp残基和Tyr残基荧光光谱的动态变化分析蛋白质分子所处的构象状态。
在PnbA酯酶氨基酸序列中,有9个色氨酸残基(24、48、103、169、360、377、383、432、448),12个酪氨酸残基(29、85、110、119、137、154、308、326、329、343、379、451)。因此,可以用色氨酸与酪氨酸残基发射光谱来检测其二级结构的变化。图5为在280 nm激发光条件下,PnbA酯酶的荧光光谱图。
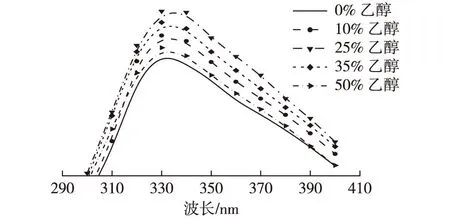
图5 PnbA酯酶的荧光光谱 Fig.5 Fluoresence spectra of PnbA
由图5可知:在此条件下,PnbA酯酶的最大发射光强在335 nm左右处,表明此时主要为色氨酸残基发出的荧光。在乙醇体积分数为0%~25%时,随乙醇浓度的增加,PnbA酯酶荧光光强逐渐增大,在25%乙醇条件下,其最高荧光强度,且最大发射光波长出现红移现象。这说明此时酶构象发生了改变,其色氨酸残基微环境发生改变,使其所属的微环境亲水性增加,极性增加,蛋白质结构趋于舒展[14],这可能是蛋白质结构的舒展,使其活性中心暴露,从而更加契合l-构型的薄荷丙酸酯底物,因此,在增加乙醇体积分数到25%时,催化生产l-薄荷醇的手性选择性以及转化率都增加。然后随着乙醇体积分数大于25%,荧光光强逐渐降低。从PnbA酯酶耐受乙醇情况来看,当乙醇体积分数大于25%时,酶迅速失活,因此可以推断此时荧光强度的降低是由于酯酶已失活聚集成团。
2.7 PnbA酯酶不对称水解 dl-薄荷醇丙酸酯
通过考察温度、pH、酶的用量以及底物浓度等因素对PnbA酯酶不对称水解dl-薄荷醇丙酸酯的影响,具体反应条件分别为(a)0.2 mL乙醇、25 mmol/Ldl-薄荷醇丙酸酯、500 U/mL PnbA粗酶、2 mL反应体积、pH 7.0;(b)25 mmol/Ldl-薄荷醇丙酸酯、2 mL反应体积、37 ℃、pH 7.0,添加25%乙醇;(c)750 U/mL PnbA粗酶、2 mL反应体积、37 ℃、pH 7.0,添加25%乙醇;(d)50 mmol/Ldl-薄荷醇酸酯、750 U/mL PnbA粗酶、2 mL反应体积、37 ℃,添加25%乙醇。结果如图6所示。由图6可知:PnbA酯酶的最适反应温度为37 ℃,最适pH 8.0,酶用量750 U/mL,dl-薄荷醇丙酸酯浓度50 mmol/L,反应进行30 min后,产物l-薄荷醇达到23.1 mmol/L,转化率达34%,产物光学纯度e.e.p>95%。

图6 温度、酶用量、底物浓度和pH对PnbA酯酶不对称水解dl-薄荷醇丙酸酯的影响 Fig.6 Effects of temperature,pH,substrate concentration and enzyme amount on the enantioselective hydrolysis of dl-menthyl propionate catalyzed by PnbA crude enzyme
3结论
利用枯草芽胞杆菌CICC 20034中的PnbA酯酶不对称水解dl-薄荷醇丙酸酯。研究发现当不添加助溶剂乙醇时,该酯酶对dl-薄荷醇酯几乎没有立体选择性;添加25%(体积分数)的助溶剂乙醇,PnbA酯酶能高效、高立体选择性地催化dl-薄荷醇丙酸酯为l-薄荷醇,不对称水解反应E值增加近40倍(E>99.43),产物光学纯度e.e.p>95%。
本研究为酶法高效拆分有应用价值的手性醇以及有机溶剂乙醇影响酶立体选择性提供了一定的实验依据,初步探究了其二级构象变化。今后还需进一步研究乙醇对该酯酶构象的变化,结合分子模拟手段,更为深入研究其构象变化的机制。
致谢
感谢浙江大学化学工程与生物工程系吴坚平副教授和陈辉博士对本研究的帮助。
参考文献:
[1]Yu L,Xu Y,Wang X,et al.Highly enantioselective hydrolysis ofdl-menthyl acetate tol-menthol by whole-cell lipase fromBurkholderiacepaciaATCC 25416.J Mol Catal B:Enzymatic,2007,47(3/4):149-154.
[2]Zheng G,Pan J,Yu H,et al.An efficient bioprocess for enzymatic production ofl-menthol with high ratio of substrate to catalyst using whole cells of recombinantE.coli.J Biotechnol,2010,150(1):108-114.
[3]孙苗苗.用于拆分制备L-薄荷醇的脂肪酶基因克隆和表达.杭州:浙江大学,2012.
[4]Watanabe K,Ueji S.Dimethyl sulfoxide as a co-solvent dramatically enhances the enantioselectivity in lipase-catalysed resolutions of 2-phenoxypropionic acyl derivatives.J Chem Soc Perkin Transactions 1,2001(12):1386-1390.
[5]Wu J,Liu S.Influence of alcohol concentration on lipase-catalyzed enantioselective esterification of racemic naproxen in isooctane:under controlled water activity.Enzyme Microb Technol,2000,26(2/3/4):124-130.
[6]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem,1976,72:248-254.
[7]Degrassi G,Kojic M,Ljubijankic G,et al.The acetyl xylan esterase ofBacilluspumilusbelongs to a family of esterases with broad substrate specificity.Microbiology,2000,146:1585-1591.
[8]Tetsuo O,Noritada I,Tomio K,et al.Stereoselective hydrolysis ofd/l-menthyl succinate by gel-entrappedRhodotorulaminutavar.texensisdells in organic solvent.Eur J Appl Microbiol Biotechnol,1981,11∶199- 204.
[9]Murase H,Sugihara A,Muro T,et al.Purification and properties of carboxylesterase fromOchrobactrumanthropi.Agric Biol Chem,1991,55(10):2579-2584.
[10]Sandra V,Uwe T B,Ian G,et al.Enantioselective hydrolysis ofd,l-menthyl benzoate tol-(±)-menthol by recombinantCandidarugosalipase LIP1.Adv Synth Catal,2002,344:10.
[11]Chen Y,Xu J,Pan J,et al.Catalytic resolution of (R,S)-HMPC acetate by immobilized cells ofAcinetobactersp.CGMCC 0789 in a medium with organic cosolvent.J Mol Catal B:Enzymatic,2004,30(5/6):203-208.
[12]Chen W,Lou W,Wang X,et al.Asymmetric hydrolysis of styrene oxide catalyzed by Mung bean epoxide hydrolase in organic solvent/buffer biphasic system.Chin J Catal,2011,32(9):1557-1563.
[13]Wehbi H.Water-miscible organic cosolvents enhance phosphatidylinositol-specific phospholipase C phosphotransferase as well as phosphodiesterase activity.Biochim Biophys Acta(BBA):Biomembranes,2003,1613(1/2):15-27.
[14]李阳,赵怡,谢思丽,等.荧光光谱分析超氧化物歧化酶的构象变化及其功能.光谱实验室,2011,28(6):2763-2769.
(责任编辑荀志金)
