氨基化细菌纤维素载体的制备及其固定 β-半乳糖苷酶
2016-01-13程浩,陈勇,应汉杰

氨基化细菌纤维素载体的制备及其固定β-半乳糖苷酶
程浩, 陈勇, 应汉杰
(南京工业大学生物与制药工程学院, 江苏南京211800)
摘要:利用二氯亚砜和乙二胺对细菌纤维素薄膜进行氯化和氨基化制备氨基化细菌纤维素薄膜,并以该薄膜作为载体固定β-半乳糖苷酶,研究载体的结构性质和固定化酶的制备条件及相关酶学性质。通过元素分析、红外光谱和X线光电子能谱等分析方法来表征载体性质。结果显示,有大量氨基接入细菌纤维素表面。最佳的固定化酶的条件:戊二醛添加量4 g/L,固定化时间3 h,酶添加量3 mg/mL,pH7.0和交联时间90 min,此条件下,最高酶活回收率为78.4%,吸附酶量为63.1 mg/g。与游离酶相比,固定化酶的最适温度为40 ℃,比游离酶高10 ℃,最适pH提高0.5,有向碱性方向移动的趋势,重复使用7次后剩余77.8%的相对酶活力。
关键词:氨基化; 细菌纤维素; 固定化;β-半乳糖苷酶
doi:10.3969/j.issn.1672-3678.2015.06.007
收稿日期:2014-11-06
基金项目:国家杰出青年基金(21025625);国家重点基础研究发展计划(973计划)(2013CB733602);国家高技术研究发展计划(863计划)(2012AA021203);国家科技支撑计划(2012BAI44G01);国家自然科学基金面上基金(21376118);国家自然科学基金青年基金(21106070);长江学者和创新发展计划(PCSIRT);江苏省自然科学基金(SBK20150207)
作者简介:程浩(1988—),男,河南南阳人,硕士研究生,研究方向:生物化工;应汉杰(联系人),教授,E-mail:yinghanjie@njtech.edu.cn
中图分类号:Q814
文献标志码:A
文章编号:1672-3678(2015)06-0036-07
Abstract:Sulfoxide chloride and ethylenediamine were used to conduct the chlorination and amination of bacterial cellulose for the immobilization of β-galactosidase. Immobilization conditions, the enzymatic properties and microstructure of immobilized β-galactosidase were studied. Elemental analysis,infrared spectrum and X-ray photoelectron spectroscopy confirmed the presence of abundant amino groups on the surface of bacterial cellulose. Results showed that the maximum recovery of enzyme activity and the amount of immobilized β-galactosidase were 78.4% and 63.1 mg/g,respectively,under the optimal immobilization conditions: glutaraldehyde concentration 4 g/L, immobilization time 4 h and enzyme concentration 3 mg/mL,pH 7.0 and crosslinking time 90 min. Compared with the free β-galactosidase,the optimal reaction temperature was increased from 30 to 40 ℃,and the optimal pH increased by 0.5. In addition,the immobilized β-galactosidase remained 77.8% of its original activity after its 7`(th) repeated use.
Keywords:amination;bacterial cellulose;immobilization;β-galactosidase
Preparation of bacterial cellulose membrane with amino group as carrier and its immobilization of β-galactosidase
CHENG Hao,CHEN Yong,YING Hanjie
(College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
细菌纤维素(BC)和植物纤维素有相似的基本结构,都是由D-葡萄糖以β-1,4糖苷键组成的无分支结构的高分子,具有很多优良性能,其持水性、结晶度、机械性能和纯度均非常高,独特的纳米纤维网络使其有良好的生物亲和性[1-2],但其难溶解、难加工且官能团单一导致的其他功能不足等弱点,限制了其进一步应用。
笔者尝试利用BC表面含有的丰富羟基,通过化学修饰在BC薄膜表面引入氨基,以期获得性能更加优良的纤维素,为拓宽细菌纤维素的应用奠定基础。β-半乳糖苷酶能催化乳糖水解生成葡萄糖和半乳糖,主要用于生产低乳糖以解决普遍存在的乳糖不耐症问题[3-5]。
笔者用修饰后的载体用戊二醛作交联剂,采用化学交联法固定β-半乳糖苷酶以利于酶的回收利用,降低使用成本。
1材料与方法
1.1 材料、试剂与仪器
β- 半乳糖苷酶(3 015 U/g,生化试剂),诺维信(中国)生物技术有限公司;邻硝基苯-β-D-吡喃半乳糖苷(oNPG)、戊二醛(50%),国药集团化学试剂有限公司;NaOH、无水乙醇、氨水,西陇化工股份有限公司;无水Na2CO3、Na2HPO4·12H2O、NaH2PO4·2H2O、二甲基甲酰胺(DMF)、氯化亚砜、乙二胺、丙酮,上海凌峰化学试剂有限公司。所用试剂均为分析纯。
往复式水浴恒温培养振荡器,上海智城分析仪器制造有限公司;UNICO7200型可见分光光度计,尤尼柯(上海)仪器有限公司;Avatar 380型傅里叶变换红外光谱仪,美国Thermo Nicolet公司;Vario MICRO cube元素分析仪,德国Elementar公司; XPSSCALABMKH型X线光电子能谱仪(XPS),美国VG公司。
1.2 氨基化细菌纤维素的制备和表征
1.2.1细菌纤维素的培养与处理
在无菌条件下用接种环从平板中刮取一环保藏的木醋杆菌,接种于50 mL种子培养基中,在30 ℃、静置条件下培养3 d后,将上层细菌纤维素膜破碎后,按照体积分数为7% 的比例于无菌条件下将种子液接入到装液量为200 mL发酵培养基的500 mL三角瓶中。30 ℃下静置培养14 d后,收集得到凝胶片层状细菌纤维素膜。纯水浸泡2 d后再用0.1 mol/L NaOH溶液将膜片多次煮沸以除去膜片中的菌体和残留培养基,最后用纯水重复冲洗至中性。经121 ℃、15 min高压灭菌后于4 ℃保存备用。
1.2.2氨基化细菌纤维素的制备
将膜在-80 ℃预冷过夜后于-56 ℃真空环境下冷冻干燥。取小片薄膜,作为样品。将5 g冻干后的细菌纤维素薄膜在300 mL DMF中于78.9 ℃、磁力搅拌过夜后,慢速逐滴加入8 mL氯化亚砜。待氯化亚砜加完后于同样温度下继续反应4 h,得到氯化纤维素(BC-Cl)。用稀释的氨水和纯水反复冲洗氯化纤维素,再用大量纯水冲洗至中性。将过滤得到的氯化纤维素在-80 ℃下预冷,并于-56 ℃真空环境下冷冻干燥,得到氯化纤维素膜片。取1 g氯化纤维素薄片置于10 mL DMF内,于磁力搅拌下加入8 mL乙二胺,持续回流3 h。反应结束后用大量无水丙酮冲洗膜片,得到氨基化纤维素(BC-en)。室温条件下真空干燥24 h后保存备用。
1.2.3氨基化细菌纤维素的表征
1)元素分析将修饰前后的细菌纤维素薄膜研磨成粉,于120 ℃烘干过夜后,进行元素分析测定。
2)傅里叶变换红外光谱(FT-IR)分析将修饰前后的细菌纤维素膜片冻干后研成粉末,与KBr以1∶100比例混合后充分研细,用压片机压片,再放入红外光谱仪中进行测定,仪器分辨率为0.4 cm-1,扫描速度为0.2 cm-1/s,波数扫描范围400~4 000 cm-1。
3)X线光电子能谱(XPS)分析用于测定样品表面元素电子的结合能以确定元素价态。将少量的粉末样黏附在导电胶上进行测试。采集全谱时通能140,步长0.8,扫描1次;采集窄谱时通能55,步长0.5,扫描4次。
1.3 酶的固定化及固定化酶基本性能测定
1.3.1氨基化纤维素载体固定β-D-半乳糖苷酶
将一定量的氨基化纤维素置于锥形瓶中,加入pH 7.0磷酸缓冲液浸泡2 h后,抽滤得到溶胀后的氨基化纤维素。向溶胀后的氨基化纤维素加入5 mL一定浓度的β-D-半乳糖苷酶溶液(先取0.1 mL经过稀释若干倍后测定原酶溶液活力),再加入2 mL一定浓度的戊二醛溶液后室温振荡3 h,制得固定化酶。吸取上清液0.1 mL,并稀释后测定残余酶活力。用与原酶液相应pH的磷酸缓冲液重复洗涤固定化酶,测定固定化酶活力。
1.3.2酶活力的测定
1)游离β-D-半乳糖苷酶活力的测定向10 mL离心管内加入3 mL质量浓度为4 g/L用磷酸缓冲液配置的oNPG溶液,30 ℃水浴7 min后,再加入稀释的酶液1 mL,摇匀后于同样温度下水浴反应10 min,然后再加入1 mol/L的Na2CO3溶液2 mL终止反应,摇匀后测定420 nm处的A420。
酶活力定义:在测定条件下(30 ℃、pH 7.0、反应时间10 min),每分钟催化生成1 μmoloNP所需的酶量为一个酶活力单位。乳糖酶活力计算见式(1)。
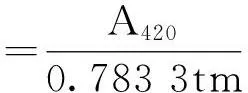
(1)
式中:A420为吸光度;0.783 3为换算系数,亦即oNP浓度为1 μmol/L时的A420值;t为反应时间,min;m为反应液中酶的质量,g。
2)固定化β-D-半乳糖苷酶活力的测定向10 mL离心管内加入3 mL质量浓度为4 g/L用磷酸缓冲液配置的oNPG溶液,30 ℃水浴7 min后,再放入大约0.01 g的氨基化纤维素薄膜固定化酶,摇匀后于同样温度下水浴反应10 min后,再加入1 mol/L的Na2CO3溶液2 mL终止反应,摇匀后测定420 nm处的A420。乳糖酶活力单位的计算同上。
2结果与讨论
2.1 氨基化细菌纤维素膜载体的表征
2.1.1元素分析结果
氨基化细菌纤维素的实际测定结果:C、H和N含量分别为41.62%、5.69%和7.12%。而以单个葡萄糖环为参与反应单元和化学修饰反应完全,则计算得到理论值为C 47.95%、H 7.84%、N 13.72%。氮元素的实测量小于完全取代值,氨基化程度大约为52%。
2.1.2FT-IR分析结果
图1为细菌纤维素及其衍生物的红外图谱。由图1可知:3 200~3 500 cm-1处为纤维素分子上—OH伸缩振动产生的宽而且强的峰;2 900 cm-1处为亚甲基、次甲基的 C—H伸缩振动吸收峰;1 640 cm-1左右处为羟基 O—H 的弯曲振动吸收峰;1 431 cm-1处为亚甲基、次甲基的 C—H弯曲振动吸收峰;1 000~1 200 cm-1处为 C—O伸缩振动吸收峰;1 114 cm-1处为 C—C骨架振动吸收峰。这些特征峰都说明实验所得细菌纤维素成分为纯纤维素。与二氯亚砜反应后的细菌纤维素膜,在709和752 cm-1处出现了C—Cl键的伸缩振动峰,且O—H的变形振动峰消失,而其他峰值基本没有变化,这说明了在纤维素C-6上的伯羟基被Cl原子所取代而发生了氯代反应。细菌纤维素的氯化产物接着氨基化之后,在 3 300 cm-1附近又出现宽的强峰,但是峰位明显向低波数移动,表明有胺基的形成[10-11]。由于纤维素及其取代产物中大量氢键的存在,此外由于氨基化产物中既有伯胺基也有仲胺基,使得高波数的振动峰较宽,不容易给出更多结构信息。

图1 细菌纤维素、氯化细菌纤维素和氨基化 细菌纤维素的红外图谱 Fig.1 Infrared spectra of the BC,BC-Cl,and BC-en
2.1.3XPS分析结果
图2为细菌纤维素氯化物的光电子能谱和数据。从图2中可知:细菌纤维素的氯化结果除了碳原子的1s轨道电子结合能在281 eV和282 eV[12]及氧原子的ls轨道电子结合能在532 eV处应该有相应的峰外,氯原子的2p轨道电子结合能在大约194 eV处有较强的峰,证明了修饰后细菌纤维素上氯原子的存在。
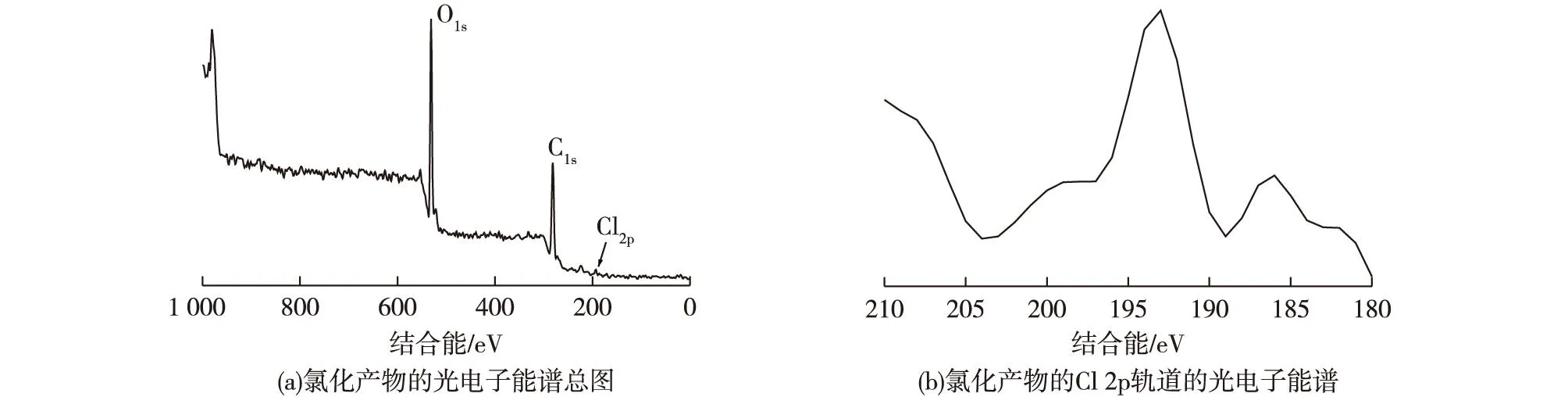
图2 细菌纤维素氯化产物的光电子能谱 Fig.2 X-ray photoelectron spectroscopy of chlorinated product of bacterial cellulose
乙二胺修饰的细菌纤维素的光电子能谱如图3所示。由图3可知:比较弱的Cl(2p)能级峰可见,在胺化修饰后的产物中仍然有少量的氯没有反应,这表明氨基化不完全。由于出现较强的N(1s)能级峰,表明大部分的氯代物都发生了氨基化反应[13],得到了预期结构的纤维素修饰产物。
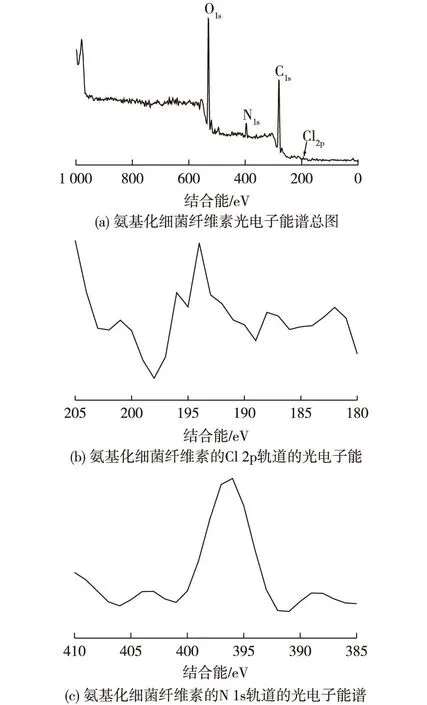
图3 氨基化细菌纤维素的光电子能谱 Fig.3 X-ray photoelectron spectroscopy of amination of bacterial cellulose
2.2 氨基化细菌纤维素载体固定 β-D-半乳糖苷酶的条件优化
2.2.1固定化时间的确定
在其他条件(酶添加量、pH、戊二醛含量和交联时间)保持一致时,0.01 g 氨基化细菌纤维素薄膜,室温振荡下分别固定 1、2、3、4、5、6和7 h 后,测定固定化酶活力回收率,考察不同固定化时间对固定化酶活力的影响,结果见图4。

图4 固定化时间对固定化酶活力和吸附酶量的影响 Fig.4 Effects of immobilization time on the activity and amount of immobilized enzyme
由图4可知:氨基化细菌纤维素固定化 3 h时,固定化酶活力回收率达到最大,为 67.8%,随固定化时间的延长,固定化酶活力呈下降趋势。主要是由于随固定化时间的延长,酶与载体共价耦联的作用位点增多,破坏了酶的高级结构,而且当载体偶联的酶量逐渐增大时,载体网络上的酶分子之间较为拥挤,在酶促反应过程中,底物不易与酶充分接触,故使固定化酶整体的活力呈现下降的趋势[14]。
2.2.2戊二醛用量的确定
在其他条件(酶添加量、pH和交联时间)保持一致时,向 0.01 g 氨基化细菌纤维素薄膜中分别加入0、2、4、6、8、10 和12 g/L(以反应总体积计)的戊二醛,室温振荡条件下,分别固定3 h后测定固定化酶活力回收率,考察不同戊二醛含量对固定化酶活力和吸附酶量的影响,结果见图5。
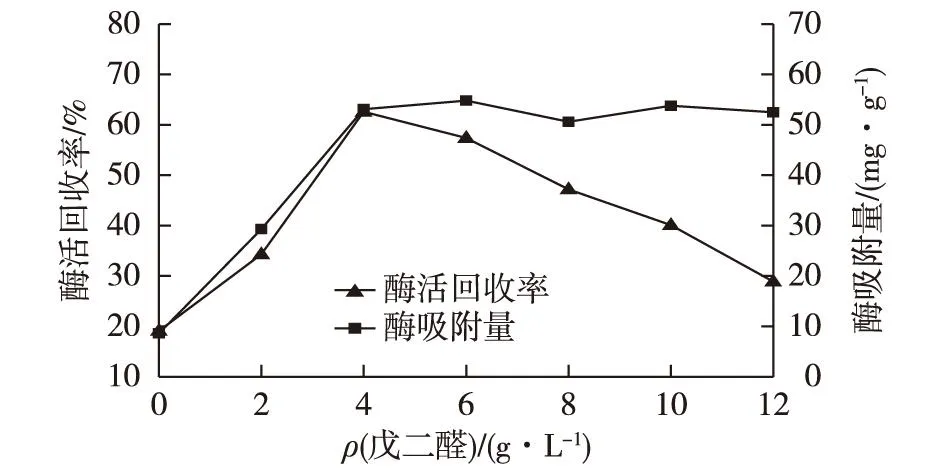
图5 戊二醛用量对固定化酶活力和吸附酶量的影响 Fig.5 Effects of glutaraldehyde concentration on the activity and amount of immobilized enzyme
由图5可以发现:固定化酶活力随戊二醛浓度增加而增大,在戊二醛质量浓度为4 g/L 时,酶活力回收率最大。低浓度的戊二醛有助于酶通过Schiff反应与载体上的氨基交联在一起,但交联又不充分;在浓度较高时,戊二醛的毒性会使半乳糖苷酶部分失活,并且戊二醛会造成空间位阻而妨碍固定化酶与底物相结合,致使固定化酶活力回收率降低。
2.2.3酶添加量的确定
保持其他条件(戊二醛4 g/L 、pH和交联时间)一致,向0.01 g氨基化细菌纤维素薄膜内加入5 mL酶液(质量浓度分别为1、2、3、4、5、6、7和8 mg/mL),室温振荡条件下固定3 h后测定固定化酶活力,考察不同浓度酶添加量对固定化酶活力的影响,结果见图6。
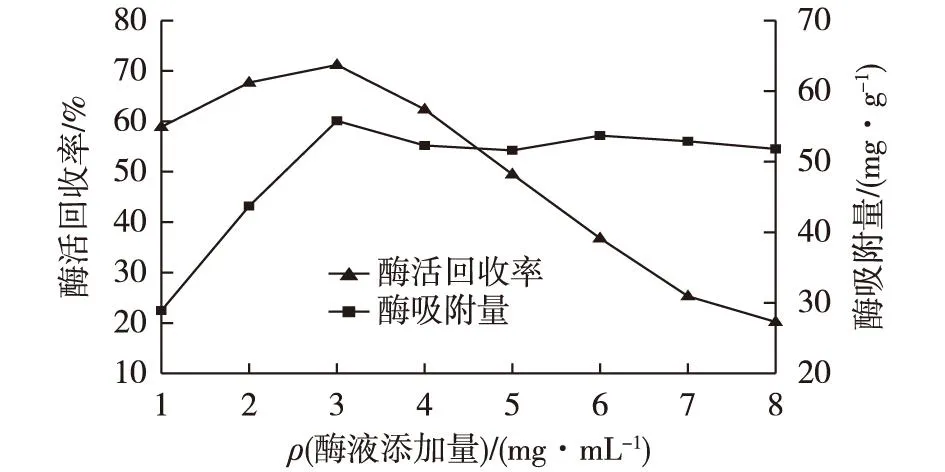
图6 酶添加量对固定化酶活力和吸附酶量的影响 Fig.6 Effects of enzyme concentration on the activity and amount of immobilized enzyme
由图6可知:当酶的浓度较低(不足)时,固定化酶活力回收率与酶浓度的增加呈正相关。酶添加量高于3 mg/mL时,固定化酶活力回收率与酶浓度的增加呈负相关。这是由于氨基化载体的活性基团有限,酶液超过一定浓度后,载体上的结合位点已被饱和,因而酶添加量增加,而酶活回收率反而下降[15]。
2.2.4pH的确定
保持其他条件一致,向0.01 g氨基化细菌纤维素薄膜内加入3 mg/mL的酶液5 mL,室温振荡下固定3 h后加入pH分别为4.0、5.0、6.0、7.0、8.0和9.0的4 g/mL戊二醛各2 mL,室温交联60 min后测定固定化酶活力和吸附酶量,结果见图7。

图7 pH对固定化酶活力和吸附酶量的影响 Fig.7 Effects of pH on the activity and amount of immobilized enzyme
由图7可以看出:环境的pH对氨基化细菌纤维素薄膜固定化β-D-半乳糖苷酶的效率有显著影响。固定化酶载量和固定化酶活力回收率随着环境pH的升高而增大; 当pH达到7.0时,氨基化细菌纤维素薄膜具有最大的酶活力回收率(75.3%)和吸附酶量(58.4 mg/g);随着pH继续增加,固定化酶活力和酶载量呈下降的趋势。引起此种现象的原因可能是在制备固定化酶的过程中,不同pH环境与酶分子直接接触,极端pH使酶分子变形的可能性大大增加。另外,戊二醛在作为交联剂的同时又是酶分子的变性剂,在一定程度上使酶分子发生构象变化而引起失活。
2.2.5交联时间的确定
保持其他条件一致,向0.01 g氨基化细菌纤维素薄膜内加入3 mg/mL的酶液5 mL,室温振荡下固定3 h后加入4 g/mL 戊二醛各2 mL,室温交联不同时间(30、60、90、120、150和180 min),测定固定化酶活力和吸附酶量,结果见图8。
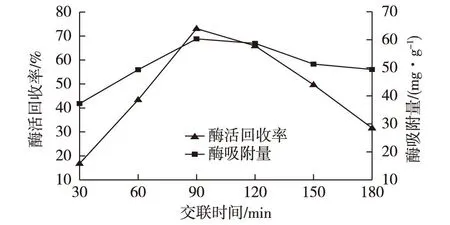
图8 交联时间对固定化酶活力和吸附酶量的影响 Fig.8 Effects of crosslinking time on the activity and amount of immobilized enzyme
由图8可知:用氨基化细菌纤维素薄膜固定β-D-半乳糖苷酶,当交联时间由30 min增加到90 min时,酶活力回收率(73.1%)和吸附酶量(60.3 mg/g)都达到最大值;其后,再延长交联时间至180 min,固定化酶活力回收率下降至31.6%,而吸附酶量也有一定幅度的下降。可能原因是,对于氨基化细菌纤维素固定酶,适当延长交联时间有助于酶分子与戊二醛充分接触从而增加吸附酶量和固定化酶活力回收率。然而,继续延长交联时间,戊二醛对酶分子的变性作用更加明显。
2.2.6最佳组合的活力回收率和吸附酶量
在以上得出的各个最优条件(即固定化时间为3 h,戊二醛质量浓度 4 g/mL,酶液用量为3 mg/mL,pH 7.0 和 交联时间为90 min)下,用氨基化细菌纤维素薄膜固定β-D-半乳糖苷酶,所得固定化酶活力回收率和吸附酶量分别为78.4% 和63.1 mg/g。韩平治等[16]用阳离子修饰的Sephadex G-100将部分纯化的赤豆β- 半乳糖苷酶通过吸附和共价交联法固定化,得到的固定化酶活力回收率为65%;潘晓亚等[17]选择明胶为载体,用戊二醛作为交联剂固定化乳糖酶,其酶活力回收率达到78.12%,可以重复回收使用。Tanriseven等[18]使用藻酸盐和明胶形成的纤维作为固定化材料,利用戊二醛作交联剂固定β-半乳糖苷酶,获得的固定化酶的相对酶活力为56%,且酶活力可以保持35 d,该固定化酶具有潜在的工业应用价值。Neri等[19]使用聚硅氧烷-聚乙烯醇磁性复合材料(mPOS-PVA)作为固定化载体,得到的固定化β-半乳糖苷酶在25 ℃下重复使用20次或在35 ℃存放24 h后只保留其50%原始酶活力,固定化效果欠佳。Toshiba等[20]利用免疫亲和性载体(免疫球蛋白G-纤维素)固定β-半乳糖苷酶时发现,固定化酶在60 ℃下保存4 h后只保留其72%的原始酶活力,重复使用10次后固定化酶活力剩余了46%。由此可以看出,用氨基化细菌纤维素固定β-半乳糖苷酶,在提高酶活力回收率上有了一定程度的提高。
2.3 固定化酶和游离酶酶学性质研究
2.3.1温度对酶促反应的影响
分别将游离酶和固定化酶置于不同温度(20、25、30、35、40、45、50、55和60 ℃)下测定酶活力,以最高酶活为100%,计算相对酶活,结果如图9所示。
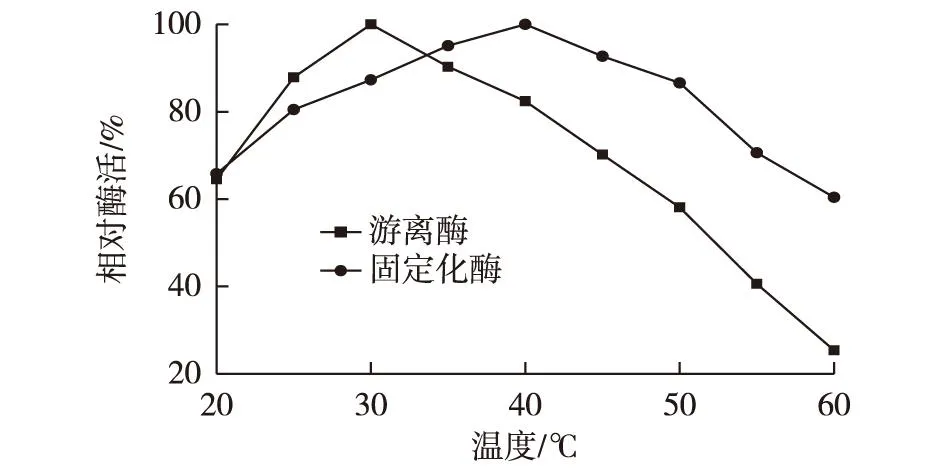
图9 反应温度对游离酶和固定化酶活力的影响 Fig.9 Effects of reaction temperature on the activity of free and immobilized enzyme
由图9可知:酶经过固定化,其最适反应温度由30 ℃提高到40 ℃左右。说明可以通过适当提高温度增大酶促反应速率以缩短反应时间。细菌纤维素膜经过溶胀能够使酶分子进入纤维束之间,这些纤维束能够有效保护酶分子免受过高温度而引起的变性失活。另外戊二醛的固定可能使酶分子的结构刚性增强,增加了其抗热性能。
2.3.2pH对酶促反应的影响
按照测定游离酶和固定化酶的方法,分别在不同pH(5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5和9.0)条件下测定游离酶和固定化酶活力,以最高酶活为100%,计算相对酶活,结果如图10所示。

图10 pH对游离酶和固定化酶活力的影响 Fig.10 Effects of pH on the activity of free and immobilized enzyme
由图10可知:游离酶的最适pH为6.5,固定化酶的最适pH为7.0,而且在偏碱性环境下固定化酶活力更高。与氨基相比,薄膜表面还有更多数量带负电的羟基,能够吸引溶液中的氢离子到周围,致使固定化酶内部微环境的 pH 比周围反应液的 pH 稍低一些,形成了适合酶催化反应的酸性环境,因此固定化半乳糖苷酶的最适反应pH向碱性方向移动。
2.3.3固定化β-半乳糖苷酶的操作稳定性
按照测定固定化酶的方法,利用同一份固定化酶进行重复批次酶促反应,结果如图11所示。由图11可以看出,在使用7次之后相对酶活力剩余为77.8%,重复使用性较好。

图11 固定化酶的重复使用性 Fig.11 Reusability evaluation of immobilized enzyme
3结论
经过DMF活化、二氯亚砜和乙二胺修饰制备出氨基化细菌纤维素薄膜,并以该薄膜为载体固定β-半乳糖苷酶,通过对固定化条件进行探讨,得到戊二醛添加量4 g/L,固定化时间3 h,酶添加量3 mg/mL,pH为7.0和交联时间为90 min时,有最高酶活力回收率(78.4%)和吸附酶量(63.1 mg/g)。该固定化酶的最适温度为40 ℃,比游离酶高10 ℃,相比游离酶,固定化情况下的最适pH提高了0.5,有向碱性方向移动的趋势,重复使用7次后还有77.8% 的相对酶活力。氨基化细菌纤维素膜可以作为固定化β-半乳糖苷酶的良好载体,但在工业应用方面有待进一步研究。
参考文献:
[1]Maneerung T,Toura S,Rujiravanit R.Impregnation of silver nanoparticles into bacterial cellulose for antimicrobial wound dressing.Carbohydr Polym,2008,72:43-51.
[2]王宗良,贾原媛,石毅.纳米细菌纤维素膜的表征与生物相容性研究.高等学校化学学报,2009,30(8):1553-1558.
[3]Jurado E,Camacho F,Luzón G,et al.Kinetic models of activity for beta-galactosidases:influence of pH,ionic concentration and temperature.Enzyme Microb Technol,2004,34(1):33-40.
[4]Toshiba H,Qayyum H.Hydrolysis of milk/whey lactose byβ-galactosidase:a comparative study of stirred batch process and packed bed reactor prepared with calcium alginate entrapped enzyme.Chem Eng Process,2008,48(1):576-580.
[5]Haider T,Husain Q.Concanavalin A layered calcium alginate-starch beads immobilizedβ-galactosidase as a therapeutic agent for lactose intolerant patients.Int J Pharm,2008,359(1/2):1-6.
[6]da Silva Filho E C,Santana S A A,Meio J C P,et al.X-ray diffraction and thermogravimetry data of cellulose,chlorodeoxycellulose and aminodeoxycellulose.J Therm Anal Calorim,2010,100(1):315-321.
[7]李海平,程涛,霍贵成.乳源糖巨肽的生物活性.中国乳品工业,2002,30(5):76-77.
[8]王凤翼.乳蛋白肽及其在食品中的应用.中国乳品工业,2002,30(5):64-65.
[9]Martin A I,Sánchez-Chaves M,Arranz F.Synthesis,characterization and controlled release behaviour of adducts from chloroacetylated cellulose andα-naphthylacetic acid.React Funct Polym,1999,39:179-187.
[10]Silvertein R M,Bassler G C,Morrel T C.Spectrometric identification of organic compounds.Chichester:Wiley,1991.
[11]Pavia D L,Basser G M,Morrill T C.Introduction to spectroscopy.2nd ed.New York:Saunders College,1996.
[12]Abdelmouleh M,Boufi S,ben Salah A,et al.Interaction of silane coupling agents with cellulose.Langmuir,2002,18(8):3203-3208.
[13]Zheng J W,Zhu Z H,Chen H F,et al.Nanopatterned assembling of colloidal gold nanoparticles on silicon.Langmuir,2000,16(10):4409-4412.
[14]任玲玲,何静,马润宇.固定化青霉素酰化酶的新载体.北京化工大学学报:自然科学版,2002,29(1):64-67.
[15]朱启忠.壳聚糖固定化半纤维素酶的研究.生物化学与生物物理进展,2000,27(3):274-276.
[16]韩平治,丁进芳,孟延发.赤豆β-半乳糖苷酶固定化及其性质研究.甘肃科学学报,2001,13(1):59-61.
[17]潘晓亚,马力,周黎黎.固定化乳糖酶的研究.中国乳品工业,2006,34(3):13-16.

[19]Neri D F M,Balcão V M,Carneiro-da-Cunha M G,et al.Immobilization ofβ-galactosidase fromKluyveromyceslactisonto a polysiloxane-polyvinyl alcohol magnetic (mPOS-PVA) composite for lactose hydrolysis.Catal Commun,2008,9(14):2334-2339.
[20]Toshiba H,Qayyum H.Immobilization ofβ-galactosidase fromAspergillusoryzaevia immunoaffinity support.Biochem Eng J,2009,43:307-314.
(责任编辑荀志金)
