进化代谢选育高浓度 耐受型产丁二酸大肠杆菌
2016-01-13管钊,吴明科,陈吴方等

管钊,吴明科,陈吴方,陈美丽,马江锋,姜岷
(南京工业大学生物与制药工程学院材料化学工程国家重点实验室,江苏南京210009)
摘要:利用大肠杆菌厌氧制备丁二酸过程中,采用氨水作为pH调节剂不仅可以中和酸性产物还可提供无机氮,被菌体利用,然而高浓度的积累会抑制菌体生长及代谢产酸的能力。为增强大肠杆菌对高浓度的耐受性,以(NH4)2HPO4为供体,通过在连续培养装置中不断提高(NH4)2HPO4浓度,以获得可耐受的产丁二酸大肠杆菌。结果表明:突变株在胁迫下,摇瓶厌氧发酵72 h,细胞干质量浓度(DCW)可达1.82 g/L,丁二酸产量为11.72 g/L,分别比出发菌株提高了1.6和4.6倍。进一步地,在5 L发酵罐上考察其利用氨水调节pH生产丁二酸的能力,厌氧发酵90 h,丁二酸质量浓度达到27.32 g/L,生产强度为0.30 g/(L·h),比出发菌株分别提高88.1%和87.5%。
关键词:进化代谢;耐铵;丁二酸;大肠杆菌
doi:10.3969/j.issn.1672-3678.2015.06.010
收稿日期:2015-03-19
基金项目:国家重点基础研究发展计划(973计划)(2013CB733901);江苏省高校优势学科建设工程
作者简介:管钊(1989—),男,江苏南通人,硕士研究生,研究方向:生物工程;姜岷(联系人),教授,E-mail:jiangmin@njtech.edu.cn
中图分类号:TQ921
文献标志码:A
文章编号:1672-3678(2015)06-0055-06
Abstract:During the process of succinic acid production by Escherichia coli,ammonia was adopted as pH regulator, not only could neutralize organic acid but also as nitrogen source for growth. would seriously inhibit the growth and metabolic capability of the strain.To improve the tolerance of E. gradually which was provided from(NH4)2HPO4. was obtained. in flask,dry cell weight of the mutant reached 1.82 g/L and succinic acid concentration reached 11.72 g/L within 72 h fermentation,which was 1.6- and 4.6-fold compared with the parent strain respectively.Furthermore,the ability of the mutant using ammonia as pH regulator for succinic acid production was investigated in a 5-L fermentor.After 90 h fermentation,concentration and productivity of succinic acid reached 27.32 g/L and 0.30 g/(L·h),which were increased by 88.1% and 87.5% compared with the parent strain.
Keywords:metabolic evolution; ammonium-tolerant; succinic acid; Escherichia coli
Isolation of ammonium-tolerant mutant of Escherichia coli for succinic acid production by metabolic evolution
GUAN Zhao,WU Mingke,CHEN Wufang,CHEN Meili,MA Jiangfeng,JIANG Min
(State Key Laboratory of Materials-Oriented Chemical Engineering,College of Biotechnology
and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 210009,China)
丁二酸(琥珀酸)作为一种重要的C4平台化合物,是制备可降解生物材料的主要原料,被广泛应用于食品、农业、医药等行业,具有广阔的市场前景。目前,丁二酸的生产方法主要有化学合成和生物合成法。与化学合成法相比,生物合成法具有对环境污染小、反应条件温和、能耗低等优点,因此受到越来越多研究人员的关注[2-3]。丁二酸生产的优良菌株主要有产琥珀酸厌氧螺菌(Anaerobiospirillumsucciniciproducens)、产琥珀酸放线杆菌(Actinobacillussuccinogenes)、产琥珀酸曼氏杆菌(Mannheimiasucciniciproducens)及大肠杆菌(Escherichiacoli),其中大肠杆菌由于其遗传背景清晰和营养成分需求简单等特点,已成为研究的热点。

进化代谢是一种适应性进化的方式[13],在驯化过程中,由于细菌具有传代速度快、数量大等优点,因此适应新环境的细菌能够获得生长优势,从而在新环境下生存,而不能适应新环境的菌体,由于生长速度慢,很快被优势菌体所淘汰[14-15]。此方法目前主要适用于下面两个方面的菌种选育,一是筛选能够抵抗某种物质或产物压力的抗逆菌株,如改善大肠杆菌在丁二酸生产中Na+的抑制[16]。二是筛选能快速利用一些廉价生物质的菌株,如改善菌株对生物质的利用效率[17]。

1材料与方法
1.1 菌株
大肠杆菌EscherichiacoliBER208,由笔者所在实验室成员自主筛选并保存,其保藏编号为CCTCC M 2012351。
1.2 培养基
种子培养基(g/L):蛋白胨10,酵母粉5,NaCl 5,卡那霉素0.03,氯霉素0.025。

发酵培养基(g/L):一水合柠檬酸3.0,Na2HPO4·7H2O 3.0,KH2PO48.0,NH4Cl 0.2,(NH4)2SO40.75,MgSO4·7H2O 1.0,CaCl2·2H2O 0.01,CoCl2·6H2O 0.001 75,ZnSO4·7H2O 0.000 5,CuCl2·2H2O 0.000 25 mg/L,Na2MoO4·2H2O 0.000 5,MnSO4·H2O 0.002 5 mg/L,H3BO30.000 12,Al2(SO4)3·7H2O 0.001 77,Fe(III)citrate 0.016 1,VB10.02,生物素0.002,卡那霉素0.03,氯霉素0.025。121 ℃高压灭菌15 min。
厌氧摇瓶发酵培养基:30 mL发酵培养基,添加 16 g/L碱式MgCO3,30 g/L葡萄糖。
1.3 培养方法
1)种子培养从保存在-80 ℃冻存管中的菌株中,按1%的接种量接入装液量为5 mL的试管中,37 ℃、200 r/min过夜培养,作为一级种子。将试管中的一级种子,以1%的接种量转接到装液量为100 mL的500 mL 三角瓶中,37 ℃、200 r/min 培养6 h,作为二级种子。
2)厌氧摇瓶发酵将二级种子按照10%的接种量接入到装有30 mL发酵培养基的血清瓶中,通入无菌CO22 min以维持厌氧环境,37 ℃、200 r/min培养72 h。
3)发酵罐培养采用发酵培养基,在5 L发酵罐中进行,装液量为2 L,接种量为10%。通入100%无菌过滤CO2进行厌氧发酵,通气量为0.1 vvm(每分钟通气量与罐体实际料液体积的比值),温度37 ℃,搅拌转速150 r/min,用50%氨水控制pH为6.6。

1.4 分析检测
1)葡萄糖的测定利用SBA240C型生物传感分析仪(山东省科学院生物研究所)测定葡萄糖。
2)菌体密度测定Spectrumlap 752S型紫外-可见分光光度计(上海棱光技术有限公司),在波长600 nm处测定吸光值。细胞干质量浓度(DCW)的计算是10 mL的发酵液,10 000 r/min离心10 min,蒸馏水洗涤菌体2次,烘干至恒质量后称质量。每个OD600相当于0.4 g/L DCW。
3)发酵液中有机酸的测定高效液相色谱法(HPLC)检测,色谱分析仪为美国Dionex Ultimate 3000系列;色谱柱为Prevail Organic Acid,流动相为25 mmol/L KH2PO4,pH 2.5,流速1.0 mL/min,紫外检测波长215 nm;进样量20 μL,控制柱温为25 ℃。
2结果与讨论
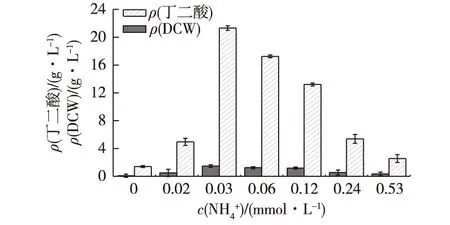
图1 NH + 4浓度对菌株BER208生长和产酸性能的影响 Fig.1 Effects of NH + 4 concentration on cell growth and succinic acid production by E.coli BER208
2.2 进化代谢选育耐铵型产丁二酸大肠杆菌突变株

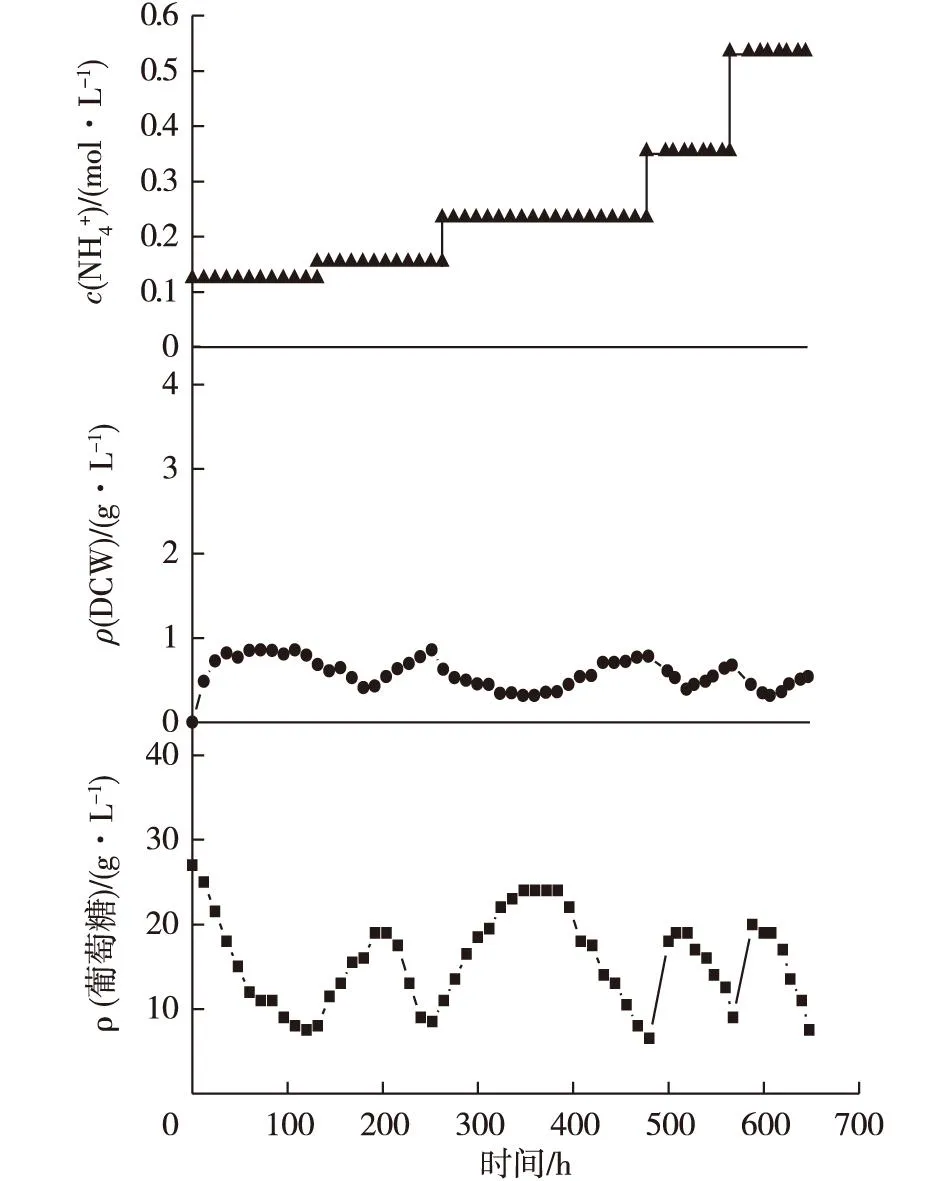
图2 进化代谢连续培养过程 Fig.2 The operational process of adaptive evolution
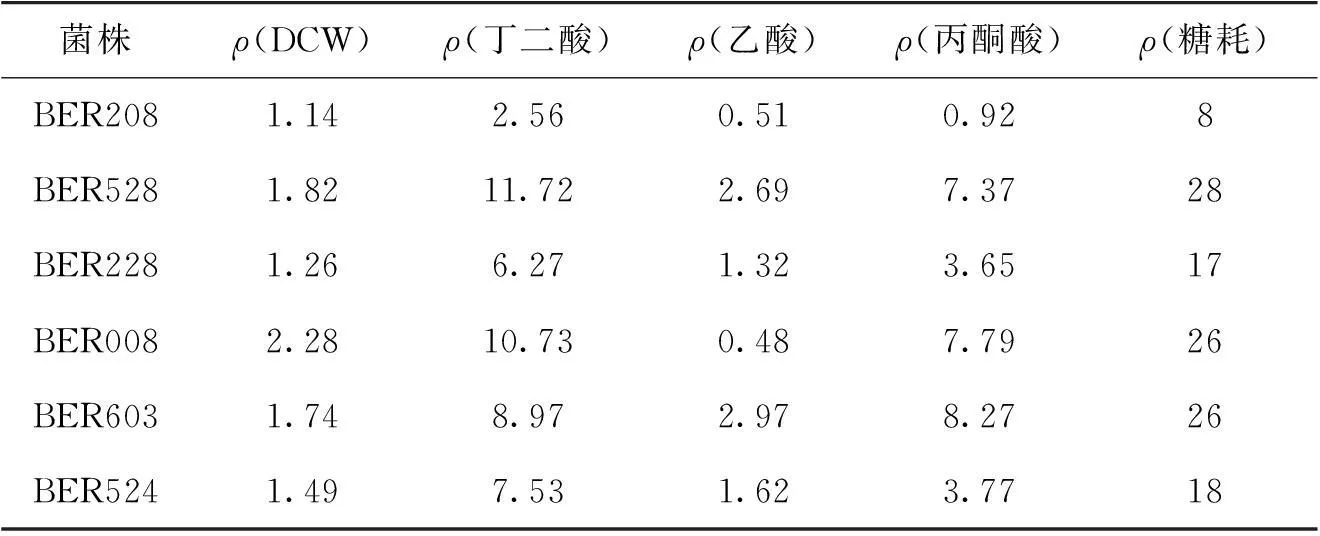
表1 突变株与出发菌株产酸效果对比
2.3 突变株BER528传代稳定性的研究
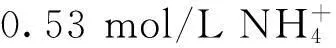

图3 突变株BER528遗传稳定性试验 Fig.3 Succinic acid-producing stability of BER528 during generation
2.4 突变株和出发菌株在不同浓度的 条件下发酵产酸效果

2.5 氨水调节对菌株生长及产酸的影响

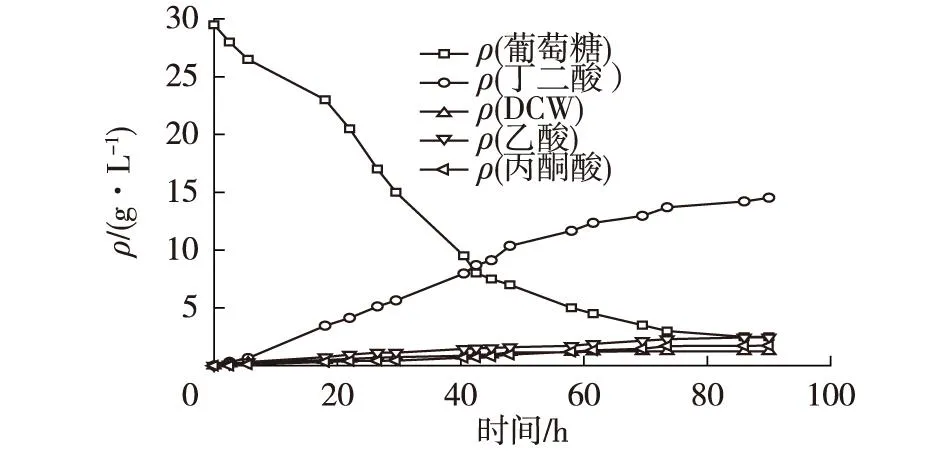
图5 出发菌株BER208生长及产酸结果 Fig.5 Time course of cell growth and production of succinic acid in the anaerobic fermentation by E.coli BER208
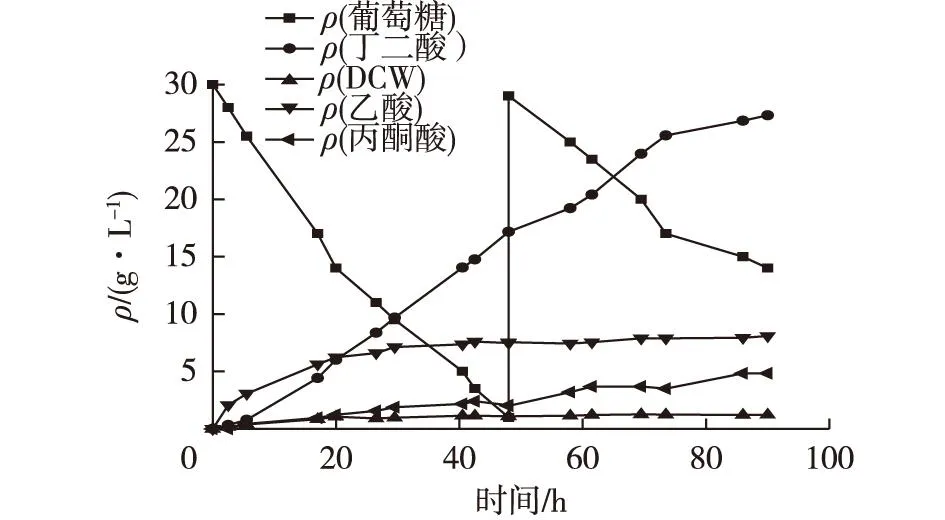
图6 突变株BER528生长及产酸结果 Fig.6 Time course of cell growth and production of succinic acid in the anaerobic fermentation by E. coli BER528
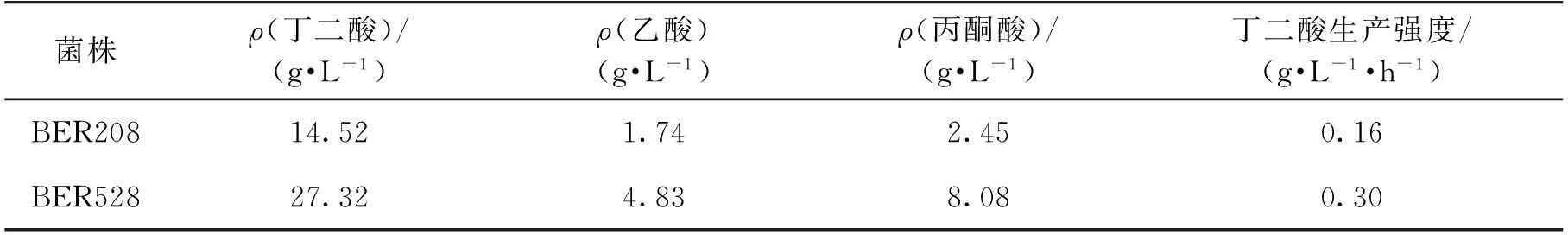
表2 出发菌株BER208与突变株BER528厌氧发酵产丁二酸结果对比
3结论
3)在5 L发酵罐中进一步地考察突变株BER528利用氨水调节pH发酵性能,厌氧发酵90 h,DCW为1.22 g/L,丁二酸产量达到27.32 g/L,丁二酸的生产速率为0.30 g/(L·h)。丁二酸产量和生产速率分别比出发菌株提高88.2%和87.5%。
参考文献:
[1]Willke T,Vorlop K D.Industrial bioconversion of renewable resources as an alternative to conventional chemistry.Appl Microbiol Biotechnol,2004,66(2):131-142.
[2]Cukalovic A,Stevens C V.Feasibility of production methods for succinic acid derivatives:a marriage of renewable resources and chemical technology.Biofuels Bioprod Biorefin Biofpr,2008,2(6):505-529.
[3]Song H,Lee S Y.Production of succinic acid by bacterial fermentation.Enzyme Microb Technol,2006,39(3):352-361.
[4]Lee P C,Lee W G,Lee S Y,et al.Effects of medium components on the growth ofAnaerobiospirillumsucciniciproducensand succinic acid production.Process Biochem,1999,35(1/2):49-55.
[5]Fang X J,Zheng X Y,Xi Y L,et al.Enhancement of succinic acid production by osmotic-tolerant mutant strain ofActinobacillussuccinogenes.World J Microbiol Biotechnol,2011,27(12):3009-3013.
[6]Kim D Y,Yim S C,Lee P C,et al.Batch and continuous fermentation of succinic acid from wood hydrolysate byMannheimiasucciniciproducensMBEL55E.Enzyme Microb Technol,2004,35(6/7):648-653.
[7]Lin H,Bennett G N,San K Y.Fed-batch culture of a metabolically engineeredEscherichiacolistrain designed for high-level succinate production and yield under aerobic conditions.Biotechnol Bioeng,2005,90(6):775-779.
[8]Glassner D A,Elankovan P,Beacom D R.Purification process for succinic acid produced by fermentation.Appl Biochem Biotechnol,1995,51-52:73-82.
[10]Kronzucker H J,Britto D T,Davenport R J,et al.Ammonium toxicity and the real cost of transport.Trends Plant Sci,2001,6(8):335-337.
[12]Lebrihi A,Lamsaif A,Lefebvre G,et al.Effect of ammonium-ions on spiramycin biosynthesis in streptomyces-ambofaciens.Appl Microbiol Biotechnol,1992,37(3):382-387.
[13]Lee J W,Kim T Y,Jang Y S,et al.Systems metabolic engineering for chemicals and materials.Trends Biotechnol,2011,29(8):370-378..
[14]Charusanti P,Fonf N L,Nagarajan H,et al.Exploiting adaptive laboratory evolution ofStreptomycesclavuligerusfor antibiotic discovery and overproduction.PloS One,2012;7(3):e33727.
[15]Unrean P,Srienc F.Metabolic networks evolve towards states of maximum entropy production.Metab Eng 2011,13(6):666-673.
[16]张常青,苟冬梅,梅家军,等.进化代谢选育高渗透压耐受型产丁二酸大肠杆菌.生物工程学报,2012(11):1337-1345.
[17]Jiang M,Wan Q,Liu R M,et al.Succinic acid production from corn stalk hydrolysate in anE.colimutant generated by atmospheric and room-temperature plasmas and metabolic evolution strategies.J Ind Microbiol Biotechnol,2014,41(1):115-123.
[18]Vemuri G N,Eiteman M A,Altman E.Effects of growth mode and pyruvate carboxylase on succinic acid production by metabolically engineered strains ofEscherichiacoli.Appl Environ Microbiol,2002,68(4):1715-1727.
(责任编辑荀志金)
