交联醇脱氢酶聚集体的制备及其在(R)- 4-氯-3-羟基丁酸乙酯合成中的应用
2016-01-13沙凤,顾金海,许琳等

交联醇脱氢酶聚集体的制备及其在(R)- 4-氯-3-羟基丁酸乙酯合成中的应用
沙凤,顾金海,许琳,严明
(南京工业大学 生物与制药工程学院,江苏 南京 211800)
摘要:基于基因组序列数据库挖掘新酶的技术,从白色念珠菌Candida albicans基因组中克隆了一条新型醇脱氢酶(CADH)基因,并在大肠杆菌Escherichia coli Rosetta(DE3)中表达。为克服游离酶稳定性差、不能重复使用的缺点,探索并优化了交联醇脱氢酶聚集体(CLEAs-CA)的制备条件。结果表明:重组CADH对底物四氯乙酰乙酸乙酯(COBE)的比活力为1.8 U/mg,产物(R)-4-氯-3-羟基丁酸乙酯((R)-CHBE)的对映体过量值大于99%。CLEAs-CA沉淀剂选择为60%饱和度的(NH4)2SO4,交联剂为10 mmol/L戊二醛。在固定化操作前,加入50 mmol/L异丙醇和0.1 mmol/L NAD`+对CADH催化活性位点、辅酶结合位点进行保护,CLEAs-CA的活力回收率提高了48.3%。将CLEAs-CA用于不对称合成(R)-CHBE,经过19次的重复使用,CLEAs-CA的活性仍保留有50%。
关键词:(R)-4-氯-3-羟基丁酸乙酯;醇脱氢酶;交联醇脱氢酶聚体;固定化
doi:10.3969/j.issn.1672-3678.2015.06.005
收稿日期:2015-04-28
基金项目:国家重点基础研究发展计划(973计划)(2011CBA00804);国家高技术研究发展计划(863计划)(2012AA022101);江苏高校优势学科建设工程
作者简介:沙凤(1991—),女,江苏靖江人,硕士研究生,研究方向:手性生物催化;严明(联系人),副教授,E-mail:yanming@njtech.edu.cn
中图分类号:TQ225.24
文献标志码:A
文章编号:1672-3678(2015)06-0024-06
Abstract:A novel alcohol dehydrogenase (CADH) from Candida albicans was discovered by genome data mining for ketoreductases. CADH was cloned and expressed in Escherichia coli Rosetta(DE3). Free enzymes usually have poor stability and are difficult to recover and reuse. To overcome such drawbacks, CADH was immobilized as cross-linked enzyme aggregates (CLEAs-CA) and the optimum conditions of the immobilization process were investigated. The recombinant product (CADH) exhibited specific activity of 1.8 U/mg toward ethyl 4-chloro-3-oxobutanoate (COBE),and the enantiomeric excess purity of (R)-CHBE was over 99%. Ammonium sulfate (60%) and 10 mmol/L glutaraldehyde were chosen as the optimum precipitant and cross-linker for the preparation of CLEAs. Moreover,addition of substrates (50 mmol/L isopropanol and 0.1 mmol/L NAD`+) in the immobilization process enhanced the activity recovery by 48.3% as compared to the CLEAs prepared without substrates. CLEAs-CA could be reused and still remained about 50% of its initial activity after 19 cycles.
Keywords:ethyl(R)-4-chloro-3-hydroxybutanoate; alcohol dehydrogenase; cross-linked enzyme aggregates (CLEAs); immobilization
Preparation of alcohol dehydrogenase cross- linked enzyme aggregates and its application to asymmetric synthesis of (R)-4- chloro-3- hydroxybutanoate
SHAFeng,GUJinhai,XULin,YANMing
(CollegeofBiotechnologyandPharmaceuticalEngineering,NanjingTechUniversity,Nanjing211800,China)
(R)-4-氯-3-羟基丁酸乙酯((R)-CHBE)是合成L-肉碱(L-carnitine)的前体物质,也是(-)-大内酰亚胺A((-)-macrolactinA)和(R)-γ-氨基-β-羟基丁酸(GABOB)等手性化合物合成的重要砌块[1-3]。与传统的化学法相比,利用氧化还原酶不对称还原前手性羰基化合物制备手性醇在催化效率、立体选择性等方面具有显著优势。目前,已有数种氧化还原酶被报道能用于不对称合成(R)-CHBE[5-11],例如来源于醛酮还原酶超家族的ARI、CmAR,来源于短链脱氢酶超家族的Gox2036,然而这些酶大都以昂贵的辅酶NADPH作为氢供体。随着公共基因序列数据库的迅速增长,笔者从基因组数据库中挖掘了1条来源于中链脱氢酶超家族、以NADH作为氢供体的醇脱氢酶(CADH)基因,随后构建了高效表达CADH的重组大肠杆菌以及建立了基于底物耦联的辅酶循环再生系统以进一步降低(R)-CHBE合成中NAD+的添加量。尽管如此,酶的稳定性和重复使用率仍是酶工业化应用中亟须解决的问题。
交联酶聚体技术(cross-linkedenzymeaggregates,CLEAs)[12]是在交联酶技术(cross-linkedenzymes,CLEs)[13]和交联酶晶体技术(cross-linkedenzymecrystals,CLECs)[14]的基础上提出的一种新型无载体固定化酶技术,它仅由沉淀和交联两步骤组成,不需要繁琐复杂的酶纯化结晶过程,操作简单、成本低廉、单位体积活性大。这项技术已经成功应用于青霉素酰化酶、醇腈酶、脂肪酶、胰蛋白酶和醇脱氢酶[15-16]的固定化。Schoevaart等[17]曾选择13种酶为研究对象,考察了不同蛋白沉淀条件及交联条件对CLEAs酶活回收率的影响。研究发现,CLEAs的制备条件并不具有普适性,因酶来源的不同呈现较大差异。
为进一步奠定醇脱氢酶(CADH)在工业中应用的基础,本研究中,笔者通过单因素实验法,研究沉淀剂种类和浓度、交联剂浓度和交联时间、NAD+及异丙醇的浓度等因子对交联醇脱氢酶聚集体(CLEAs-CA)酶活力回收率的影响,以确定CLEAs-CA制备的最适条件。此外,笔者也进一步考察CLEAs-CA在不对称合成(R)-CHBE过程中的稳定性。
1材料和方法
1.1 菌株与质粒
菌株C.albicansSC5314、E.coliDH5α以及E.coliRosetta保藏于笔者所在实验室,质粒pET-22b(+)购自Novagen公司。
1.2 主要试剂及仪器
各种限制性内切酶、PrimeSTARHSDNA聚合酶和T4DNA连接酶,宝生物工程(大连)有限公司;细菌基因组试剂盒、质粒小提试剂盒、胶回收试剂盒,天根生化科技(北京)有限公司;PCR引物合成,南京金斯瑞生物科技有限公司。4-氯乙酰乙酸乙酯,Fluka公司;(R)/(S)-4-氯-3羟基丁酸乙酯,Sigma-Aldrich公司;抗生素及其余试剂,生工生物工程(上海)股份有限公司。
PowerWaveXS酶标仪,BIO-TEK公司;Centrifuge5804R型高速冷冻离心机,Eppendorf公司。
1.3 醇脱氢酶 CADH基因在大肠杆菌的克隆和表达
根据C. albicansSC5314醇脱氢酶的基因序列(GenBank:KC236900)设计引物。上游引物:5′-G ̄G ̄A ̄A ̄T ̄T ̄C ̄C ̄ A ̄ T ̄ A ̄ T ̄ G ̄T ̄C ̄A ̄A ̄T ̄T ̄C ̄C ̄A ̄T ̄C ̄T ̄A ̄C ̄T ̄C ̄A ̄G ̄T ̄A ̄C ̄G-3′,下游引物:5′-C ̄G ̄C ̄G ̄ G ̄ A ̄ T ̄ C ̄ C ̄T ̄T ̄A ̄T ̄G ̄G ̄A ̄T ̄T ̄A ̄A ̄A ̄C ̄A ̄C ̄G ̄A ̄C ̄T ̄C ̄T ̄T ̄C ̄C ̄T-3′ (上游、下游引物分别引入NdeⅠ及BamHⅠ酶切位点,划线处为酶切位点)。扩增的DNA片段与pET-22b(+)载体进行相同限制性内切酶酶切,纯化后经T4DNA连接酶连接并转化至E. coliDH5α,酶切验证后的阳性克隆送南京金斯瑞生物科技有限公司测序。将所构建的重组质粒pET-22b-adh转化至E. coliRosetta(DE3)中表达。诱导条件如下:以1%(体积分数)的接种量转接到含75μg/mL氨苄青霉素和34μg/mL氯霉素的自诱导培养基中,取重组菌和对照菌所处理的粗酶液进行SDS-PAGE电泳分析。
1.4 交联醇脱氢酶聚集体( CLEAS- CA)的制备
1.4.1CADH粗酶液的获取
E. coliRosetta(pET-22b-adh)在自诱导培养基中诱导培养15h,菌液经4 ℃、8 000r/min离心15min后,弃上清,收集的菌体用磷酸钠缓冲液(pH7.0)清洗2次后悬浮在同样的缓冲中,使用高压均质机(-20 ℃、8.0×107Pa)对细胞进行破碎。细胞破碎液经4 ℃、10 000r/min离心30min后,弃沉淀,上清即为醇脱氢酶CADH的粗酶液。
1.4.2CLEAs-CA制备条件的优化
100μL的粗酶液中加入900μL的沉淀剂(根据沉淀剂的终浓度对沉淀剂和磷酸钠缓冲比例进行调整),混匀,冰上放置30min,加入9mL磷酸钠缓冲复溶聚集体,测定CADH的保留酶活,研究不同种类沉淀剂和浓度对CADH的影响。
1mL的粗酶液中加入9mL的沉淀剂(沉淀剂的种类和终浓度的选择依据上述实验结果),混匀,冰上放置30min,加入不同浓度的戊二醛(5、10、15、20和25mmol/L)混匀,每隔一段时间(0.5、1、2和3h)取200μL悬浊液检测醇脱氢酶交联过程中的保留酶活,研究不同浓度的交联剂和交联时间对CLEAs-CA酶活回收率的影响。
1.5 测定方法
1.5.1酶活性测定
蛋白定量采用Bradford法[18]。游离酶及CLEAs-CA的酶活力在100mmol/L、pH7.0磷酸钠缓冲液中测定,反应体系包括:1mmol/LNADH、10mmol/LCOBE、适量的酶。在30 ℃下检测波长340nm处吸光值变化。一个酶活力单位(U)定义为每分钟消耗1μmolNADH所需要的酶量。CLEAs的酶活回收率由(1)式计算。

(1)
1.5.2COBE及CHBE检测方法
分析COBE与CHBE浓度采用气相色谱法(Agilent7820A)测定。分析条件:PEG20M毛细管柱(20m×0.32mm×0.25μm);载气为N2,分流比1∶20;气化和检测室的温度220 ℃,梯度升温(初始温度130 ℃,保持3min;以20 ℃/min程序升温至135 ℃,保持7min;再以40 ℃/min程序升温至150 ℃,保持3min;再以20 ℃/min程序升温至160 ℃,保持1min);检测器为FID。
产物对映体过量值(e.e.值)的测定也同样使用气相色谱仪,分析条件:色谱柱CP-ChirasilDexCB(25m×0.25mm×0.25μm);载气为高纯N2,分流比1∶50;进样室和检测室温度250 ℃。产物CHBE的对映体过量值(e.e.值)由式(2)计算:

(2)
式中:cS为(S)-CHBE的浓度,cR为(R)-CHBE的浓度。
2结果与讨论
2.1 CADH基因的克隆表达
根据CADH的基因序列设计引物,将PCR产物经0.8%的琼脂糖凝胶电泳鉴定,电泳结果见图1。由图1可知:在近1 000bp处有特异性扩增条带,其大小与预期符合(目的产物约为1 011bp)。酶切鉴定后的阳性克隆送南京金斯瑞生物科技有限公司测序,测序结果与GenBank中目的序列完全一致。重组大肠杆菌细胞蛋白的SDS-PAGE电泳见图2。由图2可知,表达的重组蛋白大约为3.67×104,与预测的酶蛋白相对分子质量大小一致。酶活测定结果:CADH对底物COBE的比活力为1.8U/mg蛋白,对异丙醇的比活力为1.9U/mg蛋白。采用气相色谱对产物的手性进行表征,(R)-CHBE的对映体过量值大于99%。与现已发现的几个能够催化合成(R)-CHBE的酶进行氨基酸序列比较发现,CADH与来源于Sporobolomyces salmonicolor 的ARI氨基酸序列相似性最高为86%,与来源于Candida magnoliae 的CR氨基酸序列相似性为54%,与来源于Bacillus sp.ECU0013的BYueD氨基酸序列相似性仅为39%。

1,5—DL2000 marker;2—CADH gene (1 011 bp); 3—pET-22b-adh;4—pET-22b;6—NdeⅠ与 BamHⅠ双酶切质粒pET-22b; 7—NdeⅠ与 BamHⅠ双酶切重组质粒pET-22b-adh 图1 来源于C. albicans的CADH基因的克隆 Fig.1 Cloning of the CADH gene from C. albicans by PCR
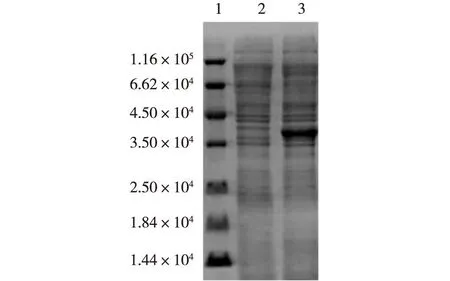
1—标准蛋白; 2—带有pET-22b质粒的 E. coli Rosetta(DE3)超声得到的可溶性蛋白; 3—带有pET-22b-adh质粒的 E. coli Rosetta(DE3)超声得到的可溶性蛋白 图2 重组大肠杆菌细胞蛋白的SDS-PAGE电泳 Fig.2 SDS-PAGE analysis of recombinant protein
2.2 沉淀剂的种类和浓度对CADH酶活力的影响
在制备CLAEs-CA的过程中,沉淀步骤是利用蛋白沉淀剂(如中性盐、水溶性有机溶剂、非离子型高聚物等)将游离酶进行物理沉淀获得酶的聚集体,该操作对不同酶种的影响有较大差异[17]。因此,考察不同饱和度的(NH4)2SO4、丙酮、乙醇及异丙醇作为沉淀剂,沉淀30 min后加入缓冲复溶聚集体,测定其酶活力,结果见图3。由图3可知:异丙醇作为沉淀剂时,CADH酶活力损失很大,最高酶活力回收率仅为7%;60%饱和度的丙酮以及30%饱和度的乙醇达到的最高回收率分别是82%和90%;当(NH4)2SO4在40%~70%饱和度范围内时((NH4)2SO4的饱和质量浓度为767 g/L),CADH的酶活力回收率甚至超过了100%,该现象在其他的酶的沉淀过程也曾出现,但其机制尚未分析清楚[17]。60%饱和度的(NH4)2SO4选用为CLAEs-CA制备过程的最优沉淀剂。
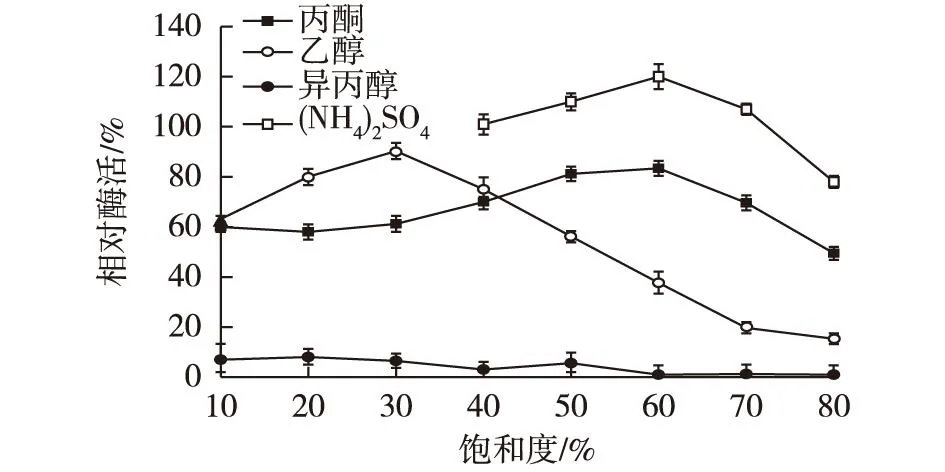
图3 沉淀剂种类和饱和度对醇脱氢酶 CADH活性的影响 Fig.3 Effects of different types and saturation of precipitant on the activity of CADH
2.3 交联剂浓度及交联时间对CLAEs-CA酶活力的影响
交联步骤是通过酶聚体分子表面的活性氨基与交联剂(一般为戊二醛)的醛基发生Schiff 碱反应,制得颗粒大小为 1~100 μm 的水不溶性 CLEAs。与沉淀步骤相比,交联过程对酶活力的回收率影响更为显著。分别选取不同浓度的戊二醛制备 CLEAs-CA,并每隔一定时间测定其保留活性,结果见图4。由图4可知:当戊二醛(GA)浓度为5 mmol/L时,交联速度缓慢,3 h时交联反应仍在继续,酶活回收率为15.8%。当戊二醛浓度大于15 mmol/L,交联速度很快,但相对的,溶液中过量的戊二醛导致交联酶快速失去活性。戊二醛浓度为10 mmol/L对CADH的活性影响相对较小,交联2 h时,CLEAs-CA的酶活回收率也仅为20.1%。这可能是因为戊二醛与酶活性中心、辅酶结合位点暴露的关键氨基酸残基反应致使酶活性的急剧下降[19]。已报道的一种解决方法是在游离酶中加入底物分子,一方面底物结合在酶的活性中心,诱导酶的构象趋向更为活跃的状态,并推测这样的状能在随后的交联过程被固定。另一方面, 酶-底物的复合物能保护酶活性中心与辅酶结合位点,阻止戊二醛与关键氨基酸反应,提高活性回收率[20]。
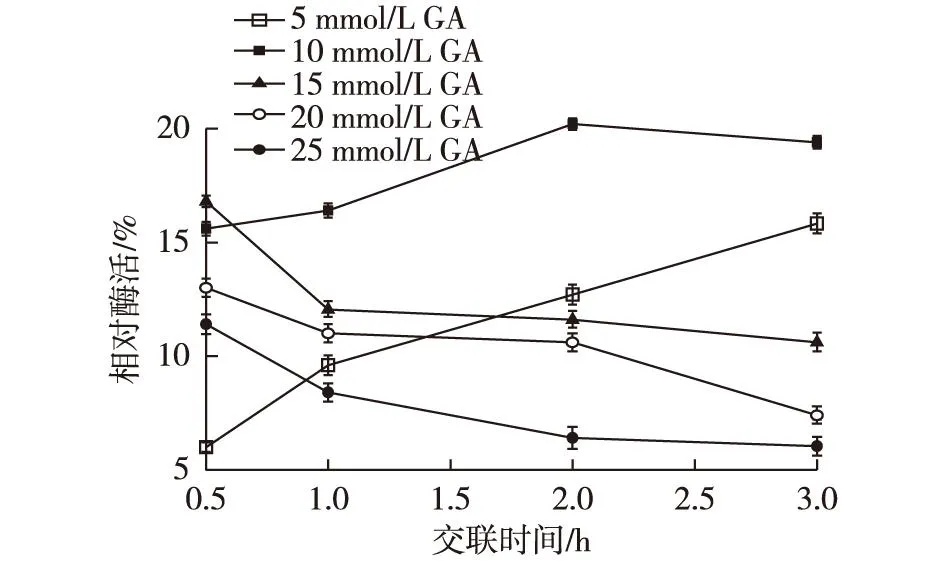
图4 交联剂浓度和时间对CLEAs-CA 酶活 回收率的影响 Fig.4 Effects of cross-linker concentration and reaction time on the activity recovery of CLEAs-CA
2.4 NAD +和异丙醇浓度对CLEAs制备的影响
CADH是NAD+依赖的氧化还原酶,对异丙醇的耐受性优于COBE,并且异丙醇与水互溶。因此,笔者考察异丙醇和NAD+对CLEAs-CA制备的影响,将异丙醇和NAD+分别加入游离酶中以形成异丙醇-酶复合物或者NAD+-酶复合物,经60%饱和度的(NH4)2SO4沉淀以及10 mmol/L戊二醛交联2 h后,测定CLEAs-CA酶活回收率,结果见图5和图6。由图5和图6可知:底物的添加有助于提高固定化酶的回收率,与50 mmol/L异丙醇相比,0.1 mmol/L NAD+提高活力回收更为明显,说明辅酶结合位点更易受戊二醛影响。另外,同时添加50 mmol/L异丙醇和0.1 mmol/L NAD+形成三元复合物,CLEAs-CA酶活回收率最终达到29.8%(表1),与不添加底物保护的固定化过程相比,固定化酶的酶活回收率提高了48.3%。
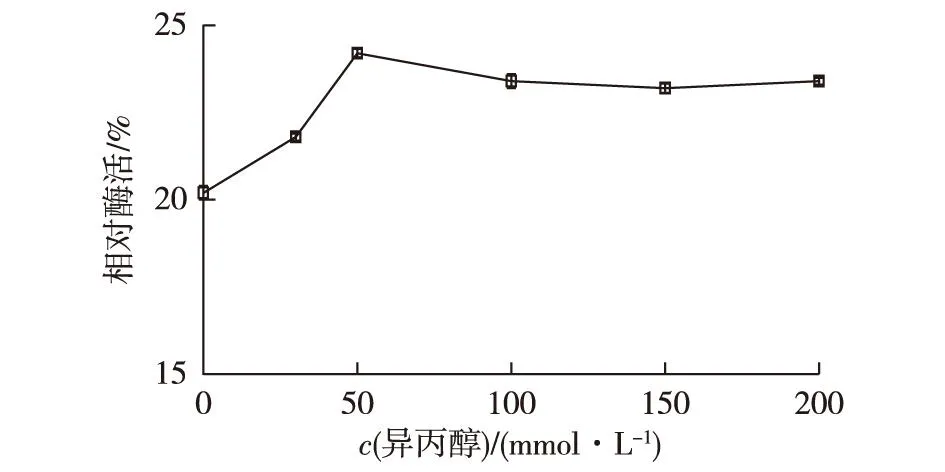
图5 异丙醇浓度对CLEAs-CA酶活回收率的影响 Fig.5 Effect of isopropanol concentration on the activity recovery of CLEAs-CA

图6 NAD +浓度对CLEAs-CA酶活回收率的影响 Fig.6 Effect of NAD + concentration on the activity recovery of CLEAs-CA

实验c(NAD+)/(mmol·L-1)c(异丙醇)/(mmol·L-1)相对酶活/%10.15029.8±0.220.1—26.8±0.23—5024.2±0.14——20.1±0.3
2.5 CLEAs-CA不对称合成( R)-CHBE
固定化酶的活性回收率、稳定性是衡量固定化技术2个重要指标,因此,催化反应在100 mmol/L、pH7.0的磷酸钠缓冲中进行,体系由180 mmol/L COBE、270 mmol/L异丙醇、0.1 mmol/L NAD+以及4 U/mL 的CLEAs-CA组成,在此条件下,进一步考察CLEAs-CA不对称合成(R)-CHBE的稳定性的影响,结果见图7。由图7可知:首批次反应1 h后,底物耗尽转化率达到99%,气相检测结果表明固定化酶的立体选择性未发生改变。批次反应结束,离心回收固定化酶,缓冲洗涤2次,用于下批次反应,并测定1 h (R)-CHBE的生成速率,用于衡量CLEAs-CA的稳定性。由图7还可知,CLEAs-CA重复使用6次后并没有明显的活力降低,在重复使用19次后,CLEAs仍保留50%的催化活性。

图7 CLEAs催化COBE合成(R)-CHBE Fig.7 Biosynthesis of (R)-CHBE in the repeated batch biotransformation
3结论
1)基于基因组序列数据库挖掘新酶的技术,从C.albicans中获得了1条拥有自主知识产权NAD+依赖的醇脱氢酶基因,并在E.coliRosetta中成功进行表达。CADH对底物COBE的比活力为1.8 U/mg 蛋白,对产物(R)-CHBE的对映体过量值大于99%。
2)确定了CLEAs-CA制备的最适条件:在固定化操作前,游离酶体系中添加50 mmol/L异丙醇和0.1 mmol/L NAD+,经60%饱和度的(NH4)2SO4沉淀以及10 mmol/L戊二醛交联2 h,CLEAs-CA酶活回收率为29.8%。将CLEAs-CA应用于不对称合成 (R)-CHBE,固定化酶重复使用19次后仍能保留50%的催化活性。
参考文献:
[1] Hikichi S,Hareau G P J,Sato F.Efficient and practical synthesis of optically active 5-t-butyldimethylsiloxy-2-cyclohexenone as a convenient chiral 2,5-cyclohexadienone synthon.Tetrahedron Lett,1997,38(48):8299-8302.
[2]Matsuda T,Yamanaka R,Nakamura K.Recent progress in biocatalysis for asymmetric oxidation and reduction.Tetrahedron:Asymmetry,2009,20(5):513-557.
[3]Bradshaw C W,Fu H,Shen G J,et al.APseudomonassp. alcohol dehydrogenase with broad substrate specificity and unusual stereospecificity for organic synthesis.J Org Chem,1992,57(5):1526-1532.
[4]Ye Q,Ouyang P,Ying H.A review-biosynthesis of optically pure ethyl (S)-4-chloro-3-hydroxybutanoate ester:recent advances and future perspectives.Appl Microbiol Biotechnol,2011,89(3):513-522.
[5]Kataoka M,Sakai H,Morikawa T,et al.Characterization of aldehyde reductase ofSporobolomycessalmonicolor.Biochim Biophys Acta,1992,1122(1):57-62.
[6]Kita K,Matsuzaki K,Hashimoto T,et al.Cloning of the aldehyde reductase gene from a red yeast,Sporobolomycessalmonicolor,and characterization of the gene and its product.Appl Environ Microbiol,1996,62(7):2303-2310.
[7]Wada M,Kawabata H,Kataoka M,et al.Purification and characterization of an aldehyde reductase fromCandidamagnoliae.J Mol Catal B:Enzymatic,1999,6(3):333-339.
[8]Jing K,Xu Z,Liu Y,et al.Efficient production of recombinant aldehyde reductase and its application for asymmetric reduction of ethyl 4-chloro-3-oxobutanoate to ethyl (R)-4-chloro-3-hydroxybutanoate.Prep Biochem Biotechnol,2005,35(3):203-215.
[9]Ni Y,Li C X,Wang L J,et al.Highly stereoselective reduction of prochiral ketones by a bacterial reductase coupled with cofactor regeneration.Org Biomol Chem,2011,9(15):5463-5468.
[10]Liu X,Chen R,Yang Z,et al.Characterization of a putative stereoselective oxidoreductase fromGluconobacteroxydansand its application in producing ethyl (R)-4-chloro-3-hydroxybutanoate ester.Mol Biotechnol,2014,56(4):285-295.
[11]He Y C,Zhang D P,Tao Z C,et al.Discovery of a reductase-producing strain recombinantE.coliCCZU-A13 using colorimetric screening and its whole cell-catalyzed biosynthesis of ethyl (R)-4-chloro-3-hydroxybutanoate.Bioresour Technol,2014,172:342-348.
[12]Cao L,van Langen L,Sheldon R A.Immobilised enzymes:carrier-bound or carrier-free?.Curr Opin Biotechnol,2003,14(4):387-394.
[13]Jansen E F,Olson A C.Properties and enzymatic activities of papain insolubilized with glutaraldehyde.Arch Biochem Biophys,1969,129(1):221-227.
[14]Häring D,Schreier P.Cross-linked enzyme crystals.Curr Opin Chem Biol,1999,3(1):35-38.
[15]Cao L,van Rantwijk F,Sheldon R A.Cross-linked enzyme aggregates:a simple and effective method for the immobilization of penicillin acylase.Org Lett,2000,2(10):1361-1364.
[16]Sheldon R A.Characteristic features and biotechnological applications of cross-linked enzyme aggregates (CLEAs).Appl Microbiol Biotechnol,2011,92(3):467-477.
[17]Schoevaart R,Wolbers M W,Golubovic M,et al.Preparation,optimization,and structures of cross-linked enzyme aggregates (CLEAs).Biotechnol Bioeng,2004,87(6):754-762.
[18]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem,1976,72(1):248-254.
[19]Mateo C,Palomo J M,van Langen L M,et al.A new,mild cross-linking methodology to prepare cross-linked enzyme aggregates.Biotechnol Bioeng,2004,86(3):273-276.
[20]Cabirol F L,Tan P L,Tay B,et al.Linumusitatissimumhydroxynitrile lyase cross-Linked enzyme aggregates:a recyclable enantioselective catalyst.Adv Synth Catal,2008,350(14/15):2329-2338.
(责任编辑荀志金)
