吸入氢气对失血性休克大鼠肺组织水通道蛋白表达的影响
2016-01-12卜庆丽,闫战秋,李会等
吸入氢气对失血性休克大鼠肺组织水通道蛋白表达的影响
卜庆丽1,闫战秋2,李会1,李恩琪2,帅训军1,姜敏1,艾登斌1
(1青岛市市立医院,山东青岛266011;2潍坊医学院)
摘要:目的探讨吸入氢气对失血性休克大鼠肺组织水通道蛋白(AQP)表达的影响。方法选择成年雄性SD大鼠40只,随机分为假手术对照组(CON组)、失血性休克组(SH组)、1%氢气组(1%H2组)及2%氢气组(2%H2组),每组各10只。SH组、1%H2组及2%H2组制备大鼠失血性休克模型,1%H2组和2%H2组分别在模型制作过程中吸入1%、2%的氢气,其他组操作中不吸入氢气。复苏2 h时,采集各组大鼠动脉血,行血气分析,测算氧合指数(PaO2/FiO2)。处死大鼠取肺组织,测定肺组织肺湿干重比(W/D)。光镜下观察肺组织,进行病理评分。取左肺组织,制成10%组织匀浆,离心后取上清液,采用酶联免疫吸附法测定肺组织AQP-1、AQP-5蛋白。结果SH组、1%H2组、2%H2组W/D、肺组织病理评分均高于CON组,PaO2/FiO2、AQP-1及AQP-5蛋白表达均低于CON组(P均<0.05)。1%H2组及2%H2组W/D、肺组织病理评分均低于SH组,PaO2/FiO2、AQP-1及AQP-5蛋白表达均高于SH组(P均<0.05)。结论 吸入氢气可能通过增加肺组织中AQP-1、AQP-5蛋白的表达,从而减轻失血性休克大鼠肺损伤的程度。
关键词:氢气;失血性休克;急性肺损伤;水通道蛋白
doi:10.3969/j.issn.1002-266X.2015.42.009
中图分类号:R605.971 文献标志码:A
收稿日期:(2015-07-10)
通信作者:艾登斌
失血性休克是临床常见的危重症,其中肺是最常受累的器官。肺损伤是导致休克后全身炎症反应的重要病理过程。因此,如何防治失血性休克后的急性肺损伤具有重要的临床意义[1,2]。研究表明,休克后肺损伤与肺内水分子的渗出及清除平衡失调有关。水通道蛋白(AQP)是一种对水分子有通透性的膜蛋白分子,与急性肺损伤、肺水肿密切相关[3]。AQP-1和AQP-5在肺脏组织中高度表达,对维持肺内水平衡起着重要作用[4]。氢气是一种生理惰性气体,可通过抗炎、抗氧化、抗凋亡等作用治疗急性肺损伤[5]。但氢气对肺组织AQP的作用尚不明确。2015年1~6月,我们采用吸入氢气处理失血性休克大鼠,观察其肺组织AQP-1、AQP-5的表达变化,探讨吸入氢气治疗失血性休克急性肺损伤的机制。
1材料与方法
1.1动物与分组成年雄性SD大鼠40只,体质量230~280 g。通过随机数字法分为假手术对照组(CON组)、失血性休克组(SH组)、1%氢气组(1%H2组)及2%氢气组(2%H2组),每组各10只。
参考文献1.2失血性休克模型制备SH组、1%H2组及2%H2组[6]制备大鼠失血性休克模型。大鼠称重后,腹腔注射20%乌拉坦(0.5 mL/100 g)进行麻醉,右侧腹股沟区备皮后分离股动脉、股静脉,分别置入套管。除CON组外,其他各组经股动脉套管放血制备失血性休克模型。连接MP150多导生理信号记录仪监测平均动脉压(MAP),放出的血液加入肝素储存于容器中备用,股静脉用于回输血液和复苏液体。置管成功后,经股动脉导管10 min内放血,维持MAP于40 mmHg,维持休克状态1 h。维持休克状态时,如血压高于45 mmHg则放部分血液,血压低于35 mmHg则回输少量血液。1 h后回输全部放出的血液并补等容量的乳酸林格氏液进行复苏,以维持MAP>80 mmHg为复苏成功的标志。CON组只进行置管不进行放血,其他操作与SH组相同。
1.3氢气干预方法参照文献[7]使用M177021氢气发生器电解水产生氢气,纯度约为99.999%。实验开始时将大鼠放入具有入气口和出气口的密闭箱子,将氢气与氧气混合气体经入气口输入箱子里,在出气口收集残气。使用JSA8-H2氢气检测仪检测出气口处氢气的浓度,调节到相应的氢气浓度。1%H2组和2%H2组分别在模型制作过程中吸入1%、2%的氢气,其他组操作中不吸入氢气。
1.4氧合指数(PaO2/FiO2)测算复苏2 h时,采集各组动脉血,使用i-STAT300型血气分析仪行血气分析,测算PaO2/FiO2。
1.5肺组织肺湿干重比(W/D)测算采集动脉血后立刻处死各组大鼠,取肺组织,剪下右肺下叶组织,用滤纸吸干表面水分后称湿重,然后放入80 ℃烤箱烤24 h至恒重后称干重,计算W/D。
1.6肺组织病理评分取右肺中叶,用预冷的生理盐水将肺组织冲洗干净,用4%甲醛溶液固定后进行HE染色。参照文献[8]光镜下观察肺组织,观察中性粒细胞浸润、肺泡内充血、肺间质水肿和肺泡水肿情况,分别对各项病理改变进行病理评分:无改变或改变非常轻微计0分;轻度改变计1分;中度改变计2分;重度改变计3分;极重度改变计4分。计算4项病理改变指标的总分,每张切片随机选择10个视野,取总分平均值。
1.7肺组织AQP-1、AQP-5蛋白表达检测取左肺组织,称重后加入9倍预冷的生理盐水,制成10%组织匀浆,离心后取上清液。采用酶联免疫吸附法(ELISA)测定肺组织AQP-1、AQP-5蛋白的表达。

2结果
SH组、1%H2组、2%H2组W/D、肺组织病理评分均高于CON组,PaO2/FiO2、AQP-1蛋白、AQP-5蛋白均低于CON组(P均<0.05)。1%H2组及2%H2组W/D、肺组织病理评分均低于SH组,PaO2/FiO2、AQP-1蛋白、AQP-5蛋白均高于SH组(P均<0.05)。见表1。
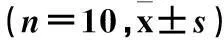
表1 各组肺组织W/D、PaO 2/FiO 2、病理评分、AQP-1蛋白、AQP-5蛋白比较
注:与CON组比较,*P<0.05;与SH组比较,#P<0.05。
3讨论
失血性休克及复苏过程中极易诱发急性肺损伤,其机制众多。既往研究发现,即使在失血性休克后无感染发生,急性肺损伤的发生率仍较高(约40%),肺内水的渗出与吸收失衡是急性肺损伤发生的重要原因[9]。
氢气是一种电中性小分子物质,具有较好的细胞膜通透性,能自由进入细胞内发挥一定的生理作用。研究证明,氢气具有抗氧化、抗凋亡和抗炎等多种作用,在各种器官保护中发挥重要作用[10]。最近有研究表明,氢气能减轻各种肺损伤[11,12]。本研究发现,SH组W/D、肺组织病理评分高于CON组,PaO2/FiO2低于CON组,提示失血性休克后可以导致肺组织损伤;1%H2组及2%H2组W/D、肺组织病理评分低于SH组,PaO2/FiO2高于SH组,提示吸入氢气后能减轻肺组织的水肿程度、减轻肺损伤,并能改善肺功能,说明吸入氢气可以改善失血性休克大鼠肺损伤的程度。
AQP是一种存在于细胞膜上对水具有特异通透性的膜蛋白,对肺内水平衡调节具有重要作用[13,14]。其中AQP-1和AQP-5为专一水通道蛋白,仅能转运水蛋白,广泛存在于各系统中。AQP-1主要存在于肺泡毛细血管内皮细胞及脏层胸膜间皮细胞上,主要清除支气管和脉管周围的的水分[15]。AQP-5主要存在于Ⅰ型肺泡上皮细胞内,主要功能是清除肺泡内的水分[16]。但吸入氢气是否对休克后肺损伤中AQP具有调控作用尚不明确。本研究发现,1%H2组和2%H2组AQP-1、AQP-5蛋白表达高于SH组,提示吸入氢气能提高肺组织中AQP-1及AQP-5,可能与其减轻肺损伤有关,推测吸入氢气可能通过促进AQP-1和AQP-5蛋白的表达,发挥减轻失血性休克后肺损伤的作用。
综上所述,吸入氢气可能通过促进肺组织中AQP-1和AQP-5蛋白的表达,从而减轻失血性休克大鼠肺损伤的程度。
参考文献:
[1] Kawanishi S, Takahashi T, Morimatsu H,et al.Inhalation of carbon monoxide following resuscitation ameliorates hemorrhagic shock-induced lung injury[J]. Mol Med Rep, 2013,7(1):3-10.
[2] Li HB, Wang GZ, Gong J,et al.BML-111 attenuates hemorrhagic shock-induced acute lung injury through inhibiting activation of mitogen-activated protein kinase pathway in rats[J]. J Surg Res, 2013,183(2):710-719.
[3] 高巨,周罗晶,陈弘,等.乌司他丁对大鼠“失血性休克—内毒素”二次打击肺组织水通道蛋白表达的影响[J].中国急救医学,2011,31(10):901-904.
[4] Singha O, Kengkoom K, Chaimongkolnukul K, et al. Pulmonary edema due to oral gavage in a toxicological study related to aquaporin-1, -4 and -5 expression[J]. J Toxicol Pathol, 2013,26(3):283-291.
[5] Ohsawa I, Ishikawa M, Takahaski K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007,13(6):688-693.
[6] Xie KL, Yu YH, Zhang ZS, et al. Hydrogen gas improves survival rate and organ damage in zymosan-induced generalized inflammation model[J]. Shock, 2010,34(5):495-501.
[7] Junko K, Hiroshi M, Toru T,et al. Effects of biliverdin administration on acute lung injury induced by hemorrhagic shock and resuscitation in rats[J]. PLoS One, 2013,8(5):e63606.
[8] Kozian A, Schilling T, Freden F, el al. One-lung ventilation induces hyperperfusion and alveolar damage in the ventilated lung:all experimental study[J]. Br J Anaesth, 2008,100(4):549-559.
[9] Maeshima K, Takahashi T, Uehara K,et al. Prevention of hemorrhagic shock-induced lung injury by heme arginate treatment in rats[J]. Biochem Pharmacol, 2005,69(11):1667-1680.
[10] Nakashima KN,Mori T. Molecular hydrogen alleviates nephrotoxicity induced by anti-cancer drag cisplatin without compromising anti-tumor activity in mice[J].Cancer Chemother Pharmacol, 2009,64(4):753-781.
[11] Awamura T,Huang CS, Tochigi N, et al. Inhaled hydrogen gas therapy for prevention of lung transplant-induced ischemia/reperfusion injury in rats[J]. Transplantation, 2010,90(6):1344-1351.
[12] 石海梅,周华成,贾雅蕊,等. 氢气对失血性休克大鼠急性肺损伤的影响[J].中华危重病急救医学,2013,25(6):347-350.
[13] Preston GM, Carroll TP, Guhhino WB, et al. Appearance of water channels in xenopus oocytes expressing red cell CHIP28 protein.[J]. Science, 1992,256(5055):385-387.
[14] Sun CY, Zhao YX, Zhong W, et al. The expression of aquaporins 1 and 5 in rat lung after thoracic irradiation[J]. J Radiat Res, 2014,55(4):683-689.
[15] Gao ZL, Xu JL, Sun DL, et al.Traditional Chinese medicine, Qing Ying Tang, ameliorates the severity of acute lung injury induced by severe acute pancreatitis in rats via the upregulation of aquaporin-1[J]. Exp Ther Med, 2014,8(6):1819-1824.
[16] Verkman AS. Role of aquaporins in lung liquid physiology[J].Respir Physiol Neumbiol, 2007,159(3):324-330.
