高糖激活Ca2+-CaN-NFAT3信号通路致H9c2细胞肥大
2016-01-12徐小红,阮骆阳,田小华等
高糖激活Ca2+-CaN-NFAT3信号通路致H9c2细胞肥大
徐小红1△,阮骆阳1,田小华1,潘凤娟1,杨彩兰2,柳国胜2
(1广东省农垦中心医院儿科,广东 湛江 524002;2暨南大学第一临床医学院儿科,广东 广州 510632)
[摘要]目的: 利用细胞实验探讨不同高糖浓度培养H9c2细胞是否引起心肌细胞肥大,探讨Ca2+-CaN-NFAT3信号通路是否参与高糖引起H9c2心肌细胞肥厚过程。方法: 体外培养H9c2大鼠心肌细胞48 h,分为5 mmol/L糖对照组、25mmol/L糖培养组、50 mmol/L糖培养组、25mmol/L糖培养加L型钙通道阻滞剂苯磺酸氨氯地平[商品名络活喜(Norvasc)]组和50 mmol/L糖培养加Norvasc组5组。观察H9c2细胞形态并测量细胞表面积大小;荧光分光光度法检测心肌细胞内钙离子浓度 [Ca2+]i;ELISA测细胞内CaN浓度;real-time PCR法及Western blot检测 CaNAβ、NFAT3和β-MHC的mRNA及蛋白表达。结果: 细胞大小、单细胞平均[Ca2+]i测定荧光值及细胞内CaN浓度在随糖浓度升高呈阶梯上升,50 mmol/L时达到最高点。加入Norvasc后细胞大小较相同条件不加Norvasc者降低。CaNAβ、 NFAT3和β-MHC的mRNA及蛋白表达随糖浓度升高逐步升高,50 mmol/L时达最高。加入Norvasc后CaNAβ、 NFAT3和β-MHC的mRNA及蛋白表达均较未加Narvasc组明显降低。结论: 高糖通过激活Ca2+-CaN-NFAT3信号通路引起H9c2心肌细胞肥大。
[关键词]妊娠期糖尿病; 心肌细胞肥大; 氨氯地平; 钙调神经磷酸酶; 活化T细胞核因子3
[中图分类号]R363[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.015
[文章编号]1000-4718(2015)11-2021-06
[收稿日期]2015-04-30[修回日期] 2015-09-07
[基金项目]*国家自然青年科学基金资助项目(No.81300705;No.81300676; No.81370909);中央高校基本科研业务费专项资金资助项目(No.12ykpy41);广东省实验体系建设项目基金(No.2012A061400004)
通讯作者△Tel: 020-85252107; E-mail: xufen3@mail.sysu.edu.cn
High glucose induces H9c2 cardiomyocyte hypertrophy through Ca2+-CaN-NFAT3 signaling pathwayXU Xiao-hong1, RUAN Luo-yang1, TIAN Xiao-hua1, PAN Feng-juan1, YANG Cai-lan1, LIU Guo-sheng2
(1DepartmentofPediatrics,CentralHospitalofGuangdongAgriculturalReclamation,Zhanjiang524002,China;2DepartmentofPediatrics,theFirstClinicalMedicalCollegeofJinanUniversity,Guangzhou510632,China.E-mail: 276798575@qq.com)
ABSTRACT[]AIM: To study the morphological changes of cardiac H9c2 cells during the developmental process of fetal rat. METHODS: Embryonic rat heart-derived H9c2 cells were maintained in DMEM supplemented with 10% fetal bovine serum. The H9c2 cells were plated at a density of 6 000 cells/cm and divided into 5 groups: H9c2 cells were treated with 5 mmol/L glucose, 25 mmol/L glucose, 50 mmol/L glucose, Norvasc (25 nmol/L)+25 mmol/L glucose, or Norvasc (25 nmol/L)+50 mmol/L glucose for 48 h. The morphology of H9c2 cells was observed. The cell surface area was measured by Image-Pro Plus 6.1 software. Fluorescence spectrophotometry was used to detect the concentration of intracellular calcium ion ([Ca2+]i)in the cardiomyocytes. The concentration of CaN in the cell was measured by ELISA. The mRNA expression of CaNAβ, NFAT3 and β-MHC in the cells was detected by real-time PCR. The protein levels of CaNAβ, NFAT3 and β-MHC in cultural H9c2 cells were detected by Western blot. RESULTS: The mean area of the cells, the mean fluorescence value of [Ca2+]i and the concentration of CaN in 25 mmol/L glucose group were higher than those in 5 mmol/L glucose group, and those were lower than those in 50 mmol/L glucose group. After treated with Norvasc, those results decreased significantly. The expression of CaNAβ, NFAT3 and β-MHC at mRNA and protein levels in 25 mmol/L glucose group was higher than those in 5 mmol/L glucose group, but was lower than those in 50 mmol/L glucose group . The expression of CaNAβ, NFAT3 and β-MHC at mRNA and protein levels decreased significantly in Norvasc treatment group. CONCLUSION: Ca2+-CaN-NFAT3 signaling pathway is perhaps involved in high glucose- induced H9c2 cardiomyocyte hypertrophy.
[KEY WORDS]Gestational diabetes mellitus; Cardiomyocyte hypertrophy; Amlodipine; Calcineurin; Nuclear factor of activated T cells 3
妊娠期糖尿病(gestational diabetes mellitus,GDM)指“妊娠期或妊娠前发生的任何程度或首次识别葡萄糖耐受不良”[1]。GDM孕妇胎儿心脏畸形发生率高于一般孕妇胎儿6~8倍[2],包括动脉导管未闭、肺动脉狭窄及室间隔肥厚等发育异常,其中心肌肥厚是心血管意外事件发生的独立危险因素,可对胎儿的发育造成严重的不良后果,甚至影响其成年后的生活质量[3-4]。GDM孕妇所生的新生儿10%~20%可有心脏扩大,新生儿肥厚性心肌病的发生与孕妇血糖控制不理想有独立相关性,超声心动检查显示心肌肥厚,室间隔增厚,心脏扩大,严重者将会发生心力衰竭。高血糖致心肌病的特点是心肌结构改变,而最终导致心力衰竭的是心肌结构和功能的改变。目前认为多种机制参与其中,包括改变心肌能量代谢和钙信号;但高血糖致胎儿心肌改变的具体机制尚不明确。本研究从钙信号通路角度研究GDM中胎儿发生心肌肥厚的可能发病机制,以期为临床防治此种疾病提供理论依据并发现可能作用靶点。
材料和方法
1材料
大鼠胚胎心肌细胞H9c2细胞购自中国科学院上海生命科学研究院细胞资源中心;D-葡萄糖购自广州化学试剂;络活喜(Norvasc;即苯磺酸氨氯地平,amiodipine besylate)由Sigma提供;胎牛血清(HyClone);DMEM高、低糖培养基(Gibco);PBS磷酸钾缓冲液(HyClone);钙调神经磷酸酶(calcineurin,CaN)酶联免疫吸附测定试剂盒(伊莱瑞特生物科技有限公司;钙离子荧光探针Fluo-3 AM(碧云天);DNase I(RNase-free)、反转录试剂盒和real-time PCR试剂盒(Vazyme);钙调神经磷酸酶Aβ(calcineurin Aβ,CaNAβ)、活化T细胞核因子3(nuclear factor of activated T cells 3,NFAT3)和β-重链肌球蛋白(β-myosin heavy chain,β-MHC) I 抗购自Abcam。
2方法
2.1细胞培养细胞解冻后,在含10%胎牛血清的DMEM培养液,5% CO2、饱和湿度、37 ℃培养箱中培养。
2.2实验分组实验共分为5组,分别为5 mmol/L、25 mmol/L、50 mmol/L糖处理组及Norvasc与25 mmol、50 mmol/L糖共处理组。
2.3细胞内Ca2+浓度([Ca2+]i)的测定Fluo-3经无血清DMEM培养基稀释至2 μmol/L;去除旧细胞培养基,用PBS洗涤细胞,先后于37 ℃、5% CO2予2 μmol/L的Fluo-3孵育1 h、30 min;弃去Fluo-3,PBS洗涤细胞2次,加培养基适量后荧光显微镜检测。
2.4细胞内CaN浓度的测定按酶联免疫吸附测定试剂盒操作步骤操作。
2.5荧光定量PCR法检测各组心肌细胞CaNAβ、NFAT3和β-MHC的mRNA表达用 TRIzol 试剂盒(Invitrogen)提取 RNA ;使用RNase-free的DNase Ⅰ配置反应液,37 ℃消化30 min,65 ℃灭活10 min去DNA,加入模板RNA、引物混合物42 ℃逆转录1 h,冰上2 min;cDNA稀释10倍后,作为PCR模板加入引物反应体系,95 ℃ 10 s,60 ℃ 34 s;40个循环,在温度60 ℃、95 ℃行融解曲线分析。GAPDH的上游引物序列为5’-CATCAACGACCCCTTCATTG-3’, 下游引物序列为5’-GAAGATGGTGATGGGTTTCC-3’;CaNAβ的上游引物序列为5’-ATGTTGCCTAGTGGAGTGTT-3’, 下游引物序列为5’-GGAGAGTATCCTCGTATTGCTT-3’; NFAT3的上游引物序列为5’-CCACAAGGCATTGAGACACAT-3’, 下游引物序列为5’-TCACCAGCAGCAGCAGCAG-3’;β-MHC的上游引物序列为5’-AATGAACACCGGAGCAAGG-3’,下游引物序列为5’-CGGGTCAGCTGAGAGATAAGAGC-3’。
2.6Western blot检测各组心肌细胞CaNAβ、NFAT3和β-MHC蛋白的表达预冷的PBS冲洗培养孔板中的H9c2细胞后立即放入预冷的裂解缓冲液中30 min,裂解产物10 000 r/min离心20 min,取上清。吸取2 μL上清液用BCA蛋白定量试剂盒测定蛋白浓度,制备10 mL 10% SDS-PAGE分离胶,凝固后配制5%浓缩胶5 mL灌满剩余空间,每孔上样50 μg。用100 V恒压浓缩胶电泳20 min,恒压140 V分离胶电泳40 min。将凝胶中已分离的蛋白质电转移至PVDF膜上,TBS洗涤3次, 倾去TBS后加封闭液置摇床室温封闭2 h;膜放入封闭液稀释 I 抗中室温反应4 h后4 ℃过夜,大量PBST洗膜3次,洗涤后将PVDF膜放入 II抗中室温摇床2 h。取出PVDF膜, PBS洗5次, 每次15 min。ECL发光法显影。
3统计学处理
采用GraphPad Prism 5行统计分析,数据以均数±标准差(mean±SD)表示,多组均数间的比较采用单因素方差分析,各组均数两两之间采用Bonferroni校正的t检验比较,以P<0.05为差异有统计学意义。
结果
1细胞表面积分析
使用Image-Pro Plus 6.0软件进行图像分析,可见各组不同条件分别培养48 h后,细胞大小随糖浓度升高逐步上升,50 mmol/L时达到最高点。加入Norvasc后细胞大小较相同条件不加Norvasc者降低,但与5 mmol/L glucose组比较,细胞大小改变的差异均无统计学意义,见图1。
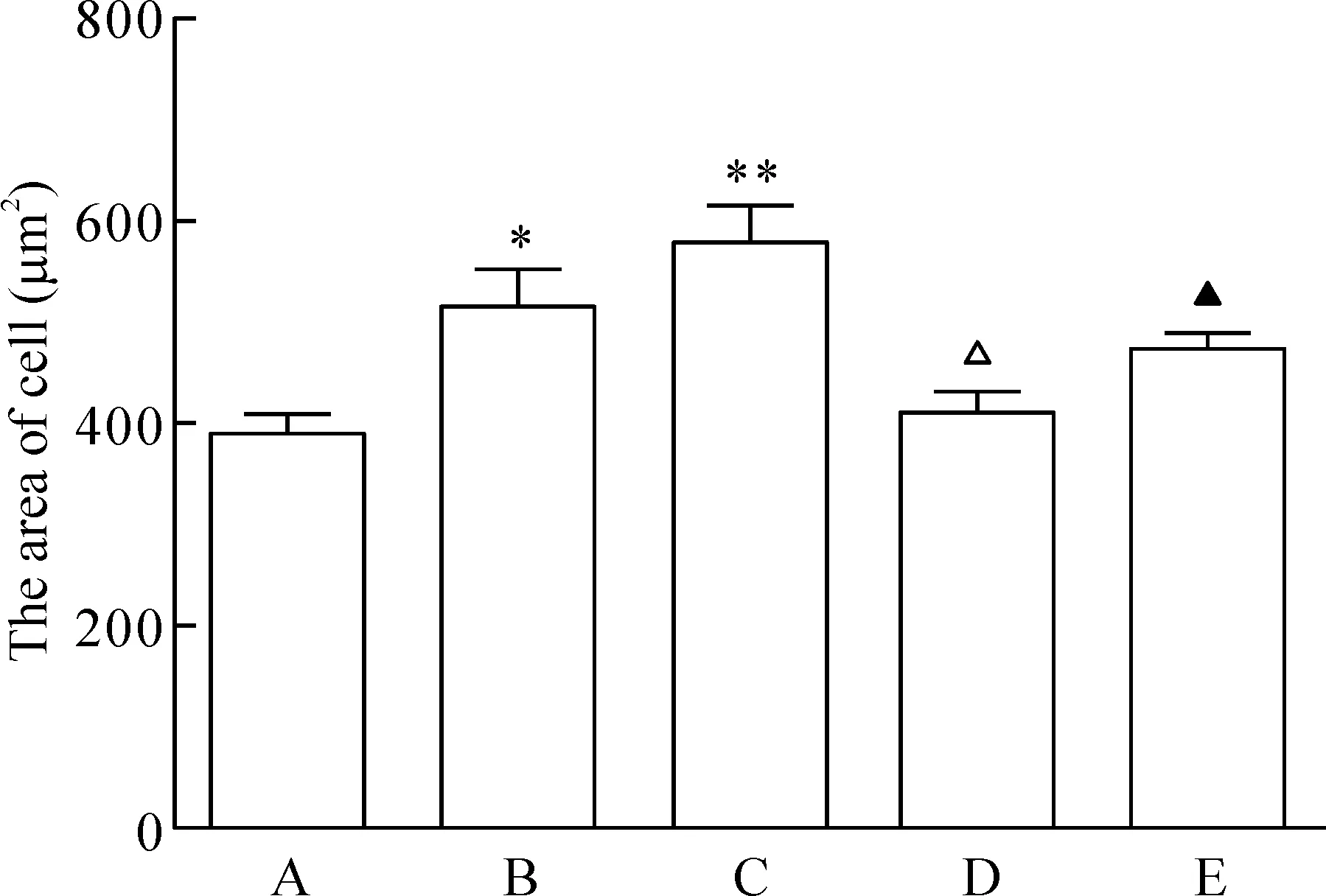
Figure 1.The mean surface area of the H9c2 cells in each group. The cells were treated with 5 mmol/L glucose (A), 25 mmol/L glucose (B), 50 mmol/L glucose (C), Norvasc+25 mmol/L glucose (D), or Norvasc+50 mmol/L glucose (E) for 48 h. Mean±SD.n=3.*P<0.05,**P<0.01vsgroup A;△P<0.05vsgroup B;▲P<0.05vsgroup C.
图1各组细胞表面积大小的测量结果
2各组细胞内[Ca2+]i活性测定结果
各组不同条件分别培养48 h后,单细胞平均[Ca2+]i活性测定荧光值随糖浓度升高逐步上升,50 mmol/L时达到最高点(P<0.05)。加入Norvasc后单细胞平均[Ca2+]i活性测定荧光值较相同条件不加Norvasc者降低(P<0.05),见图2。
3各组细胞CaN浓度的测定
各组不同条件分别培养48 h后,其余各组CaN浓度均较5 mmol/L时糖浓度组升高(P<0.05);CaN浓度随糖浓度升高呈阶梯上升(P<0.05)。加入Norvasc后CaN浓度较相同条件不加Norvasc者降低(P<0.05),见图3。
4Real-time PCR检测各组H9c2细胞CaN、NFAT3和β-MHC mRNA的变化
各组不同条件分别培养48 h后,CaN、NFAT3及β-MHC的mRNA表达随糖浓度升高呈阶梯上升,50 mmol/L时表达最多。加入Norvasc后, CaN的mRNA表达均明显降低,见图4。

Figure 2.The fluorescence images of [Ca2+]iin the H9c2 cells with different treatments (×200) and the quantitative analysis of the mean fluorescence intensity of [Ca2+]iin each group. The definition of the grouping was the same as Figure 1. Mean±SD.n=3.*P<0.05,**P<0.01vsgroup A;△P<0.05vsgroup B;▲P<0.05vsgroup C.
图2各组[Ca2+]i荧光染色观察和各[Ca2+]i荧光值的测定结果
5Western blot检测各组H9c2细胞CaN、NFAT3和β-MHC蛋白的表达
各组不同条件分别培养48 h后,CaN、NFAT3及β-MHC蛋白表达随糖浓度升高逐步上升,50 mmol/L组达到最高点,差异有统计学意义。加入Norvasc后,各蛋白表达均明显降低,见图5。
讨论
高血糖持续时间的长短是糖尿病心肌病造成心力衰竭严重程度的重要标尺[5],故将高血糖作为造成糖尿病心肌损伤的独立危险因素来研究[6]。H9c2细胞来源于大鼠胚胎心室肌克隆培养的心脏成肌细胞,有文献证实氧化应激条件下H9c2细胞具有的应答反应相似于原代培养的乳鼠心肌细胞[7]。因其来源于大鼠胚胎的心肌细胞,更能直接反映胚胎心脏的生理病理状态,所以我们用其来研究GDM中大鼠胚胎在持续高血糖环境下心肌细胞发生的可能改变。
CaN-NFAT3信号通路在心脏发育发展过程中发挥了重要作用。有研究人员[8]发现,CaN-NFAT3信号在小鼠胚胎E9即启动了心脏瓣膜的形成过程,E11在心内膜中参与指导瓣膜状小叶的重塑,这种连续的心肌层-心内膜信号协调了各种分子和细胞事件以确保瓣膜形成过程的起始和延续。相较CaN-NFAT3信号通路在胚胎心血管发育过程中的作用,其在心肌肥大中所扮演的角色则更受人关注,也了解得更为透彻。钙调神经磷酸酶是由一个催化亚单位(CnA)和一个调节亚单位(CnB)组成的异二源体,在CnA的α、β和γ 3种亚型中,在心脏中介导钙调神经磷酸酶活性与CnAβ亚型有关,与CnAα和CnAγ无关[9]。Ca2+/钙调素(calmodulin,CaM)-calcineurin (CnAβ)-NFAT3组成钙调神经磷酸酶信号通路。多项研究[10-11]认为:多种病因均能使心肌细胞质内Ca2+浓度增加,激活的Ca2+/CAM依赖的CaN,在依赖Ca2+和CaN的通路里去磷酸化胞浆中的转移NFAT3,暴露其上的核定位信号,并需要GATA等配偶体的协助来完成核转运[12],转位入细胞核,活化多种心肌肥大的相关基因调节心脏中的心房利钠因子(atrial natriuretic factor,ANF)、脑钠尿肽(brain natriuretic peptide,BNP)、β重链肌球蛋白(β-MHC)等肥大基因特异性表达,导致心肌细胞蛋白核酸合成增加,心肌细胞体积增大,形成心肌肥大。

Figure 3.The concentration of CaN in the H9c2 cells with different treatments detected by ELISA. The definition of the grouping was the same as Figure 1. Mean±SD.n=3.*P<0.05,**P<0.01vsgroup A;△P<0.05vsgroup B;▲P<0.05vsgroup C.
图3ELISA测定各组细胞内CaN浓度的结果

Figure 4.The mRNA expression in the H9c2 cells with different treatments detected by real-time PCR. The definition of the grouping was the same as Figure 1. Mean±SD.n=3.*P<0.05,**P<0.01vsgroup A;△P<0.05vsgroup B;▲P<0.05vsgroup C.
图4Real-time PCR检测各组H9c2细胞CaNAβ、NFAT3和β-MHC的mRNA表达
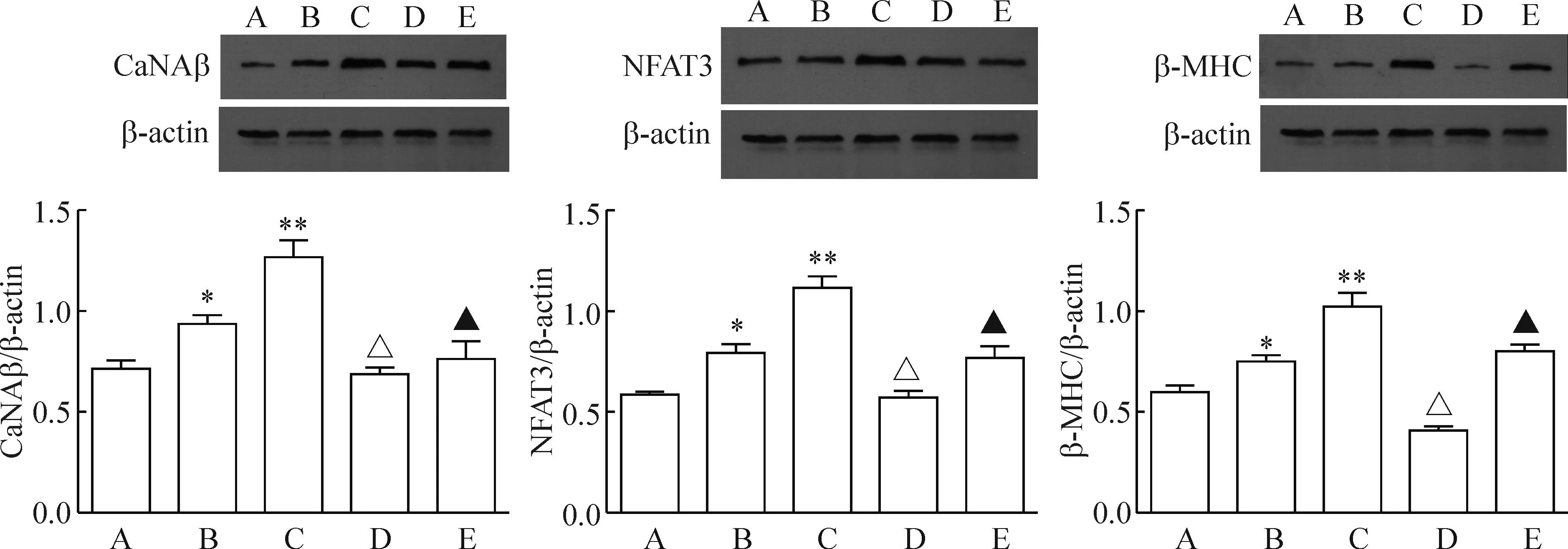
Figure 5.The protein levels in the H9c2 cells with different treatments detected by Western blot analysis. The definition of the grouping was the same as Figure 1. β-actin is the same.Mean±SD.n=3.*P<0.05,**P<0.01vsgroup A;△P<0.05vsgroup B;▲P<0.05vsgroup C.
图5Western blot检测各组CaNAβ、 NFAT3和β-MHC的蛋白表达
细胞内游离钙作为第二信使广泛参与细胞生理活动的调节过程。钙离子浓度对于该信号通路的影响是显而易见的,Somvanshi等[13]提供了直接的证据证明生长抑素受体2(somatostatin receptor-2,SSTR2)通过调节Ca2+相关的致心肌肥厚的信号途径来保护心脏。Hsu等[14]发现压力超负荷早期释放心肌肥厚早期的信号Egr1(early growth response 1)诱导Cav3.2通过钙调神经磷酸酶-NFAT信号通路调节心肌肥大。我们选择用不同浓度的葡萄糖培养H9c2来探索高糖对其存活、生长的可能影响,并利用加入L型钙通道阻滞剂苯磺酸氨氯地平来探讨Ca2+在其中的可能作用及主要信号途径,以期探索并发现影响胎儿心脏发育的关键影响因素并提供可能的治疗干预对策,争取为以后临床发展提供理论依据。
我们的研究发现高糖可导致H9c2细胞平均单个细胞体积增加,为进一步研究这种肥大可能通过何种信号通路来完成,我们检测了其中的CaNAβ、NFAT3及β-MHC的mRNA及蛋白表达,并采用ELISA检测CaN总的蛋白表达,发现它们的变化趋势一致,均随培养糖浓度的增加而增加,并随浓度进一步增高而增高,提示两者具有相关性。因已有的认识证明CaN的激活主要依赖胞浆内Ca2+浓度的升高,它的活性受细胞内Ca2+的变化所调节,所以钙离子通道抑制剂也是目前心肌肥厚一个研究热点和重要的治疗靶点。L型钙通道抑制剂Norvasc被用来反证高糖培养的H9c2细胞中Ca2+是否存在内流,引起[Ca2+]i的变化并激活CaN,从而激活信号通路最终致心肌细胞肥大。我们发现,使用Norvasc后细胞内钙活性明显降低,CaN浓度明显降低及CaNAβ、NFAT3及β-MHC的mRNA及蛋白表达也明显降低,提示Ca2+参与了CaNAβ-NFAT3信号通路的激活,Ca2+尤其是细胞内钙在高糖培养致H9c2细胞肥大中可能发挥了重要作用。但心肌肥大的信号转导机制非常复杂, Liu等[15]提供了与LPS诱导的炎症反应和链接的CaN-NFAT3信号转导通路介导心肌肥厚发展的相关证据,他们使用了信号通路中多个关键点的抑制剂,证明钙调磷酸酶抑制剂显著抑制了NFAT3核定位,证实了LPS通过CaN-NFAT3 信号转导通路导致H9c2细胞的心肌肥厚。该研究提供了我们下一步研究的思路。
总而言之,根据我们的研究,有理由认为高糖培养可能通过激活Ca2+-CaN-NFAT3信号通路而导致H9c2细胞肥大,钙离子通道抑制剂Norvasc可以抑制这种作用。
[参考文献]
[1]Kariagina I, Emanuel I. Laboratory techniques for diagnosis and monitoring of diabetes mellitus (Lecture)[J]. Klin Lab Diagn, 2002(5):25-32.
[2]Hrabovski I, Milasnovif L, Grujif Z, et al. Influence of glucose homeostasis on maturation and ontogenesis of fetus[J]. Med Pregl, 2011, 64(11-12):552-556.
[3]Passarella G, TrifirbG, Gasparetto M, et al. Disorders in glucidic metabolism and congenital heart diseases: detection and prevention[J]. Pediatr Cardiol, 2013, 34(4):931-937.
[4]Zielinsky P, Piccoli AJ. Myocardial hypertrophy and dysfunction in maternal diabetes[J]. Early Hum Dev, 2012, 88(5):273-278.
[5]Fang ZY, Schull-Meade R, Leano R, et al. Screening for heart disease in diabetic subjects[J]. Am Heart J, 2005, 149(2):349-354.
[6]Boudina S, Abel ED. Diabetic cardiomyopathy, causes and effects[J]. Rev Endocr Metab Disord, 2010, 11(1):31-39.
[7]Comelli M, Domenis R, Bisetto E, et al. Cardiac differentiation promotes mitochondria development and ameliorates oxidative capacity in H9c2 cardiomyoblasts[J]. Mitochondrion, 2011, 11(2):315-326.
[8]Wagner M, Siddiqui MA. Signal transduction in early heart development (II): ventricular chamber specification, trabeculation, and heart valve formation[J]. Exp Biol Med (Maywood), 2007, 232(7):866-880.
[9]Bueno OF, Wilkins BJ, Tymitz KM, et al.Impaired cardiac hypertrophic response in calcineurin Aβ-deficient mice[J]. Proc Natl Acad Sci U S A, 2002,99(7): 4586-4591.
[10]谭建新,刘郴州,王优,等.钙通道阻滞剂对缺氧右心室心肌钙调神经磷酸酶活性的调控作用[J]. 中国病理生理杂志, 2004, 20 (9):1631-1634.
[11]Wilkins BJ, Dai YS, Bueno OF, et al. Calcineurin/NFAT coupling participates in pathological, but not physiological, cardiac hypertrophy[J]. Circ Res, 2004, 94(1):110-118.
[12]Yang XY, Yang TT, Schubert W, et al. Dosage-dependent transcriptional regulation by the calcineurin/NFAT signaling in developing myocardium transition[J]. Dev Biol, 2007, 303(2):825-837.
[13]Somvanshi RK, Zou S, Qiu X, et al. Somatostatin receptor-2 negatively regulates beta-adrenergic receptor mediated Ca2+dependent signaling pathways in H9c2 cells[J]. Biochim Biophys Acta, 2014, 1843(4):735-745.
[14]Hsu SC, Chang YT, Chen CC. Early growth response 1 is an early signal inducing Cav3.2 T-type calcium channels during cardiac hypertrophy[J]. Cardiovasc Res, 2013, 100(2):222-230.
[15]Liu CJ, Cheng YC, Lee KW, et al. Lipopolysaccharide induces cellular hypertrophy through calcineurin/NFAT-3 signaling pathway in H9c2 myocardiac cells[J]. Mol Cell Biochem, 2008, 313(1-2):167-178.
(责任编辑: 陈妙玲, 罗森)

