Mcl-1信号通路阻断剂对H37Rv感染小鼠巨噬细胞凋亡的影响
2016-01-12张宇晴,王新敏,王婵等
Mcl-1信号通路阻断剂对H37Rv感染小鼠巨噬细胞凋亡的影响*
张宇晴1, 4,王新敏5,王婵2, 4,王飞雨1, 4,王小芳1, 4,赵瑾3,4,吴芳1,4,吴江东1, 4,季榕5,张万江1, 4,章乐1, 4△
(石河子大学医学院1病理生理学教研室,2病原生物学与免疫学教研室,3病理学教研室,4新疆地方与民族高发病教育部重点实验室,5第一附属医院,新疆 石河子832002)
[摘要]目的: 探讨Mcl-1信号通路阻断剂在结核分枝杆菌H37Rv感染小鼠模型中对Mcl-1表达、巨噬细胞凋亡情况及结核分枝杆菌的影响。方法: 小鼠腹腔注射H37Rv菌悬液,建立感染小鼠模型,针对Mcl-1的信号通路选用JAK/STAT信号通路阻断剂AG490、MAPK信号通路阻断剂PD98059和PI3K信号通路阻断剂LY294002用腹腔注射方式作用于各组感染小鼠模型,分为H37Rv感染组、AG490处理组、PD98059处理组、 LY294002处理组和对照组。通过细胞抗酸染色观察结核分枝杆菌H37Rv感染小鼠腹腔巨噬细胞的动物模型是否建立成功;通过免疫细胞化学检测结核分枝杆菌H37Rv感染巨噬细胞的Mcl-1表达情况,使用流式细胞技术检测各组巨噬细胞的凋亡率,采用结核分枝杆菌菌落计数来判断巨噬细胞凋亡对结核分枝杆菌的清除效果。结果: 细胞抗酸染色结果可见感染的巨噬细胞内散在排列的红色短小抗酸结核分枝杆菌。免疫细胞化学结果显示H37Rv感染组、AG490处理组和LY294002处理组中的Mcl-1蛋白为强阳性表达,PD98059处理组中Mcl-1蛋白为弱阳性表达,对照组Mcl-1蛋白为阴性表达。流式细胞术检测发现H37Rv感染组巨噬细胞凋亡率较对照组高,PD98059处理组的凋亡率显著高于各组,差异显著(P<0.05)。结核分枝杆菌菌落计数结果显示PD98059处理组对H37Rv菌株抑菌作用最明显。结论: Mcl-1信号通路阻断剂通过抑制JAK/STAT、MAPK和PI3K信号通路增加结核分枝杆菌H37Rv感染巨噬细胞的凋亡率,抑制结核分枝杆菌生长;其中,MAPK信号通路干扰Mcl-1的作用最明显,感染的巨噬细胞凋亡率最高,抑菌作用最强。
[关键词]Mcl-1; 细胞凋亡; 结核分枝杆菌; H37Rv; 巨噬细胞
[中图分类号]R378.91+1; R363[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.022
[文章编号]1000-4718(2015)11-2065-05
[收稿日期]2015-03-18[修回日期] 2015-07-14
[基金项目]*国家自然科学基金资助项目(No.81102088; No. 81441101);天津市自然科学基金资助项目(No.12JCYBJC16600; No.13JCYBJC22000);武警后勤学院附属医院重点项目(No.FYJ201510);武警后勤学院附属医院种子基金资助项目(No.FYM201107; No. FYM201538)
通讯作者△姬文婕 Tel: 022-60577283; E-mail: ji_wenjie@hotmail.com; 魏路清 Tel: 022-60578671;E-mail:wei_luqing@hotmail.com
Effect of Mcl-1 signaling pathway blockers on apoptosis of mouse macrophages infected withMycobacteriumtuberculosisH37RvZHANG Yu-qing1,4, WANG Xin-min5, WANG Chan2,4, WANG Fei-yu1,4, WANG Xiao-fang1,4, ZHAO Jin3,4, WU Fang1,4, WU Jiang-dong1,4, JI Rong5, ZHANG Wan-jiang1,4, ZHANG Le1,4
(1DepartmentofPathophysiology,2DepartmentofPathogenBiology&Immunology,3DepartmentofPathology,4LaboratoryofXinjiangEndemicandEthnicDiseases,5TheFirstAffiliatedHospital,MedicalcollegeofShiheziUniversity,Shihezi832002,China.E-mail: 1257067540@qq.com)
ABSTRACT[]AIM: To explore the effects of Mcl-1 signal pathway blockers on Mcl-1 expression, macrophage apoptosis and Mycobacterium tuberculosis in the model of mice infected with Mycobacterium tuberculosis H37Rv. METHODS: A mouse infection model was established by intraperitoneal injection of H37Rv suspension. The signaling pathway blockers AG490, PD98059 and LY294002 for JAK/STAT, MAPK and PI3K, respectively, were intraperitoneally injected into the mice infected with H37Rv. Cell acid-fast staining was used to observe whether the mouse peritoneal macrophages infected with H37Rv were successfully established. Immunocytochemical method was employed to detect Mcl-1 expression in the mouse peritoneal macrophages infected with H37Rv. The apoptotic rate in each group was measured by flow cytomerty. The scavenging capacity of apoptotic macrophages against H37Rv was determined by Mycobacterium tuberculosis colony counting. RESULTS: The result of cell acid-fast staining revealed the existence of dispersive arrangement of red short antiacid Mycobacterium tuberculosis within infected macrophages. The result of cell immunocytochemistry showed strongly positive expression of Mcl-1 protein in H37Rv infection group, AG490 treatment group and LY294002 treatment group, weakly positive expression of Mcl-1 protein in PD98059 treatment group, and negative expression of Mcl-1 protein in control group. The result of flow cytometry found that the macrophage apoptotic rate in H37Rv infection group was higher than that in control group, while that in PD98059 treatment group was high than that in other groups with statistically significant differences (P<0.05). The result of Mycobacterium tuberculosis colony counting showed that PD98059 treatment had the most significant inhibitory effect on H37Rv strain. CONCLUSION: Mcl-1 signaling pathway blockers increase the apoptotic rate of macrophages infected with Mycobacterium tuberculosis H37Rv and inhibit the growth of Mycobacterium tuberculosis by inhibiting the signaling pathways of JAK/STAT, MAPK and PI3K, among which the MAPK has the most obvious interfering effect on Mcl-1, and leads to the highest apoptotic rate of infected macrophages and the strongest bacteriostasis.
[KEY WORDS]Mcl-1; Apoptosis;Mycobacteriumtuberculosis; H37Rv; Macrophages
结核病(tuberculosis,TB)是由结核分枝杆菌(Mycobacteriumtuberculosis,MTB)感染所引起的一种致残率、病死率极高的传染性疾病。髓细胞白血病1(myeloid cell leukemia-1,Mcl-1)属于Bcl-2家族,正常情况下,Mcl-1通过与Bcl-2家族中的Bax结合来抑制细胞凋亡[1],由于 Mcl-1受到正向调控而表达异常,导致单核巨噬细胞在吞噬结核分枝杆菌之后不能正常凋亡成为结核分枝杆菌理想的庇护所,因此,通过抑制Mcl-1的表达促进感染巨噬细胞的凋亡从而杀灭结核分枝杆菌成为可能。Mcl-1基因的表达主要是通过JAK/STAT、MAPK和PI3K/AKT等胞内信号通路的激活进行的[2],如果通过阻断信号通路途径抑制结核分枝杆菌感染巨噬细胞中Mcl-1的表达则有可能导致受到感染的巨噬细胞凋亡从而杀死潜伏在其中的结核分枝杆菌,所以本研究使用JAK/STAT信号通路抑制剂AG490,MAPK信号通路阻断剂PD98059和PI3K/AKT信号特异性抑制剂LY294002分别作用于感染H37Rv的BALB/c小鼠,通过观察小鼠模型中结核分枝杆菌H37Rv感染巨噬细胞中Mcl-1的表达,检测结核分枝杆菌H37Rv感染巨噬细胞凋亡率,通过结核分枝杆菌菌落计数判断巨噬细胞凋亡对结核分枝杆菌的清除效果,探讨Mcl-1信号通路阻断剂在结核分枝杆菌H37Rv感染小鼠巨噬细胞凋亡中的调控作用。
材料和方法
1材料
1.1菌株结核分枝杆菌国际标准强毒株H37Rv株购自中国药物生物制品检定所。
1.2实验动物6~8周龄SPF级雌性BALB/c小鼠,体重18~20 g,购于石河子大学实验动物中心。
1.3主要试剂Mcl-1兔多克隆抗体粉型,Mcl-1 多克隆抗体购于北京博奥森生物技术有限公司;PV6001 polink-1辣根过氧化物酶检测试剂盒购于中杉金桥;Annexin V-APC/7-AAD凋亡检测试剂盒购自联科生物技术有限公司;其余实验试剂均取自石河子大学病理实验室。
2方法
2.1实验菌株及菌悬液的制备取生物安全柜内改良罗氏培养基上生长2~3周状态良好的结核分枝杆菌H37Rv菌落置灭菌研菌器中,加少量含0.05% Tween-20的生理盐水溶液充分研磨,使其成均匀浑浊的菌悬液。麦氏比浊法调细菌浓度约1.0×1010CFU/L。
2.2动物模型的建立及分组实验动物随机分为5组,即H37Rv感染组、AG490处理组、PD98059处理组、 LY294002处理组和对照组,每组10只。
2.3小鼠感染模型的建立小鼠腹腔注射H37Rv结核分枝杆菌造模,注射量约为0.3 mL,AG490、PD98059和LY294002各100 μg经腹腔注射方式作用于各组感染小鼠模型,对照组小鼠仅注射灭菌生理盐水溶液0.3 mL,感染小鼠置生物安全三级实验室内,IVC笼具中饲养。在各组感染小鼠的动物模型复制注射后第5天剖杀小鼠,提取小鼠腹腔巨噬细胞。
2.4小鼠腹腔巨噬细胞的收集将小鼠脱颈处死,仰卧固定于操作台,腹腔注入无血清DMEM培养液5 mL,静置5 min,注射器抽取腹腔液约4 mL,离心洗涤后显微镜下计数,调整至所需浓度,接种于放有无菌盖玻片的6孔板内,置于37 ℃、5% CO2培养箱中培养。
2.5抗酸染色方法滴加复红染色剂,染色 5 min,水洗。加3%盐酸乙醇脱色1 min,水洗。加亚甲兰复染剂,染色1 min,水洗待干。抗酸染色结核杆菌阳性菌体染后呈鲜红色,胞核呈蓝色。
2.6细胞免疫化学观察I抗兔抗鼠Mcl-1(37 °C,1 h),阴性对照以PBS代替I抗,PBS洗3次,每次5 min, II 抗为PV6001山羊抗兔IgG/HRP聚合物,PBS洗3次,每次5 min,DAB显色,苏木素复染2 min,中性树脂封片。染色以细胞核或细胞浆中出现淡黄色或棕黄色颗粒为阳性细胞,高倍镜视野下综合细胞染色强度和阳性细胞所占比例进行评分,每张切片随机观察5个视野,计数500个细胞中阳性细胞所占比例进行评分。按染色百分数及强弱分成(-)~ (+++)进行定性判定:阳性细胞数<10%为(-),10%~40% (+),41%~70% (++),>70% (+++)[3]。
2.7流式细胞术检测细胞凋亡率按照Annexin V-APC/7-AAD凋亡检测试剂盒说明书操作,取出细胞培养板,离心去除上清液,加入100 μL 1×binding buffer重悬细胞,轻轻混匀后,再加入5 μL Annexin V-APC和10 μL 7-AAD,避光孵育15 min,最后加入380 μL 1×binding buffer,30 min内用流式细胞仪检测。
2.8结核分枝杆菌菌落计数将取出的腹腔液放入离心机中,6 000 r/min离心20 min,去上清液,加入1 mL 1% Triton X-100对巨噬细胞进行裂解,镜下观察,待巨噬细胞全部裂解后(约10 min),加入1 mL DMEM培养基(含10%胎牛血清)终止裂解,微型振荡器上振荡混匀5 min,分别做10-2、10-3和10-4倍稀释,接种于罗氏培养基,每个稀释度涂布3个平板,置于37 ℃温箱中培养,21 d后进行菌落计数。
3统计学处理
应用SPSS 17.0软件处理,计量资料数据用均数±标准差(mean±SD)表示,组间比较用t检验或方差分析,方差分析后组间两样本均数的比较行q检验,计数资料或计量资料不服从正态性且方差不齐时采用非参数检验,以P<0.05为差异有统计学意义。
结果
1细胞抗酸染色
100倍物镜明视野下,阳性病例可见感染的巨噬细胞内散在排列的红色短小抗酸杆菌,对照组均为阴性,见图1。
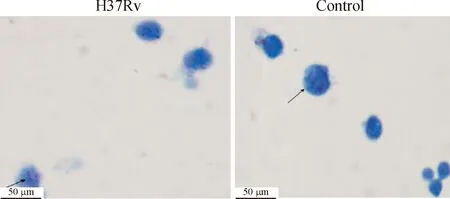
Figure 1.Cell acid-fast staining.
图1细胞抗酸染色
3检测各组巨噬细胞凋亡率结果
流式细胞术分析结果显示,H37Rv感染组细胞凋亡率较对照组高(P<0.05),AG490处理组细胞凋亡率高于H37Rv感染组,LY294002处理组细胞凋亡率高于AG490处理组,PD98059处理组细胞凋亡率显著高于各组细胞凋亡率(P<0.05),见图3、表1。
4结核分枝杆菌菌落计数
结核分枝杆菌菌落计数结果显示,H37Rv感染组菌落数最高,各处理组菌落数均较H37Rv感染组低,H37Rv感染组与对照组之间差异显著(P<0.05),其中,PD98059处理组菌落数最低(P<0.05),见图4。
2小鼠腹腔巨噬细胞中Mcl-1的表达
Mcl-1主要在细胞浆表达,部分呈核质型,阳性细胞胞浆或胞核呈淡黄色、黄色或棕黄色颗粒,50例5种不同组小鼠Mcl-1的阳性表达率分别如下:H37Rv感染组表达率为100%(10/10),AG490处理组表达率为100%(10/10),PD98059处理组为20%(2/10), LY294002处理组为100%(10/ 10)。H37Rv感染组、AG490处理组和LY294002处理组中的Mcl-1蛋白为强阳性表达,PD98059处理组中Mcl-1蛋白为弱阳性表达,对照组Mcl-1蛋白为阴性表达,Mcl-1蛋白在H37Rv感染组与对照组之间差异显著(P<0.05),见图2、表1。
讨论
有研究发现,用活菌 H37Ra 或灭活菌H37Rv 感染小鼠腹腔巨噬细胞 10 h 后抗酸染色即可计数、观察巨噬细胞吞噬活菌的情况[4],实验中细胞抗酸染色技术发现巨噬细胞内吞噬的结核分枝杆菌,抗酸染色技术特异性高,可以明确诊断结核疾病[5],是结核分枝杆菌H37Rv感染小鼠腹腔巨噬细胞造模成功的保证。
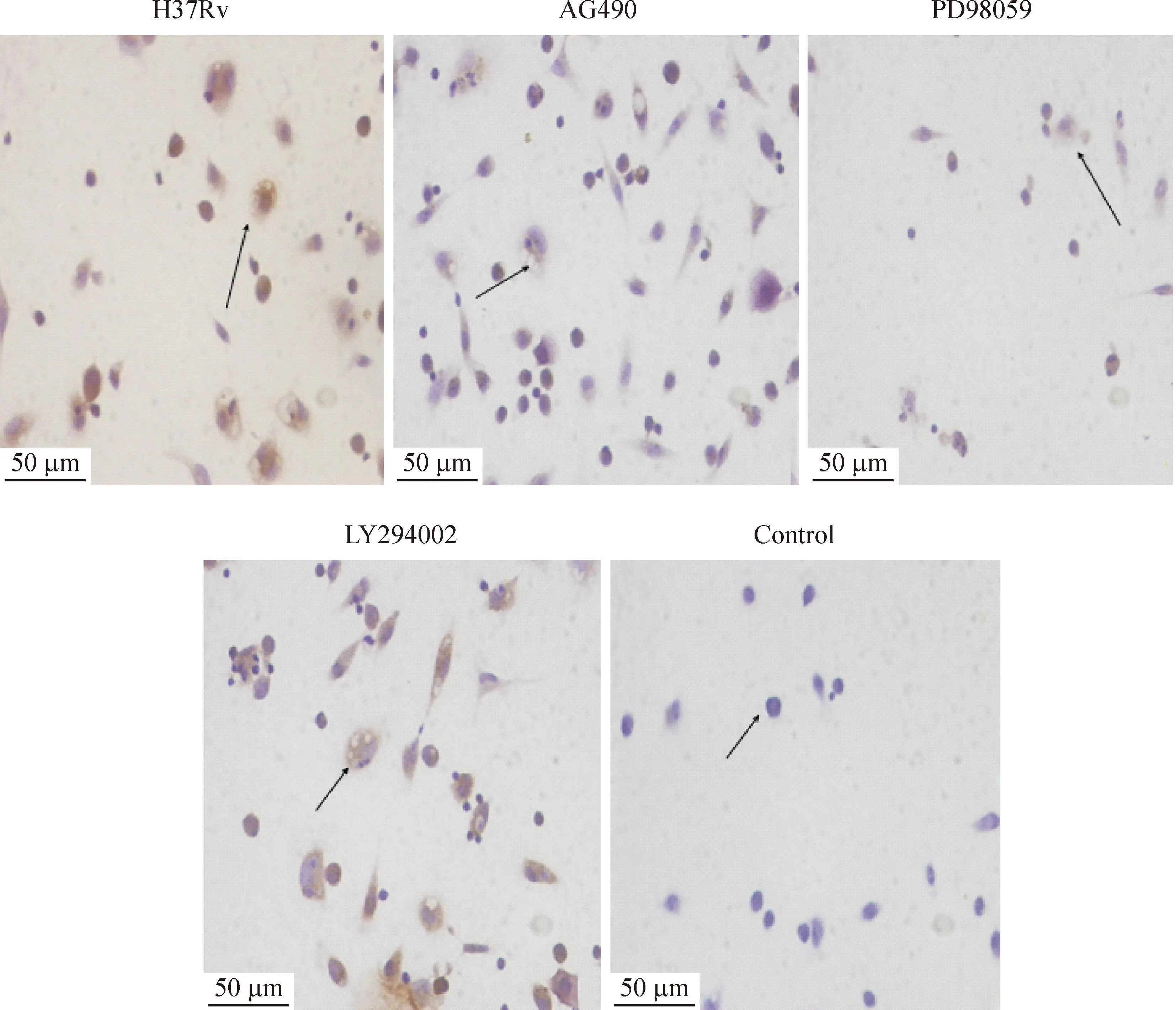
Figure 2.The expression of Mcl-1 in infected macrophages.
图2各组感染巨噬细胞中Mcl-1的表达

Figure 3.The apoptotic rate ofMycobacteriumtuberculosin-infected macrophages detected by flow cytometry.
图3流式细胞术检测感染结核分枝杆菌巨噬细胞的凋亡率
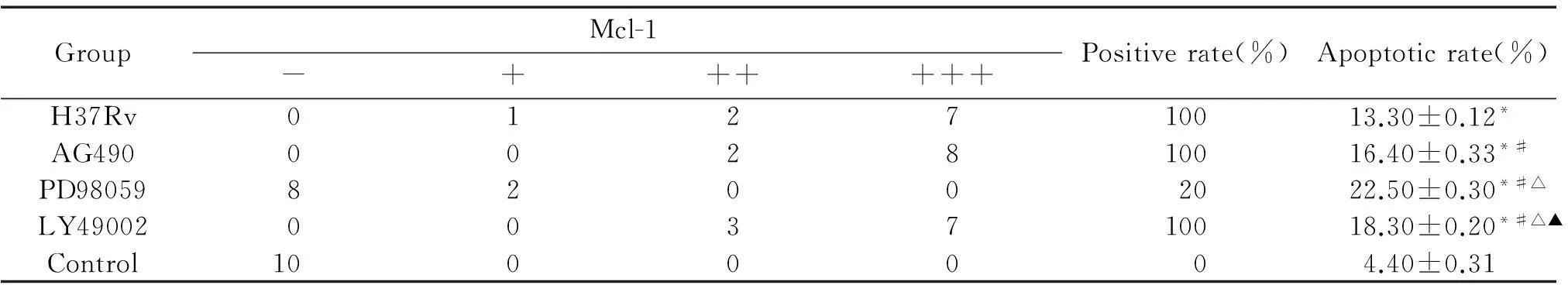
表1 Mcl-1在感染巨噬细胞中的表达和各组感染巨噬细胞的凋亡率
*P<0.05vscontrol;#P<0.05vsH37Rv;△P<0.05vsAG490;▲P<0.05vsPD98059.
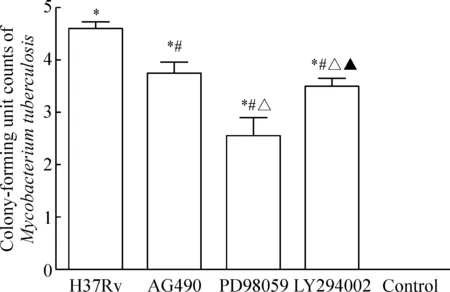
Figure 4.Colony-forming unit counting ofMycobacteriumtuberculosisin the mouse peritoneal macrophages (log10CFU). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsH37Rv group;△P<0.05vsAG490 group;▲P<0.05vsPD98059 group.
图4各组巨噬细胞内结核分枝杆菌菌落计数
另有研究发现Mcl-1在感染的巨噬细胞中高表达,Mcl-1的过表达可以抑制细胞凋亡,在感染的发生发展中具有重要作用[6]。同时,Mcl-1也可参与细胞凋亡和细胞周期的调节及细胞对药物敏感性等[7]。结核分枝杆菌是一种典型的胞内致病菌,结核免疫主要是细胞免疫,结核分枝杆菌侵入机体,既可被巨噬细胞吞噬和杀灭,也可通过多种特殊受体逃避杀伤机制而在巨噬细胞中存活、繁殖。Sly等[8]证实结核分枝杆菌通过上调Mcl-1等抗凋亡基因的表达,抑制或下调巨噬细胞的凋亡。研究发现,结核分枝杆菌H37Rv感染巨噬细胞后,巨噬细胞中Mcl-1的表达水平在感染4 h后开始升高,24 h达到高峰,一直维持到感染的48 h,有文献报道[9]在小鼠感染模型复制成功后第9天巨噬细胞凋亡率最高,9 d之后逐渐降低,为了研究Mcl-1与细胞凋亡率的关系,本实验选在小鼠感染结核分枝杆菌H37Rv的第3天注射信号通路阻断剂,以小鼠感染注射模型的第5天(即感染结核分枝杆菌H37Rv的第9天)作为时间节点,实验发现H37Rv感染组中Mcl-1呈强阳性表达,结核分枝杆菌诱导巨噬细胞凋亡率较低,实验结果证实结核分枝杆菌H37Rv通过上调Mcl-1的表达来抑制巨噬细胞的凋亡。提示Mcl-1过表达可抵抗结核分枝杆菌感染中的巨噬细胞凋亡,导致结核分枝杆菌感染巨噬细胞中的凋亡平衡受到异常调控,巨噬细胞凋亡量减少。
结核分枝杆菌感染宿主细胞后,所涉及的胞内信号转导通路较为肯定的有JAK/STAT、MAPK、PI3K/AKT等。这些信号转导通路的持续激活导致Mcl-1的表达上调,Tsutsui等[10]研究证实在NK/T细胞淋巴瘤细胞株中,AG490通过阻断JAK/STAT信号转导通路抑制STAT3的活化来下调Mcl-1表达,从而促进肿瘤细胞的凋亡,在人巨细胞病毒中,抑制ERK-MAPK 依赖的通路中蛋白的转录,Mc1-1蛋白的水平下调[11],ERK 1/2的特异性抑制剂PD98059常作为MAPK传递途径的生物阻断剂来研究细胞的凋亡,通过抑制MEK的活性来抑制ERK的磷酸化,起到阻断MAPK信号通路的作用[12],Gao等[13]研究发现,在人白血病细胞系中,LY294002可通过抑制AKT的活性来下调Mcl-1蛋白的表达,增加抗肿瘤剂的杀伤力。本研究应用JAK酶抑制剂AG490、MAPK抑制剂PD98059和PI3K蛋白激酶抑制剂LY294002作用于感染H37Rv的小鼠模型,观察结核分枝杆菌H37Rv感染巨噬细胞凋亡中Mcl-1的表达,结果发现AG490处理组和LY294002处理组中的Mcl-1表达水平较感染组无变化,PD98059处理组中Mcl-1的表达水平明显受到抑制,流式细胞技术检测各处理组的巨噬细胞凋亡率,结果显示各组巨噬细胞凋亡率较对照组均升高。结核杆菌菌落数结果显示,H37Rv感染组菌落数较高,各处理组菌落数较H37Rv感染组低,实验结果说明,Mcl-1信号通路阻断剂AG490、PD98059和LY294002可以通过阻断JAK/STAT、MAPK和PI3K信号通路来增加结核分枝杆菌H37Rv感染巨噬细胞凋亡率,从而杀死潜伏其中的结核分枝杆菌。
研究发现,RAS-RAF-MEK-ERK信号通路可导致PI3K/AKT通路的活化[14],巨噬细胞感染结核分枝杆菌后,可能通过激活酪氨酸蛋白激酶、使JAK2/STAT1-α磷酸化,STAT1-α受到活化诱导细胞生成大量TNF-α[15],caspase酶系的活性增强,从而启动凋亡。Caspase酶系对Mcl-1的分解作用可能是Mcl-1表达下调的主要原因,由此推测,AG490、PD98059和LY294002阻断JAK/STAT、MAPK和PI3K信号通路后,TNF-α作用受到抑制,caspase酶系活性降低,Mcl-1表达水平上调,TNF-α受到抑制致使Mcl-1上调的这种作用可能拮抗了信号通路阻断剂所致的Mcl-1下调的作用,导致AG490处理组和LY294002处理组中Mcl-1的表达水平无明显变化,在MAPK信号通路中,TNF-α受p38 MAPK和ERK两条支路调控,实验中,PD98059处理组干扰Mcl-1的作用最明显,巨噬细胞凋亡率最高,这种现象可能是由于ERK支路被阻断后,p38 MAPK通路活化生成大量TNF-α,caspase酶系活性增加,Mcl-1的表达下调。结核杆菌菌落数结果显示,各处理组中PD98059处理组菌落数最低,实验结果说明PD98059通过抑制结核分枝杆菌H37Rv感染巨噬细胞中Mcl-1明显增加巨噬细胞的凋亡从而杀灭结核分枝杆菌,实验结果提示MAPK信号通路在结核分枝杆菌H37Rv感染巨噬细胞中起着重要的作用。
细胞凋亡受多种因子及信号途径的调节,结核的发生发展也是多途径共同作用的结果,在结核分枝杆菌感染中,巨噬细胞的凋亡、结核分枝杆菌的清除是通过 Mcl-1信号通路途径JAK/STAT、MAPK和 PI3K/AKT转导的,我们通过应用信号通路阻断剂AG490、PD98059和LY294002来抑制Mcl-1的表达,结果发现PD98059明显抑制结核分枝杆菌H37Rv感染巨噬细胞中Mcl-1的表达,结核分枝杆菌的清除作用增加,由于多种生存和分化信号参与了Mcl-1表达的调节,JAK/STAT、MAPK、 PI3K/AKT、Mcl-1与其它凋亡调节基因及信号分子之间的相互作用尤其复杂,下一步实验将进一步研究Mcl-1与其它信号通路间的相互作用,希望信号通路阻断剂在结核分枝杆菌H37Rv感染巨噬细胞凋亡中对Mcl-1的抑制作用可以为结核疾病开辟一条新的治疗途径。
[参考文献]
[1]Kodama T, Hikita H, Kawaguchi T, et al. Mc1-1 and Bcl-xL regulate Bak/Bax-dependent apoptosis of the megakaryocytic lineage at multistages[J]. Cell Death Differ, 2012, 19(11):1856-l869.
[2]Thomas LW, Lam C, Edwards SW. Mcl-1; the molecular regulation of protein function[J]. FEBS Lett, 2010, 584(14):2981-2989.
[3]杨威,胡虞乾,杨红杰,等. Mcl-1在肝硬化和肝癌组织中的表达及临床意义[J].华夏医学, 2013, 26(6):1052-1056.
[4]何宗林,杜先智. 活菌H37Ra与灭活菌H37Rv感染小鼠腹腔巨噬细胞的实验研究[J]. 中国免疫学杂志, 2011, 27(8):675-680.
[5]Kohli R, Punia RS, Kaushik R, et al. Relative value of immunohistochemistry in detection of mycobacterial antigen in suspected cases of tuberculosis in tissue sections[J]. Indian J Pathol Microbiol, 2014, 57(4):574-578.
[6]王婵,王新敏,王飞雨,等. Mcl-1短发夹RNA在Raw264.7细胞内特异性的筛选 [J]. 中国免疫学杂志, 2015, 31(2):151-155.
[7]Karami H, Baradaran B, Esfehani A, et al. Down-regulation of Mcl-1 by small interference RNA induces apoptosis and sensitizes HL-60 leukemia cells to etoposide[J]. Asian Pac J Cancer Prev, 2014, 15(2):629-635.
[8]Sly LM, Hingley-Wilson SM, Reiner NE, et al. Survival ofMycobacteriumtuberculosisin host macrophages involves resistance to apoptosis dependent upon induction of antiapoptotic Bcl-2 family member Mcl-1[J].J Immunol, 2003, 170(1):430-437.
[9]董江涛,徐芳,田玺择,等. 不同毒力结核分枝杆菌感染小鼠对肺泡巨噬细胞的凋亡率及其 时相性变化的影响[J]. 中国免疫学杂志, 2012, 28(5):389-392.
[10]Tsutsui M, Yasuda H, Suto H, et al. Frequent STAT3 activation is associated with Mcl-1 expression in nasal NK-cell lymphoma[J]. Int J Lab Hematol, 2010, 32(4):419-426.
[11]Reeve MB, Breidenstein A, Compton T. Human cytomegalovirus activation of ERK and myeloid cell leukemia-1 protein correlates with survival of latently infected cells [J]. Proc Natl Acad Sci U S A, 2012, 109(2):588-593.
[12]Mazzon E, Impellizzeri D, Di paola R, et al. Effects of mitogen-activated protein kinase signaling pathway inhibition on the development of cerulein-induced acute pancreatitis in mice[J]. Pancreas, 2012, 41(4):560-570.
[13]Gao N, Cheng S, BudHraja A, et al. 3, 3’-Diindolylmethane exhibits antileukemic activityinvitroandinvivothrough a Akt-dependent process[J]. PLoS One, 2012, 7(2):1-10.
[14]Yajima I, Kumasaka MY, Thang ND, et al. RAS/RAF/MEK/ERK and PI3K/PTEN/AKT signaling in malignant melanoma progression and therapy[J]. Dermatol Res Pract, 2012, 2012:354191.
[15]Subbian S, O’Brien P, Kushner NL, et al. Molecular immunologic correlates of spontaneous latency in a rabbit model of pulmonary tuberculosis[J]. Cell Commun Signal, 2013, 11(1):16.
(责任编辑: 陈妙玲, 罗森)

▲并列第1作者
