激活Nodal信号通路促进小鼠胚胎干细胞向定型内胚层分化
2016-01-12钟娃,夏忠胜,欧阳慧等
激活Nodal信号通路促进小鼠胚胎干细胞向定型内胚层分化*
钟娃,夏忠胜,欧阳慧,袁宇红,于涛,单体栋,陈其奎△
(中山大学孙逸仙纪念医院消化内科 ,广东 广州 510120)
[摘要]目的: 探讨激活Nodal信号通路在小鼠胚胎干细胞(embryonic stem cells,ESC)向定型内胚层(definitive endoderm,DE)分化中的作用,寻找小鼠ESC向DE分化的最佳培养体系。方法: 根据培养基的不同,实验分为3组:胚胎干细胞组(基础培养+LIF)、自然分化组(基础培养基)和activin A组(基础培养基+50 μg/L activin A)。细胞培养1~7 d, 收集不同作用时点(1、3、5、7 d)的细胞及细胞爬片。用流式细胞术检测CXCR4阳性细胞的比例;免疫细胞化学法检测CXCR4蛋白的表达;Western blot检测OCT4及CXCR4蛋白的表达。结果: 流式细胞术检测结果提示,随着培养时间的延长,CXCR4阳性细胞的比例,胚胎干细胞组在1~7 d无明显变化,自然分化组和activin A组逐渐增高,第5天达高峰(P<0.05),其中activin A组最高(P<0.05)。细胞免疫组化结果显示CXCR4阳性细胞呈棕褐色或棕黄色。Western blot的结果提示,随着培养时间的延长,胚胎干细胞组OCT4和CXCR4蛋白表达无明显变化;自然分化组和activin A组的CXCR4蛋白的表达逐步增高,OCT4蛋白的表达逐步下降,第5天达高峰(P<0.05),其中 activin A组的表达最明显(P<0.05)。结论: 在小鼠ESC分化过程中,在诱导培养的第5天, DE的比例最高。激活Nodal信号通路可以促进小鼠ESC向具有CXCR4分子标志的DE分化,有利于获取更多的DE细胞。
[关键词]Nodal信号通路; 小鼠胚胎干细胞; 定型内胚层; 细胞分化
[中图分类号]Q291; R363[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.024
[文章编号]1000-4718(2015)11-2076-07
[收稿日期]2015-06-10[修回日期] 2015-07-14
[基金项目]*北京市自然科学基金资助项目(No.7152061)
通讯作者△Tel: 010-85231240; E-mail: zhoujunlin@medmail.com.cn
Promoting effects of activated Nodal signal pathway on definitive endoderm induction from mouse embryonic stem cellsZHONG Wa, XIA Zhong-sheng, OU-YANG Hui, YUAN Yu-hong, YU Tao, SHAN Ti-dong, CHEN Qi-kui
(DepartmentofGastroenterology,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China.E-mail:qkchen@21cn.com)
ABSTRACT[]AIM: To study the process of promoting mouse embryonic stem cells (ESC) to specify to definitive endoderm by up-regulating of Nodal signal pathway in order to find the best cultivated systems of differentiation of mouse ESC to definitive endoderm cells. METHODS: The cells were divided into different groups based on the culture medium: ESC group (serum-free medium + LIF), natural differentiation group (serum-free medium) and activin A group (serum-free medium + 50 μg/L activin A). The cells and the sterilized coverslips with cells were collected at 1, 3, 5 and 7 d of the cultivation. The proportion of CXCR4+ cells was detected by flow cytometry. The expression of CXCR4 was determined by immunocytochemical method, and the protein expression of OCT4 and CXCR4 was detected by Western blot. RESULTS: The proportion of CXCR4+ cells showed no dramatic change in ESC group along with the extending of cultivation day, while there were gradually increased in natural differentiation group and activin A group and the highest level was observed at 5 d. Among the 3 groups, the proportion of CXCR4+ cells at 5 d was the highest in activin A group. The brown or tan staining in the cells observed under microscope was considered as positive CXCR4 by immunocytochemistry. The protein levels of OCT4 and CXCR4 in ESC group along with the extending of cultivation days was observed. The expression levels of OCT4 were gradually decreased in the cells in natural differentiation group and activin A group, while those of CXCR4 were gradually increased with the highest level at 5 d. It was highest in the cells in activin A group. CONCLUSION: The proportion of definitive endoderm was the highest at 5 d of the induction during in vitro mouse ESC differentiation. Up-regulation of Nodal signal pathway by adding activin A at the early stage of mouse ESC differentiation promotes mouse ESC to specify to definitive endoderm with CXCR4 molecular marker.
[KEY WORDS]Nodal signal pathways; Mouse embryonic stem cells; Definitive endoderm; cell differentiation
胚胎干细胞(embryonic stem cells,ESC)具有多向分化潜能,可以分化为外胚层、中胚层以及内胚层细胞。其中内胚层在发育过程中逐渐分化为定型内胚层(definitive endoderm,DE)以及脏内胚层(visce-ral endoderm)。DE 随着胚胎的发育,形成原始消化道及与消化道相关的脏器组织,如肝脏、胰腺等等消化器官[1-2]。DE可以作为肝细胞、胰腺细胞及肠道上皮细胞的共同前体细胞群,进行体外定向诱导分化。Kim等[3]研究者以ESC来源的DE为前体细胞,通过BMP-4的诱导和Wnt信号通路的上调,在体外成功地获得肝脏样细胞。因此DE的诱导分化具有重要的作用,它是消化系统器官再生、移植研究的基础。Nodal/activin A 信号在维持干细胞的稳定增殖与胚胎的发育中起着关键的作用[4-5]。Activin A 作为TGF-β 家族的一员,与TGF-β 共同作用于细胞表面的Nodal 信号通路受体,使Nodal/TGF-β信号转导通路激活。细胞信号转导分子SMAD2、 SMAD3被磷酸化后与SMAD4作用,后者转移进入细胞核内,启动下游因子的转录,促进细胞的增殖或分化[6]。本研究探讨激活Nodal信号通路在小鼠ESC向DE分化中的作用,寻找小鼠ESC向DE分化的最佳培养体系,为下一步DE定向诱导分化为消化系统细胞提供尽可能多的种子细胞[7]。
材料和方法
1材料与试剂
DMEM、非必需氨基酸和GlutaMAX(Invitrogen);胎牛血清(Biochrom);重组小鼠白血病抑制因子(leukaemia inhibitory factor,LIF;Millipore); β-巯基乙醇(Gibco); activin A、Wnt3a 和兔抗小鼠单克隆PE-CXCR4抗体 (R&D);小鼠抗小鼠单克隆OCT4抗体和兔抗小鼠单克隆CXCR4 抗体 (Abcam);羊抗兔IgG抗体、兔抗小鼠IgG抗体和兔抗小鼠GAPDH单克隆抗体(CST);S-P超敏试剂盒和DAB显色试剂盒(博士德公司)。流式细胞仪为BD产品。
2细胞培养
小鼠ESC名称为ES-E14TG2a;小鼠品系为129/Ola,购于ATCC。将小鼠ESC在无饲养层细胞中贴壁培养,每天观察并换液, 2~3 d传代1次。将1×105个细胞种于6孔培养板中,如制作细胞爬片则将24 mm×24 mm大小的灭菌盖玻片放置6孔培养板中。放在37 ℃、5% CO2、饱和湿度培养箱内继续培养。
3DE细胞的诱导
根据培养基的不同分为3组:胚胎干细胞组(基础培养基+LIF)、自然分化组(基础培养基)和activin A组(基础培养基+50 μg/L activin A),并培养1、3、5、7 d。
4方法
4.1流式细胞术检测CXCR4阳性细胞的比例0.25% 胰蛋白酶消化、中和、离心后去上清,用PBS 2 mL液重悬细胞,取1.0×106个细胞至流式管,离心、去上清后,PBS 200 μL重悬细胞,该管为空白对照组,从中取30 μL至另一流式管为实验组,在避光情况下,按每1.0×106个细胞的剂量加入10 μL PE标记的抗小鼠CXCR4单克隆抗体至实验组中,室温孵育20 min,PBS洗1次,再用PBS 200 μL重悬细胞,悬液上机测定。由于本次研究使用的CXCR4抗体为PE标记,选择488 nm的激光进行测定。观察在不同培养条件下,第1、3、5、7天 各 组细胞中CXCR4+细胞的表达情况。细胞表面分子的表达分析采用BD流式细胞仪,各象限细胞比例等数据记录采用EXPO32 MultiCOMP v1.1C软件,数据分析采用EXPO32 Analysis v1.2B软件。
4.2免疫细胞化学检测定型内胚层标志CXCR4的表达取出培养板,PBS洗3 遍,4%多聚甲醛室温固定30 min,PBS 洗3次,每次3 min,加正常兔血清封闭液室温封闭20 min,滴加稀释的CXCR4 I抗(1∶50),4 ℃过夜。PBS洗3次,每次3 min,加生物素标记兔抗大鼠IgG,37 ℃ 孵育20 min,PBS 洗3次,每次3 min;滴加试剂SABC,37 ℃孵育20 min,PBS洗4次,每次5 min。使用DAB显色试剂盒显色,蒸馏水洗涤。脱水,透明,封片,显微镜下观察。
4.3Western blot法检测胚胎干细胞干性标志OCT4及定型内胚层标志CXCR4蛋白的表达样品处理:在6孔板的每个孔中加入配置好的RIPA-cocktail混合液50 μL(冰上操作),裂解30 min;4 ℃、14 000 r/min、20 min 离心处理后收集上清即得总蛋白质样品。取定量裂解后的细胞样品100 μL 加入5×蛋白上样缓冲液25 μL,混匀后放在PCR仪上进行98 ℃、15 min使蛋白变性。按照每孔25 μg 蛋白量上样,经SDS-PAGE 后,将蛋白从电泳凝胶中转移到PVDF 膜上;加入5 %脱脂奶粉封闭1 h,用TBST 洗膜3次,每次5 min;然后加OCT4及CXCR4的I抗(1∶1 000),4 ℃摇床慢摇孵育过夜;TBST 缓冲液洗3次,每次5 min,加入II抗(1∶1 000)室温孵育1 h;TBST 缓冲液洗3次,每次10 min,用化学发光剂显影,X 线片曝光。胶片扫描为电子图片后,以β-actin作为内参照,进行各目的条带灰度的半定量分析,条带的灰度分析采用ImageJ软件。实验重复3次。
5统计学处理
采用SPSS 17.0软件,计量资料用均数±标准差(mean±SD)表示,多组间的比较采用单因素方差分析后,各组均数间两两比较采用Bonferroni校正的t检验进行。以P<0.05为差异有统计学意义。
结果
1流式细胞术检测结果
蓝色峰代表对照组,红色峰代表实验组,红色峰右移部分即紫色线表示的部分为CXCR4阳性细胞。在培养第1、3、5和7天,胚胎干细胞组所占比例分别为0.353%±0.050%、0.450%±0.100%、0.673%±0.220% 和0.553%±0.100%;自然分化组为分别1.655%±0.023%、4.207%±2.032%、14.993%±3.000%和5.340%±1.525%; 而activin A组分别为4.310%±1.536%、 6.173%±2.022%、31.860%±3.010%和6.557%±2.502%;同一时点不同组进行两两比较,自然分化组及activin A组CXCR4阳性细胞比例均高于胚胎干细胞组(P<0.05),其中在第5天,activin A组CXCR4阳性细胞的比例最高,自然分化组次之。同组不同时点进行两两比较,胚胎干细胞组各时点CXCR4阳性细胞的比例无显著差异;自然分化组及activin A组CXCR4阳性细胞的比例均在第5天达高峰(P<0.05),见图1、2。
Figure 1.The proportion of CXCR4+cells.
图1CXCR4+细胞的比例
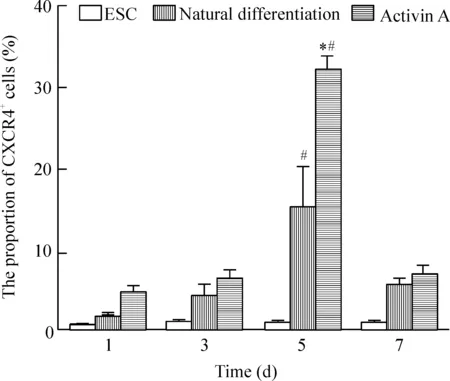
Figure 2.The proportion of CXCR4+cells. Mean±SD.n=3.*P<0.05vs1 d;#P<0.05vsESC group.
图2CXCR4阳性细胞所占比例的柱状图
2细胞免疫化学检测结果
显微镜下观察CXCR4阳性细胞显示棕黄色或者棕褐色,见图3。
3Western blot检测细胞OCT4及CXCR4蛋白的表达
同组不同时点进行两两比较,胚胎干细胞组随培养时间的延长,OCT4及CXCR4蛋白的表达基本不变,差异无统计学意义;自然分化组及activin A组随分化时间的延长,OCT4蛋白的表达逐步下降,CXCR4蛋白的表达逐步增高,与第1天比较差异有统计学意义(P<0.05)。在分化第5天进行3组间两两比较, activin A组的CXCR4蛋白表达最高,OCT4蛋白表达最低,自然分化组次之,组间差异有统计学意义(P<0.05),见图4及表1、2。

Figure 3.The protein expression of CXCR4. The brown or tan staining observed in the cells was considered as positive CXCR4.Scale bar=50 μm.
图3ACXCR4蛋白的表达
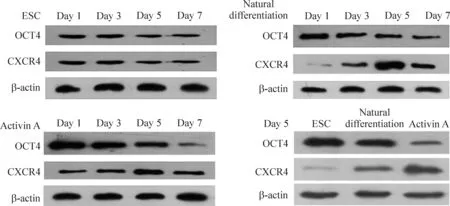
Figure 4.The expression of OCT4 and CXCR4 detected by Western blot.
图4OCT4及CXCR4蛋白表达的Western blot条带分析

表1 OCT4和CXCR4的蛋白条带灰度比值
*P<0.05vsday 1.
表2第5天OCT4和CXCR4的蛋白条带灰度比值
Table 2.The ratio of gray of OCT4 and CXCR4 protein bands on day 5 (Mean±SD.n=3)

GroupOCT4CXCR5ESC1.494±0.1560.218±0.038Naturaldifterentia-tion1.051±0.1200.734±0.088*ActivinA0.356±0.045*#1.276±0.230*#
讨论
ESC 是一种具有强大的多向分化潜能及自我更新能力的多能干细胞,在体内或体外可以分化为成体几乎所有类型的组织细胞。利用ESC 来源的细胞对机体组织进行修复及功能替代治疗,将可能是未来临床上治疗某些不可逆性疾病(如:心功能不全、遗传性疾病、糖尿病、神经元退变及肠上皮难治性损伤等)的新选择[8-10]。然而,ESC 诱导分化的细胞数量有限,不能满足临床治疗疾病的要求,是目前面临的重要问题,优化ESC的定向诱导培养具有重要的意义。
目前较为公认的小鼠定型内胚层标志分子主要有 CXCR4、Sox17、E-cadherin、Tm4sf2和Goose-coid[11-14]。其中,CXCR4 及E-cadherin分别作为趋化因子受体及细胞间连接分子均表达于细胞表面,通过相应的抗体,可以使用流式细胞仪进行测定。尤其是CXCR4,在ESC 分化早期仅表达于定型内胚层,具有较高的特异性。本研究以CXCR4作为标志分子,对ESC来源的DE的分化进行鉴定。在早期的建系中,ESC以小鼠成纤维细胞为滋养细胞,抑制小鼠ESC的分化。但由于饲养层制备繁琐,分泌成分不明,给研究带来诸多不便。后来研究发现,LIF受体存在于小鼠ESC表面,成纤维细胞通过LIF抑制小鼠ESC的分化。因此ESC在添加一定浓度的LIF培养基中培养,即使无滋养层细胞亦可以抑制其分化,使其保持多向分化潜能[15-16]。我们的研究发现, 自然分化组的培养基中去除LIF后,随着培养时间的延长,DE(CXCR4阳性细胞)的比例、CXCR4蛋白的表达逐步增高,在分化第5天达高峰;干性标志OCT4蛋白的表达逐步下降,提示胚胎干细胞出现了自然分化。既往对模型动物的研究结果表明,Nodal/activin A 信号是内胚层发育早期最关键的信号系统[17]。多个研究报道显示,虽然在ESC 体外形成EB 的自然分化过程中可以形成一定比例的DE,但在EB 分化早期(分化后24 h 内)加入Nodal 通路活化因子activin A可以在一定程度上增加DE的分化比例[18]。我们的研究发现,activin A 组加入activin A(50 μg/L)激活Nodal/activin A 信号通路诱导ESC向限定型内胚层的分化,结果显示DE(CXCR4阳性细胞)的比例和CXCR4蛋白的表达较ESC组和自然分化组明显增高,在分化第5天达高峰;OCT4蛋白的表达明显下降,提示激活Nodal/activin A 信号通路可以诱导ESC向DE的分化。这一研究结果与以往的研究结果相似,但以往的研究认为高浓度的activin A(100 μg/L)才能起到这个作用[19]。我们的研究发现, 在小鼠ESC分化早期,采用activin A(50 μg/L)上调Nodal信号通路,同样可以促进DE的分化,建立最佳的培养分化体系。
本研究结果发现,在小鼠ESC分化过程中,在诱导培养的第5天, DE的比例最高。激活Nodal信号通路可以促进小鼠ESC向DE分化,有利于优化ESC的定向诱导培养,获取更多的DE细胞,为ESC向消化系统分化提供基础。
[参考文献]
[1]Lu CC, Brennan J, Robertson EJ. From fertilization to gastrulation: axis formation in the mouse embryo[J]. Curr Opin Genet Dev, 2001, 11(4):384-392.
[2]Robb L, Tam PP. Gastrula organiser and embryonic patterning in the mouse[J]. Semin Cell Dev Biol, 2004, 15(5):543-554.
[3]Kim SE, An SY, Woo DH, et al. Engraftment potential of spheroid-forming hepatic endoderm derived from human embryonic stem cells[J]. Stem Cells Dev, 2013, 22(12):1818-1829.
[4]James D, Levine AJ, Besser D, et al. TGFβ/activin/nodal signaling is necessary for the maintenance of pluripotency in human embryonic stem cells[J]. Development, 2005, 132(6):1273-1282.
[5]Mfopou JK, Chen B, Sui L, et al. Recent advances and prospects in the differentiation of pancreatic cells from human embryonic stem cells[J]. Diabetes, 2010, 59( 9): 2094-2101.
[6]程婷婷,孙莹璞. Nodal信号通路在人胚胎干细胞中的作用机制[J]. 国际生殖健康/ 计划生育杂志, 2014, 33(2):140-143.
[7]Zhu Z, Huangfu D. Human pluripotent stem cells: an emerging model in developmental biology[J]. Development, 2013, 140(4):705-717.
[8]Dai W, Kay GL, Kloner RA. The Therapeutic effect of cell transplantation versus noncellular biomaterial implantation on cardiac structure and function following myocardial infarction[J]. J Cardiovasc Pharmacol Ther, 2014, 19(4):350-357.
[9]Fan X, Sun D, Tang X, et al. Stem-cell challenges in the treatment of Alzheimer’s disease: a long way from bench to bedside[J]. Med Res Rev, 2014, 34(5):957-978.
[10]Szot GL, Yadav M, Lang J, et al. Tolerance induction and reversal of diabetes in mice transplanted with human embryonic Stem Cell-derived pancreatic endoderm[J]. Cell Stem Cell, 2015, 16(2):148-157.
[11]Iwashita H, Shiraki N, Sakano D, et al. Secreted cerbe-rus1 as a marker for quantification of definitive endoderm differentiation of the pluripotent stem cells[J]. PLoS One, 2013, 8(5):e64291.
[12]Ghanbari A, Khazaei M, Hashemi-Tabar M, et al. Sonic hedgehog inhibition induces mouse embryonic stem cells to differentiate toward definitive endoderm[J]. Indian J Exp Biol, 2013, 51(3):201-207.
[13]Kalisz M, Winzi M, Bisgaard HC, et al. EVEN-SKIPPED HOMEOBOX 1 controls human ES cell differentiation by directly repressingGOOSECOIDexpression[J]. Dev Biol, 2012, 362(1):94-103.
[14]Kim PT, Ong CJ. Differentiation of definitive endoderm from mouse embryonic stem cells[J]. Results Probl Cell Differ, 2012, 5(5):303-319.
[15]Williams RL, Hilton DJ, Pease S, et al. Myeloid leukaemia inhibitory factor maintains the developmental potential of embryonic stem cells[J]. Nature, 1988, 336(6200):684-687.
[16]Smith AG, Heath JK, Donaldson DD, et al. Inhibition of pluripotential embryonic stem cell differentiation by purified polypeptides[J]. Nature, 1988, 336(6200):688-690.
[17]Sui L, Bouwens L, Mfopou JK. Signaling pathways during maintenance and definitive endoderm differentiation of embryonic stem cells[J]. Int J Dev Biol, 2013, 57(1):1-12.
[18]Diekmann U, Naujok O, Blasczyk R, et al. Embryonic stem cells of the non-human primate Callithrix jacchus can be differentiated into definitive endoderm by activin-A but not IDE-1/2[J]. J Tissue Eng Regen Med, 2015, 9(4):473-479.
[19]Toivonen S, Lundin K, Balboa D, et al. Activin A and Wnt-dependent specification of human definitive endoderm cells[J]. Exp Cell Res, 2013, 319(17):2535-2544.
(责任编辑: 陈妙玲, 罗森)

