细胞微粒在自身免疫性疾病发病中的作用:一种新的潜在治疗靶标①
2016-01-08廖焕金,兰巧芬,陈秋华等
doi:10.3969/j.issn.1000-484X.2015.11.026
细胞微粒在自身免疫性疾病发病中的作用:一种新的潜在治疗靶标①
廖焕金兰巧芬陈秋华②谢彤②吴平刘华锋③潘庆军③
(广东医学院附属医院临床医学研究中心,湛江 524001)
中图分类号R392
文献标志码码A
文章编号号1000-484X(2015)11-1557-04
①本文受国家自然科学基金(81471530),广东省自然科学基金(S2013010011568),湛江市科技攻关项目(2013B01086)资助。
②广东医学院附属医院风湿免疫科,湛江524001。
③广东医学院附属医院肾脏疾病研究所,湛江524001。
作者简介:廖焕金(1990年-),男,主要从事自身免疫性疾病发病机制研究。
通讯作者及指导教师:谢彤(1967年-),男,主任医师,主要从事风湿免疫性疾病防治研究,E-mail:xtR34@163.com。
刘华锋(1969年-),男,教授,博导,主要从事免疫性肾小球疾病发病机制方面的研究,E-mail:hf-liu@263.net。
潘庆军(1978年-),男,博士,副教授,硕导,主要自身免疫性疾病防治研究,E-mail:stilwapan@gmail.com。
细胞微粒(Microparticles,MPs) 是一类在某些生理或病理状况下,从血管内皮细胞或循环血细胞 出芽脱落的富含磷脂的直径约为0.1~1.0 μm的颗粒,具有生物活性可参与多种免疫性疾病(Immune diseases)的发病[1]。微粒被认为是多功能的亚细胞结构,通过释放生物活性分子和表面抗原与靶细胞的受体相互作用,介导细胞内信号转导,传递分子物质和诱导细胞内信号[2,3]。因此,细胞微粒可能作为自身免疫性疾病新的潜在治疗靶标。
本文谨对细胞微粒在自身免疫性疾病发病中的作用做一综述,以类风湿关节炎(Rheumatic arthritis,RA)和系统性红斑狼疮(Systemic lupus erythematosus,SLE)为例,以期为自身免疫性疾病的防治提供新的策略。
1细胞微粒的生成、信号转导和检测
细胞凋亡和活化是释放微粒的主要机制[4,5]。通过诱导细胞活化或凋亡,使之出芽产生微粒是研究微粒功能的重要手段。在类风湿性关节炎(Rheumatoid arthritis,RA)发病中,抗中性粒细胞胞浆抗体(Anti-neutrophil cytoplasmic antibodies,ANCAs)可诱导细胞因子型中性粒细胞释放微粒[6]。另外,一种广泛使用的蛋白抑制剂即星形孢菌素可以诱导凋亡促进囊泡的形成,然后分离成为微粒[7]。因此,对不同微粒诱导剂的发现,有利于我们进一步探索微粒的形成、释放机制,以及其生物学功能。
微粒其在细胞的信号传导和生物活性分子传递中具有重要的作用。免疫性疾病中,与疾病相关的微粒主要是内皮细胞、免疫细胞、血小板等活化和凋亡产生的[8]。微粒内含有DNA、RNA、蛋白质、补体、生长因子和细胞因子等,而且膜上具有各种前体细胞的表面受体(如CD31、CD40、CD40L、CD4、CD5、CD105等)[1,8,9]。这些微粒可以在外周血中进行广泛的转移,通过释放生物活性物质和表面受体与靶受体相互识别,进而参与免疫性疾病的发病。
微粒的精确分离和检测也尤为重要。微粒的检测方法主要有扫描电子显微镜、流式细胞仪和ELISA等,由于通量高、用时短、操作简单,ELISA和流式细胞仪是目前比较常用的方法[10]。检测原理主要基于微粒携带了前体细胞的一些表面抗原和胞质中的蛋白抗原、DNA、RNA等,因此可通过对微粒表面特异抗原和胞质成分的检测来鉴别和分离微粒[7]。研究发现,还可以用核酸染料来检测微粒内的DNA和RNA确定其来源[11]。虽然可以通过检测表面特异抗原和胞质成分来分离和鉴别微粒,但微粒的检测常常受到其大小和体液中的可溶性分子限制。同时,对于直径小于0.3 μm的微粒体很难分离检测到,而且易受一些主观因素的影响,很难使整个检测过程标准化[10]。
2细胞微粒在RA发病中的作用
RA是一种常见的自身免疫性疾病,其特征以慢性关节炎症为主,易反复发作,最终出现关节畸形甚至不同程度的残疾[12,13]。既往发现免疫异常、遗传背景、环境差异和表观遗传修饰等因素可以使自身抗体的产生增加、促进关节炎症和骨破坏[14],但其发病机制仍未完全解析。近年研究发现,微粒被认为是细胞损伤和活化的分子标志物,也是新的信号传递物质。血小板、内皮细胞和免疫细胞产生的微粒携带的多种胞质成分及表面抗原在RA的免疫应答异常中可能具有重要作用。
十多年前,Knifjj-Dutmer等[1]已证实血中PMPs水平与RA疾病的活动度密切相关,来自临床RA病人活动期和非活动期的血浆PMP高于健康对照组。从而开启了微粒在免疫性疾病发病中的研究热潮。近年研究发现,RA病人血浆和滑膜液中的微粒数量都有所升高[15]。在体外检测发现,从RA病人分离的微粒可以促进内皮细胞活化和损害人的血管内皮细胞及其功能[16]。但目前,在RA中,微粒的种类,微粒主要来源于何种细胞,通过何种途径影响信号传导,对疾病发展的影响尚不明确,有待进一步研究。
在RA的发病中,炎症反应是一个重要环节。众多炎性和免疫细胞(如树突状细胞、T淋巴细胞和单核/巨噬细胞等)与 RA的疾病进展密切相关。已发现体外产生的EMP能够刺激黏附分子的表达,增加单核细胞黏附,促进炎性细胞聚集,诱发炎症反应[17]。除影响单核细胞参与炎症反应外,微粒还能够促进一些炎症因子的表达。已报道,来源于RA或骨关节炎(Osteoarthritis,OA)滑膜液的微粒与成纤维样滑膜细胞共培养时可以诱导生成IL-6、IL-8、MCP-1、RANTES和VEGF[18],微粒增高可使体内C反应蛋白(CRP)的水平增高[19]。此外,TNF-α刺激内皮细胞产生的EMP可以诱导浆细胞样树突状细胞(Plasmacytoid dendritic cells,pDC)成熟,成熟的树突状细胞不仅能够分泌炎性细胞因子如IL-6、IL-8[20],还可以促进T淋巴细胞向Th1分化[21]。Th1细胞分泌的因子(如IFN-γ、IL-2和TNF-α)已被证明可促进RA的发展[14]。
在自身免疫性疾病中,微粒、免疫球蛋白和补体能够形成促进炎症发生的免疫复合物(Immune complexes,ICs)。补体在RA的发病机制中发挥重要作用,有证据表明在人类RA滑膜和RA的动物模型中可以通过经典途径和旁路途径激活补体[22]。并且,已发现在RA病人软骨中含有免疫球蛋白和C3沉积物。而且,在胶原诱导的关节炎和其他RA小鼠模型中,关节炎依赖于补体的级联反应[23]。进一步发现,在RA滑膜液中可检测到细胞来源的微粒与补体形成的复合物。在对RA滑膜液中的微粒进行检测时发现,微粒的大小不同,推测大的微粒是微粒-ICS复合物(MP-ICS),是基于免疫复合物中含有大量来源于血小板及表达CD41的微粒,另外MP-ICS有很高的促炎作用,可引起中性粒细胞白三烯的释放[24]。这些发现表明微粒可以和补体形成免疫复合物并参与RA的发病。据此,我们推测表达自身抗原的血小板微粒与抗体或补体形成的MP-ICS可能是导致炎症持续存在的原因之一。
T细胞介导的免疫反应异常是类风湿关节炎的主要发病机制,如Th1/Th2和Th17/Treg等应答失衡。在RA中,内皮细胞活化后可作为抗原提呈细胞(APC)向T细胞递呈抗原,并表达与淋巴细胞表面配体相互作用的多种分子。研究发现,微粒携带的多种表面分子可能为APC与T细胞间的相互作用创造了条件,参与了T细胞的活化和增殖[25]。进而发现,在RA中,微粒可刺激T细胞活化,诱导产生Th1型细胞因子(IFN-γ和IL-2),提示微粒可通过活化T细胞并产生一系列生物学效应,介导T细胞免疫应答[21]。
B细胞可通过抗原提呈和分泌抗体,在RA适应性免疫应答中发挥重要作用。PMPs通过携带的CD40L可以调节适应性免疫应答的发生。这些微粒可传递活化信号给B细胞,进而分泌更多的IgG,经CD4+T细胞协同作用后,可进一步形成生发中心(Germinal center)[26]。另外,BAFF(B-cell activating factor,BAFF)是肿瘤坏死家族的一员,对B细胞的活化,增殖和抗凋亡至关重要。Messer等[27]在体外研究中发现,从类风湿关节炎和骨关节炎患者的滑膜液中分离的微粒能够诱导类风湿性关节炎成纤维细胞样滑膜细胞(Fibroblast-like synoviocytes,FLS)释放B细胞活化因子(B cell-activating factor,BAFF)、胸腺基质淋巴细胞生成素(Thymic stroma lymphopoietin,TSLP)和分泌性白细胞蛋白酶抑制剂(Secretory eukocyte protease inhibitor,SLPI ),进而影响B细胞增殖活化。因此,微粒可通过影响B细胞的功能参与RA的发病,但具体机制有待深入研究。
综上,在RA中微粒可能通过细胞表面分子和释放胞质的成分,在激活血小板释放炎症介质、B细胞和T细胞活化、介导抗体的生成和激活补体形成免疫复合物等过程中扮演重要角色。此外,研究还发现来源于T细胞和单核细胞的微粒可以诱导滑膜纤维细胞表达基质蛋白酶和产生介质[28],说明微粒可能还会促进RA关节软骨和骨骼的破坏,甚至出现畸形,可能作为一种新的RA的潜在治疗靶标。
3细胞微粒在SLE发病中的作用
SLE是一种慢性自身免疫性炎症疾病,常累及全身多系统、多器官,典型特征为多种自身抗体及免疫复合物的形成,主要病理特征是免疫复合物沉积在组织造成SLE患者的炎症反应[29]。遗传和环境因素相互作用导致的免疫细胞功能紊乱与SLE密切相关。虽然SLE中免疫复合物的作用已经明确,但免疫复合物中核抗原来源还仍不清楚。所以研究微粒在(核)抗原的来源和免疫复合物的形成过程所起作用,将有助于解析SLE的发病机制。
凋亡调节紊乱或吞噬凋亡小体异常是SLE发病机制中的关键环节。研究已发现,自身抗原物质可能来源于凋亡细胞,与凋亡小体的清除异常密切相关。在细胞凋亡分子重组中,RNA和DNA被包装成凋亡小体,小的凋亡小体和微粒容易逃过被吞噬的命运,可以转移到外周血中或与抗体形成免疫复合物沉积在组织,从而影响人的生理活动[30,31]。Radic等[32]研究表明在细胞凋亡时,用共聚焦显微镜和单克隆自身抗体分子重组技术发现凋亡小体含有DNA、组蛋白、组蛋白-DNA复合物和核小体颗粒。进一步发现组蛋白、DNA、RNA和SSB抗原出现在被巨噬细胞吞噬的凋亡小体中[33]。这些研究表明自身抗原物质可能来源于凋亡小体或凋亡产生的微粒。当凋亡调节紊乱或吞噬凋亡小体异常时可诱发SLE。
尽管SLE的发病机制仍不明确,但免疫调节紊乱贯穿整个发病过程,主要以异常B细胞失调产生大量自身抗体、炎症T细胞浸润至靶器官及抗原呈递细胞功能异常为特征。如微粒在RA中的作用中所述,微粒包含相关的自身抗原及内容物能够刺激B和T淋巴细胞产生相应的抗体。一旦诱导产生抗核抗体,就可以通过激活树突状浆细胞产生干扰素等细胞因子,或者和核抗原形成免疫复合物沉积在组织中。
基于,微粒是在细胞死亡和激活时释放含有核分子的质膜囊泡,DNA是微粒的一个重要组成部分,在血液中的DNA存在游离和颗粒两种形式。因此在SLE中,微粒可作为抗DNA抗体和抗核小体抗体的靶抗原,与血液中的抗核抗体形成免疫复合物沉积在组织中。研究发现,位于肾脏中的这些复合物包含IgM,IgG,IgA和补体,能够导致狼疮肾炎(Lupus nephritis,LN)的发生[34]。Ullal等[35]研究发现SLE患者血液中,IgG阳性的微粒水平增加时,总微粒数量也会有所增加。在人类SLE和小鼠模型中研究IgG阳性的微粒数量和抗DNA水平之间的关系时也提示微粒是免疫复合物的重要来源。Nielsen等研究表明未结合细胞源性微粒的膜联蛋白V的水平与SLE的疾病活动度、肾炎活动度、高血压、动脉血栓形成病史和甘油酸水平有关[36]。进一步发现,除在RA血清中IgM阳性的微粒外,SLE病人血细胞来源的微粒与正常对照组、RA病人组和系统性硬化症相比,IgG、IgM和C1q阳性的微粒水平升都有所上升[37]。所以IgG阳性的微粒与典型狼疮抗体密切相关(抗-dsDNA,抗-ENA和抗-组蛋白等)。在检测NZB/NZWF1狼疮小鼠的抗DNA抗体与THP-1和Jurkat凋亡细胞产生微粒的结合试验中发现,只有某些确定的抗DNA抗体能结合微粒,特别是结合双链DNA[38]。
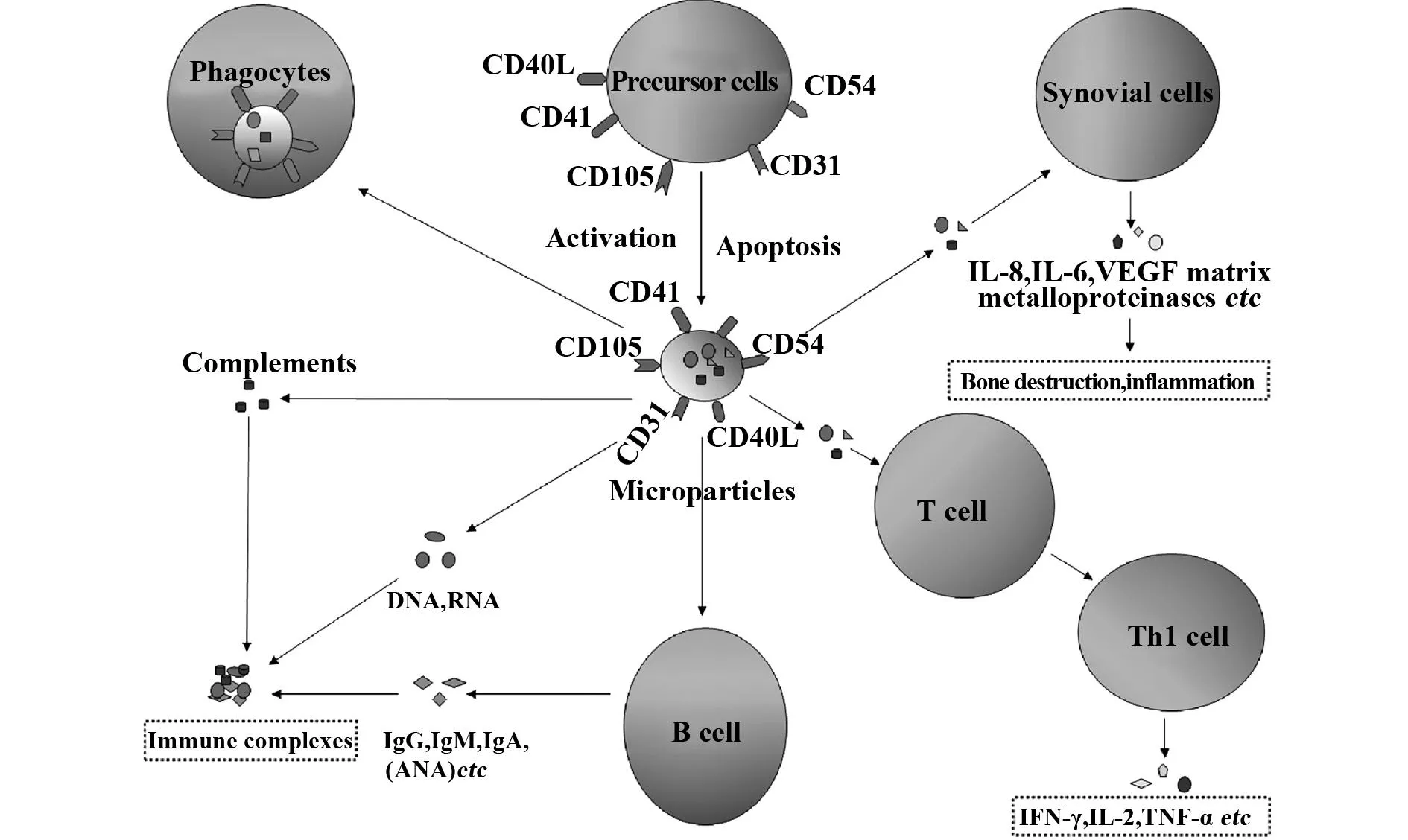
图1 细胞微粒参与自身免疫性疾病发病的假说Fig.1 A hypothesis of function of microparticles in development of autoimmune diseases
综上,特定微粒的数量可能与SLE的疾病活动度密切相关,并提示微粒是免疫复合物的一个重要来源,可能作为一种新的SLE的潜在治疗靶标。
5结论
细胞微粒在自身免疫性疾病的发病中是具有功能多样化的亚细胞结构,被认为是细胞损伤和活化的标志物,也是新的信号传导物质。在RA中,这些微粒携带促炎物质可引起滑膜炎,也可活化淋巴细胞,介导抗体的产生。在SLE中,微粒在信号传导和免疫复合物的形成中扮演重要角色,可作为自身抗原的载体并启动和维持自身抗体的产生。因此,细胞微粒有望作为自身免疫性疾病新的潜在治疗靶标。
参考文献:
[1]Knijff-Dutmer EA,Koerts J,Nieuwland R,etal.Elevated levels of platelet microparticles are associated with disease activity in rheumatoid arthritis[J].Arthritis Rheum,2002,46(6):1498-1503.
[2]Mack M,Kleinschmidt A,Bruhl H,etal.Transfer of the chemokine receptor CCR5 between cells by membrane-derived microparticles:a mechanism for cellular human immunodeficiency virus 1 infection[J].Nat Med,2000,6(7):769-775.
[3]Rozmyslowicz T,Majka M,Kijowski J,etal.Platelet-and megakaryocyte-derived microparticles transfer CXCR4 receptor to CXCR4-null cells and make them susceptible to infection by X4-HIV[J].AIDS, 2003,17(1):33-42.
[4]Sebbagh M,Renvoize C,Hamelin J,etal.Caspase-3-mediated cleavage of ROCK I induces MLC phosphorylation and apoptotic membrane blebbing[J].Nat Cell Biol,2001,3(4):346-352.
[5]Daleke DL.Regulation of transbilayer plasma membrane phospholipid asymmetry[J].J Lipid Res,2003,44(2):233-242.
[6]Hong Y,Eleftheriou D,Hussain AA,etal.Anti-neutrophil cytoplasmic antibodies stimulate release of neutrophil microparticles[J].J Am Soc Nephrol,2012,23(1):49-62.
[7]Reich CR,Pisetsky DS.The content of DNA and RNA in microparticles released by Jurkat and HL-60 cells undergoing in vitro apoptosis[J].Exp Cell Res,2009,315(5):760-768.
[8]Berckmans RJ,Nieuwland R,Tak PP,etal.Cell-derived microparticles in synovial fluid from inflamed arthritic joints support coagulation exclusively via a factor VII-dependent mechanism[J].Arthritis Rheum,2002,46(11):2857-2866.
[9]Pisetsky DS,Gauley J,Ullal AJ.Microparticles as a source of extracellular DNA[J].Immunol Res,2011,49(1-3):227-234.
[10]Lacroix R,Robert S,Poncelet P,etal.Overcoming limitations of microparticle measurement by flow cytometry[J].Semin Thromb Hemost,2010,36(8):807-818.
[11]Ullal AJ,Pisetsky DS,Reich CR.Use of SYTO 13,a fluorescent dye binding nucleic acids,for the detection of microparticles in in vitro systems[J].Cytometry A,2010,77(3):294-301.
[12]Seri Y,Shoda H,Matsumoto I,etal.Peptidylarginine deiminase type4 (PADI4) role in immune system〗[J].Nihon Rinsho Meneki Gakkai Kaishi,2014,37(3):154-159.
[13]Ishikawa LL,Colavite PM,Da RL,etal.Commercial bovine proteoglycan is highly arthritogenic and can be used as an alternative antigen source for PGIA model[J].Biomed Res Int,2014,2014:148-594.
[14]Schulze-Koops H,Kalden JR.The balance of Th1/Th2 cytokines in rheumatoid arthritis[J].Best Pract Res Clin Rheumatol,2001,15(5):677-691.
[15]Vinuela-Berni V,Doniz-Padilla L,Figueroa-Vega N,etal.Proportions of several types of plasma and urine microparticles are increased in patients with rheumatoid arthritis with active disease[J].Clin Exp Immunol,2015,180(3):442-451.
[16]Rodriguez-Carrio J,Alperi-Lopez M,Lopez P,etal.Altered profile of circulating microparticles in rheumatoid arthritis patients[J].Clin Sci (Lond),2015,128(7):437-448.
[17]Jansen F,Yang X,Franklin BS,etal.High glucose condition increases NADPH oxidase activity in endothelial microparticles that promote vascular inflammation[J].Cardiovasc Res,2013,98(1):94-106.
[18]Berckmans RJ,Nieuwland R,Kraan MC,etal.Synovial microparticles from arthritic patients modulate chemokine and cytokine release by synoviocytes[J].Arthritis Res Ther,2005,7(3):R536-R544.
[19]Cui Y,Zheng L,Jiang M,etal.Circulating microparticles in patients with coronary heart disease and its correlation with interleukin-6 and C-reactive protein[J].Mol Biol Rep,2013,40(11):6437-6442.
[20]Angelot F,Seilles E,Biichle S,etal.Endothelial cell-derived microparticles induce plasmacytoid dendritic cell maturation:potential implications in inflammatory diseases[J].Haematologica,2009,94(11):1502-1512.
[21]刘长营,孙奕.内皮细胞微粒诱导T细胞活化并产生Th1型细胞因子[J].检验医学,2014,29(4):357-362.
[22]Okroj M,Heinegard D,Holmdahl R,etal.Rheumatoid arthritis and the complement system[J].Ann Med,2007,39(7):517-530.
[23]Williams AS,Mizuno M,Richards PJ,etal.Deletion of the gene encoding CD59a in mice increases disease severity in a murine model of rheumatoid arthritis[J].Arthritis Rheum,2004,50(9):3035-3044.
[24]Cloutier N,Tan S,Boudreau LH,etal.The exposure of autoantigens by microparticles underlies the formation of potent inflammatory components:the microparticle-associated immune complexes[J].EMBO Mol Med,2013,5(2):235-249.
[25]Vincent-Schneider H,Stumptner-Cuvelette P,Lankar D,etal.Exosomes bearing HLA-DR1 molecules need dendritic cells to efficiently stimulate specific T cells[J].Int Immunol,2002,14(7):713-722.
[26]Sprague DL,Elzey BD,Crist SA,etal.Platelet-mediated modulation of adaptive immunity:unique delivery of CD154 signal by platelet-derived membrane vesicles[J].Blood,2008,111(10):5028-5036.
[27]Messer L,Alsaleh G,Freyssinet JM,etal.Microparticle-induced release of B-lymphocyte regulators by rheumatoid synoviocytes[J].Arthritis Res Ther,2009,11(2):R40.
[28]Distler JH,Jungel A,Huber LC,etal.The induction of matrix metalloproteinase and cytokine expression in synovial fibroblasts stimulated with immune cell microparticles[J].Proc Natl Acad Sci USA,2005,102(8):2892-2897.
[29]Kyogoku C,Tsuchiya N.A compass that points to lupus:genetic studies on type I interferon pathway[J].Genes Immun,2007,8(6):445-455.
[30]Halicka HD,Bedner E,Darzynkiewicz Z.Segregation of RNA and separate packaging of DNA and RNA in apoptotic bodies during apoptosis[J].Exp Cell Res,2000,260(2):248-256.
[31]Hasselmann DO,Rappl G,Tilgen W,etal.Extracellular tyrosinase mRNA within apoptotic bodies is protected from degradation in human serum[J].Clin Chem,2001,47(8):1488-1489.
[32]Radic M,Marion T,Monestier M.Nucleosomes are exposed at the cell surface in apoptosis[J].J Immunol,2004,172(11):6692-6700.
[33]Schiller M,Bekeredjian-Ding I,Heyder P,etal.Autoantigens are translocated into small apoptotic bodies during early stages of apoptosis[J].Cell Death Differ,2008,15(1):183-191.
[34]Tsokos GC.Systemic lupus erythematosus[J].N Engl J Med,2011,365(22):2110-2121.
[35]Ullal AJ,Reich CR,Clowse M,etal.Microparticles as antigenic targets of antibodies to DNA and nucleosomes in systemic lupus erythematosus[J].J Autoimmun,2011,36(3-4):173-180.
[36]Nielsen CT,Ostergaard O,Johnsen C,etal.Distinct features of circulating microparticles and their relationship to clinical manifestations in systemic lupus erythematosus[J].Arthritis Rheum,2011,63(10):3067-3077.
[37]Nielsen CT,Ostergaard O,Stener L,etal.Increased IgG on cell-derived plasma microparticles in systemic lupus erythematosus is associated with autoantibodies and complement activation[J].Arthritis Rheum,2012,64(4):1227-1236.
[38]Ullal AJ,Marion TN,Pisetsky DS.The role of antigen specificity in the binding of murine monoclonal anti-DNA antibodies to microparticles from apoptotic cells[J].Clin Immunol,2014,154(2):178-187.
[收稿2015-03-20修回2015-04-13]
(编辑许四平)
