人参皂苷Rh2通过激活Gsk-3β削弱β-catenin在肝癌HepG2细胞中的作用①
2016-01-08石庆强左国伟冯子强赵绿翠游智梅李丹阳陈地龙
石庆强 左国伟 冯子强 赵绿翠 罗 念 游智梅 夏 菁 李丹阳 李 静 陈地龙
(重庆北部新区第一人民医院急诊科,重庆401121)
①本文为国家自然科学基金(31271368)和重庆市教委基金(KJ110308)。
②重庆医科大学临床检验诊断学省部共建教育部重点实验室,重庆400016。
③重庆医科大学,组织学与胚胎学教研室,干细胞与组织工程研究室,重庆400016。
陈地龙(1971年-),男,博士,研究员,硕士生导师,主要从事中药对肿瘤的抑制作用方面的研究,E-mail: chendilong@21cn.com。
[摘 要] 目的:研究人参皂苷Rh2对HepG2细胞的作用机制。方法:用pLOV-EF1a-MCS-3FLAG-β-catenin慢病毒感染HepG2细胞,运用荧光显微镜观察细胞荧光强度变化。通过CCK-8法检测细胞增殖反应。采用FCM检测细胞周期及凋亡变化;利用ELISA法检测细胞产生Gsk-3β活性;用PCR法检测细胞Gsk-3β、β-catenin、Bcl2、CyclinD1、Bax、MMP3基因的表达;用CHIP法检测细胞Bcl2、CyclinD1、Bax、MMP3基因的表达;运用Western blot法检测细胞Gsk-3β、β-catenin、Bcl2、CyclinD1、Bax、MMP3蛋白的表达。结果:用pLOV-EF1a-MCS-3FLAG-β-catenin慢病毒感染HepG2细胞,被感染的HepG2细胞命名为HepG2-β-catenin;CCK-8分析结果显示,加药组给予(10~160 μmol/L)Rh2后HepG2及HepG2-β-catenin细胞的增殖受到抑制,且Rh2对肝癌HepG2-β-catenin和HepG2细胞的生长抑制呈剂量和时间依赖。在HepG2细胞中48、72 h 半数抑制率分别为100 μmol/L,58.12 μmol/L,在HepG2-β-catenin细胞中48、72 h半数抑制率分别是129.2 μmol/L,83.33 μmol/L,故Rh2作用于HepG2-β-catenin细胞浓度均高于HepG2细胞,与HepG2细胞组比较差异具有统计学意义(P<0.01)。FCM检测结果显示,Rh2可诱导HepG2和HepG2-β-catenin细胞周期阻滞在G0/G1期,HepG2+ Rh2组G0/G1期(64.57±0.65),而HepG2-β-catenin+ Rh2组G0/G1期(58.61±2.01);FCM检测结果显示,Rh2可诱导HepG2和HepG2-β-catenin细胞早期凋亡,HepG2+ Rh2组凋亡率(17.27±2.77),而HepG2-β-catenin+ Rh2组凋亡率(9.02±1.76)。ELISA结果显示,Rh2作用HepG2细胞12、24、48、72 h后,Gsk-3β的活性随着作用时间延长,逐渐升高,在48 h最高,随后其活性开始降低。Rh2诱导HepG2和HepG2-β-catenin细胞48 h,与对照组相比,Gsk-3β的活性均增高,而加入Bio后其活性降低,HepG2+ Rh和HepG2-β-catenin+ Rh2组间无明显差异;PCR、CHIP、WB结果显示,人参皂苷Rh2诱导HepG2和HepG2-β-catenin细胞后,Gsk-3β、Bax基因及蛋白表达增加,而β-catenin、CyclinD1、Bcl2、MMP3基因及蛋白表达水平下调。与HepG2-β-catenin+Rh2组相比,HepG2+Rh2组除Gsk-3β外各基因及蛋白的表达变化更为显著。结论:过表达β-catenin可削弱人参皂苷Rh2对肝癌HepG2细胞的药理作用。人参皂苷Rh2通过激活Gsk-3β降解β-catenin,影响下游基因的表达,促进肝癌细胞的凋亡及抑制其转移。
[关键词] 人参皂苷Rh2;HepG2;Gsk-3β;β-catenin
doi:10.3969/j.issn.1000-484X.2015.11.008
·中医中药与免疫·
人参皂苷Rh2通过激活Gsk-3β削弱β-catenin在肝癌HepG2细胞中的作用①
石庆强左国伟②冯子强③赵绿翠③罗念③游智梅③夏菁③李丹阳③李静③陈地龙③
(重庆北部新区第一人民医院急诊科,重庆401121)
①本文为国家自然科学基金(31271368)和重庆市教委基金(KJ110308)。
②重庆医科大学临床检验诊断学省部共建教育部重点实验室,重庆400016。
③重庆医科大学,组织学与胚胎学教研室,干细胞与组织工程研究室,重庆400016。
陈地龙(1971年-),男,博士,研究员,硕士生导师,主要从事中药对肿瘤的抑制作用方面的研究,E-mail: chendilong@21cn.com。
[摘要]目的:研究人参皂苷Rh2对HepG2细胞的作用机制。方法:用pLOV-EF1a-MCS-3FLAG-β-catenin慢病毒感染HepG2细胞,运用荧光显微镜观察细胞荧光强度变化。通过CCK-8法检测细胞增殖反应。采用FCM检测细胞周期及凋亡变化;利用ELISA法检测细胞产生Gsk-3β活性;用PCR法检测细胞Gsk-3β、β-catenin、Bcl2、CyclinD1、Bax、MMP3基因的表达;用CHIP法检测细胞Bcl2、CyclinD1、Bax、MMP3基因的表达;运用Western blot法检测细胞Gsk-3β、β-catenin、Bcl2、CyclinD1、Bax、MMP3蛋白的表达。结果:用pLOV-EF1a-MCS-3FLAG-β-catenin慢病毒感染HepG2细胞,被感染的HepG2细胞命名为HepG2-β-catenin;CCK-8分析结果显示,加药组给予(10~160 μmol/L)Rh2后HepG2及HepG2-β-catenin细胞的增殖受到抑制,且Rh2对肝癌HepG2-β-catenin和HepG2细胞的生长抑制呈剂量和时间依赖。在HepG2细胞中48、72 h 半数抑制率分别为100 μmol/L,58.12 μmol/L,在HepG2-β-catenin细胞中48、72 h半数抑制率分别是129.2 μmol/L,83.33 μmol/L,故Rh2作用于HepG2-β-catenin细胞浓度均高于HepG2细胞,与HepG2细胞组比较差异具有统计学意义(P<0.01)。FCM检测结果显示,Rh2可诱导HepG2和HepG2-β-catenin细胞周期阻滞在G0/G1期,HepG2+ Rh2组G0/G1期(64.57±0.65),而HepG2-β-catenin+ Rh2组G0/G1期(58.61±2.01);FCM检测结果显示,Rh2可诱导HepG2和HepG2-β-catenin细胞早期凋亡,HepG2+ Rh2组凋亡率(17.27±2.77),而HepG2-β-catenin+ Rh2组凋亡率(9.02±1.76)。ELISA结果显示,Rh2作用HepG2细胞12、24、48、72 h后,Gsk-3β的活性随着作用时间延长,逐渐升高,在48 h最高,随后其活性开始降低。Rh2诱导HepG2和HepG2-β-catenin细胞48 h,与对照组相比,Gsk-3β的活性均增高,而加入Bio后其活性降低,HepG2+ Rh和HepG2-β-catenin+ Rh2组间无明显差异;PCR、CHIP、WB结果显示,人参皂苷Rh2诱导HepG2和HepG2-β-catenin细胞后,Gsk-3β、Bax基因及蛋白表达增加,而β-catenin、CyclinD1、Bcl2、MMP3基因及蛋白表达水平下调。与HepG2-β-catenin+Rh2组相比,HepG2+Rh2组除Gsk-3β外各基因及蛋白的表达变化更为显著。结论:过表达β-catenin可削弱人参皂苷Rh2对肝癌HepG2细胞的药理作用。人参皂苷Rh2通过激活Gsk-3β降解β-catenin,影响下游基因的表达,促进肝癌细胞的凋亡及抑制其转移。
[关键词]人参皂苷Rh2;HepG2;Gsk-3β;β-catenin
doi:10.3969/j.issn.1000-484X.2015.11.008
中图分类号R735.7
文献标志码码A
文章编号号1000-484X(2015)11-1476-10
作者简介:石庆强(1986年-),男,医师,主要从事人参对肿瘤的抑制作用方法的研究,同时就职于重庆医科大学,组织学与胚胎学教研室,干细胞与组织工程研究室,E-mail:569770664@qq.com。
通讯作者及指导教师:李静(1972年-),女,博士,副教授,硕士生导师,主要从事中药对肿瘤的抑制作用方面的研究,E-mail: lijingyangyang@126.com.cn。
[Abstract]Objective:To investigate the inhibitory effect of Rh2 on HepG2 cells and explore the underlying mechanism.Methods: We used lentivirus carrying β-catenin to infect HepG2 cell,and detected expression of β-catenin using fluorescence microscopy.The effect of Rh2 on proliferation of HepG2-β-catenin and HepG2 cells was measured by CKK-8 assay,and flow cytometry was used to detect cell cycle and apoptosis.The activity of Gsk-3β was checked by ELISA kit.The expression of Gsk-3β,β-catenin,Bax,Bcl2,CyclinD1,MMP3 genes were measured by qRT-PCR.In order to checked the relationship between β-catenin and TCF4,CHIP assay kit was used,the expression of Bax,Bcl2,CyclinD1,MMP3 genes were measured by PCR.The expressions of Gsk-3β,β-catenin,Bax,Bcl2,CyclinD1,MMP3 proteins were examined by Western blot.Results: HepG2 cells were successfully infected by pLOV-EF1a-MCS-3FLAG-β-catenin lentivirus,named HepG2-β-catenin.CCK-8 showed that ginsenoside Rh2 could effectively inhibit the proliferation of HepG2 and HepG2-β-catenin cells in vitro,which exhibits a dose-dependent manner at range of 10-160 μmol/L Rh2.The IC50 of Rh2 exposure on HepG2 cell for 48,72 h were 100 μmol/L and 58.12 μmol/L,but the IC50 of Rh2 exposure on HepG2-β-catenin for 48,72 h were 129.2 μmol/L,83.33 μmol/L,respectively. The IC50 of Rh2 exposure on HepG2-β-catenin cell was higher than HepG2 cell,compared with HepG2 group the differences was statistically significant(P< 0.01).Flow cytometry indicated that Rh2 could arrest HepG2 and HepG2-β-catenin cells in G0/G1 phase;the cell population in G0/G1 phase of HepG2+Rh2 group was(64.57±0.65)%,HepG2-β-catenin+Rh2 group was(58.61±2.01)%.Flow cytometry indicated that Rh2 could induced early apoptosis in HepG2 and HepG2-β-catenin cells.The apoptosis rate of HepG2 + Rh2 group was (17.27 ± 2.77)%,HepG2-β-catenin + Rh2 group(9.02 ± 1.76)%.The ELISA results indicated that HepG2 cells was induced by Rh2 for 12,24,48,72 h,the activity of Gsk-3β gradually increased,peak in 48 h,then decreased.Compared with control group,Rh2 induced HepG2 and HepG2-β-catenin cells for 48 hours,Gsk-3β activity were increased,and their activity reduced after adding Bio,there were no significant differences between HepG2+Rh2 and HepG2-β-catenin+Rh2 groups.The PCR,CHIP and WB results showed that the expression of Gsk-3β,Bax gene and proteins increased,while the β-catenin,CyclinD1,Bcl2,MMP3 gene and proteins down-regulation in HepG2 and HepG2-β-catenin cell induced by Rh2.Compared with HepG2-β-catenin + Rh2 group,the expression of other gene and proteins changed significantly,however,Gsk-3β was no significant difference.Conclusion: Over-expression of β-catenin may weaken the pharmacological effects of ginsenoside Rh2 on HepG2 cells.The activity of Gsk-3β was increased by ginsenoside Rh2 to degrade β-catenin,affecting the expression of downstream genes,promoting apoptosis of liver cancer cells and inhibiting metastasis.
Rh2 weaken effects of β-catenin on HepG2 hepatocellular carcinoma through activating Gsk-3β
SHIQing-Qiang,ZUOGuo-Wei,FENGZi-Qiang,ZHAOLÜ-Cui,LUONian,YOUZhi-Mei,XIAJing,LIDan-Yang,LIJing,CHENDi-Long.EmergencyDepartmentofFirstPeople′sHospitalofChongqingNewNorthZone,Chongqing401121,China
[Key words]Rh2;HepG2,Gsk-3β;β-catenin
肝癌(Hepatocellular carcinoma,HCC)是世界上最常见的恶性肿瘤之一,易于肝内转移及向肺、骨、肾、脑转移[1,2]。在中国有十分之一的人携带肝炎病毒,肝炎病毒是致癌的高危因素,而肝癌的发病率正在逐年增加[3,4]。尽管在诊断和治疗取得很大进步,但肝癌仍是癌症相关死亡的全球第三大原因。对广大肝癌患者来说,手术切除是最有效的治疗方法,但5年生存率<12%[5]。随着介入治疗的发展,使化疗药物可以直接作用于肝癌细胞,部分患者的寿命得以延长[6-8]。然而,有的肝癌患者对化疗不敏感,容易产生耐药。对于这部分患者来说,目前缺乏有效的治疗方法。因此,寻求有效的药物来提高治疗效果成为研究焦点。
越来越多的研究显示,治疗肝癌时人参成为备选药物之一,人参的预防和抗癌作用通过损伤DNA、诱导细胞凋亡、抑制细胞增殖及免疫调节发挥作用[9-12]。研究证明用人参皂苷Rh2诱导SMMC-7721细胞后,可使细胞周期阻滞在G0/G1期,并减少S期和G2/M期的细胞比例。此外,人参皂苷Rh2可下调正性调控因子(CyclinD1、CyclinE)的表达,并上调负性调控因子(P16、P21基因)的表达[13]。有研究报道,人参皂甙Rh2可诱导胰腺癌细胞、肝癌细胞和A549肺癌细胞的凋亡。
Wnt信号通路的异常激活同多种恶性肿瘤如结、直肠癌,肝癌,乳腺癌,前列腺癌等发生发展有关[14]。β-catenin作为Wnt通路中重要的信号传递因子参与调节细胞的生长和增殖。研究发现,肝癌细胞中β-catenin蛋白的表达水平显著高于癌旁组织,同时,β-catenin对抗癌药物有抵抗作用。β-catenin在正常组织及癌组织中,其稳定性依赖于由Axin、APC 和 GSK-3β构成的降解复合物,主要由GSK-3β调节β-catenin在细胞内的表达水平。在无Wnt刺激下,GSK-3β作用于Axin、APC和β-catenin蛋白组成的复合物并磷酸化β-catenin,被磷酸化的β-catenin可以蛋白酶体的方式迅速降解[15];在Wnt的刺激下,GSK-3β向细胞膜转移并与Dishevelled和LRP-5受体结合从而阻止GSK3β对β-catenin的磷酸化,其结果是β-catenin逃脱了蛋白酶体的降解,从而在胞浆累积并向胞核移位。聚集在核内的β-catenin与转录因子如LEF/TCF相互作用,启动下游靶基因的转录,如c-Myc、CyclinD1、c-jun/fra-1、uPAR、PPARδ、MMP-3、WISP等[16]。上述基因的激活会导致细胞增殖加速和向远处转移的能力增强,故GSK-3β可作为一个潜在的抗癌靶点。
糖原合酶激酶-3(Glycogen synthase kinase 3,GSK-3)是一种广泛表达的丝氨酸/苏氨酸激酶,在1970年被发现,是参与糖原代谢的关键酶。GSK-3由 433个氨基酸残基组成,在哺乳动物体内含有GSK-3α和 GSK-3β两种亚型,二者有类似的立体结构和底物,但其功能有所不同,其广泛存在于各种细胞中,除了其在糖原代谢中的作用,GSK-3β作为一个下游调节开关,参与多种信号转导通路调节,在胚胎发育、细胞分化、肿瘤形成等多方面发挥重要作用[17]。Tsuchiya等[18]在结肠癌细胞中发现,GSK-3β可通过降解β-catenin来抑制结肠癌细胞的生长。此外,在实体肿瘤的化疗时,影响化疗药物的敏感性和耐药性与GSK-3β活性相关。研究发现,肝癌细胞中GSK-3β蛋白的表达水平显著低于正常肝组织及癌旁组织,而且低表达的GSK-3β临床病理特征预示着预后不良[19]。我们实验室研究发现,TSPG和Rh2可抑制KG1α细胞增殖而诱导细胞凋亡,经TSPG和Rh2作用后,KG1α细胞胞核中的β-catenin蛋白明显减少,其表达区域由胞核向胞膜转移。在肝癌细胞中Rh2是否有类似的作用?而过表达β-catenin是否可以削弱Rh2这一药理作用呢?Rh2使KG1α细胞胞核中的β-catenin蛋白减少,这与GSK-3β是否有关?
因此,我们假设Rh2抗癌的作用可能是激活了GSK-3β的活性从而降解β-catenin。我们首先检测Rh2对HepG2细胞的药理作用,然后构建了过表达β-catenin的慢病毒质粒感染HepG2细胞,检验过表达β-catenin能否削弱Rh2对HepG2细胞的药理作用;再用GSK-3β抑制剂Bio[(2′Z,3′E)-6-Bromoindirubin-3′-oxime,糖原合酶激酶-3β抑制剂]来验证Rh2是否激活了GSK-3β;用PCR、CHIP、WB检测β-catenin下游基因的变化,进一步证实Rh2对HepG2细胞的药理作用可能是通过激活了GSK-3β的活性从而降解β-catenin来实现的。
1材料与方法
1.1材料人参皂苷 Rh2 购于标准物质网,纯度99%;Bio购于Sigma,人肝癌细胞 HepG2株,由左国伟教授提供,pLOV-EF1a-MCS-3FLAG质粒(re-expression β-catenin慢病毒质粒及空质粒)及293T慢病毒包装细胞由上海纽恩生物科技公司提供,DMEM-F12培养基、胎牛血清、0.25%胰酶、嘌呤酶素购于HyClone;DMSO购于Merk;96孔板购于BIOFIL;Annexin V-FTIC/PI双染细胞周期凋亡检测试剂盒购于南京凯基生物公司;流式细胞仪购于Becton-Dick;BCA蛋白浓度测定试剂盒(增强型)、BeyoECL Puls(超敏ECL化学发光试剂盒)购于Sigma,0.45 μm PDVF膜购于Millipore公司;CCK-8细胞增殖毒性检测试剂盒购于DOJINDO研究所,染色质共沉淀试剂盒购于Cell Signaling Technology;PCR仪器购于美国Bio-Rad公司,倒置荧光显微镜购于日本Olympus 公司;小鼠抗人β-actin购于北京中杉金桥,兔抗人Gsk-3β、β-catenin、MMP3、TCF购于Cell Signaling Technology;兔抗人Bax、BCL2、CyclinD1购于北京鼎国生物技术有限公司;
1.2方法
1.2.1细胞培养HepG2细胞以1×105个/ml 接种于含10%血清的DMEM-F12 培养液中,在37℃、5%CO2、饱和湿度下常规培养,48~72 h传代一次。
1.2.2HepG2细胞的感染及筛选用CCK8筛选嘌呤霉素工作浓度为0.5 μg/μl。取两个一次性无菌瓶,分别接种2×105ml-1细胞。37 ℃恒温培养24 h,弃去培养基,其中一瓶中加入β-catenin慢病毒颗粒50 μl及4 mg/ml Polybrene 1 μl,另一瓶继续原条件培养。感染24 h后,用倒置荧光显微镜观察感染效果,HepG2-β-catenin感染细胞呈绿色荧光,弃去培养基,加入含有0.5 μg/μl嘌呤霉素的DMEM-F12 培养液进行筛选,获得稳定感染的HepG2-β-catenin细胞。HepG2-β-catenin细胞接种在含0.5 μg/ml嘌呤霉素的DMEM-F12培养基中,在37℃、5%CO2、饱和湿度下常规培养,48~72 h传代一次。
1.2.3CCK-8法检测细胞增殖分别取生长良好的HepG2和HepG2-β-catenin细胞以1 ×104每孔的密度接种于96孔板中,分成对照组和药物组。药物组加入不同浓度(10~160 μmol/L)人参皂苷Rh2,对照组加入含0.1% DMSO的DMEM-F12完全培养液,每孔200 μl,每药物浓度组设6个复孔。分别培养24、48、72 h后,每孔加入20 μl CCK-8液体,37℃恒温孵育3 h,用酶标仪测光吸收度值,以对照组作为100%,计算各组抑制率,抑制率(IR%)=[1-药物组(A)]/对照组(A)×100%,实验重复3次。
1.2.4流式细胞术检测细胞周期分别取对数生长期的HepG2和HepG2-β-catenin细胞接种于培养基中,分为对照组与药物组及抑制剂组,药物组加入人参皂苷Rh2(100 μmol/L),抑制剂组加入人参皂苷Rh2(100 μmol/L)+ Bio(10 μmol/L),以每孔3 ml的培养体系接种于6孔板,每组平行接种3个复孔,培养48 h后,收集细胞,用PBS液洗涤2次后,700 ml/L冰乙醇固定,4℃保存。流式细胞仪检测,经计算机处理分析得出细胞周期各时相比例。
1.2.5流式细胞技术检测细胞凋亡率分别取对数生长期的HepG2和 HepG2-β-catenin细胞接种于培养基中,分为对照组与药物组及抑制剂组,药物组加入人参皂苷Rh2(100 μmol/L),抑制剂组加入人参皂苷Rh2(100 μmol/L)+Bio(10 μmol/L),以每孔3 ml的培养体系接种于6孔板,每组平行接种3个复孔,培养48 h后,收集细胞,用流式细胞仪检测,计算机处理分析结果。
1.2.6ELISA法检测细胞Gsk-3β活性将取对数生长期的HepG2、HepG2-β-catenin细胞接种于培养基中,分为对照组与药物组及抑制剂组,药物组加入人参皂苷Rh2(100 μmol/L),抑制剂组加入人参皂苷Rh2(100 μmol/L)+Bio(10 μmol/L),作用48 h,收集各组细胞并提取蛋白,提取步骤依照说明书操作。在96孔酶标板上,空白孔中加入样品稀释液100 μl,余孔分别加入标准品或待测样品100 μl,把样品加于酶标板孔底部,轻轻振荡,混匀,用覆膜盖上酶标板,放入37℃恒温箱中120 min。移去液体,用力甩干。取100 μl生物素标记抗体工作液加入上述各孔,放入37℃恒温箱中60 min。用力甩去孔内液体,每孔加入PBS 溶液350 μl,浸泡2 min,洗3次,用力甩干,每孔加入100 μl辣根过氧化物酶标记亲和素工作液,放入37℃恒温箱中60 min后,去除孔内液体,用力甩干,每孔加入PBS 溶液350 μl,浸泡2 min,洗5次,用力甩干。依次每孔加入90 μl底物溶液,在37℃条件下,避光显色30 min,每孔加入50 μl终止溶液,终止反应,测量各孔的光密度(OD值)。
1.2.7PCR法测HepG2、 HepG2-β-catenin细胞中Gsk-3β、β-catenin、Bcl2、CyclinD1、Bax、MMP3基因的表达实验分为6组:HepG2-β-catenin、HepG2-β-catenin+Rh2、HepG2-β-catenin+ Rh2+Bio、HepG2、Rh2、Rh2+Bio。收集各处理组细胞,提取总的RNA,逆转录成功后进行定量分析。β-actin:Forward:5′-CATCAAGAAGGTGGTGAAGCA-3′;Reverse:5′-CGTCAAAGGTGGAGGAGTGG-3′。β-catenin:Forwa-rd:5′-CGCCAGGGCGCCAGGGTTTTCCCAGTCAC-GAC-3′;Reverse-5′-TAATACGACTCACTAGAGGG-3′。 Gsk-3β:Forward:5′-GGATTCGTCAGGAACAGGACA-3′;Reverse:5′-TTAGCATCTGACGCTGCTGT-3′。 Bcl2:Forward:5′-GGTGAACTGGGGGAGGATTG-3′;Rev erse:5′-GGCAGGCATGTTGACTTCAC-3′。 CyclinD1:Forward:5′-CATGGAGAGACAGACAGAGCA-3′;Re verse:5′-TATCCACGGGGCTGTTCCTA-3′。 Bax:Forw ard:5′-TTCATCCAGGATCGAGCAGG-3′;Reverse:5′-CTTGGTGGACGCATCCTGAG-3′。 MMP3:Forward:5′-TAATGGAGATGCCCACTTTGATG-3′;Reverse:5′-GAGTGAAAGAGACCCAGGGAGTG-3′。
1.2.8CHIP-PCR法检测HepG2、 HepG2-β-catenin细胞中Bcl2、CyclinD1、Bax、MMP3基因的表达实验分为6组:HepG2-β-catenin、HepG2-β-catenin+ Rh2、HepG2-β-catenin+ Rh2+Bio、HepG2、Rh2、Rh2+Bio。在含有9ml培养基的各组细胞培养瓶中(75 cm2)分别加入243 μl 37%甲醛,使甲醛终浓度为1%,放入37℃恒温箱中孵育10 min。终止交联:在细胞培养瓶中加入450 μl 2.5 mol/L甘氨酸,调整甘氨酸至终浓度为0.125 mol/L,轻轻摇晃,室温放置5 min。倒掉培养基,用预冷的PBS洗细胞2次,用力使用细胞刮刀刮瓶底,并加入8 ml PBS,用移液管移入15 ml离心管中,2 000 r/min 5 min,离心,收集细胞。弃去上清,根据细胞数量,加入 400 μl SDS Lysis Buffer。调整细胞终浓度为每100 μl含1×106个细胞,再加入蛋白酶抑制剂复合物。超声破碎:VCX750,25%功率,4.5 s冲击,10 s间隙,共12次。除杂及抗体哺育:超声破碎结束后,1 000 r/min 4℃离心,10 min,去除不溶物质。取3个EP管,分别加入100 μl上清液,实验组加入抗体,对照组不加抗体,电泳组则加入4 μl 5 mol/L NaCl,65℃恒温箱中孵育3 h解交联,在SDS凝胶上电泳,检验超声破碎的效果。在实验组和对照组中分别加入900 μl CHIP Dilution Buffer和20 μl 50×PIC。再次加入60 μl Protein A Agarose/Salmon Sperm DNA。4℃,慢速颠转1 h。4℃,静置10 min,700 r/min离心1 min,取上清。各留取20 μl作为input。实验组加入1 μl 抗体,对照组则不加抗体,在4℃条件下颠转过夜。洗沉淀复合物和解交联:免疫复合物的沉淀及清洗,孵育过夜后,每管加入60 μl Protein A Agarose/Salmon Sperm DNA。在4℃条件下颠转2 h。4℃,静置10 min后,700 r/min离心1 min。除去上清。依次用下列溶液(①low salt wash buffer--one wash,②high salt wash buffer--one wash,③LiCl wash buffer--one wash,④TE buffer--two wash )清洗沉淀复合物。加入溶液,4℃,颠转10 min,4℃,静置10 min,700 r/min离心1 min,弃去上清。清洗完毕后,每管加入洗脱液(10%SDS,1 mol/L NaHCO3, ddH2O)250 μl,室温下颠转15 min,静置离心,收集上清。重复洗涤一次。每管洗脱液为500 μl。解交联:每管中加入20 μl 5 mol/L NaCl(NaCl终浓度为0.2 mol/L)。吹打混匀,65℃解交联过夜。DNA样品的回收:解交联结束后,实验组和对照组加入1 μl RNaseA(MBI),37℃恒温孵育1 h。 实验组和对照组加入10 μl 0.5 mol/L EDTA, 20 μl 1 mol/L Tris.HCl(pH6.5),2 μl 10 mg/ml蛋白酶K,45℃处理2 h。采用omega胶回收试剂盒回收DNA片段,加入100 μl ddH2O离心,收集样品。PCR分析:操作步骤详见上述PCR的操作。
1.2.9Western blot法检测HepG2、HepG2-β-catenin细胞Gsk-3β、β-catenin、Bcl2、CyclinD1、Bax、MMP3蛋白的表达将取对数生长期的HepG2、HepG2-β-catenin细胞接种于培养基,分为对照组与药物组及抑制剂组,对照组常规培养,药物组加入人参皂苷Rh2(100 μmol/L),抑制剂组人参皂苷Rh2(100 μmol/L)+Bio(10 μmol/L),孵育48 h,收集各组细胞,提取蛋白。提取步骤按照说明书进行操作。测蛋白浓度,并使蛋白变性。配制胶体,电泳,电转,结束后,将膜取出并放在5%牛奶封闭液中室温封闭1.5 h;4℃下与兔抗人抗体Gsk-3β(1∶1 000)、β-catenin(1∶1 000)、Bcl2(1∶1 000)、CyclinD1、Bax(1∶1 000)、MMP3(1∶500),鼠抗人β-actin(1∶1 000)孵育过夜;用TBST溶液漂洗后分别加入辣根过氧化物酶标记山羊抗兔IgG和山羊抗小鼠IgG(1∶1 000),常温孵育1.5 h,再次用TBST漂洗,加入显色剂ECL试剂显色去曝光。
1.3统计学分析采用SPSS 17.0软件对所得数据进行统计处理,数据以±s表示。多组间比较采用单因素方差分析,两两比较采用LSD检验。P<0.05表示差异有统计学意义。
2结果
2.1获得HepG2-β-catenin细胞用pLOV-EF1a-MCS-3FLAG-β-catenin慢病毒感染HepG2细胞,感染成功的HepG2细胞命名为HepG2-β-catenin,通过荧光显微镜观察,细胞中可见大量绿色荧光;而HepG2细胞中无荧光(图1)。用流式细胞仪检测结果显示,感染第2天细胞的感染率为94.08%,第3天感染率为99.49%(图2)。用PCR检测HepG2和HepG2-β-catenin细胞β-catenin基因的表达,与HepG2组相比,随着感染后时间延长,HepG2-β-catenin细胞β-catenin基因表达明显高于HepG2组,与HepG2组比较差异具有统计学意义(P<0.01)(图3)。
2.2Rh2对HepG2 和HepG2-β-catenin细胞增殖的抑制作用采用CCK-8法检测结果显示,对照组细胞体外生长活跃,经Rh2(10~160 μmol/L)处理,HepG2细胞增殖受到抑制,计算48、72 h 半数抑制率分别为100 μmol/L、58.12 μmol/L,与对照组比较差异具有统计学意义(P<0.01),且Rh2对肝癌HepG2细胞的生长抑制作用呈剂量和时间依赖。同时,我们也检测了Rh2对HepG2-β-catenin细胞增殖的影响,经Rh2作用48、72 h,对HepG2-β-catenin细胞的48、72 h 半数抑制率分别是129.2 μmol/L,83.33 μmol/L,Rh2作用于HepG2-β-catenin细胞的浓度均高于HepG2细胞,与HepG2组比较差异具有统计学意义(P<0.01),见图4、5。

图1 荧光显微镜观察HepG2和HepG2-β-catenin细胞β-catenin基因转染状况Fig.1 HepG2 and HepG2-β-catenin were observed by fluorescence microscopyNote: A0.HepG2-β-catenin;B0.HepG2.
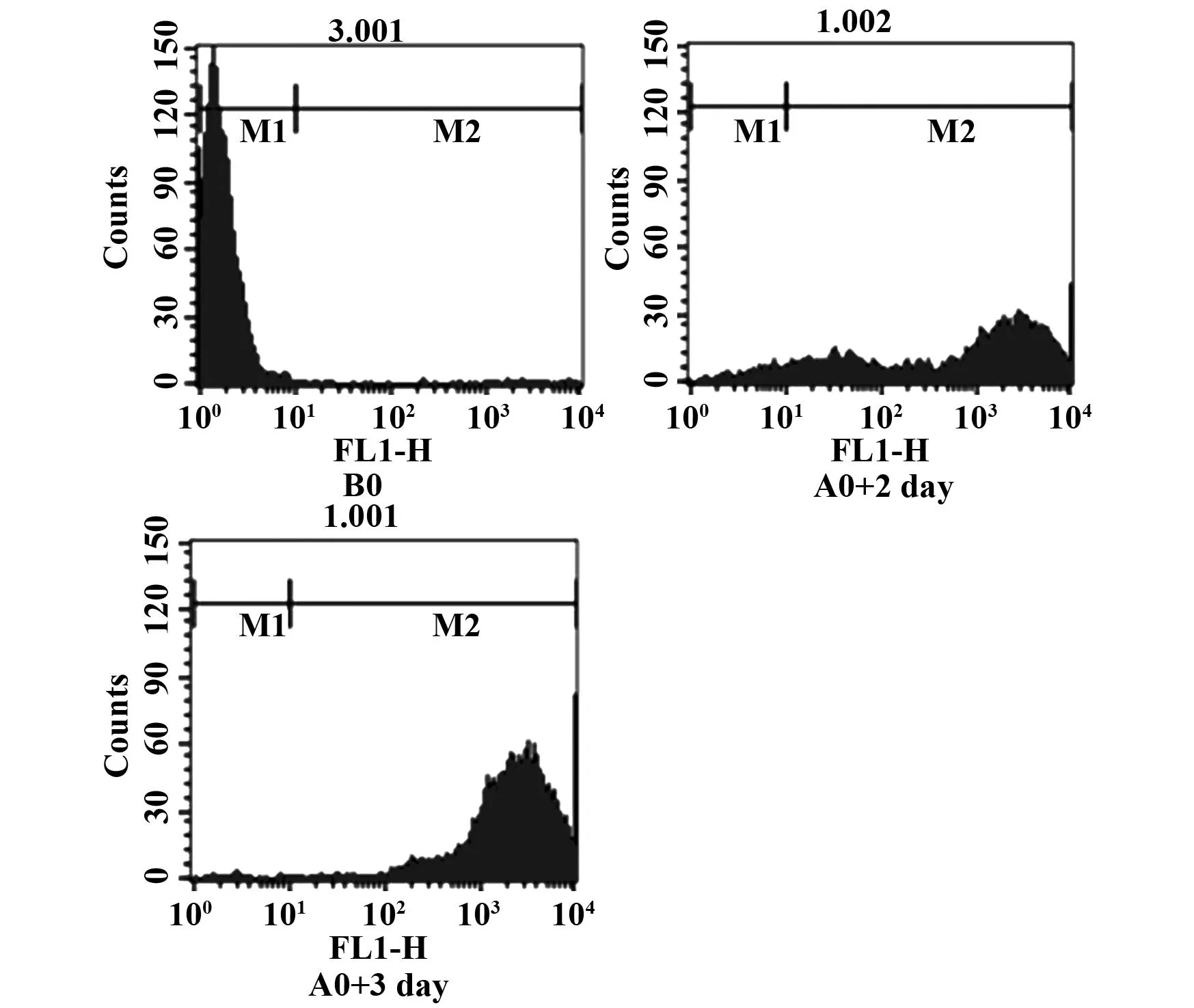
图2 流式细胞术检测HepG2细胞感染率Fig.2 Rate of infection was analyzed by flow cytometryNote: B0.HepG2 cells;A0+2 day.HepG2-β-catenin cells+2 day;A0+3 day.HepG2-β-catenin +3 day.
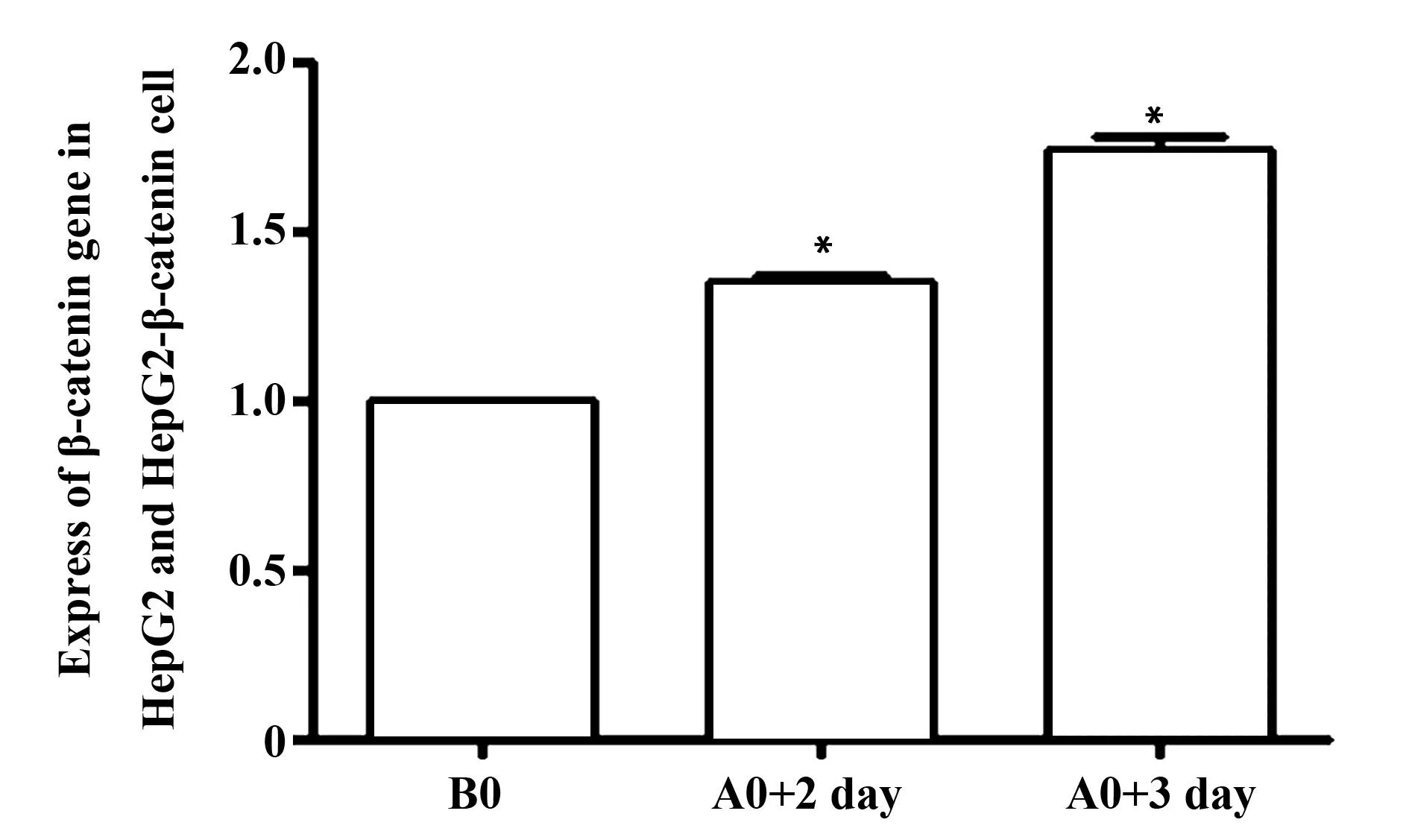
图3 用PCR方法检测细胞β-catenin的表达Fig.3 Expression of β-catenin gene in HepG2 and HepG2-β-catenin were measured by qRT-PCRNote: B0.HepG2 cells;A0+2 day.HepG2-β-catenin cells+2 day;A0+3 day.HepG2-β-catenin +3 day.*.P<0.01.
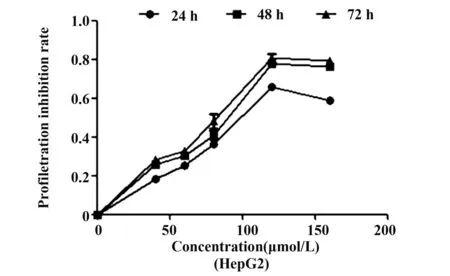
图4 Rh2对HepG2细胞的增殖抑制作用Fig.4 Inhibitory effect of Rh2 on HepG2 cellsNote: HepG2 cells were incubated with Rh2 for 24,48,72 h and then assessed by the CKK assay.
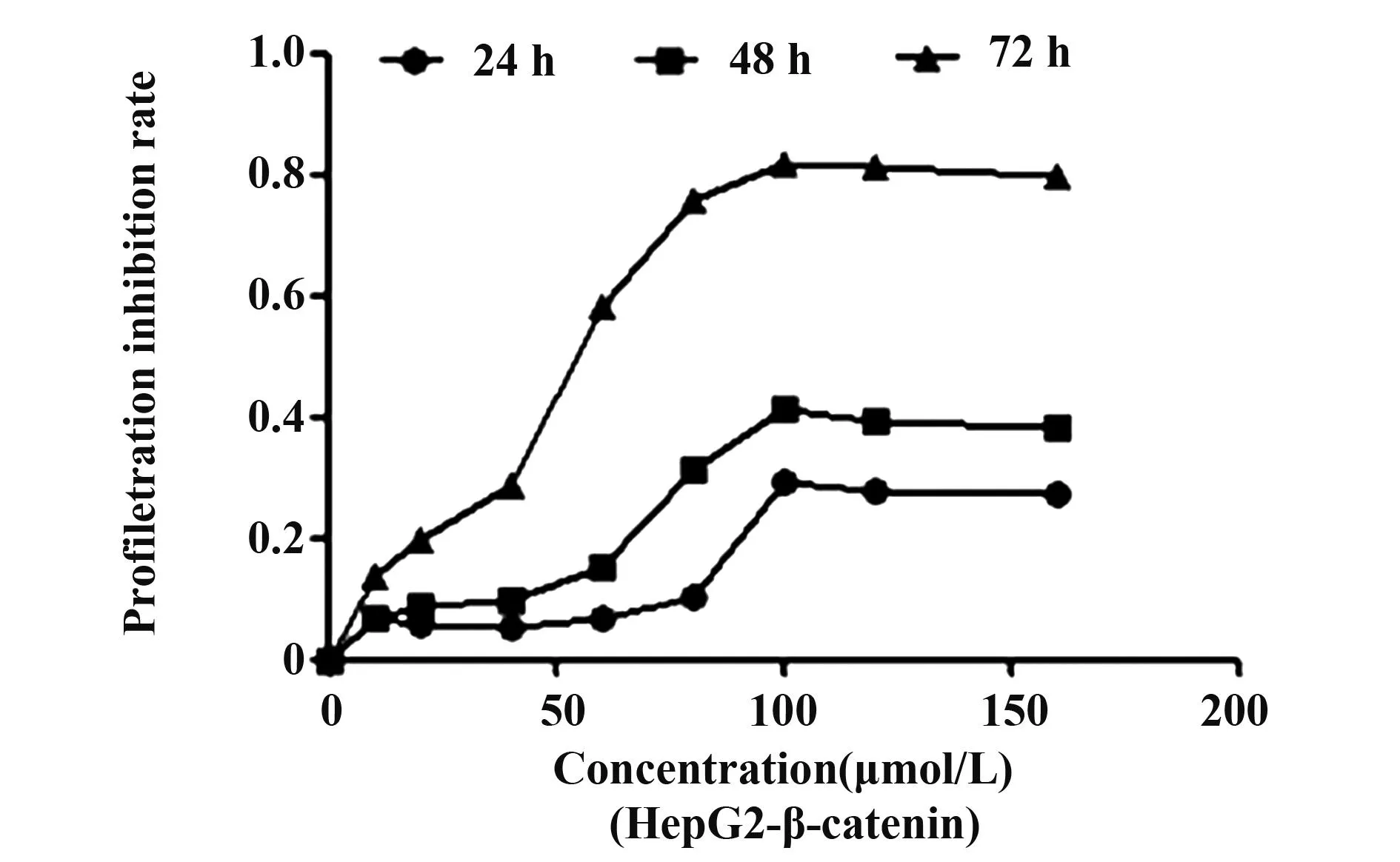
图5 Rh2对HepG2-β-catenin细胞的增殖抑制作用Fig.5 Inhibitory effect of Rh2 on HepG2 cellsNote: HepG2-β-catenin cells were incubated with Rh2 for 24,48,72 h and then assessed by the CKK assay.
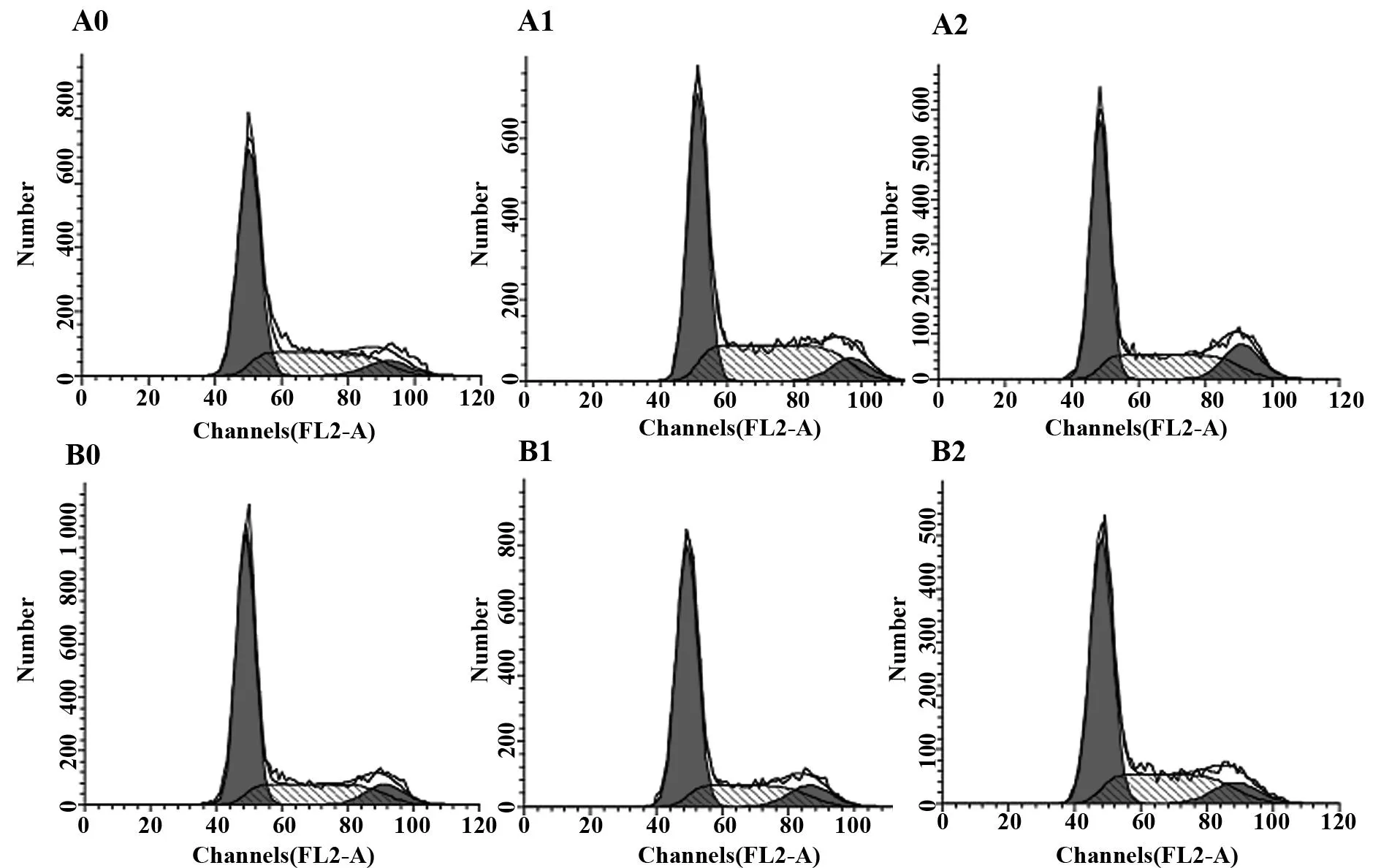
图6 Rh2对HepG2和HepG2-β-catenin细胞周期的影响Fig.6 Effect of Rh2 on HepG2 and HepG2-β-catenin cells cycleNote: HepG2-β-catenin and HepG2 cells was induced for 24 h with Rh2 or Rh2+Bio.Cell cycle distribution was analyzed by flow cytometry;A0.HepG2-β-catenin;A1.HepG2-β-catenin+ Rh2 A2;HepG2-β-catenin+ Rh2+Bio;B0.HepG2;B1.HepG2+ Rh2;B2.HepG2+ Rh2+Bio.
2.3Rh2对HepG2 和HepG2-β-catenin细胞周期的影响Rh2诱导HepG2和HepG2-β-catenin细胞周期阻滞在G0/G1期;HepG2组G0/G1期(61.02±1.48)%,HepG2+Rh2组(64.57±0.65)%,HepG2-β-catenin组(52.86±1.46)%,HepG2-β-catenin+Rh2组(58.61±2.01)%。与HepG2组相比,HepG2-β-catenin组细胞的G0/G1期(52.86+1.46)%明显低于HepG2组(61.02+1.48)%,差异有统计学意义(P<0.01),见表1、图6。
表1 100 μmol/L Rh2对HepG2和HepG2-β-catenin细胞周期的影响(±s,n=3)Tab.1 Effect of Rh2 cell cycle of HepG2 and HepG2-β-catenin cells(±s,n=3)
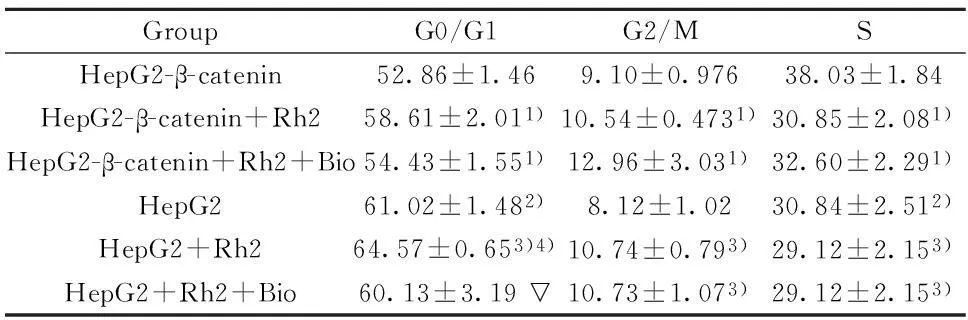
表1 100 μmol/L Rh2对HepG2和HepG2-β-catenin细胞周期的影响(±s,n=3)Tab.1 Effect of Rh2 cell cycle of HepG2 and HepG2-β-catenin cells(±s,n=3)
GroupG0/G1G2/MSHepG2-β-catenin52.86±1.469.10±0.97638.03±1.84HepG2-β-catenin+Rh258.61±2.011)10.54±0.4731)30.85±2.081)HepG2-β-catenin+Rh2+Bio54.43±1.551)12.96±3.031)32.60±2.291)HepG261.02±1.482)8.12±1.0230.84±2.512)HepG2+Rh264.57±0.653)4)10.74±0.793)29.12±2.153)HepG2+Rh2+Bio60.13±3.19▽10.73±1.073)29.12±2.153)
Note:1)P<0.01 HepG2-β-catenin+ Rh2,HepG2-β-catenin+ Rh2+Bio vs HepG2-β-catenin group;2)P<0.01 HepG2 vs HepG2-β-catenin;3)P<0.01HepG2+ Rh2,HepG2+ Rh2+Bio vs HepG2;4)P<0.01 HepG2+ Rh2 vs HepG2-β-catenin+ Rh2.
2.4Rh2对HepG2 和HepG2-β-catenin细胞的早期凋亡作用Rh2诱导HepG2和HepG2-β-catenin细胞早期凋亡。HepG2组细胞凋亡率(10.01±2.02)%,HepG2+Rh2组细胞凋亡率(17.27±2.77)%,HepG2-β-catenin组细胞凋亡率(5.26±0.50)%,HepG2-β-catenin+ Rh2组细胞凋亡率(9.02±1.76)%,HepG2-β-catenin+Rh2组细胞凋亡率低于HepG2+Rh2组细胞,差异有统计学意义(P<0.01),见表2、图7。
2.5Rh2可激活细胞Gsk-3β的活性Rh2诱导HepG2细胞12、24、48、72 h后,Gsk-3β活性逐渐升高,在48 h最高,随后其活性降低。与对照组相比,Rh2诱导HepG2和HepG2-β-catenin细胞48 h,Gsk-3β的活性均增高,而加入Bio后其活性降低。与Rh2组相比,差异具有统计学意义(P<0.01),而HepG2+ Rh2和HepG2-β-catenin+ Rh2组之间无差异,见图8、9。
表2 Rh2对HepG2和HepG2-β-catenin细胞早期凋亡的影响(±s,n=3)Tab.2 Effect of Rh2 on cell apoptosis of HepG2 and HepG2-β-catenin cells(±s,n=3)
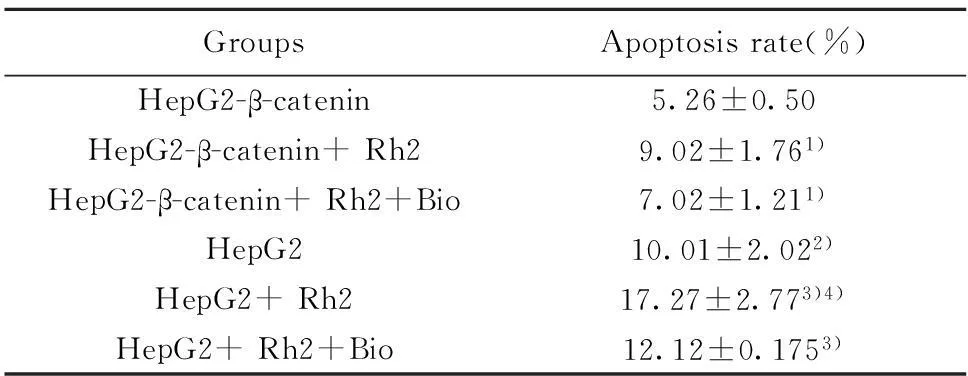
表2 Rh2对HepG2和HepG2-β-catenin细胞早期凋亡的影响(±s,n=3)Tab.2 Effect of Rh2 on cell apoptosis of HepG2 and HepG2-β-catenin cells(±s,n=3)
GroupsApoptosisrate(%)HepG2-β-catenin5.26±0.50HepG2-β-catenin+Rh29.02±1.761)HepG2-β-catenin+Rh2+Bio7.02±1.211)HepG210.01±2.022)HepG2+Rh217.27±2.773)4)HepG2+Rh2+Bio12.12±0.1753)
Note:1)P<0.01 HepG2-β-catenin+ Rh2,HepG2-β-catenin+ Rh2+Bio vs HepG2-β-catenin group;2)P<0.01 HepG2 vs HepG2-β-catenin;3)P<0.01 HepG2+ Rh2,HepG2+ Rh2+Bio vs HepG2;4)P<0.01 HepG2+ Rh2 vs HepG2-β-catenin+ Rh2.
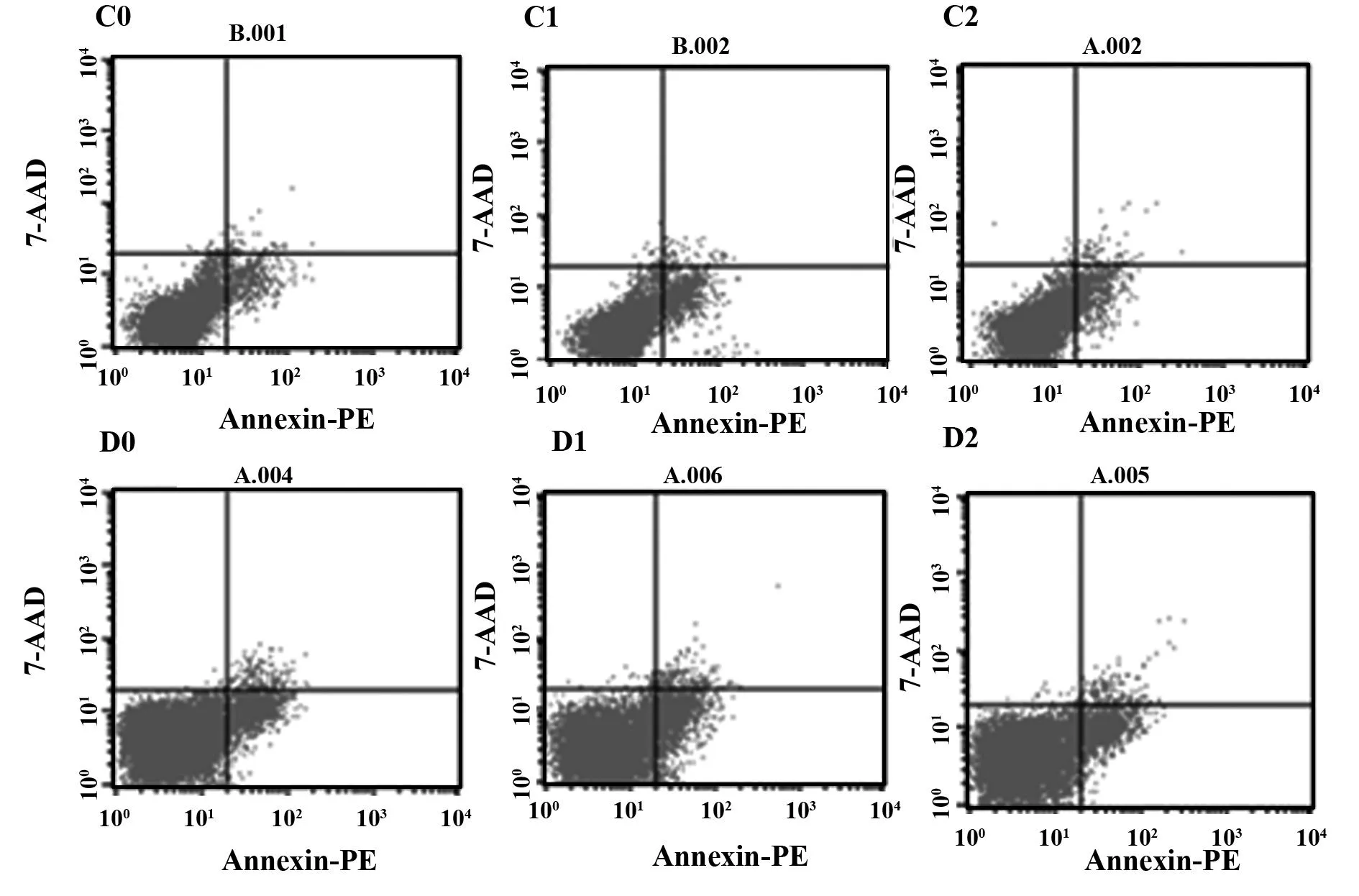
图7 Rh2 对HepG2和HepG2-β-catenin细胞凋亡的影响Fig.7 Effect of Rh2 on HepG2 and HepG2-β-catenin cells apoptosisNote: HepG2-β-catenin and HepG2 cells was induced for 24 h with Rh2 or Rh2+Bio.Cell cycle distribution was analyzed by Annexin V-FTIC/PI.C0.HepG2-β-catenin;C1.HepG2-β-catenin+ Rh2;C2.HepG2-β-catenin+ Rh2+Bio;D0.HepG2;D1: HepG2+ Rh2;D2.HepG2+ Rh2+Bio.
2.6Rh2对HepG2和HepG2-β-catenin细胞Gsk-3β、Bax、β-catenin、CyclinD1、Bcl2、MMP3基因表达的影响Rh2诱导HepG2和HepG2-β-catenin细胞后,Gsk-3β、Bax基因的表达增加,而β-catenin、CyclinD1、Bcl2、MMP3基因表达下调。与HepG2-β-catenin+Rh2组相比,HepG2+Rh2组中Bax基因表达增加更为显著;而β-catenin、Bcl2、CyclinD1、MMP3基因表则降低明显,且差异有统计学意义(P<0.01),见图10。
2.7Rh2对HepG2和HepG2-β-catenin细胞Bax、CyclinD1、Bcl2、MMP3基因表达的影响Rh2与HepG2和HepG2-β-catenin细胞共培养后,超声破碎细胞,提出DNA,电泳验证,其分子量在100~500 bp,TCF4抗体结合DNA后用半定量PCR检测。HepG2+Rh2组和HepG2-β-catenin+Rh2组细胞中Bax基因表达增加,而CyclinD1、Bcl2、MMP3基因表达下调;与HepG2-β-catenin+Rh2相比,HepG+Rh2组中Bax基因表达增加更明显;而Bcl2、CyclinD1、MMP3基因表达降低更为明显,差异有统计学意义(P<0.01),见图11、12。
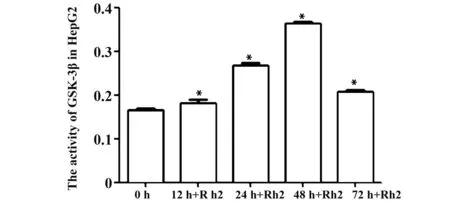
图8 ELISA检测HepG2细胞中Gsk-3β的活性Fig.8 Activity of Gsk-3β was checked by ELISA kitNote: In treat group,the activity of GSK-3β increased with time-depend manner.*.P<0.01.
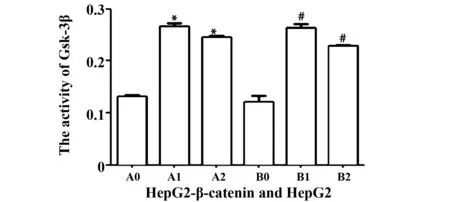
图9 ELISA检测HepG2-β-catenin 和HepG2细胞中Gsk-3β的活性Fig.9 Activity of Gsk-3β in HepG2-β-catenin and HepG2 was checked by ELISA kitNote: A0.HepG2-β-catenin;A1.HepG2-β-catenin+ Rh2;A2.HepG2-β-catenin+ Rh2+Bio;B0.HepG2;B1. HepG2+Rh2;B2.HepG2+ Rh2+Bio.*.P<0.01 HepG2-β-catenin+Rh2,HepG2-β-catenin+ Rh2+Bio vs HepG2-β-catenin group;#.P<0.01,HepG2+ Rh2,HepG2+ Rh2+Bio vs HepG2.
2.8Rh2对HepG2和HepG2-β-catenin细胞Gsk-3β、Bax、β-catenin、CyclinD1、Bcl2、MMP3蛋白表达的影响Rh2诱导后,HepG2和HepG2-β-catenin细胞Gsk-3β、Bax蛋白表达增加,而β-catenin、CyclinD1、Bcl2、MMP3蛋白表达下调。与HepG2-β-catenin+Rh2组相比, HepG+Rh2组细胞中Bax蛋白表达量大于HepG2-β-catenin +Rh2组;而β-catenin、Bcl2、CyclinD1、MMP3蛋白表达低于HepG2-β-catenin+Rh2组,差异有统计学意义(P<0.01),见图13。

图10 PCR检测HepG2-β-catenin 和HepG2细胞中Gsk-3β、β-catenin Bax、Bcl2、CyclinD1、MMP3基因的表达Fig.10 Expression of Gsk-3β,β-catenin,Bax,Bcl2,CyclinD1,MMP3 genes were measured by qRT-PCRNote: A0.HepG2-β-catenin;A1.HepG2-β-catenin+ Rh2;A2.HepG2-β-catenin+ Rh2+Bio;B0.HepG2;B1.HepG2+ Rh2;B2.HepG2+Rh2+Bio.*.P<0.01 HepG2-β-catenin+ Rh2,HepG2-β-catenin+ Rh2+Bio vs HepG2-β-catenin group;△.P<0.01 HepG2 vs HepG2-β-catenin;▽.P<0.01HepG2+ Rh2,HepG2+ Rh2+Bio vs HepG2;#.P<0.01 HepG2+ Rh2 vs HepG2-β-catenin+ Rh2.

图11 电泳检查超声破碎的DNAFig.11 DNA electrophoresis figureNote: A0.HepG2-β-catenin;A1.HepG2-β-catenin+ Rh2;A2.HepG2-β-catenin+ Rh2+Bio;B0.HepG2;B1.HepG2+ Rh2;B2.HepG2+ Rh2+Bio.
3讨论
人参作为传统中草药广泛应用于中医治疗中,近年来其有效成分用于各种肿瘤的预防与治疗[9,13]。大量研究表明,人参皂甙Rh2可显著影响并诱导胰腺癌细胞、肝癌细胞和A549肺癌细胞凋亡[12,20-22]。我们的实验研究也发现,人参皂甙Rh2可抑制HepG2肝癌细胞增殖,且呈浓度和时间依赖性。48、72 h的Rh2 IC50 分别为100 μmol/L,58.12 μmol/L。我们实验室研究发现,TSPG可抑制KG1α细胞增殖并诱导细胞凋亡,该作用机制可能与其抑制β-catenin蛋白及mRNA表达水平有关。临床研究表明,细胞过表达β-catenin对化疗或放疗有抵制作用,且预后差[18]。我们用过表达β-catenin的慢病毒感染HepG2肝癌细胞,获取HepG2-β-catenin细胞,检测结果发现,Rh2对HepG2-β-catenin细胞的增殖抑制也呈浓度和时间依赖性,但所需Rh2的浓度明显高于HepG2细胞,作用48、72 h的 Rh2 IC50分别是129.2 μmol/L、83.33 μmol/L。其结果显示,过表达β-catenin会削弱Rh2对HepG2肝癌细胞的药理作用。

图12 用半定量PCR检测Bax、Bcl2、CyclinD1、MMP3基因的表达Fig.12 Expression of Bax,Bcl2,CyclinD1,MMP3 genes were measured by PCRNote: A0.HepG2-β-catenin;A1.HepG2-β-catenin+ Rh2;A2.HepG2-β-catenin+ Rh2+Bio.B0.HepG2;B1.HepG2+ Rh2;B2.HepG2+ Rh2+Bio.

图13 Western blot检测HepG2-β-catenin 和HepG2细胞中Gsk-3β、β-catenin Bax、Bcl2、CyclinD1、MMP3蛋白的表达Fig.13 Expression of Gsk-3β,β-catenin,Bax,Bcl2,CyclinD1,MMP3 protein were measured by Western blotNote: A0.HepG2-β-catenin;A1.HepG2-β-catenin+ Rh2;A2.HepG2-β-catenin+ Rh2+Bio;B0.HepG2;B1.HepG2+ Rh2;B2.HepG2+ Rh2+Bio.*.P<0.01 HepG2-β-catenin+ Rh2,HepG2-β-catenin+ Rh2+Bio vs HepG2-β-catenin group;△.P<0.01 HepG2 vs HepG2-β-catenin;▽.P<0.01 HepG2+ Rh2,HepG2+ Rh2+Bio vs HepG2;#.P<0.01 HepG2+ Rh2 vs HepG2-β-catenin+ Rh2.
先前的研究结果显示,Wnt/β-catenin信号通路持续激活可促进结肠、胰腺组织肿瘤细胞的增殖和肿瘤的形成[14,23]。为了探索Rh2及过表达β-catenin对HepG2肝癌细胞周期和凋亡的影响,我们采用流式细胞术检测显示,与HepG2组细胞相比,HepG2-β-catenin组细胞G0/G1期细胞比例(52.86±1.46)%明显低于HepG2组(61.02±1.48)%,说明过表达β-catenin可对细胞周期产生影响,G0/G1期细胞比例的减少,可加速细胞的增殖。结果提示,Rh2对HepG2和HepG2-β-catenin的抗癌作用是使细胞周期阻滞于G0/G1期。同时,Rh2作用HepG2和HepG2-β-catenin细胞后,CyclinD1基因和蛋白表达水平均降低。CyclinD1作为肿瘤恶性增殖关键因子,其表达水平下调可使肿瘤细胞增殖失控得到抑制。HepG2+Rh2组细胞中CyclinD1基因和蛋白表达水平明显低于HepG2-β-catenin+Rh2组,说明过表达β-catenin可削弱Rh2下调CyclinD1基因和蛋白表达的作用。流式细胞术检测结果显示,Rh2作用后,HepG2和HepG2-β-catenin细胞凋亡率均增高,但HepG2-β-catenin+Rh2组细胞凋亡率低于HepG2+Rh2组。上述实验结果表明,过表达β-catenins可削弱Rh2对HepG2肝癌细胞生存抑制作用和降低凋亡率。
GSK-3β的异常磷酸化及失活参与肝癌的形成。本文用酶免疫吸附试验检测结果显示,Rh2均能以时间与浓度依赖方式激活HepG2和HepG2-β-catenin细胞GSK-3β活性,且两组之间无明显差异。又采用GSK-3β抑制剂Bio拮抗Rh2的作用,来验证Rh2是否激活了GSK-3β。在HepG2和HepG2-β-catenin细胞同时加入Rh2和Bio后,GSK-3β活性均有所降低,但仍然明显高于HepG2和HepG2-β-catenin细胞组,这证明Rh2可以激活GSK-3β,且此过程可以被Bio所拮抗。用PCR和Western blot法检测了Rh2诱导HepG2和HepG2-β-catenin细胞48 h后,GSK-3β基因和蛋白表达水平均增高,且两种细胞之间无统计学差异。以上结果说明,Rh2既激活GSK-3β的活性又能够使其表达增强。
β-catenin在正常组织及癌组织中作为一个重要的分子,它的稳定性依赖于由Axin、APC 和 GSK-3β构成的降解复合物,主要由GSK-3β去调节β-catenin在细胞内的表达水平。Rh2诱导HepG2和HepG2-β-catenin细胞48 h后,GSK-3β活性增加。用PCR和Western blot检测结果表明,与HepG2组细胞相比,HepG2+ Rh2组细胞中β-catenin基因和蛋白表达水平明显下降。同时检验结果发现,与HepG2-β-catenin组相比,HepG2-β-catenin+ Rh2组中β-catenin基因和蛋白水平有所下降,但下降幅度没有HepG2+ Rh2组明显。该结果表明,过表达β-catenin能削弱Rh2对β-catenin的降解作用,进一步证实Rh2降解β-catenin是通过激活GSK-3β的活性。
在无Wnt刺激下,GSK-3β作用于Axin、APC和β-catenin蛋白组成的复合物并磷酸化β-catenin,被磷酸化的β-catenin可以蛋白酶体的方式迅速降解[15];在Wnt的刺激下,GSK-3β向细胞膜转移并与Dishevelled和LRP-5受体结合,从而阻止GSK3β对β-catenin的磷酸化,其结果是β-catenin逃脱了蛋白酶体的降解,因此在胞浆累积并向胞核移位。本文采用PCR检测结果显示,与HepG2组细胞相比,HepG2+ Rh2组中CyclinD1、Bcl2、MMP3表达减少,而Bax增加。前面的实验结果显示,Rh2诱导HepG2后β-catenin表达量明显下降,为了进一步探讨β-catenin进入细胞核数量减少对下游基因的影响,我们采用染色质免疫共沉淀的方法检测下游基因[24]。结果显示,Rh2诱导HepG2细胞48 h后,在HepG2+ Rh2中CyclinD1、Bcl2、MMP3表达减少,而Bax表达增加,Western blot检测结果与染色质免疫共沉淀结果一致。同时检测结果显示,HepG2-β-catenin+Rh2组细胞中Bax基因和蛋白表达增加程度与Bcl2、CyclinD1、MMP3基因和蛋白表达减少程度均明显弱于HepG2+Rh2组。该结果表明,Rh2可通过激活GSK-3β活性降解β-catenin,使进入细胞核内的β-catenin减少,进而抑制周期、增殖及迁移相关蛋白的表达,促进凋亡相关蛋白的表达,最终抑制HepG2细胞增殖,促进其凋亡;而过表达β-catenin能削弱Rh2对HepG2细胞的促凋亡作用。
Rh2抗肿瘤的作用显著,但它能否抑制肿瘤的转移尚未被证实。β-catenin是黏附分子,有关β-catenin在肿瘤细胞转移中的作用报道很少。Miyazawa等[26]人发现,在浸润性肿瘤组织中可以出现 β-catenin细胞核表达。MMP3 是降解细胞外基质的重要蛋白水解酶,主要的作用底物是Ⅳ型胶原,通过降解细胞外基质和基底膜的主要成分Ⅳ型胶原,从而参与肿瘤的浸润和转移过程。本实验Western blot和PCR检测结果显示,Rh2能够抑制HepG2细胞β-catenin和MMP3蛋白及基因的表达,结果还提示Rh2可能具有抗肿瘤转移作用。
综上所述,过表达β-catenin可削弱Rh2对肝癌HepG2细胞的药理作用。Rh2通过激活Gsk-3β降解β-catenin,影响下游基因的表达,促进肝癌细胞的凋亡及抑制其转移。
参考文献:
[1]Myzak MC,Karplus PA,Chung FL,etal.A novel mechanism of chemoprotection by sulforaphane:inhibition of histone deacetylase[J].Cancer Res,2004,64:5767-5774.
[2]Jung HK,Lee DS,Yoon SS,etal.Systemic metastasis of hepatocellular carcinoma responsive to multidisciplinary treatment including debulking surgery[J].Ann Surg Treat Res,2014,86:100-104.
[3]Tanase AM,Dumitrascu T,Dima S,etal.Influence of hepatitis viruses on clinicopathological profiles and long-term outcome in patients undergoing surgery for hepatocellular carcinoma[J].Hepatobiliary Pancreat Dis Int,2014,13:162-172.
[4]Nishikawa H,Arimoto A,Wakasa T,etal.Comparison of clinical characteristics and survival after surgery in patients with non-B and non-C hepatocellular carcinoma and hepatitis virus-related hepatocellular carcinoma[J].J Cancer,2013,4:502-513.
[5]Ker CG,Chen JS,Kuo KK,etal.Liver surgery for hepatocellular carcinoma:laparoscopic versus open approach[J].Int J Hepatol,2011,2011:596792-596799.
[6]Lee JE,Bae SH,Choi JY,etal.Epirubicin,cisplatin,5-FU combination chemotherapy in sorafenib-refractory metastatic hepatocellular carcinoma[J].World J Gastroenterol,2014,20:235-241.
[7]Kuroiwa-Trzmielina J,de Conti,AScolastici C,etal.Chemoprevention of rat hepatocarcinogenesis with histone deacetylase inhibitors:efficacy of tributyrin,a butyric acid prodrug[J].Int J Cancer,2009,124:2520-2527.
[8]Osaki A,Suda T,Kamimura K,etal.A safe and effective dose of cisplatin in hepatic arterial infusion chemotherapy for hepatocellular carcinoma[J].Cancer Med,2013,2:86-98.
[9]Chen L,Dai J,Wang Z,etal.Ginseng total saponins reverse corticosterone-induced changes in depression-like behavior and hippocampal plasticity-related proteins by interfering with GSK-3 beta-CREB signaling pathway[J].Evid Based Complement Alternat Med,2014,14:506735-506739.
[10]Ho YL,Li KC,Chao W,etal.Korean red ginseng suppresses metastasis of human hepatoma SK-Hep1 cells by inhibiting matrix metalloproteinase-2/-9 and urokinase plas minogen activator[J].Evid Based Complement Alternat Med,2012,12:965846-965849.
[11]Kim MJ,Yun H,Kim DH,etal.AMP-activated protein kinase deter mines apoptotic sensitivity of cancer cells to ginsenoside-Rh2[J].J Ginseng Res,2014,38:16-21.
[12]Wang Z,Zheng Q,Liu K,etal.Ginsenoside Rh(2)enhances antitumour activity and decreases genotoxic effect of cyclophosphamide[J].Basic Clin Pharmacol Toxicol,2006,98:411-415.
[13]Yan XJ,Gong LH,Zheng FY,etal.Triterpenoids as reversal agents for anticancer drug resistance treatment[J].Drug Discov Today,2014,19:482-488.
[14]Thompson MD,Monga SP.WNT/beta-catenin signaling in liver health and disease[J].Hepatology,2007,45:1298-1305.
[15]Mosimann C,Hausmann G,Basler K.Beta-catenin hits chromatin:regulation of Wnt target gene activation[J].Nat Rev Mol Cell Biol,2009,10:276-286.
[16]Barbetti V,Gozzini A,Cheloni G,etal.Time-and residue-specific differences in histone acetylation induced by VPA and SAHA in Aml1/ETO-positive leukemia cells[J].Epigenetics,2013,8:210-219.
[17]Maurer U,Preiss F,Brauns-Schubert P,etal.GSK-3 -at the crossroads of cell death and survival[J].J Cell Sci,2014,127:1369-1378.
[18]Tsuchiya K,Nakamura T,Okamoto R,etal.Reciprocal targeting of Hath 1 and beta-catenin by wnt glycogen synthase kinase 3 beta in human colon cancer[J].Gastroenterology,2007,132:208-220.
[19]Gao Y,Liu Z,Zhang X,etal.Inhibition of cytoplasmic GSK-3beta increases cisplatin resistance through activation of Wnt/beta-catenin signaling in A549/DDP cells[J].Cancer Lett,2013,22:336:231-239.
[20]Tsai KH,Hsien HH,Chen LM,etal.Rhubarb inhibits hepatocellular carcinoma cell metastasis via GSK-3-beta activation to enhance protein degradation and attenuate nuclear translocation of beta-catenin[J].Food Chem,2013,138:278-285.
[21]Chung KS,Cho SH,Shin JS,etal.Ginsenoside Rh2 induces cell cycle arrest and differentiation in human leukemia cells by upregulating TGF-beta expression[J].Carcinogenesis,2013,34:331-340.
[22]Christensen LP.Ginsenosides chemistry,Biosynthesis,analysis,and potential health effects[J].Adv Food Nutr Res,2009,55:1-99.
[23]Tang XP,Tang GD,Fang CY,etal.Effects of ginsenoside Rh2 on growth and migration of pancreatic cancer cells[J].World J Gastroenterol,2013,19:1582-1592.
[24]Lazarova DL,Bordonaro M,Carbone R,etal.Linear relationship between Wnt activity levels and apoptosis in colorectal carcinoma cells exposed to butyrate[J].Int J Cancer,2004,110:523-531.
[25]Arce L,Pate KT,Waterman ML.Groucho binds two conserved regions of LEF-1 for HDAC-dependent repression[J].BMC Cancer,2009,9:159.
[26]Miyazawa K,Iwaya K,Kuorda M,etal.Nuclear accumulation of beta-catenin in intestinal type gastric carcinoma:Corelation with early tumor invasion[J].Virchows Arch,2000,437:508-513.
[收稿2015-06-06修回2015-07-20]
(编辑倪鹏)
