亥茅酚苷对脂多糖诱导巨噬细胞一氧化氮和白介素6表达的影响
2016-01-08罗超沈立吕昌
罗 超 沈 立 吕 昌
(绍兴文理学院元培学院,绍兴312000)
[摘 要] 目的:探讨亥茅酚苷对脂多糖(LPS)诱导的小鼠巨噬细胞株RAW264.7炎症介质及细胞因子(NO、IL-6)释放的影响。方法:应用LPS(1 μg/ml)刺激RAW264.7细胞,采用不同浓度亥茅酚苷(20、40、80 μg/ml)干预,Griess试剂法测定NO释放量;酶联免疫吸附试验(ELISA)测定IL-6释放,用免疫印迹法(Western blot)检测细胞一氧化氮合酶(iNOS)的表达,实时荧光定量反转录聚合酶链反应(RT-PCR)技术分析iNOS、IL-6 mRNA的表达。结果:亥茅酚苷各剂量组(20、40、80 μg/ml)均能抑制LPS诱导的RAW264.7细胞NO、IL-6的释放(P<0.01),并下调iNOS 蛋白、iNOS mRNA、IL-6 mRNA的表达。结论:亥茅酚苷对LPS诱导的巨噬细胞NO、IL-6释放和iNOS表达有抑制作用,具有一定的抗炎活性。
[关键词] 亥茅酚苷;巨噬细胞;炎症;一氧化氮;白介素6
doi:10.3969/j.issn.1000-484X.2015.11.009
亥茅酚苷对脂多糖诱导巨噬细胞一氧化氮和白介素6表达的影响
罗超沈立吕昌①
(绍兴文理学院元培学院,绍兴312000)
[摘要]目的:探讨亥茅酚苷对脂多糖(LPS)诱导的小鼠巨噬细胞株RAW264.7炎症介质及细胞因子(NO、IL-6)释放的影响。方法:应用LPS(1 μg/ml)刺激RAW264.7细胞,采用不同浓度亥茅酚苷(20、40、80 μg/ml)干预,Griess试剂法测定NO释放量;酶联免疫吸附试验(ELISA)测定IL-6释放,用免疫印迹法(Western blot)检测细胞一氧化氮合酶(iNOS)的表达,实时荧光定量反转录聚合酶链反应(RT-PCR)技术分析iNOS、IL-6 mRNA的表达。结果:亥茅酚苷各剂量组(20、40、80 μg/ml)均能抑制LPS诱导的RAW264.7细胞NO、IL-6的释放(P<0.01),并下调iNOS 蛋白、iNOS mRNA、IL-6 mRNA的表达。结论:亥茅酚苷对LPS诱导的巨噬细胞NO、IL-6释放和iNOS表达有抑制作用,具有一定的抗炎活性。
[关键词]亥茅酚苷;巨噬细胞;炎症;一氧化氮;白介素6
doi:10.3969/j.issn.1000-484X.2015.11.009
中图分类号R392
文献标志码码A
文章编号号1000-484X(2015)11-1486-04
通讯作者①,广东省妇幼保健院药学部,广州510010,E-mail:iml-ch@163.com。
作者简介:罗超(1985年-),男,讲师,主要从事新药评价研究,E-mail:luofish01@163.com。
[Abstract]Objective:To investigate the effect of Sec-O-Glucosylhamaudol on inflammatory mediator and cytokine(NO and IL-6)production in Lipopolysaccharide(LPS)stimulated murine macrophage(RAW264.7).Methods: Macrophages were induced with LPS,and incubated with different concentrations of Sec-O-Glucosylhamaudol(20,40,80 μg/ml),the quantity of NO production was measured by Griess reagent;the IL-6 production were measured by enzyme linked immunosorbent assay(ELISA),the expression of nitric oxide synthase(iNOS)in cells were detected by Western blot;the expression of iNOS and IL-6 mRNA were analyzed by real-time PCR.Results: Each concentrations of Sec-O-Glucosylhamaudol(20,40,80 μg/ml)inhibited the production of NO and IL-6 in LPS-stimulated RAW264.7 cells(P<0.01).This compound also reduced the mRNA expression of iNOS and IL-6.Conclusion: Sec-O-Glucosylhamaudol exhibited anti-inflammatory activity by inhibited the NO and IL-6 production in LPS stimulated RAW264.7 cells.
Effects of Sec-O-Glucosylhamaudol on expressions of nitric oxide and interleukin-6 in Lipopolysaccharide stimulated murine macrophage
LUOChao,SHENLi,LÜChang.YuanpeiCollege,ShaoxingUniversity,Shaoxing312000,China
[Key words]Sec-O-Glucosylhamaudol;Macrophage;Inflammation;Nitric oxide;Interleukin-6
中药防风为伞形科植物防风[Saposhnikovia divaricata(Turcz)Schisck]的未抽花茎植株的干燥根,临床常用于感冒头痛,风湿痹痛,风疹瘙痒,破伤风。药理学研究表明,防风粗提取物具有解热、镇痛、镇静、抗炎、抗过敏、抗惊厥、抑菌和增强机体非特异性免疫功能的作用[1]。亥茅酚苷(Sec-O-Glucosylhamaudol)是从中药防风中分离纯化得到的一个色原酮类化合物,其作为抗炎免疫类中成药主要成分已有报道[2,3],然而,国内外对亥茅酚苷的抗炎作用研究相对空白。本实验中,我们建立脂多糖(LPS)诱导的小鼠巨噬细胞株(RW264.7)炎症模型,评估亥茅酚苷的抗炎活性。
1材料与方法
1.1试剂DMEM培养基、胎牛血清购于美国Gibco公司,LPS购于美国Sigma公司,总蛋白提取试剂盒、NO检测试剂盒购于碧云天生物,TRIZOL、Bradford蛋白定量试剂盒、两步法Realtime-PCR检测试剂盒、ECL化学发光试剂盒购自美国Invitrogen公司,小鼠IL-6 ELISA检测试剂盒购自北京达科为公司,PCR引物由英韦创津广州公司合成,兔抗鼠iNOS单克隆抗体、兔抗鼠GAPDH单克隆抗体来源于美国CST公司。
1.2仪器CO2细胞培养箱(美国Forma Scientific公司),多功能酶标仪(美国Bio-Rad公司),电泳仪及转移装置(美国Bio-Rad公司),ABI 7500荧光定量PCR仪(美国Bio-Rad公司),倒置相差显微镜(日本Olympus公司)。
1.3细胞小鼠来源的巨噬细胞株RAW264.7购自中国科学院上海细胞库,培养于含10%的胎牛血清、100 U/ml青霉素、链霉素的DMEM培养液,置于5%CO2、37℃培养箱中培养,1~2 d换液1次。待细胞生长至70%~80%融合度后进行传代,2~3 d传代1次。
1.4方法
1.4.1MTT法检测亥茅酚苷对RAW264.7细胞活力的影响调整RAW264.7细胞悬液浓度为 1×105ml-1,加入96孔板内,每孔100 μl,置 37 ℃,5% CO2培养箱培养过夜,之后加入不同浓度亥茅酚苷80 μl,使其终浓度分别为20、40、80 μg/ml,每组设5复孔,继续培养 24 h。加入5 mg/ml MTT溶20 μl,继续培养4 h。终止培养,小心吸去孔内培养液。每孔加入 150 μl DMSO,置摇床上低速振荡10 min,使结晶物充分溶解。在酶标仪上 570 nm处测量各孔的吸光值,计算样品对细胞的抑制率。
1.4.2亥茅酚苷对LPS诱导的RAW264.7 细胞释放NO、IL-6的影响取指数生长期细胞,调整细胞悬液浓度为5×105ml-1,取0.5 ml加于 24孔细胞培养板内,置 37℃、5%CO2培养箱培养过夜,根据预实验结果,每孔分别加入20、40、80 μg/ml的亥茅酚苷以及终浓度为1 μg/ml的LPS,置37℃继续培养 24 h。取细胞上清,通过Griess试剂法[4],酶标仪A540nm检测细胞培养基中的NO含量;采用酶联免疫吸附试验(ELISA)试剂盒,用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中IL-6含量。
图1 亥茅酚苷Fig.1 Sec-O-Glucosyhamaudol
1.4.3亥茅酚苷对LPS诱导的iNOS蛋白表达的影响取指数生长期细胞,调整细胞悬液浓度为5×105ml-1,取0.5 ml加于24孔细胞培养板内,置 37℃、5%CO2培养箱培养过夜,之后每孔加入20、40、80 μg/ml的亥茅酚苷以及终浓度为1 μg/ml的LPS,置37℃继续培养24 h。提取细胞总蛋白,用免疫印迹法(Western blot)检测细胞iNOS的表达。SDS细胞裂解液破碎细胞,将裂解物离心后取上清,Bradford法检测蛋白浓度,然后进行SDS-PAGE电泳分离蛋白并转膜,蛋白转膜封闭后,置于抗iNOS的单克隆抗体溶液中,4℃过夜反应后,然后将膜置于含辣根过氧化酶标记的抗体溶液中,进行室温孵育,最后通过ECL化学发光法显影成像,并分析结果。
1.4.4亥茅酚苷对LPS诱导的iNOS,IL-6 mRNA表达的影响取指数生长期细胞,调整细胞悬液浓度为1×106ml-1,取1 ml加于12 孔细胞培养板内,置37℃、5%CO2培养箱培养过夜,之后每孔加入20、40、80 μg/ml的亥茅酚苷以及终浓度为1 μg/ml的LPS,置37℃继续培养6 h。用Trizol 试剂提取细胞总RNA,逆转录成cDNA,从GeneBank中获得序列,采用NCBI网上primer-blast软件设计引物,引物和扩增片段大小见表1,在荧光定量PCR仪上用相应的引物、cDNA 等材料按步骤进行扩增,采用2-△△CT相对定量法进行基因表达分析。
2结果
2.1亥茅酚苷对巨噬细胞细胞活力的影响如表2所示,亥茅酚苷在20~80 μg/ml计量范围内对巨噬细胞活力没有明显的影响(差异无统计学意义)。

表1 iNOS,IL-6以及GAPDH引物序列Tab.1 PCR primer pairs used to amplify iNOS,IL-6 and GAPDH
因此本实验选取的最大剂量80 μg/ml对巨噬细胞来说是安全的。
2.2亥茅酚苷对LPS诱导的RAW264.7 细胞释放NO的影响正常状态下,巨噬细胞产生NO的量处于基础水平。在受到LPS刺激时,NO产生显著增加(与正常组比较,P<0.01)。不同浓度亥茅酚苷孵育RAW264.7巨噬细胞后剂量依赖性地抑制LPS诱导的NO分泌,其抑制率分别为26.87%、41.96%和51.63%,差异具有统计学意义(P<0.01)(表3)。
表2 亥茅酚苷对RAW264.7细胞活力的影响(±s,n=5)Tab.2 Effect of Sec-O-Glucosylhamaudol on RAW264.7 cell viability(±s,n=5)

表2 亥茅酚苷对RAW264.7细胞活力的影响(±s,n=5)Tab.2 Effect of Sec-O-Glucosylhamaudol on RAW264.7 cell viability(±s,n=5)
Treatmentgroup(n=5)OD570Control1.721±0.069Sec-O-Glucosylhamaudol(20μg/ml)1.743±0.073Sec-O-Glucosylhamaudol(40μg/ml)1.682±0.101Sec-O-Glucosylhamaudol(80μg/ml)1.587±0.042
2.3亥茅酚苷对LPS诱导的RAW264.7 细胞释放IL-6的影响如表3所示,亥茅酚苷剂量依赖性地抑制LPS诱导的RAW264.7 细胞释放IL-6,其抑制率分别为23.87%、35.43%和45%,差异具有统计学意义(P<0.01)(表3)。
2.4亥茅酚苷对iNOS活性的影响如图2所示,在正常情况下,巨噬细胞中基本无iNOS的表达,而在LPS的刺激下,iNOS的表达显著增高,而亥茅酚苷剂量依赖性地抑制LPS诱导的巨噬细胞表达iNOS蛋白。
2.5亥茅酚苷对iNOS和IL-6 mRNA表达的影响如表4所示,在正常情况下,巨噬细胞中iNOS、IL-6 mRNA的表达均很少,而经过LPS刺激之后,其表达量显著增高。而亥茅酚苷对其表达具有明显的抑制,并具有浓度依赖性。亥茅酚苷在20、40、80 μg/ml剂量时对iNOS mRNA表达的抑制率分别为23.62%、42.01%、51.56%,而对IL-6 mRNA表达的抑制率分别为24.7%、39.2%、47.7%。
表3 亥茅酚苷抑制脂多糖诱导的巨噬细胞产生NO、IL-6(±s,n=3)Tab.3 Sec-O-Glucosylhamaudol inhibited NO and IL-6 production in LPS-induced RAW264.7 cells(±s,n=3)

表3 亥茅酚苷抑制脂多糖诱导的巨噬细胞产生NO、IL-6(±s,n=3)Tab.3 Sec-O-Glucosylhamaudol inhibited NO and IL-6 production in LPS-induced RAW264.7 cells(±s,n=3)
GroupsNO(μmol/L)Inhibitionrate(%)IL-6(ng/mg)Inhibitionrate(%)Control4.42±0.187-0.032±0.008-LPS1μg/ml18.09±0.2151)-3.032±0.1181)-Sec-O-Glucosylhamaudol(20μg/ml)13.23±0.2052)26.872.316±0.0452)23.87Sec-O-Glucosylhamaudol(40μg/ml)10.50±0.2822)41.961.969±0.0632)35.43Sec-O-Glucosylhamaudol(80μg/ml)8.75±0.1292)51.631.682±0.0642)45
Note:1)P<0.01,significant compared with vehicle-treated control;2)P<0.01,significant compared with LPS alone.
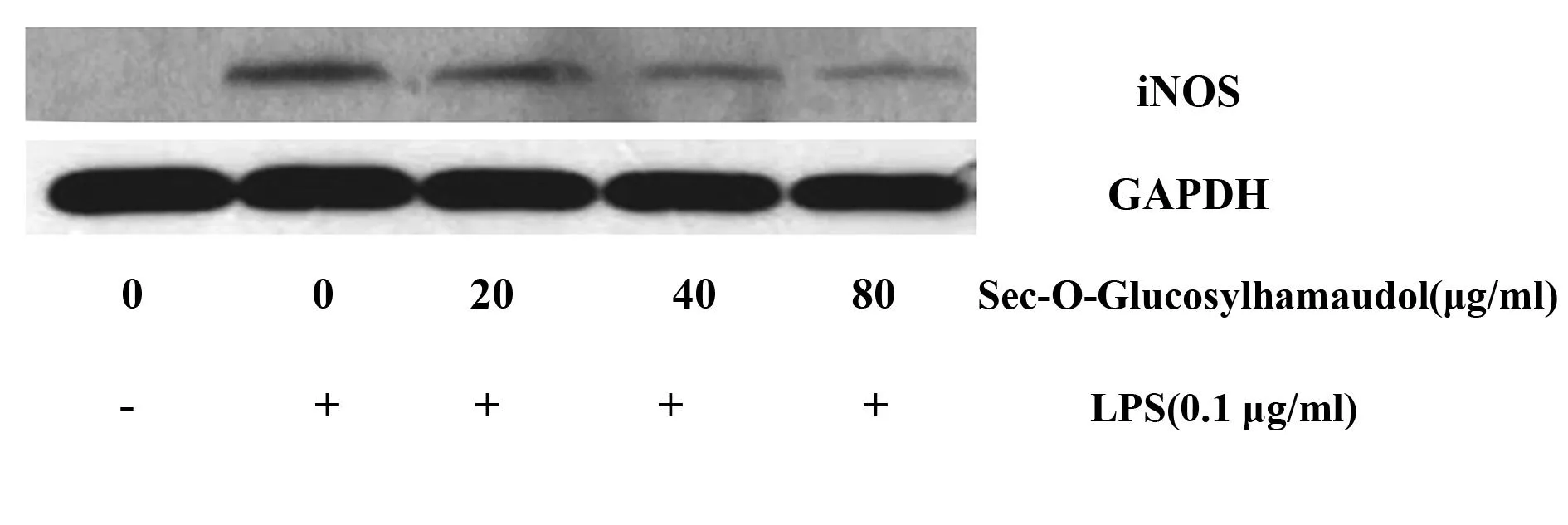
图2 亥茅酚苷抑制脂多糖诱导的巨噬细胞iNOS蛋白的表达Fig.2 Sec-O-Glucosylhamaudol inhibited iNOS express-ion in LPS-induced RAW264.7 cells
表4 亥茅酚苷抑制巨噬细胞iNOS、IL-6 mRNA的表达(±s,n=3)Tab.4 Sec-O-Glucosylhamaudol inhibited iNOS,IL-6 mRNA expression in LPS-induced RAW264.7 cells(±s,n=3)
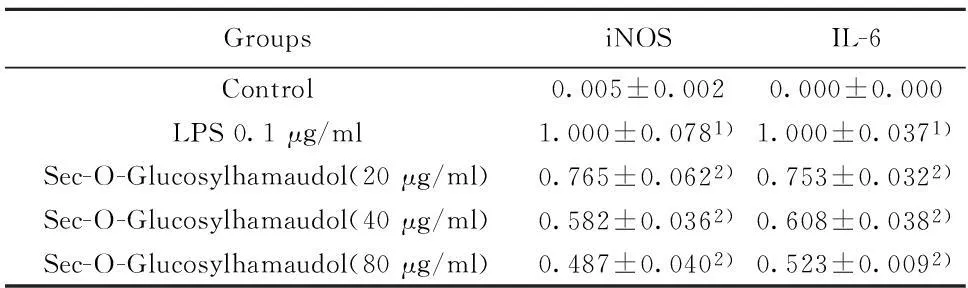
表4 亥茅酚苷抑制巨噬细胞iNOS、IL-6 mRNA的表达(±s,n=3)Tab.4 Sec-O-Glucosylhamaudol inhibited iNOS,IL-6 mRNA expression in LPS-induced RAW264.7 cells(±s,n=3)
GroupsiNOSIL-6Control0.005±0.0020.000±0.000LPS0.1μg/ml1.000±0.0781)1.000±0.0371)Sec-O-Glucosylhamaudol(20μg/ml)0.765±0.0622)0.753±0.0322)Sec-O-Glucosylhamaudol(40μg/ml)0.582±0.0362)0.608±0.0382)Sec-O-Glucosylhamaudol(80μg/ml)0.487±0.0402)0.523±0.0092)
Note:1)P<0.01,significant compared with vehicle-treated control;2)P<0.01,significant compared with LPS alone.
3讨论
炎症是由多细胞参与的复杂过程,其本质是机体应对各种损伤性刺激实现自我保护的复杂防御反应,众多种类的细胞以及活性成分参与了这个过程[5]。而过度的炎症反应则会反过来促使多种疾病的发生和发展,如动脉粥样硬化、糖尿病、脓毒血症以及各种类型的关节炎等[6],其中,巨噬细胞是调节炎症反应的重要细胞,也是体内启动炎症介质的中心细胞。脂多糖经细菌释放进入宿主体内后通过TLR4受体介导,激活巨噬细胞炎症信号通路,诱导大量炎症因子的合成及释放,如NO、前列腺素PGs等炎症介质以及TNF-α和IL-6等促炎性细胞因子,从而导致机体出现一系列的炎症反应。诸多研究表明,在巨噬细胞内,NO主要是在诱导型一氧化氮合成酶(iNOS)催化下产生,高表达的iNOS 以及过度产生的NO,参与了炎症性疾病的发生与发展[7,8]。
中药的抗炎免疫功效已经在临床治疗中得到了广泛的应用,如鱼腥草注射液、牛黄解毒片、板蓝根、双黄连等,并且这些药物的复方或单体抗炎机理也得到了深入的研究[9-12]。灵芝多糖肽、白芍苷、槐定碱[13-15]等植物提取成分也已经在脂多糖诱导的巨噬细胞炎症模型上得到了充分的研究,发现这些化合物对一些炎症介质及促炎因子具有一定的抑制作用,具有潜在的抗炎活性开发价值。已经研究发现的具有抗炎活性的天然成分种类众多,分布广泛,如生物碱、萜类、黄酮、香豆素类、多糖、皂苷、木脂体、鞣质以及脂肪族、芳香族化合物等,周家驹等[16]已在《中药抗炎活性成分》一书中做了系统的阐述。
研究表明,中药防风具有解热、镇痛、镇静、抗炎、抗过敏、抗惊厥、抑菌和增强机体非特异性免疫功能的作用。同为防风中色原酮类化合物升麻甙和5-O-甲基维斯阿米醇甙的解热、镇痛、抗炎活性研究已相对成熟[17]。本研究以脂多糖刺激的RAW264.7巨噬细胞为炎症细胞模型,探讨亥茅酚苷对LPS激活的巨噬细胞NO、IL-6的释放,以及iNOS的表达。结果显示,亥茅酚苷在20~80 μg/ml剂量范围内,剂量依赖性地抑制脂多糖诱导的巨噬细胞产生NO、IL-6,而且对巨噬细胞iNOS蛋白表达也有明显的抑制作用。进一步研究发现,亥茅酚苷在转录水平上对iNOS、IL-6 mRNA有负向调节作用。我们的研究显示亥茅酚苷对LPS诱导的体外炎症反应具有一定的抑制作用,该抑制作用主要表现在其对相应炎症介质基因表达的调控,而其体内抗炎活性值得进一步的探讨。
参考文献:
[1]王成章,张崇禧.防风国内外研究进展[J].人参研究,2008,(1):35-41.
[2]高咏莉.生药防风的化学成分与药理作用研究进展[J].山西医科大大学学报,2004,35(2):216-218.
[3]Shen DD,Xie XJ,Zhu ZJ,etal.Screening active components from Yu-Ping-Feng-San for regulating initiative key factors in allergic sensitization [J]. PloS One,2014,9(9):1-11.
[4]Green LC,Wagner DA,Glogowski J,etal.Analysis of nitrate,nitrite,and [15N]nitrate in biological fluids [J].Anal Biochem,1982,126(1):131-138.
[5]White M.Mediators of inflammation and the inflammatory process[J].J Allergy Clin Immunol,1999,103(3 Pt 2):S378-S381.
[6]Leirisalo-Repo M.The present knowledge of the inflammatory process and the inflammatory mediators[J].Pharmacol Toxicol,1994,75(Suppl 2):1-3.
[7]Cross RK,Wilson KT.Nitric oxide in inflammatory bowel disease[J].Inflamm Bowel Dis,2003,9(3):179-189.
[8]Nagy G,Koncz A,Telarico T,etal.Central role of nitric oxide in the pathogenesis of rheumatoid arthritis and systemic lupus erythematosus[J].Arthritis Res Ther,2010,12(3):210-216.
[9]陈婧,方建国,吴方建,等.鱼腥草抗炎药理作用机制的研究进展[J].中草药,2014,45(2):284-289.
[10]李霞,于庆海,艾明,等.人工培植牛黄抗炎作用及其机制的初步探讨[J].沈阳药科大学学报,2000,17(6):431-433.
[11]刘云海,方建国,谢委.板蓝根抗内毒素机制研究[J].中国药科大学学报,2003,34(5):442-447.
[12]高春联,苗明三.双黄连注射液药理与临床研究分析[J].时珍国医国药,2010,21(12):3066-3070.
[13]游育红,林志彬.灵芝多糖肽对小鼠腹腔巨噬细胞一氧化氮产生的影响[J].中国药理学通报,2004,20(12):1398-1401.
[14]陈刚,郭莉霞,邓小红,等.白芍总苷对巨噬细胞一氧化氮和诱导型一氧化氮合酶生成的影响及其机制研究[J].中国免疫学杂志,2008,24(4):345-347.
[15]张巍,李业成,张高明,等.槐定碱对LPS诱导的RAW264.7巨噬细胞CD14、P38、iNOS表达的影响[J].免疫学杂志,2015,31(2):100-104.
[16]周家驹,谢桂荣,严新建.中药抗炎活性成分[M].北京:科学出版社,2012:1-280.
[17]薛宝云,李文,李丽,等.防风色原酮甙类成分的药理活性研究[J].中国中药杂志,2000,25(5):297-299.
[收稿2015-04-11]
(编辑张晓舟)
