沙棘多糖提取物对LPS/D-GalN诱导的小鼠肝损伤的保护作用及其对TLR4,SOCS3表达的调控①
2016-01-08谢基明董仕超陈俊娜王玉珍
王 雪 张 威 刘 欢 谢基明 董仕超 陈俊娜 王 岩 刘 芳 王玉珍
(内蒙古农业大学生命科学学院,呼和浩特010018)
[摘 要] 目的:研究沙棘多糖提取物对LPS联合D-GalN诱导的肝损伤的保护作用以及对肝脏TLR4,SOCS3蛋白表达的调控。方法:将C57BL/6系雄性小鼠随机分为6组,即空白对照组、模型组、地塞米松阳性对照组、沙棘多糖低、中、高剂量组;沙棘多糖低、中、高剂量组分别以50、100和200 mg/kg沙棘多糖溶液连续灌胃14 d。通过腹腔注射LPS(10 μg/kg)和D-GalN(700 mg/kg)建立急性肝损伤模型,阳性药物组在建模前腹腔注射地塞米松(10 mg/kg)。建模4 h后采集血清和肝脏组织,检测血清ALT和AST水平,HE染色观察沙棘多糖提取物对肝损伤的影响。Western blot检测TLR4,SOCS3的表达情况。结果:沙棘多糖提取物显著降低了LPS/D-GalN诱导的小鼠血清中ALT和AST水平(P<0.01,P<0.05);HE染色观察显示,沙棘多糖明显减轻了肝细胞损伤和炎性细胞浸润。Western blot检测表明,沙棘多糖提取物抑制了LPS/D-GalN诱导的TLR4的表达,但是对SOCS3的表达影响不明显。结论:沙棘多糖提取物有效抑制了LPS/D-GalN诱导的肝损伤,这种保护作用可能是通过抑制TLR4的表达来发挥作用的,而非通过调控SOCS3来实现的。
[关键词] 沙棘多糖;LPS;D-GalN;肝损伤;TLR4;SOCS3
doi:10.3969/j.issn.1000-484X.2015.11.004
沙棘多糖提取物对LPS/D-GalN诱导的小鼠肝损伤的保护作用及其对TLR4,SOCS3表达的调控①
王雪张威刘欢谢基明②董仕超陈俊娜王岩刘芳王玉珍
(内蒙古农业大学生命科学学院,呼和浩特010018)
[摘要]目的:研究沙棘多糖提取物对LPS联合D-GalN诱导的肝损伤的保护作用以及对肝脏TLR4,SOCS3蛋白表达的调控。方法:将C57BL/6系雄性小鼠随机分为6组,即空白对照组、模型组、地塞米松阳性对照组、沙棘多糖低、中、高剂量组;沙棘多糖低、中、高剂量组分别以50、100和200 mg/kg沙棘多糖溶液连续灌胃14 d。通过腹腔注射LPS(10 μg/kg)和D-GalN(700 mg/kg)建立急性肝损伤模型,阳性药物组在建模前腹腔注射地塞米松(10 mg/kg)。建模4 h后采集血清和肝脏组织,检测血清ALT和AST水平,HE染色观察沙棘多糖提取物对肝损伤的影响。Western blot检测TLR4,SOCS3的表达情况。结果:沙棘多糖提取物显著降低了LPS/D-GalN诱导的小鼠血清中ALT和AST水平(P<0.01,P<0.05);HE染色观察显示,沙棘多糖明显减轻了肝细胞损伤和炎性细胞浸润。Western blot检测表明,沙棘多糖提取物抑制了LPS/D-GalN诱导的TLR4的表达,但是对SOCS3的表达影响不明显。结论:沙棘多糖提取物有效抑制了LPS/D-GalN诱导的肝损伤,这种保护作用可能是通过抑制TLR4的表达来发挥作用的,而非通过调控SOCS3来实现的。
[关键词]沙棘多糖;LPS;D-GalN;肝损伤;TLR4;SOCS3
doi:10.3969/j.issn.1000-484X.2015.11.004
中图分类号①本文为国家自然科学基金 (31270922,81260662,81560677)项目。;②内蒙古自治区人民医院检验科,呼和浩特010020。
作者简介:王雪(1991年-),女,主要从事免疫药理方面的研究,E-mail:920159706@qq.com。
通讯作者及指导教师:王玉珍(1976年-),女,教授, 主要从事天然免疫应答的调控研究,E-mail:wangyuzhen817@126.com。
[Abstract]Objective:To study the protective effects of sea buckthorn polysaccharide extracts on lipopolysaccharide(LPS)/D-galactosa mine (D-GalN)-induced liver injury in mice and investigate the regulation on hepatic TLR4 and SOCS3 expression.Methods: C57BL/6 male mice were randomly divided into six groups:control group,model group,dexamethasone positive control group,low,medium and high dose group of sea buckthorn polysaccharide.Mice in the sea buckthorn polysaccharides low,medium and high dose group were gavaged with 50,100 and 200 mg/kg sea buckthorn polysaccharide extracts for 14 days respectively.Acute liver injury model were established by intraperitoneal injection of LPS(10 μg/kg) and D-GalN (700 mg/kg).The mice in the dexamethasone positive control group were intraperitoneally injected with dexamethasone (10 mg/kg) before model establishment.Serum and liver samples were collected after model establishment for 4 h .Serum levels of ALT and AST were detected.Histological changes of liver tissue were observed by HE staining.Hepatic expression of TLR4 and SOCS3 was detected by Western blot.Results: Sea buckthorn polysaccharide significantly inhibited LPS/D-GalN-induced elevation in serum levels of ALT and AST.It also alleviated liver cell injury and inflammatory infiltration.Western blot results showed that sea buckthorn polysaccharide inhibited LPS/D-GalN-induced TLR4 expression.SOCS3 expression was not dramatically influenced by sea buckthorn polysaccharide supplementation.Conclusion: Sea buckthorn polysaccharide protects against LPS/D-GalN-induced liver injury.This protective effects may be achieved by inhibiting the expression of TLR4 but not associated with modulation on SOCS3 expression.
Protective effects of sea buckthorn polysaccharide extracts on LPS/D-GalN-induced liver injury in mice and modulation on TLR4,SOCS3 expression
WANGXue,ZHANGWei,LIUHuan,XIEJi-Ming,DONGShi-Chao,CHENJun-Na,WANGYan,LIUFang,WANGYu-Zhen.CollegeofLifeScience,InnerMongoliaAgriculturalUniversity,Hohhot010018,China
[Key words]Sea buckthorn polysaccharide;LPS;D-GalN;Liver injury;TLR4;SOCS3
沙棘(Hippophae rhamnoides L.),属于胡颓子科沙棘属植物,主要产于我国西北、东北、华北及西南等十多个省区。沙棘具有活血散瘀、化痰宽胸、补脾健胃、生津止渴、清热止泻的功效。早在公元八世纪,沙棘在蒙医和藏医中就被广泛使用。研究发现,沙棘的果实、茎皮、叶子等部分器官中含有丰富的营养及药用成分,具有很高的食用和药用价值[1]。
多糖具有重要的免疫调节作用,广泛存在于植物、动物、微生物中。研究显示,植物多糖对急慢性肝脏损伤疾病有疗效[2-5]。我国是一个肝病大国,保肝和护肝也成为大众关注的重点。沙棘多糖的保肝作用及其机制研究还很缺乏。
TLR4是天然免疫应答中的重要模式识别受体,通过结合脂多糖(LPS)后刺激促炎性因子的大量产生,参与多种肝病的病理过程[6]。 SOCS3是一种细胞因子信号转导的抑制分子,在TLR4识别LPS及转导信号途径中发挥负调控作用,可以下调细胞因子的表达。我们以前的研究表明,沙棘多糖在体外可以促进巨噬细胞的增殖和吞噬细胞活性的增高[7],但沙棘多糖是否具有保肝功能及其对TLR4和SOCS3这一对作用相反的信号分子是否具有调控作用目前还不清楚。本实验通过建立LPS/D-GalN 诱导的肝损伤模型研究沙棘多糖的保肝作用,检测肝脏中TLR4和SOCS3的表达情况分析其作用机制,为保肝新药的研发奠定基础。
1材料与方法
1.1实验材料与试剂实验用沙棘产自呼和浩特,沙棘多糖分离纯化方法依据实验室前期研究成果[9],C57BL/6雄性小鼠购自北京维通利华实验动物有限公司。实验环境:动物房保持通风、干燥、室温22℃~25℃,湿度50%±5%,12 h/12 h昼夜交替,自由饮水,标准饲养饲料。LPS(L4391)购自Sigma公司,D-GalN(G0500)购自Sigma公司,地塞米松磷酸盐注射液(国药H41020055)产自郑州卓峰制药有限公司; TLR4和SOCS3抗体购自美国Cell Signaling公司,免疫组化二抗和DAB显色剂购自北京中杉金桥生物技术有限公司,Western blot二抗购自LI-COR公司。
1.2动物实验方法120只8周龄健康C57BL/6小鼠随机分为6组:正常对照组,肝损伤模型组,地塞米松阳性对照组,沙棘多糖低、中和高剂量组,每组20只小鼠。沙棘多糖低、中、高剂量组分别以50、100和200 mg/kg的沙棘多糖连续灌胃14 d,其余组以同体积生理盐水灌胃,末次灌胃后禁食不禁水24 h,然后通过腹腔注射LPS(10 μg/kg)和D-GalN(700 mg/kg)建立急性肝损伤模型,阳性药物组腹腔注射地塞米松(10 mg/kg),正常组只注射同体积生理盐水。注射后4h时采集各组小鼠的血液和肝脏组织。引颈处死小鼠,摘取肝脏,置于10%中性甲醛中固定,用于HE染色及Western blot分析。
1.3血清中ALT、AST的检测采集的血液静置凝固后,3 000 r/min离心10 min,分离血清,立即检测。血清中ALT、AST含量通过全自动生化分析仪测定,测定结果由内蒙古自治区人民医院检验科提供。
1.4肝脏病理组织形态学观测肝脏组织经石蜡切片、苏木素-伊红染色(Hematoxylin-eosin staining,HE),最后将肝脏组织切片置于400倍光学显微镜下,观测肝小叶结构、肝细胞的结构和形态、炎性细胞浸润灶数量。
1.5Western blot检测肝脏组织TLR4、SOCS3的表达情况肝脏组织按照重量/体积=1/9的比例加入组织蛋白抽提液,经破碎后4 000 r/min离心10 min即得到10%肝脏组织蛋白匀浆,利用BCA试剂盒方法检测蛋白含量。经SDS-PAGE电泳分离所需蛋白,湿法转膜到聚偏二氟乙烯膜(PVDF)。 5% BSA 封闭1 h后,分别加入TLR4一抗、SOCS3一抗于两块PVDF膜,4℃孵育过夜。经TBST分别数次洗膜后加入二抗室温孵育1 h,再次洗膜后用Odyssey红外激光扫描成像仪分别检测两种蛋白的表达量,并分析其变化。
2结果
2.1沙棘多糖对血清中ALT、AST的影响血清中的ALT、AST通常被当作急性肝损伤早期的重要生化指标。从ALT和AST检测结果的统计学分析中可以看出(图1),在LPS/D-GalN诱导的肝损伤模型中,4 h时模型组比正常对照组的ALT、AST的活性有显著升高,说明模型构建成功。同时可以看出沙棘多糖显著抑制了小鼠血清中ALT和AST活性的上升(P<0.01,P<0.05),并且具有剂量依赖性。
2.2沙棘多糖对肝脏组织病理形态的影响如肝脏病理组织切片结果所示(图2),与对照组相比,LPS/D-GalN诱导的肝损伤模型组肝组织内可见较多的炎性细胞浸润。地塞米松治疗组肝脏组织内极少见炎性浸润灶。沙棘多糖作用后炎性细胞浸润灶明显减少,尤其是在中高剂量组更为明显。

图1 沙棘多糖对LPS/D-GalN诱导的肝损伤小鼠血清中ALT、AST的影响Fig.1 Effects of sea buckthorn polysaccharides on serum activities of ALT and AST in LPS/D-GalN induced liver injury miceNote: A.Control group;B.Model group;C.Dexamethasone positive control group;D.Low dose group of sea buckthorn polysacc-harides;E.Medium dose group of sea buckthorn polysaccharides;F.High dose group of sea buckthorn polysaccharides,*.P<0.05,**.P<0.01.
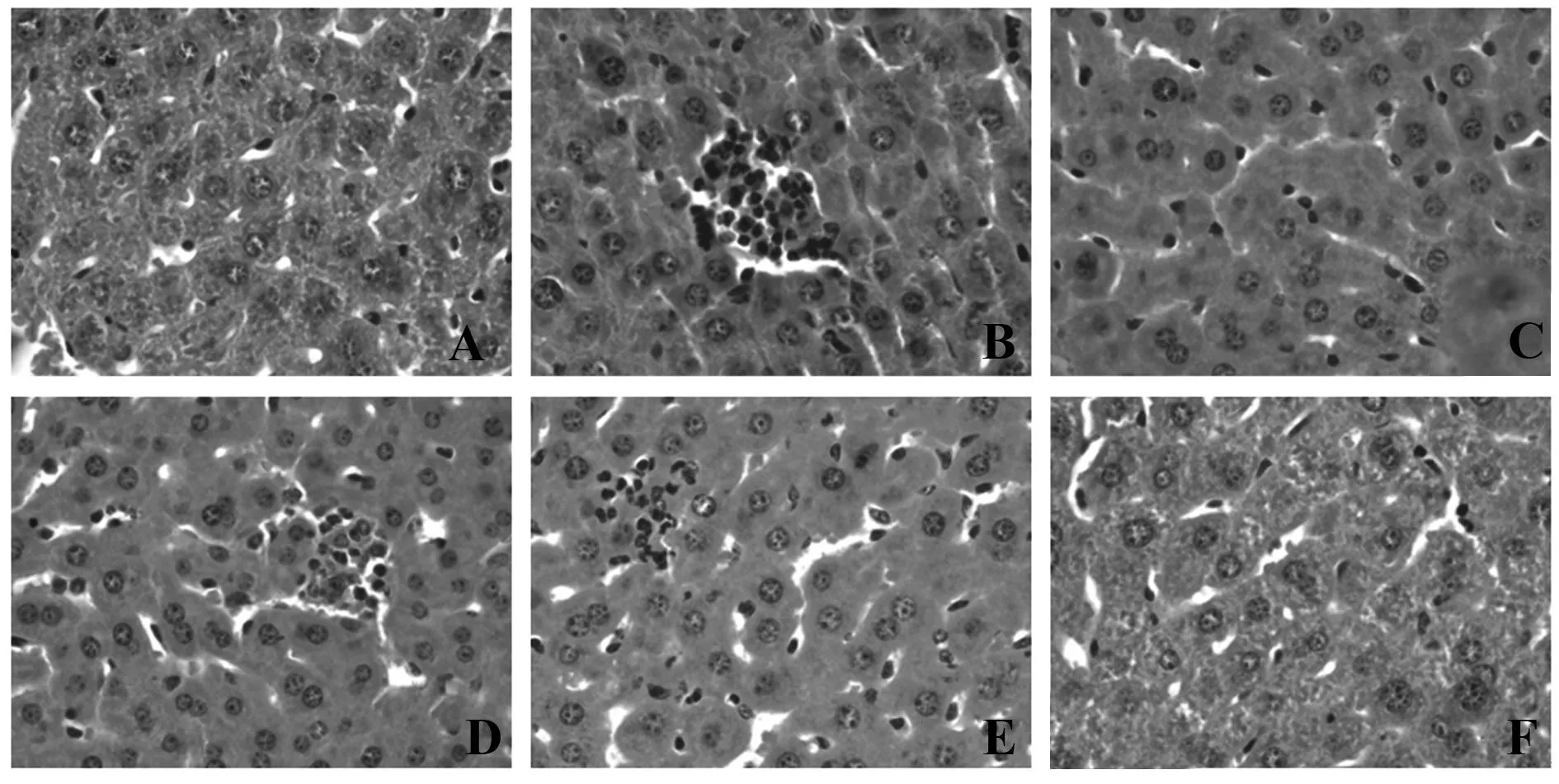
图2 肝脏组织病理切片(HE染色,×400)Fig.2 Histopathology of liver tissue (HE staining,×400)Note: A.Control group;B.Model group;C.Dexamethasone positive control group;D.Low dose group of sea buckthorn polysacc-harides;E.Medium dose group of sea buckthorn polysaccharides;F.High dose group of sea buckthorn polysaccharides.
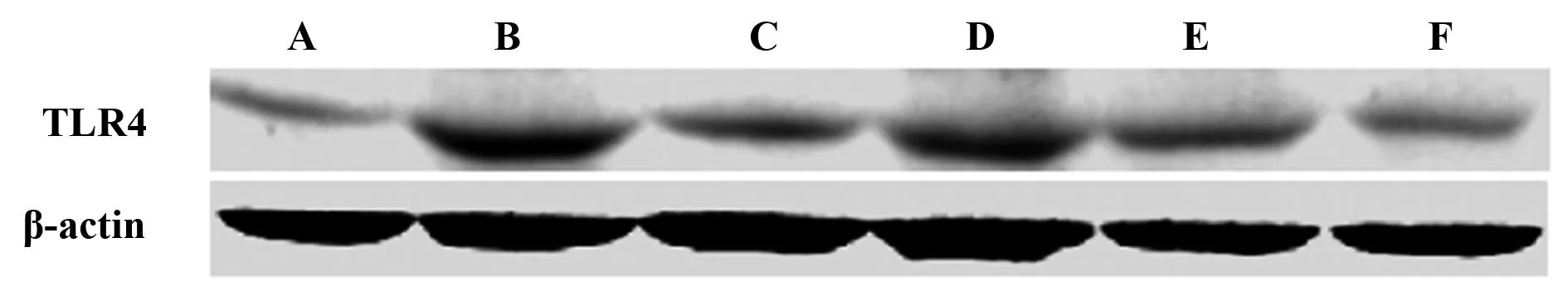
图3 Western blot检测沙棘多糖对肝组织中TLR4表达的影响Fig.3 Effects of sea buckthorn polysaccharide on hepatic TLR4 expression detected by Western blotNote: A.Control group;B.Model group;C.Dexamethasone positive control group;D.Low dose of sea buckthorn polysaccharides;E.Medium dose group of sea buckthorn polysaccharides;F.High dose group of sea buckthorn polysaccharides.
2.3沙棘多糖对肝脏中TLR4表达的影响TLR4在正常组的小鼠肝脏组织中有少量的本底表达,而模型组中TLR4的表达量显著增高,沙棘多糖各剂量组小鼠肝脏中TLR4的表达量比模型组都有所降低,且随沙棘多糖量的增多呈现出逐次降低的趋势,高剂量组的效果最为明显 (图3)。本实验采用红外激光扫描成像系统软件(Odyssey CLX)对TLR4与内参actin的Western blot结果进行光密度比对,从而对TLR4的表达量进行一个相对定量分析,根据软件统计结果也可以看出沙棘多糖剂量依赖性地降低了LPS/D-GalN诱导的TLR4的表达(图4)。
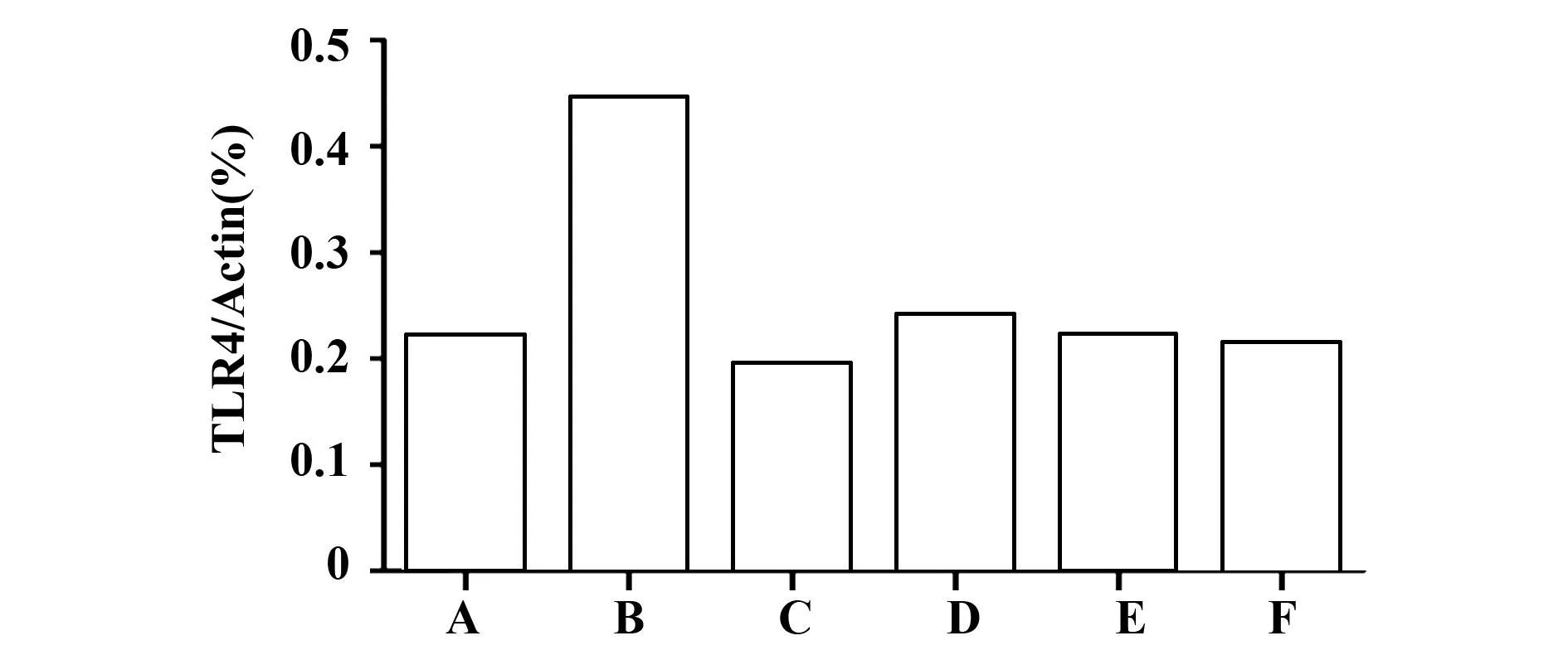
图4 肝脏组织中TLR4/actin的Western blot检测结果的相对定量分析Fig.4 Relative and quantitative analysis of hepatic TLR4/actin detected by Western blotNote: A.Control group;B.Model group;C.Dexamethasone positive control group;D.Low dose group of sea buckthorn polysaccharides;E.Medium dose group of sea buckthorn polysaccharides;F.High dose group of sea buckthorn polysaccharides.

图5 Western blot检测沙棘多糖对肝脏中SOCS3的影响Fig.5 Effects of sea buckthorn polysaccharide on hepatic SOCS3 expression detected by Western blotNote: A.Control group;B.Model group;C.Dexamethasone positive control group;D.Low dose group of sea buckthorn polysaccharides;E.Medium dose group of sea buckthorn polysaccharides;F.High dose group of sea buckthorn polysaccharides.
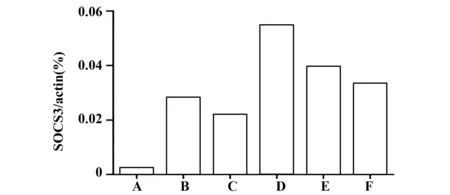
图6 肝脏组织中SOCS3/actin的Western blot检测结果的相对定量分析Fig.6 Relative and quantitative analysis of hepatic SOCS3/actin detected by Western blotNote: A.Control group;B.Model group;C.Dexamethasone positive control group;D.Low dose group of sea buckthorn polysaccharides;E.Medium dose group of sea buckthorn polysacc-harides;F.High dose group of sea buckthorn polysaccharides.
2.4沙棘多糖对肝脏中SOCS3表达的影响通过实验结果可以看出(图5和图6),正常组的小鼠肝脏中SOCS3基本没有表达,模型组SOCS3诱导性增高,地塞米松组和沙棘多糖各剂量组中SOCS3的表达量与模型组相比没有明显差别。由此可知沙棘多糖可能对SOCS3的表达没有影响。
3讨论
LPS作为内毒素,可引起体内天然免疫系统的激活,产生大量促炎性因子,这些炎性因子可引起一系列炎症反应,它们的过量表达与肝损伤和肝细胞坏死有着密不可分的关系,D-GalN的作用是消耗肝细胞内的磷酸尿嘧啶核苷酸使细胞处于异常状态,成倍放大LPS的效应[8]。地塞米松是一种糖皮质激素,有文献显示其可以有效抑制TLR4信号通路抑制促炎性因子的合成,保护肝细胞[9],所以选用地塞米松作为实验的阳性对照药物。实验研究表明,LPS/D-GalN共同作用会引起小鼠肝脏强烈的炎症反应,从而引起肝细胞弥漫性变性、坏死、炎症细胞的浸润等。因此本实验通过LPS/D-GalN共同作用诱导小鼠急性肝损伤来模拟肝炎的发生。
采用HE染色检测沙棘多糖对肝脏组织病理切片的影响,同时结合ALT和AST两项指标的检测结果探究沙棘多糖对肝损伤小鼠肝脏组织的保护作用。LPS在机体内与其结合蛋白相结合成一种可溶性复合体,直接与细胞表面受体TLR4结合,通过TLR4信号通路跨膜传导至胞浆中激活NF-κB信号通路,又通过活化的NF-κB进入核内,激活促炎性因子的转录翻译,诱发大量促炎性因子的合成;SOCS3是一种细胞因子信号传导抑制分子,在TLR4识别LPS及转导信号途径中发挥负调控作用,抑制NF-κB通路,下调细胞因子的表达。本实验通过Western blot检测肝损伤小鼠肝脏组织中TLR4和SOCS3的表达量来进一步探索沙棘多糖对肝脏的保护作用机制。
我们的研究结果显示,沙棘多糖剂量依赖性地降低了TLR4的表达。文献报道显示,TLR4的表达量与肝损伤程度呈正相关[10],说明沙棘多糖通过抑制TLR4的表达发挥保肝作用。对TLR4信号通路负调控因子SOCS3进一步检测发现,其在各组的表达量无明显变化,说明沙棘多糖对SOCS3的表达无影响,因此我们推测沙棘多糖可能通过抑制TLR4信号通路抑制促炎性因子表达,从而发挥保肝作用,这一保护作用并非通过调控SOCS3的表达实现的。
综上所述,可以认为沙棘多糖具有良好的抗炎作用,可以有效缓解LPS/D-GalN诱导的小鼠急性肝损伤,达到保护肝脏的效果。沙棘多糖的天然免疫调节机制可能是通过调节TLR4信号通路来实现的。
参考文献:
[1]丁小林,秦利平.沙棘中的营养成分与生物活性物质研究进展[J].中国食物与营养,2008,9(1):57-59.
[2]王君巧,聂少平,余强,等.黑灵芝多糖对免疫抑制小鼠的免疫调节和抗氧化作用[J].食品科学,2012,33(23):274-277.
[3]李天一,汪丽佩,吴国琳,等.黄芪多糖对免疫性肝损伤小鼠协同刺激分子的影响[J].中华中医药学刊,2014,32(3):529-531.
[4]吴巧攀,乔洪翔,何厚洪,等.银杏叶渣中多糖的提取及其抗氧化活性研究[J].中国现代应用药学,2014,31(1):9-13.
[5]郭凤霞,曾阳,马继雄,等.沙棘粗多糖对正常和造模糖尿病小鼠血糖影响的研究[J].中国药物警戒,2012,9(11):647-651.
[6]Ben-Ari Z,Avlas O,Fallach R,etal.Ischemia and reperfusion liver injury is reduced in the absence of Toll-like receptor 4[J].Cell Physiol Biochem,2012,30(2):489-498.
[7]宋亮,谢基明,王玉珍,等.沙棘多糖的提取纯化及其对巨噬细胞的作用研究[J].内蒙古农业大学学报(自然科学版),2013,34(5):87-92.
[8]Wang Y,Li Y,Xie J.Protective effects of probiotic Lactobacillus casei Zhang against endotoxin- and d-galactosa mine-induced liver injury in rats via anti-oxidative and anti-inflammatory capacities[J].Int Immunopharmacol,2013,15(1):30-37.
[9]李云旭,王玉珍,王金玲,等.地塞米松对大鼠急性肝衰竭的治疗作用及机制探讨[J].内蒙古农业大学学报(自然科学版),2012,33(3):136-140.
[10]李和平,李曼曼,汪新建,等.TLR4信号分子在脂多糖诱导小鼠肝损伤过程中的变化[J].中国兽医学报,2014,34(12):1962-1966.
[收稿2015-03-21修回2015-06-24]
(编辑许四平)
