ADAM9 在胰腺癌中的表达及临床意义
2015-12-31伍丹丹张吉翔刘玉兰董卫国
伍丹丹,张吉翔,刘玉兰,柳 舟,董卫国
武汉大学人民医院消化内科,湖北 武汉430060
胰腺癌是消化道常见的恶性肿瘤之一,除了手术,目前没有其他有效的治疗方法,且手术患者多于1 年内死亡[1-2],对人们健康构成巨大威胁。病理上胰腺癌患者约90%属于腺癌,90%为胰腺导管细胞癌,早期临床症状多不典型。随着分子生物学研究的进展,虽有多种基因表达产物被证实与胰腺癌的发生、发展密切相关,但其分子机制大多不明确[3-4]。研究[5]报道,去整合素-金属蛋白酶(a disintegrin and metalloproteinase,ADAM)9 基因是在胰腺癌中过表达的候选基因之一。ADAM9 又称mehrin γ,是ADAM 大家族的一员,属于1 型跨膜蛋白,含有8 个结构域。研究发现ADAM9 在前列腺癌、乳腺癌、结肠癌和肝癌等多种恶性肿瘤及其转移癌中表达显著升高[6-8],在小鼠肿瘤模型中有促进肿瘤发展的作用[9]。ADAM9 可以裂解和释放肿瘤发生和血管生成的重要分子,如EGF、Tie-2、FGFR2iiibFlk-1、EphB4、CD40、VCAM-1、TNF-α 和VE-cadherin,有助于细胞与细胞、细胞与基质间的相互作用,在高表达的肿瘤组织中可作为潜在的治疗靶点[10]。本研究旨在探讨ADAM9 在胰腺癌组织中的蛋白表达量,并分析其与临床病理特征之间的关系,为胰腺癌的预防和治疗提供新的理论依据。
1 材料与方法
1.1 一般材料 胰腺癌组织芯片(OD-CT-DgPan03)购自上海芯超生物科技有限公司,包含人胰腺导管腺癌31 例,每例均提供相应癌旁组织(病检均为正常胰腺组织);男20 例,女11 例,平均年龄(59.13 ±9.86)岁;根据WTO 肿瘤细胞病理分级[11],Ⅰ级(高分化)4例,Ⅰ~Ⅱ级(介于高分化和中分化之间)4 例,Ⅱ级(中分化)23 例。所有组织均经10%的甲醛缓冲液固定24 h,并经过统一方法加工处理,采用美国Superfrost Plus 或APES 处理的Superfrost Plus 防脱载玻片固定组织标本。
1.2 方法
1.2.1 主要试剂:鼠抗人ADAM9 单克隆抗体,购自美国R&D 公司,工作浓度按1∶200 稀释;即用型免疫组化超敏SP(鼠/兔)试剂盒、氨基联苯胺(DAB)显色试剂盒购自福州迈新生物技术有限公司;PBS 购自杭州吉诺生物医药技术公司。
1.2.2 免疫组化染色:采用免疫组化SP 法,按照试剂盒染色步骤,切片常规脱蜡,微波抗原修复,BSA 封闭,滴加一抗过夜,滴加生物素化的鼠抗兔IgG 30 min,DAB 染色,苏木精复染、脱水、透明、封片。采用PBS 代替一抗作空白对照,非免疫血清代替一抗作阴性对照,已知阳性片作阳性对照。
1.2.3 ADAM9 半定量积分法[12]:根据细胞对染色反应的阳性强度及阳性细胞率分别进行分级计分。每张切片至少选取5 个高倍(400 倍)视野,每个视野计数100 个细胞,细胞的染色强度按无着色、淡黄色、棕黄色和棕褐色分别记为0、1、2、3 分,染色强度≥1 分的细胞记为阳性细胞;ADAM9 阳性细胞率取5 次阳性细胞计数平均百分数,按<25%、25% ~50%、51% ~75%、>75%分别记为0、1、2、3 分。根据上述两项记分之和判断结果,≥2 分的记为ADAM9 表达阳性,<2分的记为阴性。
1.3 统计学处理 采用SPSS 19.0 软件进行统计学分析,定性资料采用配对χ2检验及Fisher 确切概率法。P <0.05 为差异有统计学意义。
2 结果
2.1 免疫组化结果 ADAM9 表达于细胞质及细胞膜上,但主要在胞浆中,呈弥散分布,染色呈浅黄色、棕黄色或棕褐色者为阳性细胞(见图1)。
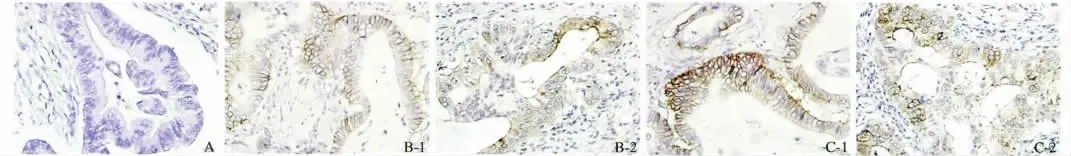
图1 ADAM9 在胰腺癌及癌旁正常组织中的表达(SP 400 ×) A:癌旁正常组织中呈阴性表达;B-1、B-2:Ⅰ级胰腺导管细胞癌组织中表达升高;C-1、C-2:Ⅱ级胰腺导管细胞癌组织中表达明显升高Fig 1 The expression of ADAM9 in pancreatic cancer tissues and paracancerous tissues (SP 400 ×) A:the expression of ADAM9 in paracancerous tissues was negative;B-1,B-2:the expression of ADAM9 in the Ⅱgrade pancreatic cancer tissues was increased;C-1,C-2:the expression of ADAM9 in the Ⅱgrade pancreatic cancer tissues was increased obviously
2.2 ADAM9 在胰腺癌及癌旁正常胰腺组织中的表达 ADAM9 主要表达在胰腺癌组织中,总得分为1 ~6 分,ADAM9 阳性表达率高达80.65%(25/31);癌旁正常组织中多数导管上皮呈阴性着色,部分胞浆呈弱着色,细胞膜均未有阳性着色,ADAM9 阳性表达率仅为9.68%(3/31)。经配对χ2检验分析,ADAM9 在胰腺癌组织中的阳性表达明显高于癌旁正常胰腺组织,差异有统计学意义(χ2=1,P <0.01)。
2.3 胰腺癌组织中ADAM9 的阳性表达与患者临床特征的关系 经Fisher 确切概率法分析,在胰腺癌组织中ADAM9 的阳性表达与胰腺癌的WTO 细胞病理分级和年龄有关(P <0.05),与患者性别无明显相关性(P >0.05,见表1)。
3 讨论
胰腺癌是全球恶性肿瘤导致死亡的主要原因之一,临床上诊断为胰腺癌的患者生存时间多不超过两年,中位生存期仅为2 ~3 个月。胰腺癌在诊断时多已发展为进展期肿瘤或发生远处转移,常见的转移部位有肝脏、肺脏和腹膜。治疗目标通常是缓解症状,治愈几乎不可能,手术或化学疗法多是为提高患者存活率或末期生活质量。

表1 胰腺癌组织中ADAM9 的阳性表达与临床参数的关系[例数(%)]Tab 1 Relationship between the expression of ADAM9 in pancreatic cancer tissue and clinical parameters[n(%)]
肿瘤发生侵袭和转移必须具备两个条件,即肿瘤血管生成和破坏细胞外基质(extracellular matrix,ECM),ECM 是肿瘤组织转移的第一道屏障。Liotta等[13]提出了肿瘤细胞侵袭过程的3 步假说:肿瘤细胞之间解黏附及肿瘤细胞与ECM 黏附,肿瘤细胞与宿主细胞分泌蛋白水解酶使ECM 降解,肿瘤细胞被生长因子和趋化因子诱导,向纵深运动,发生浸润及转移。细胞与细胞、细胞与基质间的相互作用对组织稳态具有重要作用,异常的细胞作用能促进肿瘤的发生、侵袭和转移,其中涉及一些重要的细胞分子,如EGF、Tie-2、FGFR2iiibFlk-1、EphB4、CD40、VCAM-1、TNF-α 和VEcadherin 等,这些分子多为肿瘤发生和血管生成的重要分子,在被蛋白酶水解或细胞释放后才能发挥作用,而ADAMs 是这些分子发生作用所涉及的主要酶类[10]。
ADAMs 是具有破坏细胞黏附、降解ECM 及促进血管生成等多种生物学功能的1 型跨膜蛋白,含有一个N 端的金属蛋白酶区域、去整合素区域、半胱氨酸富含区域、内皮生长素样区域及具有潜在信号模体的大胞质尾。ADAM9 是该家族广泛表达的蛋白之一,在正常组织中多为低表达,而在肾癌、前列腺癌、乳腺癌、黑色素瘤和结肠癌等恶性肿瘤中均呈高表达。研究报道,ADAM9 在肿瘤发生、侵袭及转移过程中发挥重要作用。ADAM9 在小鼠模型中有肿瘤发生的作用[9];过表达的ADAM9 蛋白可促进乳腺癌细胞的侵袭力[6-10],沉默ADAM9 基因则可抑制乳腺癌细胞的侵袭力[14];敲除ADAM9 基因后,可促使肿瘤细胞发生形态学改变,增加对放化疗的敏感性,降低肿瘤细胞的侵袭力[15]。
本次研究通过免疫组化的方法检测ADAM9 在胰腺癌中的表达量,并分析表达量的差异是否与肿瘤细胞的分化程度和患者年龄、性别相关。ADAM9 在胰腺癌中的阳性表达率高达(80.65%),明显高于癌旁正常胰腺组织(9.68%),且主要表达于细胞的胞浆中。ADAM9 的表达量与肿瘤细胞的分化程度有关,在高分化的胰腺癌中阳性表达率为较低,在中分化的胰腺癌中阳性表达率较高,因此,ADAM9 的表达可能与胰腺癌的恶性程度有关。ADAM9 的表达在不同年龄层中也有明显差异,≥60 岁的胰腺癌病例比<60 岁的胰腺癌病例阳性表达率高,且差异有统计学意义。年龄是胰腺癌发生的一个重要高危因素,因此,ADAM9 可能是导致高危人群发生胰腺癌的原因之一。
ADAM9 促进肿瘤细胞发生、侵袭和转移的可能机制有:(1)ADAM9 通过整合素区域作用于细胞黏附及细胞与基质黏附。ADAM9 结合α6β1整合素后可显著诱导成纤维细胞活力来促进细胞迁移[16],在非小细胞肺癌中ADAM9 作为配体结合α3β1整合素,能增强肿瘤细胞的侵袭力,引起脑组织发生转移[17]。(2)ADAM9 可作为蛋白水解酶降解ECM,ADAM9 金属蛋白酶区域在弗林蛋白转换酶的作用下使无活性的蛋白水解酶前体转变为有活性的蛋白水解酶,可以降解ECM蛋白,为肿瘤细胞的侵袭和转移提供有力的条件。(3)去整合素区域和半胱氨酸富含区域有助于肿瘤细胞和基质细胞产生黏附,促进ADAM9 金属蛋白酶在肿瘤细胞侵袭过程中发挥作用[18]。另外,ADAM9 可通过裂解EGF 受体配位子和成纤维细胞因子受体而促成前列腺癌的发生[9],ADAM9 也可裂解和释放肿瘤发生和血管生成的其他重要分子,如EFGFR2iiib、Tie-2、Flk-1、EphB4 等。ADAM9 可在肿瘤细胞发生、侵袭和转移过程的每一步发挥作用,因此,ADAM9 与肿瘤的发生、发展密切相关。
本研究表明,ADAM9 在胰腺癌组织中的表达显著高于正常胰腺组织,且ADAM9 的表达与肿瘤细胞分化程度和患者年龄具有相关性,提示ADAM9 促进胰腺癌的发生、发展。由于病例数较少及临床资料不完整,未能分析ADAM9 表达与肿瘤分期、淋巴结转移及生存时间等是否相关。
综上所述,ADAM9 的表达与胰腺癌的发生、发展密切相关,可作为提示肿瘤恶性生物学行为的一个指标,且可为临床治疗胰腺癌提供新的靶点。
[1] Siegel R,Ma J,Zou Z,et al. Cancer statistics,2014[J]. CA Cancer J Clin,2014,64(1):9-29.
[2] Chen WQ,Zhang SW,Zeng HM,et al. Report of cancer incidence and mortality in China,2010 [J]. China Cancer,2014,23(1):1-10.陈万青,张思维,曾红梅,等. 中国2010 年恶性肿瘤发病与死亡[J].中国肿瘤,2014,23(1):1-10.
[3] Oshima M,Okano K,Muraki S,et al. Immunohistochemically detected expression of 3 major genes (CDKN2A/p16,TP53,and SMAD4/DPC4)strongly predicts survival in patients with resectable pancreatic cancer[J]. Ann Surg,2013,258(2):336-346.
[4] Yang L,Yang H,Li J,et al. ppENK gene methylation status in the development of pancreatic carcinoma [J]. Gastroenterol Res Pract,2013,2013:130927.
[5] Alldinger I,Dittert D,Peiper M,et al. Gene expression analysis of pancreatic cell lines reveals genes overexpressed in pancreatic cancer[J].Pancreatology,2005,5(4-5):370-379.
[6] Lendeckel U,Kohl J,Arndt M,et al. Increased expression of ADAM family members in human breast cancer and breast cancer cell lines[J]. J Cancer Res Clin Oncol,2005,131(1):41-48.
[7] Tao K,Qian N,Tang Y,et al. Increased expression of a disintegrin and metalloprotease-9 in hepatocellular carcinoma:implications for tumor progression and prognosis[J]. Jpn J Clin Oncol,2010,40(7):645-651.
[8] Hirao T,Nanba D,Tanaka M,et al. Overexpression of ADAM9 enhances growth factor-mediated recycling of E-cadherin in human colon cancer cell line HT29 cells [J]. Exp Cell Res,2006,312(3):331-339.
[9] Peduto L,Reuter VE,Shaffer DR,et al. Critical function for ADAM9 in mouse prostate cancer [J]. Cancer Res,2005,65 (20):9312-9319.
[10] Peduto L. ADAM9 as a potential target molecule in cancer[J]. Curr Pharm Des,2009,15(20):2282-2287.
[11] Li YL. Pathology[M]. 7th ed. Beijing:People's Medical Publication House,2008:89.李玉林. 病理学[M]. 7 版. 北京:人民卫生出版社,2008:89.
[12] Shi W,Li JS. Clinical significance of the expression of ADAM9 in colon carcer[J]. J Southeast Univ (Med Sci Edi),2009,28(4):274-278.施文,李俊生. 结肠癌组织中ADAM9 的表达及其与微血管密度的关系[J]. 东南大学学报(医学版),2009,28(4):274-278.
[13] Liotta LA,Rao CN,Barsky SH. Tumor invasion and the extracellular matrix[J]. Lab Invest,1983,49(6):636-649.
[14] Micocci KC,Martin AC,Montenegro Cde F,et al. ADAM9 silencing inhibits breast tumor cell invasion in vitro[J]. Biochimie,2013,95(7):1371-1378.
[15] Josson S,Anderson CS,Sung SY,et al. Inhibition of ADAM9 expression induces epithelial phenotypic alterations and sensitizes human prostate cancer cells to radiation and chemotherapy [J]. Prostate,2011,71(3):232-240.
[16] Nath D,Slocombe PM,Webster A,et al. Meltrin gamma (ADAM-9)mediates cellular adhesion through alpha(6)beta(1)integrin,leading to a marked induction of fibroblast cell motility[J]. J Cell Sci,2000,113(Pt 12):2319-2328.
[17] Shintani Y,Higashiyama S,Ohta M,et al. Overexpression of ADAM9 in non-small cell lung cancer correlates with brain metastasis[J]. Cancer Res,2004,64(12):4190-4196.
[18] Zigrino P,Nischt R,Mauch C. The disintegrin-like and cysteine-rich domains of ADAM-9 mediate interactions between melanoma cells and fibroblasts[J]. J Biol Chem,2011,286(8):6801-6807.
