溃疡性结肠炎外周血CD3 + 、CD4 + 、CD8 + T 细胞的活化及其与炎症标志物的关系
2015-12-31袁柏思金鑫鑫路又可王少东杨妙芳汪芳裕
袁柏思,金鑫鑫,路又可,刘 炯,王少东,杨妙芳,汪芳裕
南京军区南京总医院消化内科,江苏 南京210002
肠道炎症和黏膜组织损伤是溃疡性结肠炎(ulcerative colitis,UC)的主要特征,确切病因还不清楚,免疫反应异常是UC 的重要发病机制之一[1]。T 淋巴细胞是免疫反应中抗原递呈的核心环节,又是重要的免疫调节剂,它们参与黏膜炎症的多种免疫反应。局部的炎症反应会通过不同的途径刺激全身的免疫反应系统,出现一系列指标的变化,本研究拟探讨UC 患者外周血CD3+、CD4+、CD8+T 淋巴细胞的表达变化及其与血液中炎症相关指标的关系。
1 资料与方法
1.1 一般资料 选取2014 年1 月-2014 年8 月南京军区南京总医院住院的UC 患者,本研究临床数据摘自医院的电子病历、内镜诊断、影像学和实验室检测资料。UC 诊断标准均参照中华医学会消化病学分会炎症性肠病协作组2012 年制订的《炎症性肠病诊断与治疗的共识意见(2012 年·广州)》[2]。UC 的蒙特利尔分型[3]为E1:局限于直肠,未达乙状结肠;E2:累及左半结肠(脾曲以远);E3:广泛病变累及脾曲以近乃至全结肠。符合标准的UC 患者25 例,男17 例,女8例,年龄21 ~74 岁,平均年龄(44.2 ±15.3)岁;病程1个月~40 年,平均病程(65.6 ±18.9)个月;E1 型1例,E2 型11 例,E3 型13 例;根据Sourtherland 疾病活动指数(DAI)[4]分为缓解期13 例和活动期12 例。其中15 例(60.0%)患者采用5-氨基水杨酸治疗,1 例(4.0%)采用免疫抵制剂治疗,9 例(36.0%)采用激素治疗,无手术治疗。对照组为7 名健康对照者,男4例,女3 例,年龄26 ~66 岁,平均(40.6 ±16.2)岁,既往无肝炎、结核、自身免疫性疾病等病史,近3 个月未服用激素、免疫抑制剂及生物制剂等药物。收集所有入选者的外周血标本。本研究得到本院伦理委员会批准,入选者均知情同意。
1.2 标本采集和检测 受检者均于早晨空腹采集静脉血2 ml,流式细胞仪检测外周血CD3+、CD4+及CD8+T 细胞的比例;另通过血细胞分析仪检测白细胞、血小板及C-反应蛋白(CRP)水平,自动化生化分析仪检测血清白蛋白水平。魏氏法检测血沉结果(参考值0 ~15 mm/h)。
1.3 统计学方法 采用SPSS 22.0 软件包进行统计学处理。两组均数的比较采用t 检验,相关性分析采用Spearman 检验,P <0.05 为差异有统计学意义。
2 结果
2.1 外周血T 细胞比例 健康对照人群和UC 患者的CD3+、CD4+和CD8+T 细胞流式细胞仪测定如图1所示。UC 患者外周血CD3+、CD4+和CD8+T 细胞的比例明显高于健康对照组,差异有统计学意义(P <0.05);活动期UC 患者T 细胞的比例明显高于正常对照组,差异有统计学意义(P <0.05);缓解期UC 患者虽略高于对照组,但仅CD8+差异有统计学意义(见图2A ~C)。
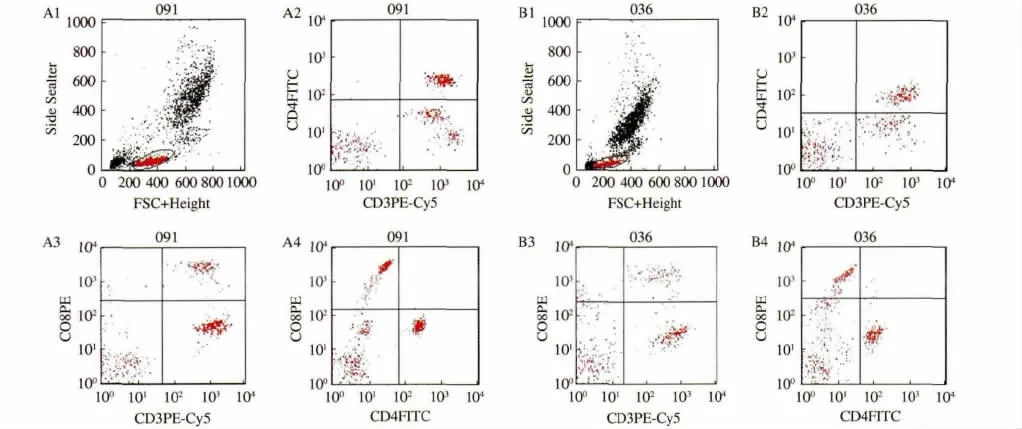
图1 流式细胞仪测定图 A:健康对照组;B:UC 组Fig 1 Representative dotplots of CD3 +,CD4 + and CD8 + T cells A:healthy control;B:UC group
2.2 外周血炎症相关指标 UC 患者白细胞计数、血小板计数、CRP 和白蛋白明显高于健康对照组(P <0.05),而血沉在两组间的差异无统计学意义(P >0.05);UC 活动组血小板计数、CRP、血沉和白蛋白明显高于健康对照组(P <0.05),而白细胞计数在两组间的差异无统计学意义(P >0.05)(见图2D ~H)。
2.3 T 细胞亚群与外周血炎症相关指标相关性分析CD3+、CD8+T 淋巴细胞比例与CRP 及血沉呈明显正相关,CD4+比例与CRP 呈明显正相关(P <0.05,见图3);CD4+T 细胞与血沉,CD3+、CD4+和CD8+T 与白细胞、血小板和白蛋白无相关性(P >0.05,数据未列出)。
3 讨论
肠黏膜屏障受损是UC 发生、发展的重要环节,肠腔内的病原微生物及其代谢产物通过受损的黏膜屏障进入循环,激发机体的炎症反应,导致一系列炎症相关指标变化。我们对UC 病情相关的部分指标进行检测,结果显示UC 活动组的白细胞计数、血小板计数、CRP和血沉均高于健康对照组,而白蛋白水平低于健康对照组。因此,UC 患者肠道的慢性炎症环境使外周血中的一系列炎症相关指标产生相应的变化,可能是由于病菌和毒素通过受损的肠黏膜屏障释放入血产生许多炎症介质及细胞因子所致,这将会对机体的免疫系统产生相应的免疫反应[5]。

图2 UC 组与对照组T 细胞亚群及炎症相关指标比较图 A:CD3 +T 细胞比例;B:CD4 +T 细胞比例;C:CD8 +T 细胞比例;D:白细胞计数;E:血小板计数;F:血沉;G:CRP 水平;H:白蛋白水平Fig 2 Comparison of T lymphocytes subsets and inflammation-related markers between UC group and control group A:CD3 +T lymphocyte;B:CD4 +T lymphocyte;C:CD8 +T lymphocyte;D:white blood cell count;E:platelet count;F:ESR;G:CRP;H:albumin
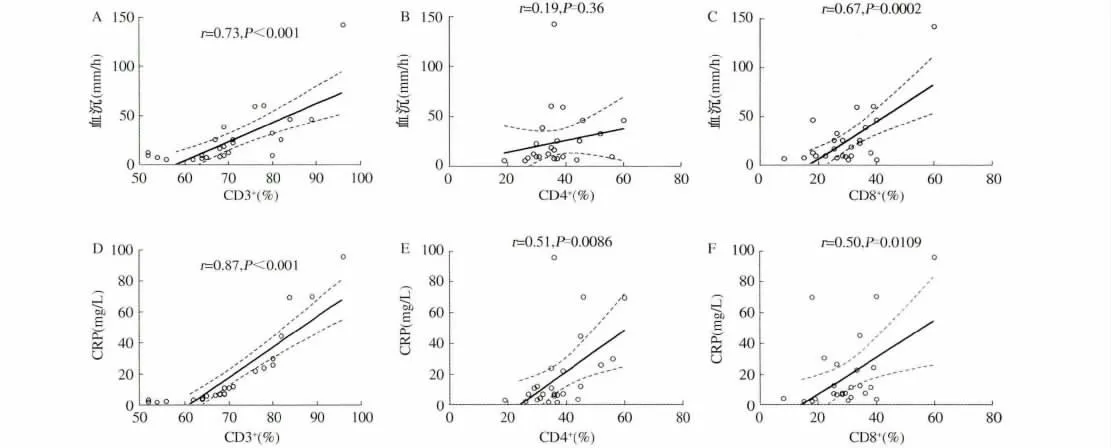
图3 T 细胞亚群与CRP、血沉的相关性分析 A:CD3 +T 细胞比例与血沉;B:CD4 +T 细胞比例与血沉;C:CD8 +T 细胞比例与血沉;D:CD3 +T 细胞比例与CRP;E:CD4 +T 细胞比例与CRP;F:CD8 +T 细胞比例与CRPFig 3 Correlation of T-cell populations with CRP and ESR in patients with UC A:the proportion of CD3 + and ESR;B:the proportion of CD4 + and ESR;C:the proportion of CD8 + and ESR;D:the proportion of CD3 + and CRP;E:the proportion of CD4 + and CRP;F:the proportion of CD8 + and CRP
T 淋巴细胞亚群各细胞成分间比例的维系是正常免疫反应的生理学基础,T 淋巴细胞在抗原刺激下呈现亚群间比例紊乱,导致免疫反应不恰当增强或减弱,造成组织损伤或炎症持久存在,是UC 发病及病情活动的机制之一[6]。一些炎症细胞因子,如IL-6 和IFNα 将可能直接刺激或调节T 细胞的活化[7]。在我们的研究中,UC 患者外周血CD3+、CD4+和CD8+T 淋巴细胞的比例明显高于健康人群,但比例的差别主要出现在UC 活动期,UC 缓解期和健康人群的差别仅出现在CD8+T 淋巴细胞,提示UC 患者肠道炎症的活动导致循环血液中CD3+、CD4+和CD8+T 淋巴细胞活化及比例增多。我们对T 细胞亚群和炎症活动的指标CRP 及血沉进行相关性分析发现,除CD4+T 细胞与血沉无相关性外,CD3+和CD8+T 淋巴细胞比例与CRP、血沉呈明显正相关,CD4+T 细胞与CRP 呈正相关。Funderburg 等[8]的研究发现CD4+和CD8+T 淋巴细胞亚群比例与促炎症细胞因子(IL-6 和IFN-α)及CRP 相关,而且T 淋巴细胞的活化和血清炎症标志物的升高与IBD 的病情密切相关[9]。因此,我们推测UC 患者肠道病变的损害导致全身的炎症反应及T 淋巴细胞的活化。关于其机制的研究,认为肠黏膜屏障受损后肠腔内的细菌毒素LPS 进入肠黏膜,进一步入血,从而使T 细胞活化和比例升高[10]。
因本研究纳入的病例数较少,且入选患者多为外院诊治过的患者,包括部分病例入院前已给予包括激素在内的对免疫反应有影响的药物治疗,必然会在一定程度上对研究的结果产生影响,因此本研究的结果具有一定的局限性,需要更大的样本量及更严格的入选标准筛选出病例进行研究。
综上所述,UC 患者CD3+、CD4+和CD8+T 淋巴细胞活化及比例升高,并和炎症相关指标CRP 及血沉呈正相关。
[1] Rosenstiel P,Sina C,Franke A,et al. Towards a molecular risk map--recent advances on the etiology of inflammatory bowel disease[J]. Semin Immunol,2009,21(6):334-345.
[2] Cooperative Group of Inflammatory BoweI Disease of Digestive Disease of Chinese Medical Association. Consensus on the diagnosis and management of inflammatory bowel disease (2012,Guangzhou)[J]. Chin J Intern Med,2012,51(10):818-831.中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012 年·广州)[J]. 中华内科杂志,2012,51(10):818-831.
[3] Silverberg MS,Satsangi J,Ahmad T,et al. Toward an integrated clinical,molecular and serological classification of inflammatory bowel disease:report of a Working Party of the 2005 Montreal World Congress of Gastroenterology[J]. Can J Gastroenterol,2005,19 Suppl A:5A-36A.
[4] Schroeder KW,Tremaine WJ,Ilstrup DM. Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis. A randomized study[J]. N Engl J Med,1987,317(26):1625-1629.
[5] Papadakis KA,Targan SR. Role of cytokines in the pathogenesis of inflammatory bowel disease[J]. Annu Rev Med,2000,51:289-298.
[6] Funderburg N,Luciano AA,Jiang W,et al. Toll-like receptor ligands induce human T cell activation and death,a model for HIV pathogenesis[J]. PLoS One,2008,3(4):e1915.
[7] Joseph SB,Miner KT,Croft M. Augmentation of naive,Th1 and Th2 effector CD4 responses by IL-6,IL-1 and TNF[J]. Eur J Immunol,1998,28(1):277-289.
[8] Funderburg NT,Stubblefield Park SR,Sung HC,et al. Circulating CD4(+)and CD8(+)T cells are activated in inflammatory bowel disease and are associated with plasma markers of inflammation[J].Immunology,2013,140(1):87-97.
[9] Solem CA,Loftus EV Jr,Tremaine WJ,et al. Correlation of C-reactive protein with clinical,endoscopic,histologic,and radiographic activity in inflammatory bowel disease[J]. Inflamm Bowel Dis,2005,11(8):707-712.
[10] Kawashima R,Kawamura YI,Oshio T,et al. Interleukin-13 damages intestinal mucosa via TWEAK and Fn14 in mice-a pathway associated with ulcerative colitis[J]. Gastroenterology,2011,141(6):2119-2129. e8.
