PPARα 激活对高脂饮食诱导的大鼠非酒精性脂肪性肝病的保护作用
2015-12-31李宗先汪再炎
李宗先,韩 真,汪再炎
皖南医学院附属弋矶山医院消化内科,安徽 芜湖241000
目前,国内外非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)被公认为是引起慢性肝脏疾病、肝功能异常最常见病因[1]。过氧化物酶体增殖物激活受体α(PPARα)属于激素核受体超家族成员之一,主要包括PPARα、PPARβ、PPARγ 3 种亚型,PPARα 在肝脏细胞中高表达,具有调节胆汁酸代谢、脂肪酸摄取、活化,并影响细胞内脂肪酸结合及线粒体脂肪酸氧化[2-3]。近年来,越来越多的研究表明,PPARα 在脂肪肝的发病机制中有显著作用。本研究中,我们主要探讨PPARα 激动剂WY14643 对高脂饮食诱导的大鼠NAFLD 的保护作用及其机制。
1 材料与方法
1.1 实验动物 选择4 周龄SPF 级SD 雄性大鼠60 只。
1.2 主要试剂和仪器 WY14643(Sigma 公司),PPARα 胆盐输出泵(Bsep)抗体(Santa Cruz 公司)。RT-PCR 试剂盒(大连宝生物公司),实时荧光定量PCR 仪(ABI 7500),全自动生化分析仪(Roche Modular DPP,瑞士)。
1.3 NAFLD 大鼠模型建立及分组 将大鼠喂养1周后随机分为3 组,每组20 只,Ⅰ组以标准饲料喂养,Ⅱ组以高脂饲料喂养,Ⅲ组高脂饲料喂养,同时每日腹腔内注射WY14643 1 mg/kg,Ⅰ组和Ⅱ组每日腹腔内注射等量的生理盐水。继续喂养2 周后,处死全部大鼠。
1.4 标本采集 处死大鼠前禁食12 h,摘出肝脏切取相同部位肝组织,并用10%甲醛缓冲液固定,用于观察肝脏病理变化,其余组织储存于液氮中,用作提取总RNA 和蛋白。
1.5 测定血清生化指标 用全自动生化分析仪检测3 组大鼠血清TBA、TG、TC、AST、ALT 变化。
1.6 大鼠肝脏病理切片 将分离出的大鼠肝脏组织,经HE 染色后,在倒置显微镜下观察其病理学改变。
1.7 RT-PCR 检测 按操作说明合成cDNA,引物设计PPARα (F:5'-TAGCTATCCATTGTTGC-3',R:5'-GCACTGAGTCGATCTCTTA-3'),Bsep (F:5'-AGCGTAGCTTCCACCAAGC-3',R:5'-GTACCGACTGACTCTAT-3'),甘油醛-3-磷酸脱氢酶(F:5'-ACTGTGTGTTATGAGGT-3',R:5'-AATGAGTCCAGCTGACGT-3')。PCR 扩增条件,PPARα:95 ℃30 s,95 ℃5 s,58 ℃34 s;Bsep:95 ℃30 s,95 ℃5 s,56 ℃34 s。采用2-ΔΔCT值法计算目的基因相对表达量,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参对照,Ⅰ组基因mRNA 相对表达量设为1,各组实验独立重复3 次,统计分析。
1.8 Western blotting 检测 用裂解液提取肝脏组织总蛋白,调整3 组蛋白上样量,使各组上样量相等,在12%聚丙烯酰胺凝胶中电泳分离,然后转移至聚偏二氟乙烯膜,5%BSA 封闭1 h,分别用PPARα、Bsep 及GAPDH 的一抗与膜结合,4 ℃孵育过夜。TBST 洗膜后,分别与辣根过氧化物酶标记的二抗结合,室温孵育1 h,经ECL 化学发光法显色,Quantity One 软件测灰度值,以PPARα、Bsep/GAPDH 吸光度比值表示。
1.9 统计学分析 采用SPSS 17.0 统计软件进行分析,多组均数间比较用单因素分析,2 组均数间比较用LSD 检验,P <0.05 为差异有统计学意义。
2 结果
2.1 大鼠肝脏病理学变化 Ⅰ组大鼠肝脏肝小叶结构完整。Ⅱ组可见肝细胞不同程度的空泡变性、脂肪变性,Ⅲ组大鼠肝细胞变性坏死、脂肪变性及炎细胞浸润与Ⅱ组比较均有所减轻(见图1)。
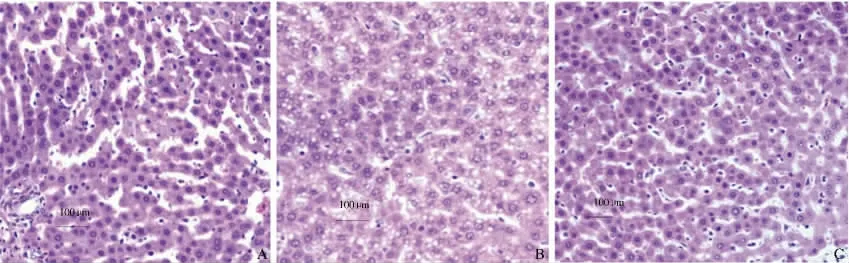
图1 大鼠肝脏病理改变(HE 200 ×) A:Ⅰ组;B:Ⅱ组;C:Ⅲ组Fig 1 Rat liver pathology (HE 200 ×) A:Ⅰgroup;B:Ⅱgroup;C:Ⅲgroup
2.2 大鼠血清生化指标变化 与Ⅰ组比较,Ⅱ组大鼠血清TBA、TG、TC、AST、ALT 明显升高(P <0.01);与Ⅱ组比较,Ⅲ组大鼠血清TBA、TG、TC、AST、ALT 明显降低(P <0.05,见表1)。
表1 大鼠血清生化指标(±s,n=3)Tab 1 Serum biochemical parameters of rats (±s)
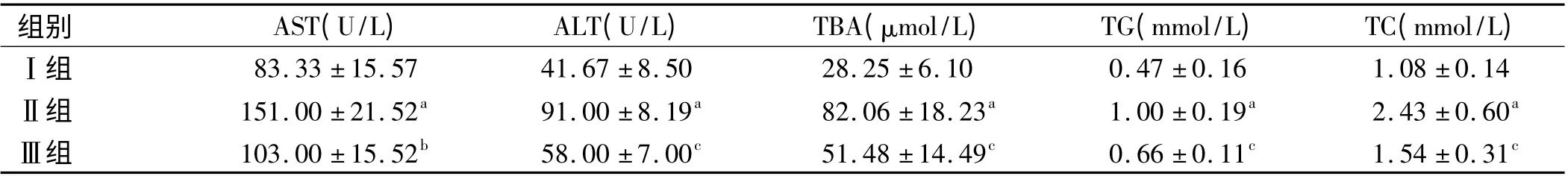
表1 大鼠血清生化指标(±s,n=3)Tab 1 Serum biochemical parameters of rats (±s)
注:与Ⅰ组比较,aP <0.01;与Ⅱ组比较,bP <0.01,cP <0.05。
组别 AST(U/L) ALT(U/L) TBA(μmol/L) TG(mmol/L) TC(mmol/L)Ⅰ组 83.33 ±15.57 41.67 ±8.50 28.25 ±6.10 0.47 ±0.16 1.08 ±0.14Ⅱ组 151.00 ±21.52a 91.00 ±8.19a 82.06 ±18.23a 1.00 ±0.19a 2.43 ±0.60aⅢ组 103.00 ±15.52b 58.00 ±7.00c 51.48 ±14.49c 0.66 ±0.11c 1.54 ±0.31 c
2.3 大鼠肝脏组织PPARα、Bsep mRNA 表达 与Ⅰ组比较,Ⅱ组大鼠肝脏组织PPARα、Bsep mRNA 明显降低(P <0.05);与Ⅱ组比较,Ⅲ组大鼠血清PPARα、Bsep mRNA 明显升高(P <0.01,见图2)。2.4 大鼠肝脏组织PPARα、Bsep 蛋白表达 与Ⅰ组比较,Ⅱ组大鼠肝脏组织PPARα、Bsep 蛋白明显降低(P <0.05);与Ⅱ组比较,Ⅲ组大鼠血清PPARα、Bsep蛋白明显升高(P <0.01,见图3)。
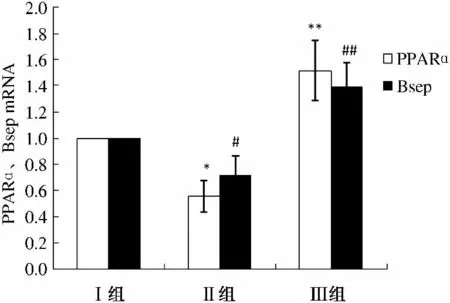
图2 大鼠肝脏组织PPARα、Bsep mRNA 表达Fig 2 Expressions of PPARα,Bsep mRNA in liver tissues of rats

图3 Western blotting 分析PPARα、Bsep 蛋白表达Fig 3 Expressions of PPARα,Bsep protein by Western blotting analysis
3 讨论
目前有关肝脂肪变性的病理生理机制尚不完全清楚,NAFLD 由于脂肪变性可进展为非酒精性脂肪性肝炎,进一步发展可发生脂肪性肝纤维化,最终导致肝硬化和肝癌[4]。由此可见,对于NAFLD 的早期干预及保护至关重要。
PPARα 属于核转录因子,在肝脏细胞中可通过调控相关基因的表达,抑制炎症因子的产生和释放,减轻氧化应激反应对肝脏组织的损伤作用[5]。PPARα 激动剂可通过上调肝脏极低密度脂蛋白受体,降低甘油三酯,调节脂质代谢[6]。Fidaleo 等[7]研究发现,高脂饮食会增加小鼠肝脏脂肪储存和氧化应激,PPARα 介导这一过程,高脂饮食可下调小鼠肝脏细胞PPARα 表达,且关闭PPARα 信号,从而降低β 氧化和过氧化氢酶活性。本实验结果显示,Ⅱ组的大鼠血清TBA、TG、TC、AST、ALT 等生化指标较Ⅰ组明显升高,肝脏组织中PPARα 表达明显下调,表明高脂饮食可下调PPARα 表达,与之前研究结果一致。PPARα 激动剂WY14643 经大鼠腹腔注射后,大鼠肝脏组织中PPARα表达明显增高,同样高脂饮食诱导大鼠NAFLD,结果发现Ⅲ组大鼠血清TBA、TG、TC、AST、ALT 等生化指标较Ⅱ组明显降低,同时病理切片显示,Ⅲ组大鼠肝细胞变性坏死、脂肪变性及炎性细胞浸润较组Ⅱ明显减轻,以上结果提示PPARα 激动剂WY14643 对高脂饮食诱导的大鼠NAFLD 具有保护作用。
PPARα 激动剂WY14643 对高脂饮食诱导的大鼠NAFLD 保护作用的潜在机制可能与Bsep 有关。Bsep是肝脏毛细胆管膜上胆汁酸外排的主要转运体,Bsep功能异常可影响胆汁酸外排障碍,最终导致肝脏胆汁淤积[8]。肝脏脂肪变性与脂质代谢紊乱关系密切,Bsep 表达量会影响胆汁淤积,从而影响肝脂肪变性。本研究结果发现,当高脂饮食下调PPARα 表达时,Bsep 表达量同时降低,大鼠肝脏组织脂肪变性严重。当PPARα 激动剂WY14643 作用后,PPARα 表达量明显升高,Bsep 表达量同时升高,此时,大鼠肝脏组织脂肪变性较单纯高脂饮食诱导组明显减轻。由此可见,WY14643 可通过激活PPARα 而上调Bsep 表达,进而起到对肝脂肪变性的保护作用。
综上所述,PPARα 激活可保护高脂饮食诱导的大鼠NAFLD,其机制可能是PPARα 激活后上调Bsep 表达,减轻肝脏细胞胆汁淤积,但其具体信号通路有待进一步深入研究。
[1] Law K,Brunt EM. Nonalcoholic fatty liver disease[J]. Clin liver Dis,2010,14(4):591-604.
[2] Burri L,Thoresen GH,Berge RK. The role of PPARα activation in liver and muscle[J]. PPAR Res,2010,2010:542359.
[3] Kersten S. Integrated physiology and systems biology of PPARα[J].Mol Metab,2014,3(4):354-371.
[4] Lavallard VJ,Gual P. Autophagy and non-alcoholic fatty liver disease[J]. Biomed Res Int,2014,2014:120179.
[5] Kong L,Ren W,Li W,et al. Activation of peroxisome proliferator activated receptor alpha ameliorates ethanol induced steatohepatitis in mice[J]. Lipids Health Dis,2011,10(30):246.
[6] Gao Y,Shen W,Lu B,et al. Upregulation of hepatic VLDLR via PPARα is required for the triglyceride-lowering effect of fenofibrate[J]. J Lipid Res,2014,55(8):1622-1633.
[7] Fidaleo M,Fracass A,Zuorro A,et al. Cocoa protective effects against abnormal fat storage and oxidative stress induced by a high-fat diet involve PPARα signaling[J]. Food Funct,2014,5(11):2931-2939.
[8] Zhang Y,Li F,Patterson AD,et al. Abcb11 deficiency induces cholestasis coupled to impaired-fatty acid oxidation in mice [J]. J Biol Chem,2012,287(29):24784-24794.
