RIP3 在小鼠结肠炎中的表达及意义
2015-12-31贾振宇沈家庆许春芳
贾振宇,沈家庆,许春芳
苏州大学附属第一人民医院消化内科,江苏 苏州215006
在肠道表面覆盖着一层肠上皮细胞,它们的主要功能是吸收肠腔内的营养物质。肠上皮细胞也参与到人体的免疫系统中,它们通过细胞间的紧密连接形成一道黏膜屏障。但是当细胞发生过度死亡时,肠黏膜屏障遭到破坏,导致肠道炎症。肠上皮细胞的死亡可以作为肠道炎症的标志[1]。程序性细胞坏死是细胞死亡的一种特殊形式,它受到受体结合丝氨酸/苏氨酸激酶3(receptor-interacting protein kinase 3,RIP3)的调控,当细胞凋亡途径受到抑制时,RIP3 可以调控细胞走向坏死的路径[2]。但是程序性细胞坏死尤其是RIP3 在结肠炎中发挥的作用尚不明确。因此,本次实验旨在探讨RIP3 介导的程序性细胞坏死在小鼠结肠炎中可能存在的作用。
1 材料与方法
1.1 实验动物与主要试剂 SPF 级雌性C57BL/6J 小鼠24 只,6 ~8 周龄,体质量18 ~19 g,购自苏州大学实验动物中心。DSS 购自美国MP 公司。两步法免疫组织化学检测试剂盒购自上海Genetech 公司,增强化学发光法试剂盒(ECL)购自美国GeneScript 公司。小鼠IL-1β、IL-6、TNF-α 多克隆抗体购自武汉博士德公司,小鼠RIP3 多克隆抗体购自美国Prosci 生物公司,羊抗兔二抗购自美国Invitrogen 公司,甘油醛-3-磷酸脱 氢 酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国GeneScript 公司。
1.2 实验分组 C57BL/6J 小鼠适应性饲养1 周,随机分为模型组、正常组,每组12 只。模型组小鼠采用DSS 诱导小鼠结肠炎模型[3],将DSS 溶于无菌水中,配置成5%水溶液,小鼠自由饮用4 d,再饮用无菌水3 d。正常组小鼠自由饮用无菌水7 d。
1.3 小鼠疾病活动指数(DAI)评分 各组小鼠每天检查体质量、腹泻、便血情况。DAI[4]:腹泻(0 为正常粪便、1 为湿润/黏性便、2 为中度腹泻/不成形便、3 为重度腹泻/水样便);便血(0 为无便血、1 为便上带血点/隐血弱阳性、2 为便上见血/隐血强阳性、3 为便鲜血);每天测量小鼠体质量并根据公式计算体质量变化:(第n 天体质量- 初始体质量)/初始体质量×100%,体质量变化(0 为体质量减少<2%、1 为体质量减少2% ~5%、2 为体质量减少5% ~10%、3 为体质量减少10% ~15%、4 为体质量减少≥15%)。在第7 天,处死小鼠,收集结肠标本,量取长度,每组中6 只小鼠结肠组织用10%甲醛固定,剩余6 只小鼠结肠组织保存于液氮中。
1.4 结肠组织病理学检查 10%甲醛固定后的结肠标本作石蜡包埋、连续切片。HE 染色观察结肠炎症变化,量化病理学指数[4]。
1.5 蛋白样品制备 小鼠结肠组织加入RIPA 蛋白裂解液,在冰上打碎制备匀浆,静置30 min,13 000 r/min离心30 min 后取上清液,测定并调整蛋白浓度,与蛋白电泳上样缓冲液等量混合,98 ℃金属浴5 min。所得蛋白样品用于Western blotting 检测小鼠IL-1β、IL-6、RIP3、TNF-α 的表达。
1.6 蛋白电泳分析 蛋白样品进行聚丙烯酰胺凝胶电泳用于检测小鼠IL-1β、IL-6、RIP3、TNF-α。聚偏二氟乙烯膜转膜后5%脱脂牛奶封闭过夜。一抗室温孵育2 h,0.1% PBST 洗膜10 min×3 次。辣根过氧化物酶标记的二抗孵育1 h,0.1% PBST 洗膜10 min ×3次。ECL 显影,Gel-pro analyzer 软件分析灰度值,以GAPDH 为定量标准算出相对灰度值。
1.7 免疫组化 结肠组织切片常规脱蜡,0.01 mol/L柠檬酸缓冲液(pH=6.0)热修复抗原,PBS(pH=7.4)洗涤5 min×3 次。3% H2O2孵育15 min 灭活内源性过氧化物酶,PBS 洗涤5 min×3 次。5% BSA 37 ℃封闭30 min,Anti-RIP3(1 ∶1 600)4 ℃过夜,PBS 洗涤5 min×3 次,辣根过氧化物酶标记的二抗37 ℃孵育30 min,PBS 洗片5 min ×3 次,DAB 显色,苏木精复染,逐级脱水,透明,中性树胶封固。
免疫组织化学检测结果按照参考文献[5]判定。按着色程度:基本未着色,染色与背景相似者为0 分;着色浅,略高于背景者为1 分;中度着色,明显高于背景者为2 分;强染,着色深者为3 分。按阳性细胞数量:阳性细胞数<25% 为0 分,25% ~50% 为1 分,51% ~75%为2 分,>75%为3 分。综合染色强度与阳性细胞数量积分相乘为总得分。
1.8 统计学分析 采用SPSS 17.0 统计软件进行分析,计量资料用±s 表示,组间比较采用t 检验,P <0.05 为差异有统计学意义。
2 结果
2.1 一般情况 模型组小鼠出现体质量下降、腹泻与便血现象,DAI 显著高于正常组。在第7 天处死小鼠,取出结肠后测量结肠长度,结果显示模型组结肠长度为(5.49 ±0.54)cm,较正常组(6.68 ±0.47)cm 明显缩短(P <0.001,见图1)。

图1 小鼠DAI 与结肠长度 A:各组小鼠DAI;B:正常组结肠长度;C:模型组结肠长度Fig 1 DAI and colon length A:DAI;B:colon length of normal group;C:colon length of model group
2.2 结肠病理学评分 结肠HE 染色,光镜下观察结肠病理切片,模型组小鼠结肠主要表现为炎症细胞浸润、隐窝破坏、溃疡形成、上皮异型性增生(见图2)。模型组结肠组织病理学评分为13.83 ±2.40,较正常组(1.00 ±0.63)显著升高(P <0.001)。
2.3 Western blotting 检测各组小鼠结肠组织中IL-1β、IL-6 的表达 从结肠组织提取蛋白用于Western blotting 检测IL-1β、IL-6 的表达。Western blotting 结果提示模型组小鼠结肠IL-1β、IL-6 的表达较正常组显著增高(见图3)。灰度分析结果显示模型组小鼠结肠IL-1β、IL-6 的相对灰度值分别为6.14 ±0.97、0.62 ±0.12,正常组IL-1β、IL-6 的相对灰度值分别为3.55 ±1.14、0.29 ±0.07,差异均有统计学意义(P <0.05)。
2.4 各组小鼠结肠组织中RIP3、TNF-α 的表达
2.4.1 RIP3、TNF-α 的表达:Western blotting 结果提示在模型组小鼠结肠组织中RIP3、TNF-α 的表达量较正常组明显上升(见图4)。灰度分析结果提示模型组RIP3、TNF-α 的相对灰度值分别为5. 39 ± 1. 34、0.64 ±0.15,正常组分别为2.55 ±0.72、0.18 ±0.07,两组比较,差异均有统计学意义(P <0.05)。

图2 小鼠结肠组织HE 染色(200 ×) A:正常组;B:模型组Fig 2 Mice colon HE staining (200 ×) A:normal group;B:model group
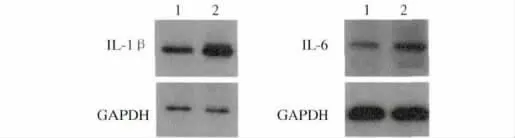
图3 小鼠结肠中IL-1β、IL-6 的表达 1:正常组;2:模型组Fig 3 Expressions of IL-1β,IL-6 in mice colons 1:normal group;2:model group
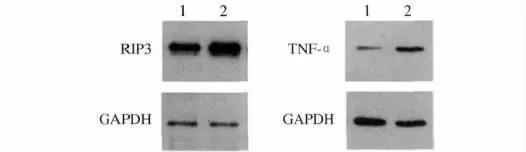
图4 小鼠结肠中RIP3、TNF-α 的表达 1:正常组;2:模型组Fig 4 Expressions of RIP3,TNF-α in mice colons 1:normal group;2:model group
2.4.2 RIP3 在结肠组织中的表达位置:免疫组化染色结果提示RIP3 表达的位置主要为结肠上皮细胞(见图5)。模型组结肠组织RIP3 表达为4.40 ±1.67,较正常组(1.40 ±0.55)明显增高,差异有统计学意义(P <0.05)。
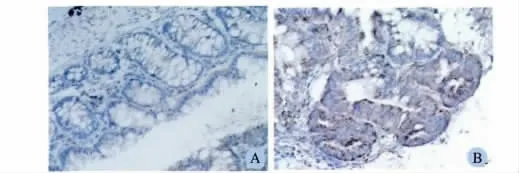
图5 小鼠结肠组织RIP3 免疫组化染色(400 ×) A:正常组;B:模型组Fig 5 Expression of RIP3 in mice colons by immunohistochemistry-paraffin A:normal group;B:model group
3 讨论
溃疡性结肠炎被认为是一种结肠非特异性疾病,其病因和发病机制目前尚不明确,大多数研究认为与结肠上皮的免疫紊乱有关[6]。肠黏膜屏障主要由肠上皮细胞构成,它在预防病菌和毒素由肠腔侵入机体方面发挥着重要作用[7]。因此,肠上皮细胞过度死亡将导致肠黏膜屏障功能障碍,如杯状细胞的死亡导致了黏蛋白分泌减少,结肠化学屏障被破坏[8]。当正常结肠黏膜屏障被破坏后,多种致病因子直接作用于结肠导致结肠炎症,但是结肠上皮细胞的死亡机制目前尚不明确。
程序性细胞死亡在维持机体内稳态中发挥着重要作用,这种细胞死亡目前分为细胞凋亡和细胞坏死两种方式[9],其中前者主要表现为凋亡小体的形成[10],后者主要表现为:细胞器的肿胀、胞膜的破裂、炎症反应的产生[9]。最近发现的RIP3 是RIP 蛋白家族的一员,在TNF-α 调控程序性细胞坏死的过程中发挥着关键性作用[2,11-12]。RIP3 可以活化细胞能量代谢途径中的关键性酶(谷氨酰胺合成酶、谷氨酸脱氢酶-1、糖原磷酸化酶),进而调节细胞中活性氧的产生,导致细胞发生程序性细胞坏死[11]。有研究[2]发现当细胞凋亡被抑制时,细胞死亡方式为RIP3 介导的程序性细胞坏死;在小鼠胰腺炎模型中,模型组胰腺组织RIP3 的表达量较正常组显著升高,同时RIP3 基因敲除鼠的胰腺炎症反应轻于野生型鼠,因此,RIP3 参与的程序性细胞坏死在小鼠胰腺炎中发挥着重要作用。但是,在小鼠结肠炎中是否存在RIP3 参与的程序性细胞坏死目前还尚不明确。
为研究程序性细胞坏死在结肠炎中的作用,我们应用DSS 建立小鼠结肠炎模型,该结肠炎模型在临床表现和病理学改变上更加接近于人类的溃疡性结肠炎[13]。实验结果显示:模型组小鼠出现体质量下降、腹泻与便血的现象;结肠HE 染色证实了小鼠结肠存在炎症性改变;炎症因子IL-1β、IL-6 的表达也显著上升。通过对小鼠结肠组织的Western blotting 定量分析,我们发现模型组小鼠结肠组织RIP3 表达量上升,同时作为RIP3 上游因子TNF-α 的表达水平也升高。所以,我们认为在小鼠结肠炎中存在程序性细胞坏死的现象。而在小鼠结肠组织RIP3 免疫组化染色中,我们发现RIP3 主要表达在结肠上皮细胞中。因此,结合Western blotting 与免疫组化结果,我们认为在模型组小鼠结肠上皮细胞内存在着TNF-α/RIP3 信号通路介导的程序性细胞坏死,过多的细胞坏死破坏了正常结肠黏膜屏障,进而导致结肠炎症。
综上所述,本研究在动物模型中发现了TNF-α/RIP3 信号通路介导的程序性细胞坏死在小鼠结肠炎中发挥的作用,为溃疡性结肠炎的发病机制与治疗靶点提供了实验依据。
[1] Kaser A,Zeissig S,Blumberg RS. Inflammatory bowel disease[J].Annu Rev Immunol,2010,28:573-621.
[2] He S,Wang L,Miao L,et al. Receptor interacting protein kinase-3 determines cellular necrotic response to TNF-alpha[J]. Cell,2009,137(6):1100-1111.
[3] Peröe M,Cerar A. Dextran sodium sulphate colitis mouse model:traps and tricks[J]. J Biomed Biotechnol,2012,2012:718617.
[4] Sann H,Erichsen Jv,Hessmann M,et al. Efficacy of drugs used in the treatment of IBD and combinations thereof in acute DSS-induced colitis in mice[J]. Life Sci,2013,92(12):708-718.
[5] Dou XT,Zheng HM,Zheng P. Preliminary study on 5-aminosalicylic acid in a mouse model of colitis-associated carcinoma[J]. Chin J Dig,2012,32(10):688-692.窦晓坛,郑海明,郑萍. 5-氨基水杨酸在结肠炎癌变模型小鼠中的初步研究[J]. 中华消化杂志,2012,32(10):688-692.
[6] Baumgart DC,Carding SR. Inflammatory bowel disease:cause and immunobiology[J]. Lancet,2007,369(9573):1627-1640.
[7] Gitter AH,Wullstein F,Fromm M,et al. Epithelial barrier defects in ulcerative colitis:characterization and quantification by electrophysiological imaging[J]. Gastroenterology,2001,121(6):1320-1328.
[8] Johansson ME,Gustafsson JK,Holmén-Larsson J,et al. Bacteria penetrate the normally impenetrable inner colon mucus layer in both murine colitis models and patients with ulcerative colitis[J]. Gut,2014,63(2):281-291.
[9] Festjens N,Vanden Berghe T,Vandenabeele P. Necrosis,a well-orchestrated form of cell demise:signalling cascades,important mediators and concomitant immune response[J]. Biochim Biophys Acta,2006,1757(9-10):1371-1387.
[10] Kerr JF,Wyllie AH,Currie AR. Apoptosis:a basic biological phenomenon with wide-ranging implications in tissue kinetics[J]. Br J Cancer,1972,26(4):239-257.
[11] Vandenabeele P,Declercq W,Van Herreweghe F,et al. The role of the kinases RIP1 and RIP3 in TNF-induced necrosis[J]. Sci Signal,2010,3(115):re4.
[12] Declercq W,Vanden Berghe T,Vandenabeele P. RIP kinases at the crossroads of cell death and survival[J]. Cell,2009,138(2):229-232.
[13] Wen HZ,Hao WW,Li J,et al. Factors influencing the development of animal models of dextran sulphatesodium induced colitis [J].World Chinese Journal of Digestology,2005,10:3665.温红珠,郝微微,李佳,等. 葡聚糖硫酸钠结肠炎模型影响因素的研究进展[J]. 世界华人消化杂志,2005,10:3665.
