D-IBS 与FD 重叠征大鼠精神状态、胃肠激素水平改变
2015-12-31陈齐鸣朱海杭张旭东
全 俊,严 晋,丁 懿,陈 磊,陈齐鸣,朱海杭,张旭东,卜 平
扬州大学临床医学院1.消化病研究室;2.病理实验室,江苏 扬州225001;3.泰兴人民医院中医科
肠易激综合征(irritable bowel syndrome,IBS)是目前最常见的功能性胃肠道疾病之一,据报道,1/3 ~2/3 IBS 患者具有与功能性消化不良(functional dyspepsia,FD)相重叠的症状[1]。IBS 与FD 重叠的发病机制尚未完全阐明,普遍认为其与精神心理异常及脑肠轴功能紊乱有关,症状重叠提示两者可能具有共同的神经胃肠病学基础[2]。目前对于IBS 重叠FD 大鼠模型胃肠激素水平与行为学因素关系的研究鲜有报道。因此,本研究在完成D-IBS 重叠FD 动物模型的基础上[3],对D-IBS 重叠FD 模型大鼠神经-免疫-内分泌失调机制进行初步研究。
1 材料与方法
1.1 实验材料
1.1.1 动物:SPF 级雄性Wistar 大鼠50 只,体质量(220 ±20)g,由北京维通利华实验动物技术有限公司提供,动物许可证号为SCXK(京)2012-0001。
1.1. 2 药物:药物大黄(批号:20120701,产地:甘肃)。大黄煎煮液制备:称取1 000 g 大黄药材,粉碎成粉末,加入1 800 ml 水浸泡5 h,煎煮8 min,定容至1 000 ml,即得1 g/ml 的大黄煎煮液,置4 ℃冰箱中保存备用[4]。
1. 1. 3 主要试剂与仪器:5-羟色胺(5-hydroxy tryptamine,5-HT)、生长抑素(somatostatin,SS)、血管活性肠肽(vasoactine intrestinal peptide,VIP)、内毒素(endotoxin,ET)及白细胞介素-10(interleukin-10,IL-10)试剂盒购自上海碧云天生物技术研究所,兔抗白细胞介素-2(interlenkin-2,IL-2)、免疫组化染色试剂盒及DBA 染色试剂盒购自北京博奥森生物技术有限公司。酶标仪为美国伯乐公司bio-680 型。旷场视频分析系统(Open-Field 行为学观察)购自上海软隆科技有限公司。
1.2 方法
1.2.1 动物分组:50 只雄性Wistar 大鼠,适应性饲养7 d,按随机数字表法将大鼠分为正常对照组(A 组),不处理;造模B 组,采用先FD 后D-IBS 造模法(先夹尾后大黄灌胃,FD +D-IBS);造模C 组,单纯FD 造模(单纯夹尾造模法);造模D 组,单纯D-IBS 造模(单纯大黄灌胃法);造模E 组,先D-IBS 后FD 造模法(先大黄灌胃后夹尾造模法,D-IBS+FD);每组10 只,每笼5只。于室温(22 ±2)℃、相对湿度保持50% ~60%、光照节律12L∶12D(6∶00 ~18∶00)、噪音<50 dB 的环境中饲养,正常摄食饮水。
1.2.2 动物模型的建立:A 组在正常条件下饲养。B组先参考郭氏夹尾刺激法[5],建立FD 模型,用尖端包裹纱布的大弯止血钳夹大鼠尾巴远端1/3 处,大鼠暴怒,令其与其他大鼠撕打,间接激怒全笼大鼠,每次刺激30 min,30 min 内连续不断地刺激,3 次/d,以不破皮流血为度,持续刺激7 d。大鼠受伤后用聚维酮碘消毒液涂擦损伤部位预防感染干扰实验结果。造模第8天,开始用大黄煎煮液(1 g/ml)灌胃,2 ml/只,2 次/d,连续灌胃14 d,建立D-IBS 模型[4]。灌胃时继续夹尾刺激,频次改为2 次/d,每次15 min。C 组夹尾刺激法14 d,D 组大黄煎煮液灌胃14 d,E 组先大黄煎煮液(1 g/ml)灌胃7 d,第8 天在灌胃的同时,进行夹尾刺激,每次刺激30 min,3 次/d,持续刺激7 d。
1.2.3 实验方法:造模结束,禁食禁水24 h,2%葡聚糖蓝2 000 溶液0.4 ml/只灌胃,30 min 后5%水合氯醛腹腔麻醉。开腹肝门静脉取血装于乙二胺四乙酸二钾(ethylene diamine tetraacetie acid-K2,EDTA-K2)抗凝管中,3 000 r/min 离心15 min,离心半径11 cm,取血浆分装后于-80 ℃冰箱冻存待测。并取胃和结肠。
1.2.4 进食量的测定:采用进食量差值测定法。每组动物每日上午8∶00 给定量的大鼠饲料,至次日上午8∶00测量剩余量,两者的差值与大鼠数目的比值,即为每只大鼠的每日进食量。
1.2.5 糖水消耗实验:采用糖水消耗百分比测定法。适应性饲养期间训练大鼠喝糖水,第1 天给予两瓶1%(1 g/100 ml)的蔗糖水溶液,第2 天开始每笼左右次序随机的糖水、蒸馏水各一瓶,直至造模前1 d(下午2∶00)开始每7 d 进行一次糖水消耗实验,评估大鼠对奖励的敏感性。测糖水消耗前1 d 禁食禁水21 h 后每笼给予每组大鼠1 瓶1%(1 g/100 ml)的蔗糖水溶液和1 瓶蒸馏水,然后测定各组大鼠在120 min 后的蔗糖水溶液和蒸馏水的饮用量,计算糖水消耗百分比率。糖水消耗实验是客观观察大鼠对于奖赏的反应,糖水消耗百分比降低提示大鼠对幸福事件反映能力降低,这是一种特异性的快感缺乏,代表大鼠的抑郁精神状态。
1.2.6 大鼠胃排空测定:大鼠取血和组织后,自幽门括约肌处取胃,沿大弯侧剪开,将胃内残留色素充分溶于10 ml 蒸馏水中,超声15 min,3 000 r/min 离心15 min,取上清液,620 nm 测吸光度,求出与A 组均值的百分比,即胃内色素相对残留率,相对残留率越低,胃排空越强。
1.2. 7 旷场实验:实验用长× 宽× 高为50 cm ×50 cm×40 cm 的旷场箱,内侧壁及底面为黑色,旷场箱正上方安置摄像头。参考文献[6],于造模前1 d 及造模后,在安静无干扰并杜绝参照物的环境条件下进行。实验前先将大鼠置于测试室内适应10 min。握住大鼠尾根部1/3 处,轻轻将大鼠放入旷场箱的正中,开始同步录像、计时。观察3 min 内大鼠活动情况,进行行为学分析。旷场实验可以客观评价大鼠行为学变化,平均速度的减少反映大鼠处于焦虑状态[7]。参照文献[8],旷场实验可以客观评价大鼠行为学变化,平均速度的减少反映大鼠处于焦虑状态。
1.2.8 血液及肠组织相关指标检测:取-80 ℃保存的血浆复融后,混匀,3 000 r/min 离心15 min,取上清液测定。采用ELISA 法检测,并按照说明书要求严格操作测定血浆5-HT、SS、VIP、ET 及IL-10。采用DAB免疫组织化学染色法检测大鼠肠组织中IL-2 表达情况。
1.3 统计学分析 采用SPSS 17.0 统计软件及EXCEL 软件进行处理,描述性资料用±s 表示,组间比较采用方差齐性检验和单因素方差分析,两两比较采用q 检验,P <0.05 为差异有统计学意义,P <0.01 为差异有显著统计学意义。
2 结果
2.1 大鼠的行为学观察 整个造模过程中,A 组大鼠的一般外观行为等无异常。与A 组相比,随着造模天数的增加,模型组(B、C、D、E)大鼠的行为状态均由正常逐渐变得少动、扎堆、弓背、不活跃;背毛由顺滑、光泽变得枯黄、蓬乱、没有光泽;睡眠逐渐变得易醒、倦卧;B 组情绪由正常变得易怒,继而淡漠,对外界刺激兴奋性低,C 组情绪由正常变得易怒,D、E 组情绪由正常变得淡漠,对外界刺激兴奋性低;B、D、E 均出现大便不成形;在造模的第2 天大鼠进食量减少,第3 天大鼠体质量增长减缓。造模14 d 后各模型组大鼠体质量增长显著下降(P <0.01,见表1)。
表1 5 组大鼠体质量及日均进食量比较(g,±s)Tab 1 Comparison of the average daily food intake and quality of 5 groups rats (g,±s)

表1 5 组大鼠体质量及日均进食量比较(g,±s)Tab 1 Comparison of the average daily food intake and quality of 5 groups rats (g,±s)
注:与A 组比较,**P <0.01,* P <0.05。
分组 例数 体质量增长 日均进食量A 组10 73.1 ±7.9 31.5 ±0.7 B 组 10 35.3 ±9.5** 20.3 ±1.1*C 组 10 45.0 ±6.1** 23.1 ±1.6*D 组 10 3.9 ±12.4** 19.8 ±0.5*E 组 10 -2.5 ±12.1** 19.5 ±0.5*
2.2 大鼠胃排空的测定 与A 组(100.0 ±13.1)%比较,B 组(144.1 ±17.2)%、C 组(168.0 ±20.0)%大鼠胃内色素相对残留率显著增大(P <0. 05),D 组(39.0 ±12.4)%显著降低(P <0.01),E 组(105.3 ±12.3)%变化差异无统计学意义(P >0.05)。
2.3 大鼠解剖结构的观察 解剖各组大鼠后肉眼观察胃及肠组织,未见溃疡及色泽形态改变。造模后B组大鼠体质量增长幅度显著下降、进食量显著减少,且造模过程中一直有稀便;肉眼观察胃肠解剖结构未见异常。与文献[3]描述相一致,说明B 组D-IBS 与FD重叠征模型建立成功,剔除E 组。
2.4 造模对大鼠糖水消耗的影响 与A 组(83.4 ±13.6)%比较,B 组(63. 4 ± 9. 3)% 显著降低(P >0.01),C 组(74.4 ±7.5)%大鼠糖水消耗百分比显著降低(P <0.05),D 组(78.2 ±5.3)%差异变化无统计学意义(P >0.05)。
2.5 大鼠旷场内平均速度 与A 组(1.49 ±0.28)%比较,B 组(1.09 ±0.22)%、E 组(0.82 ±0.21)%大鼠旷场内平均活动速度显著降低(P <0. 05),C 组(1.53 ±0.40)%变化差异无统计学意义(P >0.05)。
2.6 大鼠血浆中脑肠肽、细胞因子测定 与A 组比较,B 组大鼠血浆5-HT 水平降低,但差异无统计学意义(P >0. 05);C 组大鼠血浆IL-10 水平显著升高(P <0.01);与A 组、B 组比较,D 组大鼠血浆ET 水平显著降低(P <0.05);B 组、D 组大鼠血浆SS 水平显著降低(P <0. 01);B、D 组大鼠VIP 水平显著升高(P <0.01,见表2)。
表2 大鼠血浆中脑肠肽、细胞因子检测结果(±s)Tab 2 Detection results of ghrelin and cytokines in the rats plasma (±s)

表2 大鼠血浆中脑肠肽、细胞因子检测结果(±s)Tab 2 Detection results of ghrelin and cytokines in the rats plasma (±s)
注:与A 组比较,* P <0.05,**P <0.01。与B 组比较,△P <0.05。
分组 例数 5-HT(pg/ml) IL-10(ng/L) ET(Eu/L) SS(μg/L) VIP(ng/L)A 组 10 145.92 ±21.03 42.31 ±6.16 0.58 ±0.09 10.75 ±0.59 284.40 ±37.37 B 组 10 136.66 ±28.81 43.71 ±4.16 0.65 ±0.13 8.40 ±2.53** 406.87 ±67.15**C 组 10 149.51 ±34.40 53.90 ±7.68** 0.59 ±0.13 9.74 ±1.01 314.46 ±63.46 D 组 10 153.23 ±27.57 45.35 ±5.50 0.47 ±0.03*△ 6.33 ±1.46** 439.23 ±52.65**
2.7 大鼠结肠组织IL-2 阳性细胞百分比测定 与A组比较,模型组结肠组织IL-2 主要表达在胞质内(见图1)。与A 组IL-2 阳性细胞(54.9 ±8.3)%比较,C组(43.7 ±4.1)%、D 组(45.4 ±5.2)%显著减少(P <0.01);B 组(54.0 ±7.5)%变化差异无统计学意义(P >0.05)。
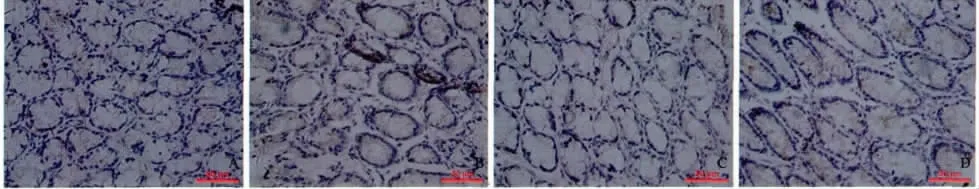
图1 大鼠结肠组织IL-2 阳性细胞百分比(400 ×) A:A 组;B:B 组;C:C 组;D:D 组Fig 1 IL-2 positive cell percentage of colonic tissue in rats A:A group;B:B group;C:C group;D:D group
3 讨论
IBS 特别是腹泻型IBS 与FD 是两种临床常见性胃肠病。IBS 和FD 临床上易发生重叠,内脏高敏感性及胃肠动力功能失调可能是其共同的发病机制,此外还包括社会心理等影响。代子艳等[8]研究发现,IBS重叠FD 患者比单纯IBS 或FD 患者合并焦虑、抑郁的比例更高,胃肠道症状更严重。本研究采用“夹尾刺激+大黄灌胃”方法构建D-IBS 与FD 重叠大鼠模型,与A 组比较,造模后大鼠出现弓背、背毛枯黄、稀大便、易怒等症状,测体质量增长显著降低,胃排空延迟明显,与D-IBS 与FD 重叠患者腹痛、腹泻、精神异常、胃排空延迟相一致。
本研究中,与A 组比较,B 组、C 组大鼠糖水消耗百分比显著降低,D 组无明显变化,推测D-IBS 与FD重叠造模大鼠较单纯D-IBS 及FD 造模大鼠更为抑郁。大鼠旷场实验,已被广泛用于神经学与精神药理学研究中[7]。本研究中,与A 组比较,B、D 组大鼠旷场内平均速度显著下降,而C 组无明显变化,说明重叠征造模大鼠及单纯D-IBS 造模大鼠活跃度下降。结合糖水消耗实验结果推测D-IBS 与FD 重叠造模大鼠精神症状更为严重。
首先,5-HT 作为神经递质,主要分布于松果体和下丘脑,参与痛觉、睡眠和体温等生理功能的调节,与胃肠道活动关系密切。研究发现,在注射相同剂量5-HT 时,伤害感受,表明外周5-HT 水平与内脏高敏感性有密切关系[9]。5-HT 是一种能产生愉悦情绪的信使,5-HT 水平较低的人群更容易发生抑郁、冲动、酗酒、自杀、攻击及暴力行为。本身为一类抗抑郁药[10],可减少患者对酒的渴求程度,减少饮酒量[11]。本研究中,与A 组比较,D 组大鼠血浆中5-HT 水平有升高趋势;B 组大鼠有降低趋势。考虑本研究中D-IBS 与FD重叠造模组大鼠同时存在抑郁和肠道高敏感这两种导致5-HT 水平相反的状态,故大鼠血浆中5-HT 水平无统计学意义。
其次,SS 广泛存在于胃肠道黏膜的D 细胞,以胃窦和胃体最高,在肠内越往下含量越低。SS 通过旁分泌机制由突起释放到G 细胞和壁细胞膜上,抑制胃泌素和HCl 分泌,在胰腺内,SS 由胰岛D 细胞分泌,通过血液循环对胃肠运动与消化道激素的分泌产生抑制作用。SS 水平降低可导致胃泌素分泌过多及胃肠蠕动增强;胃泌素促进胃窦、胃体收缩,增加胃肠道的运动,同时促进幽门括约肌收缩;整体综合作用是使胃排空减慢[12]。本研究中,与A 组比较,D-IBS 与FD 重叠造模组大鼠血SS 显著降低,推测D-IBS 与FD 重叠造模组大鼠胃排空延迟及肠蠕动增强与血浆SS 水平降低有关。
再次,VIP 是神经递质的一种,存在于中枢神经和肠神经系统中。食管下括约肌的舒张则是由迷走神经纤维末梢释放的VIP 介导的,VIP 又通过促进靶细胞合成NO 而使平滑肌舒张。对肠液的分泌具有很强的促进作用,对胃液的分泌可起抑制作用,对消化道平滑肌的收缩产生抑制作用[13]。本研究中,与A 组比较,具有腹泻症状的B、D 组血浆VIP 水平显著升高,推测D-IBS 与FD 重叠造模组大鼠腹泻症状与血浆VIP 水平升高有关。
此外,ET 是革兰氏阴性菌菌体中存在的毒性物质的总称,是多种革兰氏阴性菌的细胞壁成分,由菌体裂解后释出。肠道菌群多为革兰氏阴性菌,如乳酸杆菌,当与宿主处于生态平衡状态,它们并不引起机体的感染,但是,在特定条件下,因为菌群失调、宿主免疫功能低下或菌群寄居部位改变造成了生态失调状态,正常菌群也能引起感染。大肠杆菌产生分泌到它们细胞外面的肠毒素能引起患者腹泻[14];造模用大黄具有广谱抗菌作用[15],故与A 组比较,较单纯大黄灌胃的D 组大鼠血浆ET 水平显著降低,而与D 组比较,“夹尾刺激+大黄灌胃”的B 组大鼠血浆内ET 水平显著升高,推测D-IBS 与FD 重叠造模组大鼠存在肠道菌群紊乱,释放ET 导致腹泻症状。
最后,IL-10 是一种多细胞源、多功能的细胞因子,调节细胞的生长与分化,参与炎性反应和免疫反应,是目前公认的炎症与免疫抑制因子。有很多观察描述了IL-10 在各种疾病的发病机理中有很重要的作用,并分为两个亚型:IL-10 表达过多疾病,IL-10 表达绝对或相对减少引起疾病,IL-10 表达过多会引起免疫抑制作用[16]。本研究中,与A 组比较,D 组大鼠血浆IL-10水平显著升高,B 组变化差异无统计学意义,推测FD大鼠免疫力下降,重叠征模型大鼠免疫力正常。
IL-2 是白细胞介素中的一种。它由多细胞来源(主要由活化T 细胞产生),又具有多向性作用的细胞因子(主要促进淋巴细胞生长、增殖、分化)。它对机体的免疫应答和抗病毒感染等有重要作用,可提高人体对病毒、细菌、真菌、原虫等感染的免疫应答,使细胞毒性T 淋巴细胞(CTL)、天然杀伤细胞(NK)、淋巴因子激活的杀伤细胞(LAK)和肿瘤浸润性淋巴细胞(TIL)增殖,并使其杀伤活性增强,进而清除体内肿瘤细胞和病毒感染细胞等[17]。IL-2 水平降低与年龄的增长及免疫缺陷病有关。本研究中,与A 组比较,C、D组大鼠肠组织中IL-2 表达阳性细胞显著减少,B 组大鼠肠组织中IL-2 表达阳性细胞数变化差异无统计学意义,推测单纯FD 与单纯D-IBS 模型大鼠存在免疫应答和抗病毒感染能力下降,D-IBS 与FD 重叠造模组大鼠无免疫应答和抗病毒感染能力变化。
本研究通过建立D-IBS 与FD 重叠征大鼠模型,观察大鼠抑郁程度、活跃度,测定大鼠血浆和组织中神经-内分泌-免疫相关脑肠肽细胞因子水平变化。研究发现,较正常对照组及单纯D-IBS 和单纯FD 造模组比较,D-IBS 与FD 重叠征大鼠模型更为抑郁、活跃度更低、生长抑素降低、血管活性肠肽水平升高、血浆内毒素水平升高,免疫功能无明显异常。
[1] Caballero-Plasencia AM,Sofos-Kontoyannis S,Valenzuela-Barranco M,et al. Irritable bowel syndrome in patients with dyspepsia:a community based study in southern Europe[J]. Eur J Gastroenterol Hepatol,1999,11(5):517-522.
[2] Zhao L,Song W,Zhu P,et al. Correlation between diarrhea type irritable bowel syndrome overlapped with functional dyspepsia and psychology and gastrointestinal hormones[J]. Chin J Dig,2013,33(2):88-92.赵梁,宋雯,朱萍,等. 腹泻型肠易激综合征重叠功能性消化不良与精神心理、胃肠激素的相关性[J]. 中华消化杂志,2013,33(2):88-92.
[3] Chen C,Quan J,Li MR,et al. The establishment of model of functional dyspepsia overlapping with irritable bowel syndrome in the rats[J]. Laboratory Animal Science,2013,30(4):18-21,30.陈晨,全俊,李曼蓉,等. 功能性消化不良重叠肠易激综合征动物模型的建立[J]. 实验动物科学,2013,30(4):18-21,30.
[4] Tang HM,Liao XH,Fang CF,et al. The establish and evaluating of irritable bowel syndrome of hepatic stagnation and spleem deficiency type[J]. Chinese Journal of Experimental Traditional Medical Formulae,2012,18(6):138-140.唐洪梅,廖小红,房财富,等. 肝郁脾虚型大鼠肠易激综合征模型的建立及评价[J]. 中国实验方剂学杂志,2012,18(6):138-140.
[5] Guo HJ,Lin J,Li GC,et al. The animal model study of functional dyspepsia[J]. Chinese Journal of Integrated Traditional and Western Medicine on Digestion,2000,9(3):141-142.郭海军,林洁,李国成,等. 功能性消化不良的动物模型研究[J]. 中国中西医结合消化杂志,2000,9(3):141-142.
[6] Su YX,Wei S,Tan Q,et al. Aggregate analysis of open field data in depression model rats[J]. Journal of Clinical Rehabilitative Tissue Engineering Research,2012,16(28):5170-5174.苏云祥,魏盛,谭倩,等. 抑郁情绪模型大鼠旷场数据的聚合分析[J].中国组织工程研究,2012,16(28):5170-5174.
[7] Hart PC,Bergner CL,Smolinsky AN,et al. Experimental models of anxiety for drug discovery and brain research[J].MethodsMol Biol,2010,602(9):299-321.
[8] Dai ZY,Wang QM,Song JZ,et al. The quality of life and mental-psychological stautus in irritable bowel syndrome with or without overlapping symptoms:a comparative study[J]. Chinese Journal of Clinical Gastroenterology,2008,20(6):346-348.代子艳,王巧民,宋继中,等. 有和无重叠症状的肠易激综合征患者生活质量及精神心理状况比较研究[J]. 临床消化病杂志,2008,20(6):346-348.
[9] Zhang LY,Dong X,Liu ZL,et al. Luminal serotonin time-dependently modulates vagal afferent driven antinociception in response to colorectal distention in rats[J]. Neurogastroenterol Motil,2011,23(1):62-69,e6.
[10] Dhar AK,Mahesh R,Jindal A,et al. Design,synthesis,and pharmacological evaluation of novel 2-(4-substituted piperazin-1-yl)1,8 naphthyridine 3-carboxylic acids as 5-HT3 receptor antagonists for the management of depression[J]. Chem Biol Drug Des,2014,84(6):721-731.
[11] Rezvani AH,Cauley MC,Levin ED. Lorcaserin,a selective 5-HT(2C)receptor agonist,decreases alcohol intake in female alcohol preferring rats[J]. Pharmacol Biochem Behav,2014,125:8-14.
[12] Liu Y,Vosmaer GD,Tytgat GN,et al. Gastrin (G)cells and somatostatin (D)cells in patients with dyspeptic symptoms:Helicobacter pylori associated and non-associated gastritis [J]. J Clin Pathol,2005,58(9):927-931.
[13] Shi XZ,Choudhury BK,Pasricha PJ,et al. A novel role of VIP in colonic motility function:induction of excitation-transcription coupling in smooth muscle cells[J]. Gastroenterology,2007,132(4):1388-1400.
[14] Pons L,Droy-Lefaix MT,Braquet P,et al. Role of free radicals and platelet-activating factor in the genesis of intestinal motor disturbances induced by Escherichia coli endotoxins in rats[J]. Gastroenterology,1991,100(4):946-953.
[15] Jiang WJ. Effect of processing on the antibacterial action and constituents of Rhubarb[J]. Zhong Yao Tong Bao,1983,8(3):18-20.
[16] Fonseca-Camarillo G,Furuzawa-Carballeda J,Llorente L,et al. IL-10-and IL-20-expressing epithelial and inflammatory cells are increased in patients with ulcerative colitis[J]. J Clin Immunol,2013,33(3):640-648.
[17] Morimoto M,Utsumiya K. Enhanced protection against Heligmosomoides polygyrus in IL-2 receptor β-chain overexpressed transgenic mice with intestinal mastocytosis[J]. J Vet Med Sci,2011,73(6):849-851.
