阿尔茨海默病果蝇模型中Aβ毒性的长度依赖性
2015-12-31韩萌,马萍丽,叶春艳等
阿尔茨海默病果蝇模型中Aβ毒性的长度依赖性
韩萌马萍丽1叶春艳2张保柱1章海燕2孙晓江黄福德3
(上海交通大学附属第六人民医院神经内科,上海200233)
摘要〔〕目的探讨阿尔茨海默病(AD)果蝇模型中β淀粉样肽(Aβ)表达产生的毒性是否存在长度依赖性。方法利用GAL4/UAS系统,分别建立Aβ40、Aβ42、Aβ43转基因AD果蝇模型,根据实验要求将果蝇分为正常对照组、Aβ40组、 Aβ42组、Aβ43组,在整体动物水平上进行果蝇行为学实验,分别检测各组果蝇的爬管能力和寿命。结果在果蝇爬管能力和生存时间的测试中,与对照组相比,AD转基因果蝇均出现日龄依赖的运动能力下降及寿命明显缩短,且Aβ片段长度较长的Aβ42、Aβ43转基因果蝇的运动能力下降和寿命缩短更显著。结论Aβ的毒性作用会导致AD转基因果蝇的运动能力下降和寿命缩短,且Aβ片段长度越长,其毒性作用越重。
关键词〔〕阿尔茨海默病;转基因果蝇;β淀粉样蛋白
中图分类号〔〕R741.02〔文献标识码〕A〔
基金项目:国家自然科学基金资助项目(81371400)
通讯作者:孙晓江(1955-),男,教授,主任医师,博士生导师,主要从事神经系统退行性疾病、脑血管病、癫痫等研究。
1中国科学院上海生命科学院神经科学研究所
2中国科学院上海生命科学院药物研究所
3中国科学院上海高等研究院干细胞与纳米医学中心
黄福德(1969-),男,教授,研究员,博士生导师,主要从事神经系统退行性疾病研究。
第一作者:韩萌(1987-),女,在读博士,主要从事阿尔茨海默病研究。
The toxicity of β-amyloid peptide depends on its length in transgenic Drosophila model of Alzheimer′s disease
HAN Meng, MA Ping-Li, YE Chun-Yan,etal.
Department of Neurology, Shanghai Sixth People′s Hospital Affiliated to Shanghai Jiaotong University School of Medicine, Shanghai 200233, China
Abstract【】ObjectiveTo investigate the toxic effects of the β-amyloid (Aβ) peptide depends on its length in transgenic Drosophila model of Alzheimer′s disease (AD).MethodsUsing the classic GAL4/UAS system, three groups of transgenic flies expressing Aβ40(Aβ40 group), Aβ42(Aβ42 group) and Aβ43(Aβ43 group) were constructed in neurons respectively. The climbing assay and survival assay were performed on the three groups and control flies.ResultsCompared with control group, all Aβ-expressing flies showed enhanced age-dependent locomotor decline and shortened lifespan, with the order:control group>Aβ40 group>Aβ42 group>Aβ43 group.ConclusionsExpression of Aβin neurons produces toxicity in Drosophila and the toxicity is length-dependent, the longer the higher.
【Key words】Alzheimer′s disease; Transgenic Drosophila; β-amyloid peptides
阿尔茨海默病(AD)以老年斑、神经元纤维缠结、β-淀粉样蛋白(Aβ)大量沉积以及神经元缺失为主要病理特征〔1,2〕。AD的病因迄今不明,发病机制学说也有多种,目前研究较多的是Aβ级联学说,认为AD发病与Aβ蛋白的异常积累有密切关系〔3,4〕。现在已建立了多种转基因AD动物模型,与其他动物模型相比,果蝇模型具有基因高度保守且便于操控、转基因技术成熟、繁殖周期短、经济等特别的优势〔5〕。本研究应用GAL4/UAS系统,在果蝇逃跑通路(GF)中分别表达不同长度的Aβ,进行行为学实验检测各组转基因果蝇和对照果蝇的运动能力和寿命是否受到损害,损害程度是否与Aβ的长度相关。
1材料与方法
1.1对象本研究所使用的果蝇均为黑腹果蝇,实验动物共分为正常对照组、Aβ40组、Aβ42组、Aβ43组。在本实验中,果蝇在标准培养基上饲养,环境温度控制在25℃,相对湿度70%,12 h昼夜循环光照。
1.2果蝇爬管能力实验材料美的加湿器,空调,果蝇管,改良的果蝇爬管能力检测装置(iRING),索尼数码相机,PC,果蝇爬管统计软件。
1.3果蝇寿命测定材料果蝇培养基(蒸馏水、玉米粉、琼脂、红糖、酵母、丙酸、100%乙醇),灭菌锅,美的加湿器,空调,果蝇管,CO2麻醉盘,解剖镜,羽毛笔,棉花,死蝇盛留器。
1.4建立转基因AD果蝇模型合成带有EcoRⅠ、XholⅠ酶切位点PCR引物,分别扩增编码果蝇necrotic基因分泌信号肽段“MASKVSILLLLTVHLLAAQTFAQ”与Aβ40、Aβ42或Aβ43多肽组成的融合蛋白的重组DNA,经EcoRⅠ、XholⅠ酶切后链接到EcoRⅠ、XholⅠ酶切了的pUASattb质粒、果蝇胚胎显微注射,获取定点插入的转基因品系。分别与p〔Gal4〕A307果蝇交配,从而获得在果蝇巨纤维通路分别等量表达含有Necrotic分泌信号肽的Aβ40、Aβ42或Aβ43融合蛋白的转基因AD果蝇模型。
1.5果蝇爬管能力实验为了能够大批量检测果蝇的爬行能力,Gargano等〔6〕研制出“RING实验方法” 。我们通过改良,找到了更自动、具有高度可重复性的,并且能够定量分析的设备和方法。简单来说,这个装置包括一个矩形的金属框架(32 cm×21 cm×6 cm),框架内可垂直的放置10个圆形透明的塑料管(半径2.1 cm,高19.0 cm);还包括可以垂直驱动框架升降的电机,一次驱动产生4个来回的迅速升降,1次/min。每管10只果蝇,每次驱动会使果蝇全部落入管底,果蝇由于习性会本能的向上爬,测试过程由录像机记录,后期应用自主研制的软件进行分析。在此次实验中,每管果蝇测试5次,以停止敲击后7 s为时间点统计果蝇的爬行高度,最后取平均值。统计3~5次实验结果后比较各组间差异。
1.6果蝇寿命实验分别将雌雄各100只果蝇分别平均分到5个果蝇培养管中,每管中20只果蝇,做上标签待观察。每3 d更换一次新鲜的培养基、食物及酵母量保持一致,同时记录各组果蝇的死亡情况。
2结果
2.1AD转基因果蝇品系的建立在本研究中,应用GAL4/UAS激活系统使不同长度的人源Aβ蛋白在果蝇特定的组织特异性表达。主要使用了p〔Gal4〕A307驱动Aβ在GF通路特异性表达。p〔Gal4〕A307的雌蝇处女蝇和携带不同长度的Aβ(Aβ40、Aβ42、Aβ43)转基因的雄蝇杂交。杂交得到的子代作为实验果蝇。将果蝇分为4组:正常对照组含有一个拷贝的p〔Gal4〕A307转基因;Aβ40组含一个拷贝的p〔Gal4〕A307 和 pUASattb-Aβ40;Aβ42含一个拷贝的p〔Gal4〕A307 和 pUASattb-Aβ42;Aβ43含有一个拷贝的p〔Gal4〕A307 和 pUASattb-Aβ43。
2.2果蝇爬管能力实验果蝇蛹化后7 d的攀爬能力均较好,各组间差异无统计学意义(P=1.000)。而日龄21 d的果蝇爬管能力已经出现了差异,除Aβ40组外,其余各组攀爬能力均较对照组明显下降;且与Aβ42组比较,Aβ片段长度更长的Aβ43组果蝇的攀爬能力下降更显著。果蝇日龄31 d时,与对照组相比,Aβ转基因品系的果蝇爬管能力急剧下降;且各组之间比较显示,Aβ40组果蝇的爬管能力减弱最轻,Aβ42组果蝇爬管能力下降加剧,与Aβ43组相当。见表1。
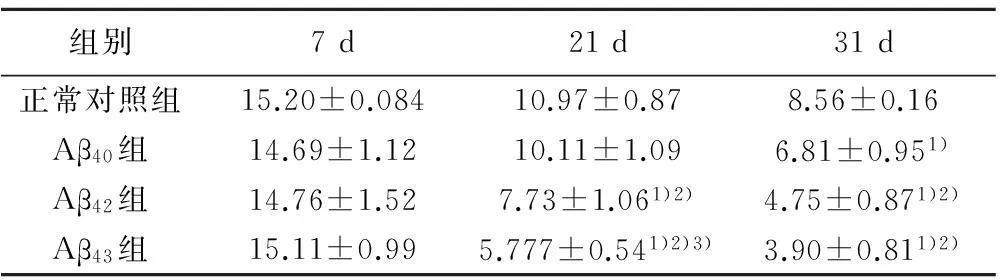
组别7d21d31d正常对照组15.20±0.08410.97±0.878.56±0.16Aβ40组14.69±1.1210.11±1.096.81±0.951)Aβ42组14.76±1.527.73±1.061)2)4.75±0.871)2)Aβ43组15.11±0.995.777±0.541)2)3)3.90±0.811)2)
与正常对照组相比:1)P<0.05;与Aβ40组相比:2)P<0.05;与Aβ42组相比:3)P<0.05
2.3果蝇寿命实验与正常对照组(44 d)相比,各组Aβ转基因果蝇的平均寿命明显缩短(P<0.05)。Aβ40组(43 d)与Aβ42组(41 d)比较,Aβ42组生存时间更短(P<0.05),而Aβ片段长度更长的Aβ43组(39 d)果蝇的寿命比Aβ40和Aβ42组寿命缩短更显著(P<0.05)。
3讨论
近年来,AD的发病机制研究已经成为热点。人们逐渐认识到AD病人大脑皮层、海马区有大量的淀粉样斑块(又称老年斑)和神经纤维缠结是其主要病理特征。后续Glenner、Masters等〔7,8〕发现,Aβ是老年斑的主要成分。Aβ是由淀粉样前体蛋白(APP)经过β泌肽酶和γ泌肽酶的蛋白裂解过程产生的,由于剪切位置或结构不同而得到不同长度的Aβ(如Aβ40、Aβ42、Aβ43和Aβ45等〔9,10〕)。这些Aβ单体经过结构折叠并聚集形成寡聚体。目前,Aβ蛋白级联假说认为,在许多毒性因子中,最主要的是寡聚体〔11~13〕。而由于不同长度的Aβ具有不同的折叠和聚集特性,导致其神经毒性也是不同的。
据报道〔14〕,p〔Gal4〕A307可驱动基因在果蝇GF特异性表达;而且,在果蝇GF系统中表达野生型或者突变型Aβ42可导致神经元内Aβ42积累显著增多、日龄依赖的突触功能障碍、运动能力损害以及果蝇寿命明显缩短〔15~17〕,可用于构建AD果蝇模型。本研究结果显示,Aβ导致的果蝇运动能力损害具有日龄依赖性,且不同长度Aβ引起的损害程度是不同的。提示可能Aβ42比Aβ40聚集性强,Aβ43又比Aβ42更强,其导致的神经毒性更重。这与之前国内外其他体外研究〔18~20〕结果一致。
4参考文献
1Glenner GG,Wong CW.Alzheimer′s disease:Initial report of the purif ication and characterization of a novel cerebrovascular amyloid protein〔J〕.Biochem Biophys Res Commun,2012;425(3):534-9.
2Creed MC,Milgram NW.Amyloid-modifying therapies for Alzheimer′s disease:Therapeutic progress and its implications〔J〕.Age(Dordr),2010;32(3):365-84.
3Gouras GK,Tampellini D,Takahashi RH,etal.Intraneuronal beta-amyloid accumulation and synapse pathology in Alzheimer′s disease〔J〕.Acta Neuropathol,2010;119(5):523-41.
4Friedrich RP,Tepper K,Ronicke R,etal.Mechanism of amyloid plaque formation suggests an intracellular basis of Abeta pathogenicity〔J〕.Proc Natl Acad Sci USA,2010;107:1942-7.
5Lenz S,Karsten P,Schulz JB,etal.Drosophila as a screening tool to study human neurodegenerative diseases〔J〕.J Neurochem,2013;127(4):453-60.
6Gargano JW,Martin I,Bhandari P,etal.Rapid iterative negative geotaxis(RING):a new method for assessing age-related locomotor decline in Drosophila〔J〕.Exp Gerontol,2005;40(3):386-95.
7Glenner GG,Wong CW.Alzheimer′s disease:initial report of the purification and characterization of a novel cerebrovascular amyloid protein〔J〕.Biochem Biophys Res Commun,1984;120(3):885-90.
8Masters CL,Simms G,Weinman NA,etal.Amyloid plaque core protein in Alzheimer disease and down syndrome〔J〕.Proc Natl Acad Sci USA,1985;82(12):4245-9.
9Kang J,Lemaire HG,Unterbeck A,etal.The precursor of Alzheimer′s disease amyloid Aβ protein resembles a cell-surface receptor〔J〕.Nature,1987;325(6106):733-6.
10Yankner BA,Lu T.Amyloid β-protein toxicity and the pathogenesis of Alzheimer′s disease〔J〕.J Biol Chem,2009;284(8):4755-9.
11Jan A,Adolfsson O,Allaman I,etal.Abeta42 neurotoxicity is mediated by ongoing nucleated polymerization process rather than by discrete Abeta42 species〔J〕.J Biol Chem,2011;286:8585-96.
12Lambert MP,Barlow AK,Chromy BA,etal.Diffusible,nonfibrillar ligands derived from Abeta1-42 are potent central nervous system neurotoxins〔J〕.Proc Natl Acad Sci USA,1998;95:6448-53.
13Walsh DM,Klyubin I,Fadeeva JV,etal.Naturally secreted loigomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo〔J〕.Nature,2002;416(5):535-9.
14Allen MJ,Shan X,Caruccio P,etal.Targeted expression of truncated glued disrupts giant fiber synapse formation in Drosophila〔J〕.J Neurosci,1999;19:9374-84.
15Zhao XL,Wang WA,Tan JX,etal.Expression of beta-amyloid induced age-dependent presynaptic and axonal changes in Drosophila〔J〕.J Neurosci 2010;30:1512-22.
16Huang JK,Ma PL,Ji SY,etal.Age-dependent alterations in the presynaptic active zone in a Drosophila model of Alzheimer′s Disease〔J〕.Neurobiol Dis,2013;51(2):161-7.
17Lin JY,Wang WA,Zhang X,etal.Intraneuronal accumulation of Abeta42 induces age-dependent slowing of neuronal transmission in Drosophila〔J〕.Neurosci Bull,2014;30(2):185-90.
18Rubin GM,Yandell MD,Wortman JR,etal.Comparative genomics of the eukaryotes〔J〕.Science,2000;287:2204-15.
19Hashmioto M,Tanable Y,Fujii Y,etal.Chronic administration of docosahexaenoicacidam eliorates the mipamient of spatial cognition learning ability in amyloid beta-infused rates〔J〕.J Nutr,2005;135(3):549-55.
20刘盈盈,杨玲,杨建光,等.β-淀粉样蛋白寡聚化模拟研究进展〔J〕.贵州科学,2011;29(6):55-8.
〔2014-03-11修回〕
(编辑徐杰)
