两株酵母菌协同酿造黄酒的控制工艺
2015-12-26刘杰傅勤峰蒋启海顾杰张云青陈国飞宁波阿拉酿酒有限公司浙江宁波315800
刘杰,傅勤峰,蒋启海,顾杰,张云青,陈国飞(宁波阿拉酿酒有限公司,浙江宁波315800)
两株酵母菌协同酿造黄酒的控制工艺
刘杰,傅勤峰,蒋启海,顾杰,张云青,陈国飞(宁波阿拉酿酒有限公司,浙江宁波315800)
利用两株酵母菌共同作为菌种制作高温糖化酒母酿造糯米黄酒。前发酵共3 d,落罐后品温达到30.5℃时开头耙30 min,然后分别隔2小时开二耙、三耙各10min,以后每隔4小时开耙10min,发酵第5天~10天每天开耙10min。头耙后0~24h温控30℃~31℃,24h~36h温控29℃~30℃,36h~48h温控28℃~29℃,以后每24小时降2℃,温度低于20℃后,按发酵质量降温。发酵22天后,糯米黄酒酒精度为19.4%(体积分数),总糖为1.8 g/L,总酸为5.4g/L。
黄酒;糯米;协同发酵;控制工艺
黄酒(Rice Wine)是世界三大酿造酒之一[1],在中国特别是南方地区受到了广泛的欢迎[2]。黄酒酿造涉及的微生物主要有霉菌、酵母菌和细菌[3]。其中,酵母菌(酒母)质量的优劣直接关系到黄酒发酵质量和风味的好坏[4]。
不同的酵母菌株具有不同的生物学特性和代谢特性,发酵后会影响黄酒的质量和风味[5]。不同酵母菌协同发酵可以克服单一酵母菌在发酵力、持久力或风味等方面的不足,做到取长补短,进而提升酿造质量和产品风味。
溶解氧和温度是影响黄酒发酵的重要因素。酵母菌在有氧条件下进行生长繁殖、无氧条件下进行酒精发酵[6]。发酵前期首先通过麦曲、酶制剂等糖化剂的作用为酵母菌繁殖提供足够的碳源和氮源,并通入适量的无菌空气以营造有氧条件。待酵母菌增殖到足够的细胞数时,维持无氧条件进行发酵作用产生酒精。
温度主要是通过影响酶的活性进而影响酵母菌活力。发酵温度过高会加快酵母衰老,并会加快升酸性杂菌的繁殖[7];发酵温度过低则会造成酵母菌代谢和发酵作用不彻底[8],在影响发酵液质量的同时也会增加煎酒、过滤等工序的困难。
现对利用两株不同的酵母菌作为菌种制作高温糖化酒母协同酿造大罐糯米黄酒的控制工艺和参数做一简介,以期为糯米黄酒的机械化酿造提供实际的参考。
1 材料与方法
1.1 物料
糯米:宁波鄞州梁桥米业有限公司;酒母:高温糖化 酒母 (Saccharomyces cerevisiae ALA02,Saccharomyces cerevisiae ALA03,宁波阿拉酿酒有限公司菌种室保存);纯种曲:圆盘制曲机制生麦曲(Aspergillusoryzae M03,宁波阿拉酿酒有限公司菌种室保存);块曲宁波阿拉酿酒有限公司自制;α-淀粉酶:诺维信(中国)生物技术有限公司;葡糖淀粉酶:苏州宏达制酶有限公司;酿造水:自来水经活性炭柱过滤。
发酵罐:前发酵罐65m3、后发酵罐130m3(内部带有温度计探头,夹套可通冷冻水,底部可通无菌压缩空气)。
1.2 混合酒母制作方法
混合酒母采用斜面原菌-试管麦芽汁-三角瓶麦芽汁-高温糖化酒母三级扩大培养的方法制作。两株酵母菌各取一接种环原菌独立接种于装有30mL麦芽汁的试管中,28℃静止培养22 h,然后取此30mL培养液分别接种于装有2 500mL麦芽汁的三角瓶中,28℃静止培养22 h。两株酵母菌分别取2瓶三角瓶培养液接种于2 t糖化液(米粉、米浆水、自来水先加热糊化,然后加麦芽、纯种曲、酶制剂糖化,杀菌、冷却至30.5℃制得糖化液,其总糖为108.2 g/L左右、氨基酸为0.17g/L左右、pH调至4.6)中,培养18h后投料使用。
1.3 配方和发酵控制方法
糯米黄酒投料配方见表1,确保物料均匀落罐,落罐品温控制在25.5℃~26.5℃。
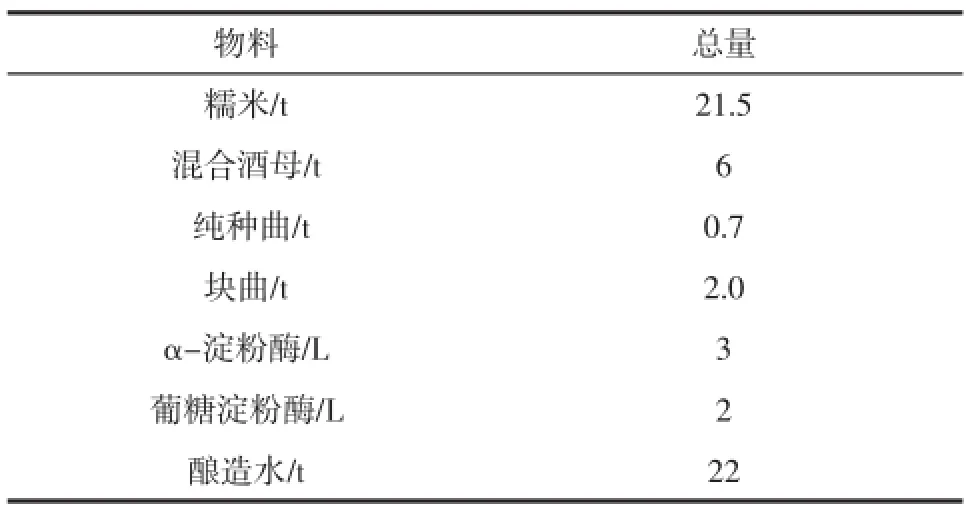
表1 糯米黄酒投料配方Table1 Feeding formula of glutinous rice wine
采用酿酒发酵工艺生产自控系统(可实现定时通气开耙和自动温控)进行发酵控制。
1.4 理化指标测定
总糖、总酸采用滴定法测定,酒精度采用蒸馏法测定[9]。
2 结果与分析
通过前期酿造试验可知,Saccharomyces cerevisiae ALA02具有前2天反应较快但持久力弱的特点,Saccharomyces cerevisiae ALA03具有代谢缓慢但持久力强的特点,两株酵母菌单独使用均会增加酿造的风险,因此将两株酵母菌混合作为菌种制作高温糖化酒母以提升黄酒的发酵质量和安全性。两株酵母菌在糖化液中适应一段时间后将各自占有一定的生态位、增殖到一定数目,共同参与到发酵作用中。
发酵开头耙时间是机械化大罐黄酒酿造的关键。过早开耙,酵母菌增殖会因糖化时间不够而缺少碳源、氮源;过晚开耙,溶解氧不足、高浓度CO2、高渗透压以及高温等逆境都会加快酵母菌的衰老。而黄酒酿造是霉菌、酵母菌和细菌协同作用的结果,上述两种情况均会造成酵母菌在与杂菌竞争过程中处于不利的地位,从而造成酸败现象的发生。糯米黄酒落罐后9 h左右品温达到30.5℃,此时要通入无菌压缩空气开头耙,头耙时间30min,然后分别隔2小时再开二耙、三耙各10min,以后每隔4小时开耙10min,发酵5 d~10 d每天下午开耙10min,10 d后不再开耙。
糯米黄酒发酵温控曲线见图1。
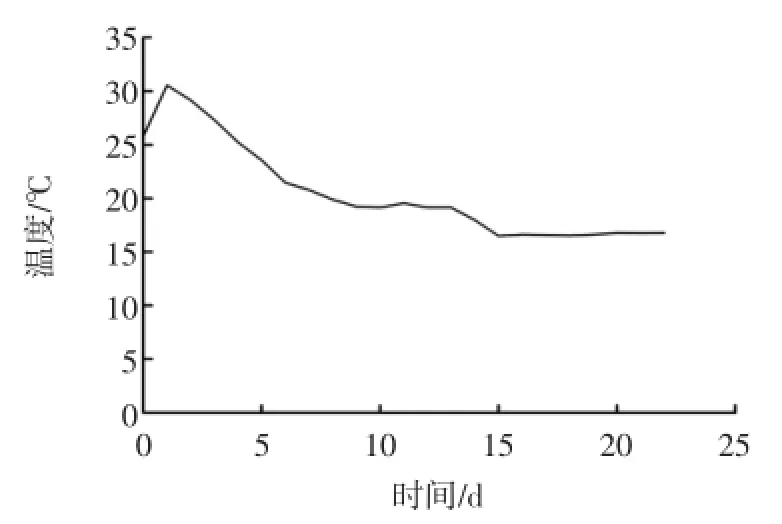
图1 糯米黄酒发酵温控曲线Fig.1 The temperature curve of fermentation of glutinous rice wine
开头耙期间温控不高于31.5℃,头耙开通后0~24 h温控30℃~31℃,24 h~36 h温控29℃~30℃,36 h~48h温控28℃~29℃,以后每24小时降2℃,温度低于20℃后,按发酵质量进行降温。
黄酒酿造是一个糖化和发酵同时进行的过程。糯米黄酒总糖变化曲线见图2。
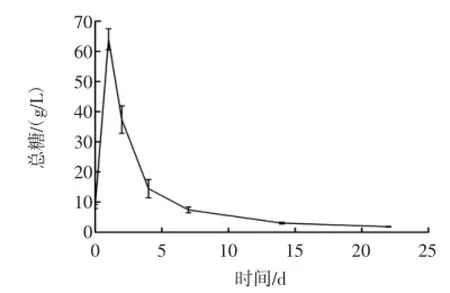
图2 糯米黄酒总糖变化曲线Fig.2 The total sugar curve of glutinous rice wine
由图2可以看出,随着时间的进行,总糖浓度先上升后下降,最后趋于平缓。投料落罐后,麦曲中各种糖化酶系、蛋白酶系和添加的酶制剂共同作用于原料,产生糊精、二糖、单糖和氨基酸等,此时在醪液中还存在少量落罐时带入的溶解氧,酵母菌将会进行同化增殖,但糖化速度远大于酵母菌同化和代谢可发酵性糖产生酒精的速度,因此落罐后总糖浓度逐渐升高;开耙后随着新鲜氧气的进入,酵母菌增殖速度加快,并代谢可发酵性糖产生大量酒精,总糖浓度逐渐下降,7 d以后总糖浓度降至8.0 g/L以下。主反应期间已经降解了大部分淀粉为可发酵性糖供酵母菌利用,酵母菌也会在高浓度酒精的条件下衰老甚至自溶,因此其发酵速率变慢,后期总糖浓度基本保持稳定。
糯米黄酒酒精度变化曲线见图3。
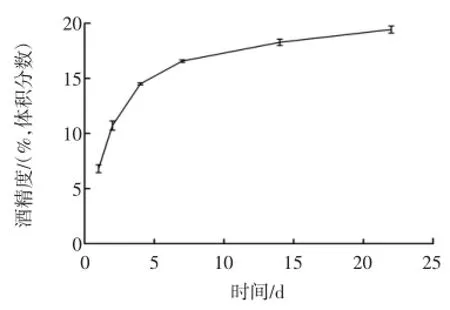
图3 糯米黄酒酒精度变化曲线Fig.3 The alcohol content curve of glutinous rice wine
可发酵性糖在无氧条件下通过酵母细胞内酒化酶系的作用产生酒精和CO2,酒精度前7天增加最快,第7天达到16.6%(体积分数),以后会因为酒精的反馈调节和酵母菌衰老使产酒精速率逐渐变慢。
酸是黄酒的风味来源之一[10]。糯米黄酒总酸变化曲线见图4。
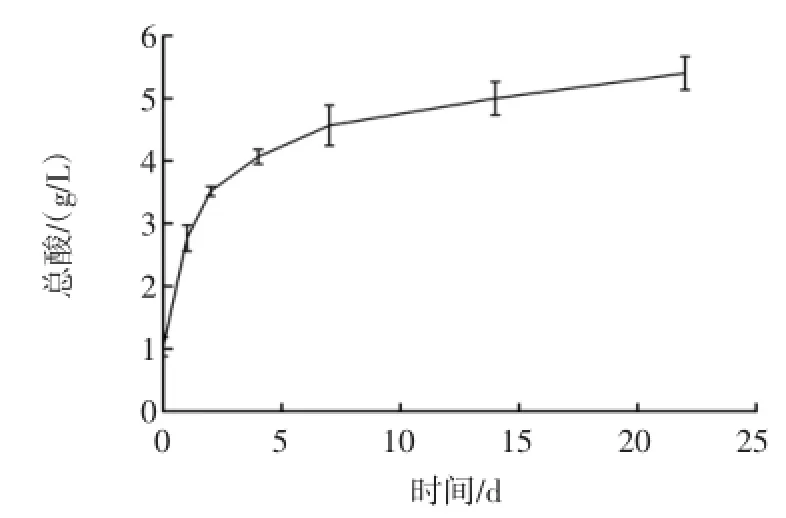
图4 糯米黄酒总酸变化曲线Fig.4 The total acid curve of glutinous rice wine
发酵过程中细菌(乳酸杆菌)大量增殖后与酵母菌、霉菌一起进行产酸代谢,发酵第7天总酸浓度逐渐上升至4.6 g/L,之后因为高浓度酒精的抑制作用、发酵品温降低而使细菌的代谢减弱以及酒体中醇、酸、酯之间的缓慢转化,导致后期总酸浓度基本稳定。
发酵第7天开始品温会降到20℃以下,此时醪液中还存在有残余淀粉和可发酵性糖,并且在麦曲和酶制剂的作用下还会继续糖化,酵母菌也会继续利用葡萄糖等可发酵性糖产生酒精,因此发酵7天后,继续维持醪液品温在16℃~20℃之间,以便实现充分发酵、提高出酒率。
与以往大罐糯米黄酒酿造时品温低于20℃直接通冷冻水降温至15℃以下相比,温度保持在16℃~20℃较长时间还可以加速酵母细胞衰老并自溶,产生的蛋白酶可降解发酵液中的蛋白质,从而提高清酒中的氨基酸浓度、并减轻煎酒时产生的多泡现象[8]。
车间采用此工艺酿造了28罐糯米黄酒,酿造质量稳定,基酒中氨基酸浓度为0.62 g/L左右。
3 结论
利用两株酵母菌等比例混合作为菌种制作高温糖化酒母酿造大罐糯米黄酒。前发酵共3 d,落罐后品温达到30.5℃时开头耙30min,然后分别隔2小时开二耙、三耙各10min,以后每隔4 h开耙10min,发酵5 d~10 d每天开耙10min,10 d后不再开耙。头耙后0~24 h温控30℃~31℃,24 h~36 h温控29℃~30℃,36 h~48 h温控28℃~29℃,以后每24小时降2℃,温度低于20℃后,按发酵质量降温。
发酵22天后,糯米黄酒酒精度为19.4%(体积分数),总糖为1.8g/L,总酸为5.4g/L,车间大生产的实际结果表明采用此种工艺酿造的基酒质量稳定、氨基酸浓度高,为机械化大罐糯米黄酒的酿造提供了实际的参考。
[1] Luo T,Fan WL,Xu Y.Characterization of volatile and semi-volatile compounds in Chinese rice wines by headspace solid phase microextraction followed by gas chromatography-mass spectrometry[J]. Journal of the Institute of Brewing,2008,114(2):172-179
[2] Liu F,He Y,Wang L,et al.Feasibility of the use of visible and near infrared spectroscopy to assess soluble solids content and pH of rice wines[J].Journal of food engineering,2007(83):430-435
[3]毛青钟.黄酒生产特点的探讨[J].酿酒科技,2005(1):67-67
[4] 谢广发.新工艺酒母在传统工艺黄酒中的应用中试[J].食品工业科技,2001,22(1):72-73
[5] 谢广发,郑志强,马晋,等.快速发酵黄酒酵母菌的筛选[J].中国酿造,2010(8):12-14
[6] 毛青钟.关于黄酒发酵过程中成分变化的探讨[J].中国酿造, 2004(12):1-5
[7]汪建国,汪琦.黄酒醪酸败原因分析及预防措施[J].中国酿造, 2005(8):36-39
[8] 谢广发.黄酒多泡原因初步分析及防止措施[J].中国酿造,2005 (7):37-38
[9] 全国食品工业标准化技术委员会酿酒分技术委员会.GB/T 13662-2008黄酒[S].北京:中国标准出版社,2008
[10]冯德明,朱长俊,王玉洁,等.黄酒发酵过程中乳酸含量分析及变化规律的研究[J].中国酿造,2009(7):158-160
Control Techniques of Cooperative Fermentation of Rice Wine by Two Strains of Saccharomyces cerevisiae
LIU Jie,FU Qin-feng,JIANG Qi-hai,GU Jie,ZHANG Yun-qing,CHEN Guo-fei
(Ningbo Ala Rice Wine Co.,Ltd.,Ningbo 315800,Zhejiang,China)
Glutinous rice wine was brewed by a cooperative fermentation method of high-temperature saccharification yeast using two strains of Saccharomyces cerevisiae.The primary fermentation periods were 3 days. Initial 30 min aeration was acted when the temperature reached 30.5℃,and then following two 10min-aeration every2 h.Then 10 min aeration was acted every4h.After that10min aeration was acted every day from the5th to 10th day during fermentation.The temperature was controlled 30℃to 31℃during 0-24 h after initial aeration,29℃-30℃during 24 h-36 h,28℃-29℃during 36 h-48 h,and then following a 2℃drop within 24 h.The temperature drop depended on the fermentation quality when it was below20℃.The alcohol content,total sugar and total acid of glutinous rice wine were19.4%(v/v),1.8g/Land5.4g/Lafter 22 days fermentation,respectively.
rice wine;glutinous rice;cooperative fermentation;control techniques
10.3969/j.issn.1005-6521.2015.01.021
2013-12-10
刘杰(1985—),男(汉),助理工程师,硕士,主要从事黄酒酿造技术的研究工作。
