L-苯丙氨酸解氨酶产生菌的原生质体诱变育种
2015-12-26李丽熊思驰黄飞王国盼韦春葵苏宏飞梁智群黄时海
李丽,熊思驰,黄飞,王国盼,韦春葵,苏宏飞,梁智群,黄时海,*
(1.广西大学生命科学与技术学院,广西南宁530005;2.南宁高新区人才交流中心,广西南宁530007)
L-苯丙氨酸解氨酶产生菌的原生质体诱变育种
李丽1,熊思驰1,黄飞2,王国盼1,韦春葵1,苏宏飞1,梁智群1,黄时海1,*
(1.广西大学生命科学与技术学院,广西南宁530005;2.南宁高新区人才交流中心,广西南宁530007)
原始菌株海洋红酵母M1202产生的L-苯丙氨酸解氨酶(PAL),能够逆反应催化反式肉桂酸(t-Ca)生成L-苯丙氨酸。对M 1202进行原生质体紫外诱变获得一株转化率为原始菌株115%的菌株TM2,经6次传代,仍具有较好的遗传稳定性。
海洋红酵母;L-苯丙氨酸解氨酶;原生质体诱变
L-苯丙氨酸(L-phenylalanine)是具有特殊生物活性的芳香族氨基酸,为人和动物不能合成的8种必须氨基酸之一,被广泛地应用于现代新型药物中[1]。它与L-天冬氨酸缩合,可以生产新型保健甜味剂阿斯巴甜(Aspartame,APM)[2]。而目前阿斯巴甜被认为是一种非常安全的二肽甜味剂[3],适合在肥胖及糖尿病人中使用[4]。自20世纪80年代以来,随着氨基酸类抗癌药物及营养保健品的开发应用,国际市场对L-苯丙氨酸的需求快速增长[5]。其制备方法,归纳起来共有4种:蛋白水解法,化学合成法,酶转化法及微生物发酵法[6-7]。其中酶转化法工艺简单,产物浓度较高,纯化步骤简便且生产能力较强,为目前工业化生产L-苯丙氨酸的主要方法之一。而酶法制备中研究较多的是利用红酵母中的L-苯丙氨酸解氨酶(PAL)逆反应催化反式肉桂酸(t-Ca)生成L-苯丙氨酸。
本试验采用海洋红酵母的L-苯丙氨酸解氨酶(PAL)生产L-苯丙氨酸。为了获得高产菌株,对原始菌株海洋红酵母M1202进行紫外诱变。考虑到原生质体对紫外线较敏感,先将M1202制备成原生质体,紫外诱变后进行原生质体再生培养,利用类似物选择培养基对再生菌株进行筛选,以期获得抗反馈调节高水平PAL酶源的突变株。
1 材料与方法
1.1 材料
1.1.1 菌株
红酵母菌M1202由实验室自主筛选保藏。
1.1.2 主要培养基
固体培养基(g/L):10°Bx麦芽汁,琼脂20.0,pH 5.5。
种子培养基:10°Bx麦芽汁,pH 5.5。
再生高渗培养基(g/L):10°Bx麦芽汁,0.8mol/L的甘露醇,琼脂20.0,pH 5.5。
菌株产酶培养基(g/L):10°Bx麦芽汁,酵母膏1.5,L-Phe 1.0,K2HPO41.0,pH5.5。
选择培养基(g/L):L-Tyr 0.5,(NH4)2SO420.0,K2HPO41.0,MgSO4·7H2O 0.2,FeSO4·7H2O 0.06,CaCl20.02,LiCl0.5,琼脂20.0,pH 5.5。
类似物筛选培养基(g/L):在上述选择培养基中,按表1添加结构类似物DL-Phe和M-OH-Ca(间羟基反式肉桂酸)。
1.1.3 主要试剂
预处理液:1%EDTA,0.1%巯基乙醇,用50mmol/L Tris-HCl配制。
原生质体渗透压稳定剂:0.5mol/L蔗糖,10mmol/LMgCl2,50mmol/LTris-HCl,pH7.0。
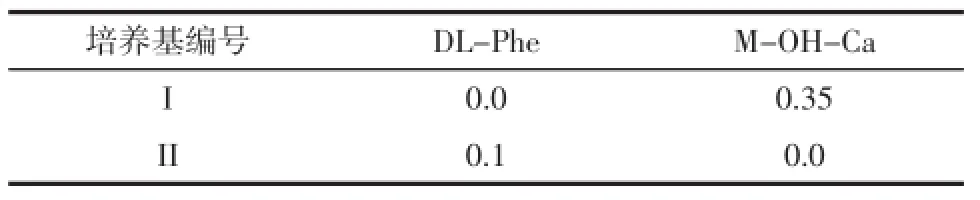
表1结构类似物添加配比Table1 The ratio of DL-phe and M-OH-Ca
红酵母去壁酶液:含质量分数1%蜗牛酶的原生质体渗透压稳定剂,微孔滤膜过滤除菌。
转化液:15g/L反式肉桂酸(t-Ca),Triton-1000.1%(体积分数),氨水浓度6.87 mol/L,碳酸氢铵浓度0.93mol/L,调pH至10.5。
生理盐水:称取9 g NaCl溶解于一定的蒸馏水后定容至1 L,灭菌备用。
1.2 方法
1.2.1 细胞悬液的制备
用接种环在斜面培养基上刮取一环菌体,接种于种子培养基,于30℃、160 r/min条件下摇床振荡培养20 h~24 h,至对数生长期。取发酵液10mL,4 000 r/min离心10min,渗透压稳定剂洗涤2次,将菌体悬浮于10mL稳定剂中制备成细胞悬液。取0.5mL,用无菌生理盐水适当稀释后用平板菌落计数法测细胞悬液浓度。
1.2.2 原生质体的制备与再生[8-9]
取5m L细胞悬液,4 000 r/min离心10min,弃上清液,加入预处理液,静置15min,用渗透压稳定剂洗涤2次,离心10min弃上清液,然后加入5mL酶液,30℃震荡保温,显微镜记录原生质体数量。吸取0.5m L酶处理液,加入4.5mL原生质体渗透压稳定剂,成原生质体悬液后经适当稀释,再用再生高渗培养基培养计数。另取0.5m L酶处理液至4.5m L无菌水中,震荡摇匀,适当稀释后,用固体培养基培养计数。计算原生质体制备率和再生率:原生质体制备率(%)=(酶解前菌落数-固体培养基上菌落数)/酶解前菌落数× 100%;原生质体再生率(%)=(再生高渗固体培养基上菌落数-固体培养基上菌落数)/(酶解前菌落数-固体培养基上菌落数)×100%。
1.2.3 原生质体紫外诱变[10]
将制备好的原生质体用渗透压稳定剂稀释至5× 103个/mL,取5mL移入直径9 cm的培养皿,并置于已预热30min的15w紫外灯下,距离20 cm。磁力搅拌下,分别照射20、40、60、80、100、120、140、160、180 s。取0.2mL照射后的菌液涂布于再生培养基上,30℃下倒置避光培养一周。整个过程需在黑暗或红光中进行,防止光复活。观察菌落形态,统计平板中的菌落数量,计算致死率,以未经诱变处理的菌悬液涂布平板作对照。
1.2.4 初筛
挑取直径大、长势稠厚的再生单菌落接种到类似物筛选培养基I、II上,30℃培养72 h。将类似物筛选培养基上菌落直径大、长势稠厚的单菌落接种于5mL种子培养基,30℃、160 r/min摇瓶培养20 h,再以4%的接种量接种至5mL产酶培养基,30℃、180 r/min培养30 h。离心得菌体,加入2m L转化液,于30℃、50 r/min条件下转化反应12 h。离心取上清,紫外-分光光度法检测转化率[11]。选取转化率较高的突变菌株斜面保藏,用于下一步复筛。
1.2.5 复筛
方法与初筛方法基本一致,采用高相液相色谱法检测L-Phe含量。
1.2.6 反式肉桂酸转化特性的研究
转化率的测定:取5mL发酵液,离心弃上清,加入2mL转化液,于30℃,50 r/min反应12 h。沸水浴10min钝化,5 000 r/min离心10min,取上清液0.1mL,稀释2 500倍,测定溶液OD271。
产酸量的测定:高相液相色谱法(HPLC),C18柱(4.6mmid×250mm),流动相为甲醇-水(体积比为30∶70),流速0.65mL/min,UV检测波长210 nm。
1.2.7 菌株连续转化稳定性研究
取培养至产酶阶段的125 g湿细胞,用生理盐水洗涤,加入250m L转化液,在不添加任何稳定剂的条件下进行生物转化12 h,测定转化率和L-Phe含量。通过计算t-Ca的转化量,向反应液中添加t-Ca使其回复到反应初始时的t-Ca浓度,并用浓氨水和碳酸氢铵调节维持反应液的pH为10.0。再次转化12 h,并多次重复上述过程,研究菌株多批次连续转化的稳定性。
2 结果与分析
2.1 原生质体制备率及再生率测定
原生质体的制备率为73.5%,再生率为13.0%。
2.2 原生质体紫外诱变
将经过紫外照射处理不同时间的菌悬液涂布于再生平板上,采用平板计数法计算菌落数,其致死率曲线如图1所示。
从图1可知,致死率随紫外照射时间的延长而增加,140 s时达到99%,之后基本稳定。当紫外照射时间为120 s,致死率为90%,菌体正诱变率最大。因此确定紫外诱变的最佳时间为120 s。
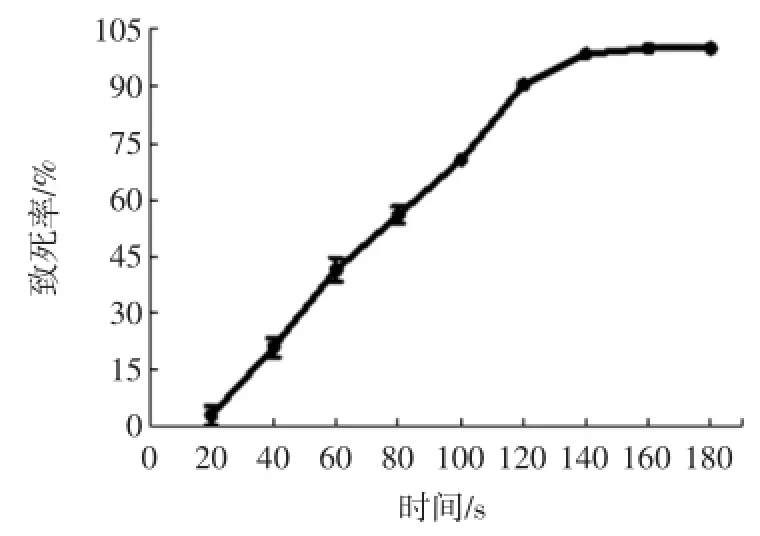
图1 紫外诱变致死率曲线Fig.1 Lethality curve of strain induced by UV
2.3 L-Phe标准曲线与t-Ca标准曲线的绘制
L-Phe标准曲线与t-Ca标准曲线的见图2与图3。
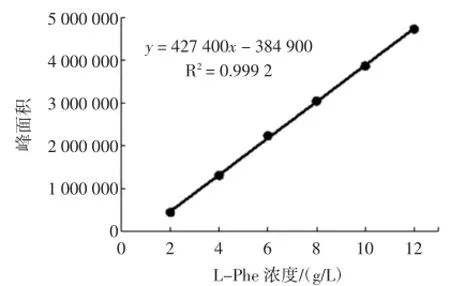
图2 L-苯丙氨酸标准曲线的绘制Fig.2 The plotting of standard curve of L-phe
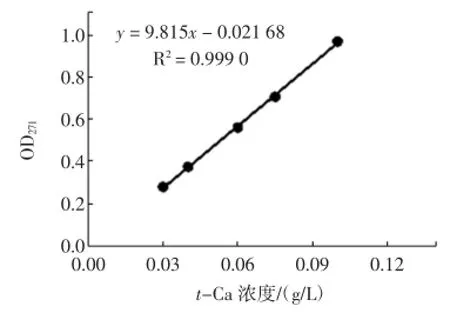
图3反式肉桂酸标准曲线的绘制Fig.3 The plotting of standard curve of t-Ca
由图2和图3可知L-Phe和t-Ca分别在2 g/L~12 g/L、0.03 g/L~0.10 g/L范围内线性关系良好。
2.4 初筛
经过紫外结合诱导类似物诱变筛选获得了106个突变株,挑取其中的65株进行初筛,结果见表2。

表2初筛结果Table2 The results of preliminary screening
经过初筛得到了5株优于出发菌株的突变株,其生物转化能力比较见表3。
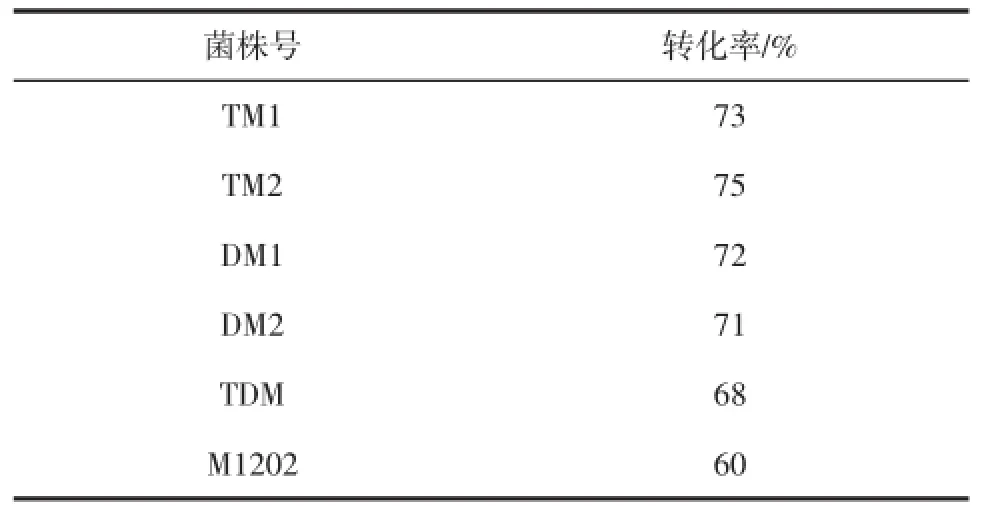
表3 诱变株和出发菌株(M 1202)PAL生物转化能力比较Table3 The PAL bioconversion capacity comparison between the original strain(M 1202)and the mutant strains by UV mutagenesis
从表3中可知,突变株DM1,DM2,TM1,TM2,TDM的转化率均大于68%,较出发菌株M1202高。
2.5 复筛
对初筛得到的五株转化率较高的菌株进行复筛,利用HPLC测定苯丙氨酸含量,结果见表4。

表4 复筛结果Table4 The results of rescreening
从表4可知,TM2的产酸量最高,达9.67 g/L。2.6 转化产物的鉴定
HPLC分析L-Phe与t-Ca的标准混合液及转化液,结果显示,混标样和转化液中的L-Phe与t-Ca分离效果较好,t-Ca保留时间约为6.78min,L-Phe保留时间约为11.34min,峰型对称且无明显干扰峰,说明酵母细胞通过催化转化反应体系中的t-Ca和NH3合成了L-Phe。
2.7 遗传稳定性实验
TM2经过6次连续传代,产酸量基本保持稳定,具有较好的遗传稳定性,结果如图4。
2.8 菌株连续转化稳定性的研究
结果如图5和图6所示。
经过120 h的10次连续转化,L-Phe积累量达63.80 g/L。第九次取样测定时(108 h),转化率降至约40%。与出发菌株M1202比较(半衰期约为70 h),TM2半衰期有了一定程度的提高。此外,这种连续补料与分批转化相比,省略了多次离心的步骤,十分有利于工业化生产。
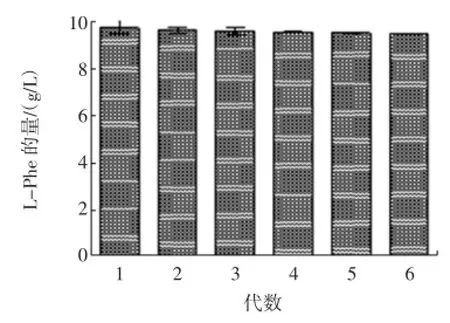
图4 菌株TM2的遗传稳定性实验Fig.4 The genetic stability experiment of strain TM2
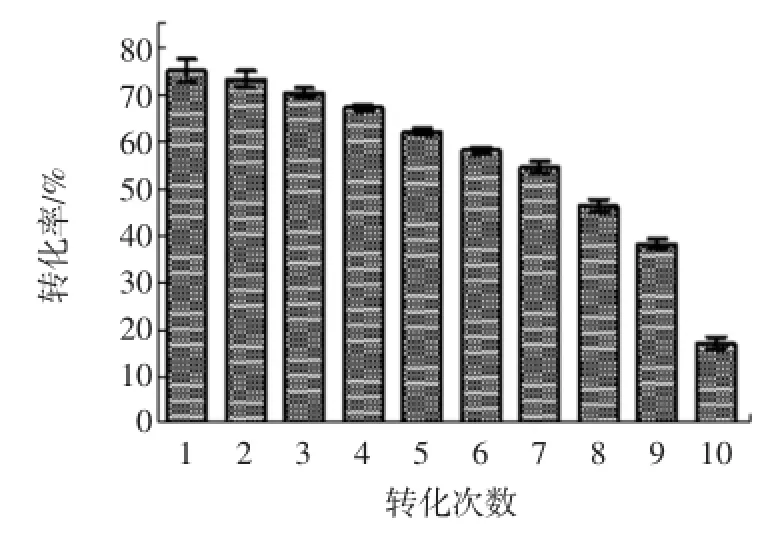
图5 转化10次对转化率的影响Fig.5 The effect of conversion rateby transform ing ten times
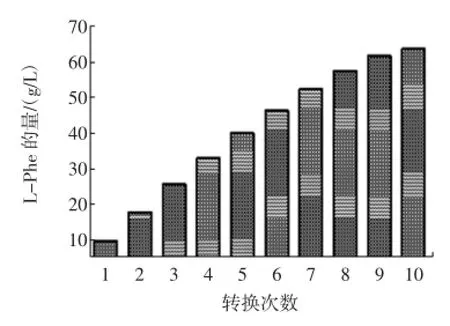
图6 转化10次的苯丙氨酸积累量Fig.6 The accumulation of L-Phe by transforming ten times
3 结论与讨论
1)紫外线产生的高能射线,直接作用于菌株DNA,引起碱基互补配对出错,从而导致菌体突变。此外,紫外诱变还具有正突变率较高、不易产生回复突变的特点[12],故常被用于微生物诱变育种。本实验将菌体制备成原生质体后再进行紫外诱变,去壁后的红酵母由于失去了细胞壁的保护,对紫外线更加敏感,从而提高了突变率。顾蕾[10]等对一株产类胡萝卜素红酵母ns-1进行原生质体紫外诱变,获得类胡萝卜素产量明显提高的突变菌株UVss,其生物量、色素产量分别比原始菌株提高了67.6%、54.1%。我们的实验结果也表明,原生质体紫外诱变与常规方法相比,在提高海洋红酵母PAL酶活、转化率等方面效果较好。比如,本实验诱变的TM2菌株的稳定性明显高于目前报道的其它微生物[13]。
2)本试验在筛选培养基中添加了结构类似物DL-苯丙氨酸(DL-Phe)和间羟基反式肉桂酸(M-OHCa),建立了高通量的筛选方法。DL-Phe为PAL非天然底物,具有较高的Km值,作为唯一碳源时能诱导出高水平的PAL[14-15];M-OH-Ca是PAL反应产物的结构类似物,添加时迫使PAL酶源菌株产生反馈调节,从而阻遏PAL的生成和影响菌体的生长、代谢。因此,添加M-OH-Ca能辅助筛选出高抗反馈调节的PAL酶源菌株。本实验结果表明,该高通量方法简单、高效、省时和低成本,并可用于再生原生质体的筛选。
3)采用改良的转化方式,分批连续补料进行转化,省略了多次离心步骤。连续10次补料,250mL转化液共加入25 g t-Ca,相当于底物浓度为100 g/L。经120 h转化,L-Phe积累量达63.80 g/L,即转化率达63.80%,这为下一步优化反应条件,扩大实验规模,奠定了坚实的基础。
[1]李冀新,张超.L-苯丙氨酸生产及应用研究进展[J].氨基酸和生物资源,2006,28(2):51-56
[2]邓菊香,王祖元.苯丙氨酸的生产现状与发展前景[J].安徽化工, 2007,33(4):1-3
[3] 马德金,张凯,唐根生.阿斯巴甜工艺制作工程分析 [J].理论研究, 2010,9(4):22-23
[4] Portmann MO,Kilcast D.Psychophysical characterization of new sweeteners of commercial importance for the EC food industry[J]. Food Chem,1996,56(3):291-302
[5]王敏.L-苯丙氨酸开发前景诱人[J].化工生产与技术,2003,10(1): 23
[6]SprengerG.From scratch to value:engineering Escherichia coli wild type cells to theproduction of L-phenylalanine and other fine chemicals derived from chorismate[J].Appl Microbiol Biotechnol,2007, 75(4):739-749
[7]Chem SJ.L-苯丙氨酸的现状与发展前景[J].精细与专用化学品, 2002(10):13-14
[8]詹萍,苏龙,周乃东.红酵母原生质体制备和再生条件研究[J].安徽农业科学,2010,38(3):1154-1155
[9]刘凤珠,牛小明.耐高渗酵母原生质体诱变育种的研究[J].食品工程,2010(2):37-39
[10]顾蕾,陆玲,袁生.红酵母原生质体制备及其紫外诱变育种的研究[J].食品工业科技,2004,25(4):60-62
[11]杨顺楷,李果龙,赵健生.酵母全细胞苯丙氨酸解氨酶(PAL)活性的紫外分光测定法[J].天然产物研究与开发,1990(1):59-62
[12]Rowlands RT.Rational screens and genetic recombination techniques[J].Enzyme Microb Technol,1984,6(7):290-300
[13]Macdonald MJ,D’Cunha GB.A modern view of phenylalanine ammonia lyase[J].Biochem Cell Biol,2007,85(3):273-282
[14]杨敏,杨顺楷.化学诱变结合结构类似物法选育高苯丙氨酸解氨酶菌种[J].应用与环境生物学报,1999,5(5):525-528
[15]李楠,熊彬,张云开,等.产L-苯丙氨酸解氨酶菌种筛选[J].广西农业生物科学,2005,24(4):335-338
Mutation Breeding of Protoplast of L-phenylalanine Ammonia-lyase Producing Strains
LI Li1,XIONG Si-chi1,HUANG Fei2,WANG Guo-pan1,WEI Chun-kui1,SU Hong-fei1,LIANG Zhi-qun1,HUANG Shi-hai1,*
(1.Life Science and Technology College,Guangxi University,Nanning 530005,Guangxi,China;2.the Communication Centre for Talents of Nanning New and High-tech Industrial Development Zone,Nanning 530007,Guangxi,China)
Using Rhodotorula benthica M1202 as the original strain,the L-phenylalanine ammonia-lyase(PAL)of M1202 could transform trans-Cinnamic acid(t-Ca)to L-phenylalanine.The aim of this study was to obtain new Rhodotorula benthica mutants with high conversion rate.UV induced mutagenesis of protoplast was performed on original strain Rhodotorula benthica M1202.A genetically stable mutant strains TM2was selected from a large amount of the regenerative mutants.The conversion rate of TM2was1.15-fold increased compared with its original strain.Further experiment confirmed after six generations successively propagating the conversion rate of TM2 was stable.
Rhodotorula benthica;L-phenylalanine ammonia-lyase;protoplast mutation
10.3969/j.issn.1005-6521.2015.01.029
2013-07-29
南宁市科学研究与技术开发计划项目(20125193);梧州市科学研究与技术开发计划项目(201201023)
李丽(1988—),女(汉),硕士研究生,研究方向:食品与发酵工程。
*通信作者:黄时海,男,博士,食品与发酵工程专业。
