谷氨酰胺转氨酶菌株的筛选及其产酶条件研究
2015-12-26宋小平王雅洁王迎新沈书文李光伟
宋小平,王雅洁,王迎新,沈书文,李光伟
(1.安徽医学高等专科学校药学系,安徽合肥230601;2.合肥天麦生物科技发展公司,安徽合肥230031;3.中国科技大学生物工程中试基地,安徽合肥230022)
谷氨酰胺转氨酶菌株的筛选及其产酶条件研究
宋小平1,王雅洁1,王迎新1,沈书文2,李光伟3
(1.安徽医学高等专科学校药学系,安徽合肥230601;2.合肥天麦生物科技发展公司,安徽合肥230031;3.中国科技大学生物工程中试基地,安徽合肥230022)
利用蛋白质交联-絮凝沉淀性能测定方法,从土壤中分离得到1株高产谷氨酰胺转氨酶(microbial transglutaminase,MTG)的菌株,命名为HF-82,初步确定为链霉菌属。单因素试验确定最适产酶氮源和碳源分别是蛋白胨和葡萄糖,正交试验确定最适发酵培养基为(g/L):葡萄糖25.0,蛋白胨20.0,酵母提取物5.0,MgSO4·7 H2O 2.0,K2HPO4·3 H2O 2.0,NaH2PO42.0,CaCO33.0,pH 7.0。此发酵工艺条件下,MTG的酶活可达到0.53 U/mL。
蛋白质交联-絮凝沉淀法;谷氨酰胺转氨酶;菌种选育;产酶条件
谷氨酰胺转氨酶(Microbial transglutaminase,简称MTG,EC2,3,2,13),是一种催化酰基转移反应的转移酶。由于其具有在蛋白质间架桥形成ε-(γ-Glu)-Lys的异型肽键[1],将蛋白质共价交联聚合,使蛋白质改性,该酶已经在食品工业、医药工业、分析检测和生物工程等方面取得广泛应用,因而具有很大的研究开发空间[2-4]。
微生物发酵法生产的谷氨酰胺转氨酶成本低,吸引了国内外学者的关注和兴趣。在谷氨酰胺转氨酶的发酵生产中,获得优良的菌种十分关键。近年,黄六容[5]利用设计的低廉简便的凝胶法从土壤中分离得到1株高产谷氨酰胺转氨酶。Claucia F[6-7]等报道运用蛋白质交联-絮凝沉淀法,在亚马逊河附近筛选到一株产谷氨酰胺转氨酶的菌,该菌产生的MTG能减少酪蛋白、大豆分离蛋白和水解动物蛋白的自由氨基,并对酪蛋白显示出明显的蛋白质交联作用。目前已报道的微生物谷氨酰胺转氨酶菌株主要属于放线菌类的链霉菌属[4-8,9]。
采用蛋白质交联-絮凝沉淀法初步估测菌株是否产酶[10-12],再用经典的比色法测定酶活大小并对其发酵条件进行了初步探讨,为该酶应用于发酵生产奠定基础。
1 材料与方法
1.1 土壤采集
参照土样采集方法[12-14],选择有机质丰富的沃土、堆肥采集土样[15],自合肥板桥屠宰场、合肥蜀山奶牛场、岳西县屠宰场、奶牛场附近菜园、安徽医学高等专科学校校园花圃取土样共17份,每份重约500 g,土样采集时间为2011年10月10日至11月10日。
1.2 培养基
1.2.1 初筛分离培养基(g/L)
精氨酸0.83,甘油12.5,NaC1 1.0,MgSO4·7H2O 2.0,土壤浸出汁200,琼脂15.0,水800。灭菌后加入无菌过滤的放线菌酮0.05,制霉菌素0.08。
1.2.2 斜面种子培养基
高氏1号培养基。
1.2.3 液体种子培养基(g/L)
葡萄糖20.0 g,蛋白胨20.0 g,酵母膏5.0,MgSO4· 7H2O 2.0,K2HPO4·3H2O 2.0,NaH2PO42.0,pH 7.0。
1.2.4 发酵培养基(g/L)
葡萄糖25.0,蛋白胨20.0,酵母提取物5.0,MgSO4· 7 H2O 2.0,K2HPO4·3 H2O 2.0,NaH2PO42.0,Ca CO33.0,pH7.0。
1.3 试剂
cycloheximide(放线菌酮),nystatin(制霉菌素),Caseinscase(酪蛋白),CBZ-Gln-GLy和r-单异氧肟酸均购自Sigma公司,其余均为国产分析纯试剂。
1.4 方法
1.4.1 菌种分离
取土壤样品1.0 g,加入9mL无菌水中制成悬浮液,充分振荡静置30min后取上层悬液,依次制备成10-1、10-2、10-3、10-4、10-5不同浓度的稀释液,取0.2mL不同浓度的稀释液涂布于分离培养基平板上,于28℃培养5 d~7 d,观察菌落形态,从平板挑取放线菌菌落进行划线培养,直至得到纯培养。
1.4.2 摇瓶发酵培养方法
将分离的菌种于斜面培养基中活化后,取一环斜面孢子,接入液体种子培养基,接到装有20mL液体种子培养基的200m L的三角瓶中,28℃,200 r/min条件下培养48h。将培养好的液体种子按10%的接种量接人装有40mL摇瓶发酵培养基的250mL三角瓶中,28℃,200 r/min恒温培养至第3天,离心得到上清液。
1.4.3 凝胶法初筛产酶菌株[15-17]
1 g酪蛋白用少量NaOH湿润后,再加入磷酸缓冲液(0.02mol/L,pH 6.5)使酪蛋白浓度达到12%.酪蛋白溶液与发酵上清液按一定比例混合均匀,于37℃反应3 h后静置,观察实验现象,依据是否有凝絮或沉淀产生判断是否产MTG,并大致估计酶活性。
1.4.4 比色法复筛产酶菌株[16,18]
对产生凝胶现象的菌株再用比色法进行复筛,测定上清液的谷氨酰胺转酶活力,进行酶活、细胞干重和pH测定。
1.4.5 产酶菌株的培养条件优化
单因素试验确定MTG发酵培养基最佳碳源是葡萄糖,最佳氮源是蛋白胨和酵母膏,在此基础上,以葡萄糖、蛋白胨和酵母膏为3个优化因素,每个因素选取3个水平,确定因素水平表,如表1所示。以MTG酶活为优化指标,按下表进行L9(33)的正交实验。

表1 发酵培养基优化的因素和水平表Table1 Factors and levels of optimization of fermentation medium
1.5 测定方法
1.5.1 生物量的测定
取10mL发酵液经4 000 r/min离心10min,蒸馏水洗涤沉淀2次,离心收集沉淀,于105℃烘干至恒重,称重。
1.5.2 MTG酶活测定方法
比色法[14,21-22]等测定酶活,底物试剂中各 物质的浓度分别是:盐酸羟胺0.1mol/L,CBZ-Gln-Gly 30 mmol/L,Tris-乙酸缓冲液0.2mol/L(pH 6.0),还原型谷胱甘肽10mmol/L。1mL底物试剂与0.2m L上清液37℃预热5min后,混合、反应10 min,迅速加入1 mL终止液(5%FeCl3·6H2O:12%三氯乙酸:3mol/L盐酸=1∶1∶1)终止反应,4 000 r/min离心,弃去沉淀,在525 nm下测上清液的吸光度,参比可用失活的酶液代替。一个MTG酶活单位(U/mL)定义为在37℃,pH 6.0的条件下反应1min生成1 umol氧肟酸的量。以L-谷氨酸-γ-单羟胺酸(氧肟酸)作标准曲线。
2 结果与讨论
2.1 初筛试验
首先,从稀释梯度涂布平板的上,根据菌落形态初步挑出135株放线菌,再结合生长形状及显微镜检结果挑出73株放线菌,将这些放线菌菌落,经平板划线分离并传代培养2代~3代。
我们对二次初选得到的73株放线菌以蛋白质交联凝絮-沉淀性能测定试验进行初筛。发现有4个菌株有明显的凝絮-沉淀现象产生,所有发生交联凝聚反应的菌株均进行2次或3次重复试验,不同批次实验中出现的现象基本一致,分别命名HF-11、HF-45、HF-82、HF-105。
2.2 复筛试验
对初筛得到的4个菌株进行复筛试验,摇瓶发酵得到的上清液进行比色反应测定MTG酶活,所有菌株都在一定程度上产生MTG,而且菌株的产酶能力和蛋白质交联凝絮结果相吻合。试验结果酶活性最高的是HF-82号为0.41U/mL,所以以该菌株为出发菌株作进一步鉴定和优化分析。
2.3 产MTG菌株的初步鉴定
HF-82菌株在平板上培养7 d后,菌落呈圆形,凸起,灰白色,边缘不规则状。采用插片法培养,于不同时期在显微镜下观察气生菌丝、基内菌丝、孢子丝的形态特征。气生菌丝丰富,灰色、基内菌丝褐色,孢子丝有不同程度的轮生,符合链霉菌的特点。初步鉴定该菌为放线菌中的链霉菌属。
2.4 发酵培养基的优化
2.4.1 不同碳源和氮源对HF-82菌株生物量与产酶的影响
分别选择不同碳源、氮源替代基础培养基中的葡萄糖、蛋白胨进行发酵产酶试验,测定生物量和酶活性,结果见表2。
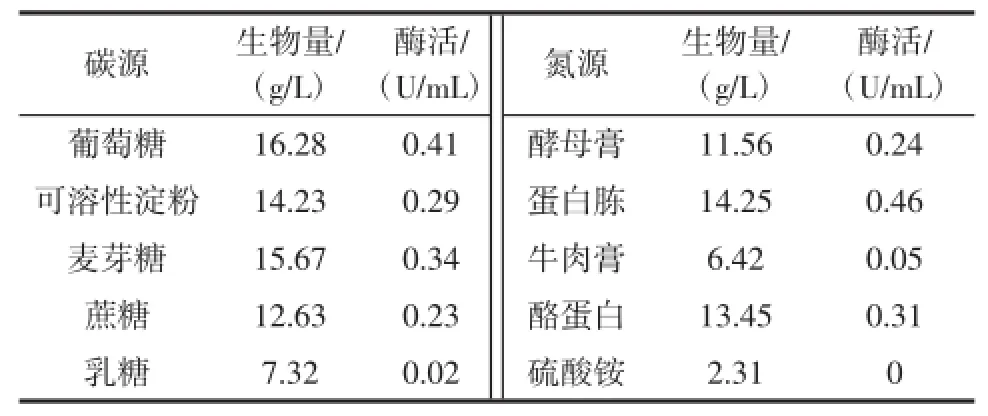
表2 HF-82菌株在不同碳源、氮源上的MTG酶活性和生物量Table2 Biomass and MTG activity of strain HF-82 on different carbon sources and nitrogen sources
结果表明,不同碳源、氮源对HF-82菌株细胞生长和产酶影响较大,以葡萄糖为碳源时细胞生长最好,同时酶活也最高,其生物量和酶活分别为16.28 g/L、0.41 U/mL,其次是麦芽糖,生物量和酶活分别为15.67 g/L、0.34U/mL,故以下试验中采用葡萄糖为碳源;氮源中,牛肉膏、酵母膏、蛋白胨、酪蛋白等有机氮源均可显著促进细胞生长,以蛋白胨为氮源,酶活最高,达到0.46U/mL,而以无机硫酸铵为氮源时,不产酶,可见蛋白胨在供试氮源中为最好的氮源,因而后续试验以蛋白胨为最佳氮源。
2.4.2 最适产酶培养基配方的确定
在单因素试验的基础上,以葡萄糖、蛋白胨和酵母膏为3个优化因素,每个因素选取3个水平,以MTG酶活为优化指标,按下表进行L9(33)的正交实验,结果如表3所示。
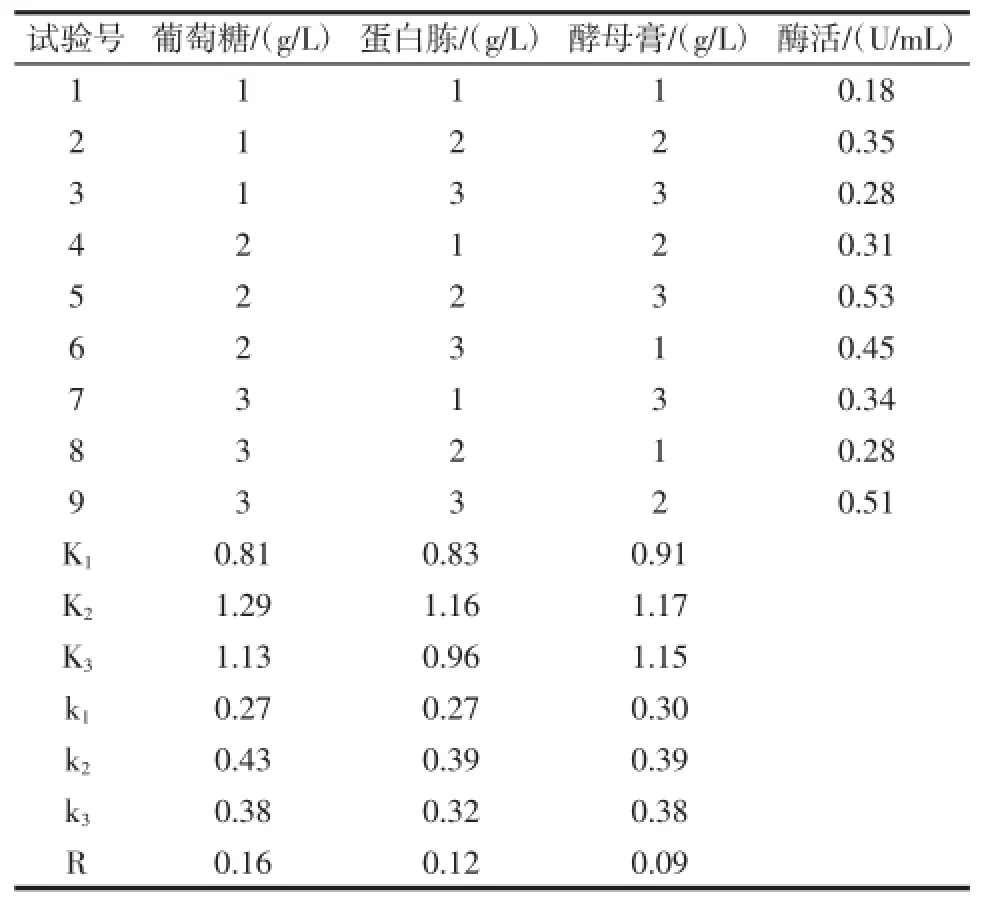
表3 正交设计实验结果Table 3 Experimental results of orthogonal design
从表3可以看出,3个因素对产酶的影响程度为:葡萄糖>蛋白胨>酵母提取物。说明葡萄糖、蛋白胨对酶活影响最大,为主要影响因素;酵母提取物对酶活影响小,为次要影响因素。因此,葡萄糖选取A2,蛋白胨选取B2,次要影响因素酵母提取物以节约为原则选取C1或C3,并用A2B2C1和A2B2C3各做1次验证试验,结果如表4所示。

表4 正交试验的验证试验Table4 Proof testing of orthogonal experiment
正交试验的验证试验表明,A2B3C2的酶活为0.52 U/mL,A2B3C1酶活为0.53U/mL,故确定最优发酵培养基为A2B3C1。所以,本试验中MTG发酵培养基组合为(g/L):葡萄糖25.0,蛋白胨20.0,酵母提取物5.0,MgSO4·7H2O2.0,K2HPO4·3H2O2.0,NaH2PO42.0,CaCO33.0,p H7.0。此时酶活达0.53U/m L。
2.5 菌体细胞的生长与产酶曲线
在HF-82菌株发酵产酶过程中,每隔8小时取样,测得菌体细胞的生长与产酶曲线分别见图1和图2。
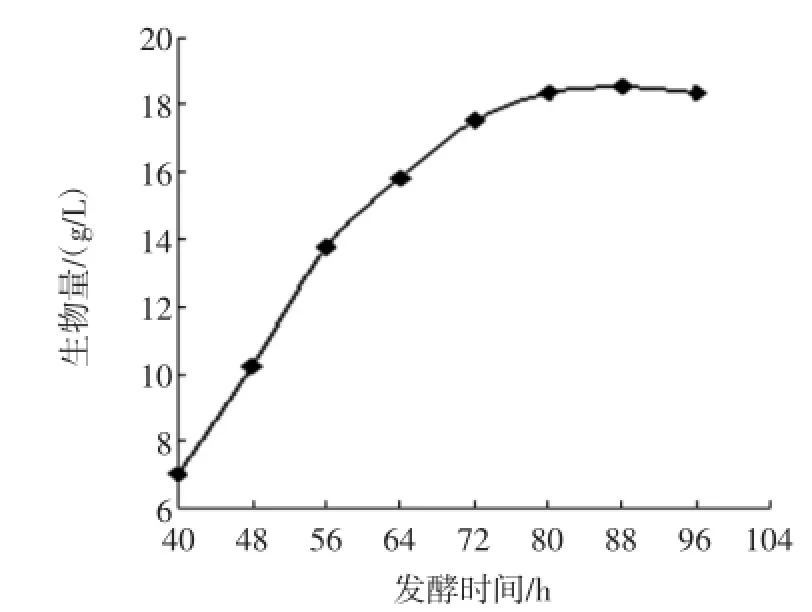
图1 菌体细胞的生长曲线Fig.1 The growth curve of HF-82

图2 菌体细胞的产酶曲线Fig.2 The enzyme activity curve of HF-82
由图1、2可知,菌体生长量和MTG的酶活与时间呈相关性;在发酵中期,细胞生长量和MTG酶活都不断增加,经过一段时间之后,菌体生长从指数生长末期开始进人稳定生长期,酶活也达到最高,并随发酵时间的延长而略有下降。所以,最佳的发酵时间为80 h,此时酶活最大,为0.53U/m L。
3 结论
本研究从土壤中筛选分离得到的菌株HF-82初步优化后,其发酵液的MTG酶活达0.53U/mL,但是与内外研究的最大表达量尚有差距。下一步将通过扩增谷氨酰胺转氨酶基因,构建表达质粒,建立高密度发酵工艺和简便有效的MTG包涵体复性方法,提高HF-82菌株的酶活。
[1] Motoki M,Seguro K.Transglutaminase and its use for food processing[J].Trends in Food Science Technology,1998(9):204-210
[2]Martin P Bonisch,Manfred Huss,Kerstin Weitl,et al.Transglutaminase cross-linking of milk proteins and impact on yoghurt gel properties[J].International Dairy Journal,2007(17):1360-1371
[3]Claucia Fernanda Volken de Souza,Ju'lio Xandro Heck,Marco Anto^nio Za'chia Ayub.Solid state bioreactor production of transglutaminase by Amazonian Bacillus circulans BL32 strain[J].Microbiol Biotechnol,2008,35:1677-1685
[4] Juliana Alves Macedo,Lara Duraes Sette,Helia Harumi Sato.Purification and Characterization of a new transgluteminase from streptomyces sp.Isolated in Brazilian soil[J].Journal of Food Biochemistry, 2011(35):1361-1372
[5]黄六容,何冬兰,刘梅芳.产谷氨酰胺转胺酶菌株的筛选及其产酶条件研究[J].华中农业大学学报,2005,24(4):369-372
[6] Luis Henrique de Barros Soares,Francine Assmann,Marco Antonio Zachia Ayub.Purification and properties of a transglutaminase produced by a Bacillus circulans strain isolated from the Amazon environment.Biotechno[J].Appl.Biochem,2003(37):295-299
[7]Claucia Fernanda Volkende Souza,D'ebora Jung Luvizetto Faccin,O-mar Mertins,et al.Kinetics of thermal inactivation of transglutaminase froma newly isolated Bacillus circulans BL32[J].ChemTechnol Biotechnol,2009(84):1567-1575
[8]Claucia Fernanda Volken de Souza,Janaina Guimarães Venzke,Simone Hickmann Flôres,et al.Enzymatic properties of transglutaminase produced by a new strain of Bacillus circulans BL32 and its action over food proteins[J].LWT-Food Science and Technology, 2011(44):443-450
[9] Ando H,Adadi M,Umeda K,etal.Purification and characteristics of a novel transglutaminase derived from microorganisms[J].A-gricultural Biological Chemistry,1989,53:2613-2617
[10]王璋,王灼维,莫湘筠.微生物谷氨酰胺转胺酶生产菌株的育种研究[J].中国生物工程杂志,2003,23(6):1-5
[11]Xiang Dong Sun,Susan D.Arntfield.Gelation properties of myofibrillar/pea protein mixtures induced by transglutaminase crosslinking [J].Food Hydrocolloids,2012(27):394-400
[12]崔国燕,胡青平.蛋白质交联-絮凝沉淀法筛选产转谷氨酰胺酶放线菌株的效果分析[J].沈阳农业大学学报,2008,39(5):632-634
[13]诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994:335-364
[14]崔艳华,张兰威.谷氨酰胺转氨酶研究进展[J].生物技术通报, 2009(1):31-34
[15]Koo B China,MiY Go,Youling LXiong.Effect of soy protein substitution for sodium caseinate on thetransglutaminate-induced cold and thermal gelation of myofibrillar protein[J].Food Research International,2009(42):941-948
[16]姜燕,唐传核,温其标,等.酶法改性对各种蛋白膜的溶解特性和体外消化率的影响[J].2009,35(3):71-73
[17]何冬兰,彭宝玉,张莹,等.微生物谷氨酰胺转胺酶对大豆分离蛋白凝胶性能的影响[J].中南民族大学学报,2010,29(1):41-44
[18]常中义,江波,王璋.培养基组成对轮枝链霉菌合成谷氨酰胺转胺酶的影响[J].无锡轻工大学学报,2001,20(1):51-54
[19]张春红,李长彪,陈国娟,等.灰轮丝链轮丝菌合成谷氨酰胺转胺酶发酵条件的研究[J].食品研究与开发,2006,27(3):7-10
[20]李赘高,沐万孟,江波,等.谷氨酰胺转氨酶摇瓶补料发酵的研究[J].食品与发酵工业,2008,34:67-70
[21]郑美英,堵国成,陈坚,等.pH和初始淀粉质量浓度对发酵生产谷氨酰胺转胺酶的影响[J].无锡轻工大学学报,2000,19(4):331-335
[22]Ho M,Leu S,Hsieh J,et al.Technical approach to simplify the purification method and characterization of transgluteminase produced from streptoverticillium ladaknum[J].Food Science,2000,65(1):76-80
Screening of Microbial Transglutaminase Producing Strain and Optimazation of Fermentation Conditions
SONG Xiao-ping1,WANG Ya-jie1,WANG Ying-xing1,SHENG Shu-wen2,LI Guang-wei3
(1.Department of Pharmacy,Anhui Medical College,Hefei230601,Anhui,China;2.Hefei Tianmai Biopharmaceutical Technology Co.,Ltd.,Hefei 230031,Anhui,China;3.Biology Engineering Test Base,University of Science and Technology of China,Hefei 230022,Anhui,China)
A high transglutaminase-producing strain was isolated through a protein cross-linked-flocculation precipitate method,which was identified primarily to be a species of Streptomyces sp.The single factor experiments showed that the optimal carbon and nitrogen sources were glucose and peptone.The optimum medium composition was glucose25.0 g/L,Peptone 20.0 g/L,Yeast extract 5.0 g/L,MgSO4·7H2O 2.0g/L,K2HPO4·3H2O 2.0 g/L,NaH2PO42.0 g/L,CaCO33.0g/L received by Orthogonal Experimental Design.Under this fermentation process,the enzyme activity was promoted to0.53U/mL.
proteincross-linked-flocculation precipitate method;transglutaminase;screening;fermentation conditions
10.3969/j.issn.1005-6521.2015.01.030
2014-06-29
安徽省教育厅自然科学研究重点项目(KJ2010A201);安徽省专业带头人培养资助项目(皖教秘人[2013]189号)
宋小平(1968—),女(汉),教授,硕士,从事生物制药的教学和研究工作。
