冠状化合物在锂同位素分离中的应用
2015-12-25束玉珍吴继宗邓惟勤
束玉珍,吴继宗,邓惟勤
中国原子能科学研究院 放射化学研究所,北京 102413
锂在自然界中存在两种稳定的同位素6Li和7Li,其丰度分别为7.53%和92.47%,这两种锂同位素具有不同的核性质,但在核能工业中都起着重要的作用。6Li通过中子轰击可产生氚,是实现核聚变反应必不可少的原料,据推测,若可控聚变堆得以实现,则每年消耗的6Li至少达5吨,当前的库存难以满足长期需求[1]。7Li中子吸收截面小,常用作反应堆中的冷却剂、传热介质和中子减速剂,高浓度的7LiOH还可以用来调节压水堆中冷却剂的pH值[2]。因此,锂同位素分离尤其是6Li的富集对新型核能的开发和利用具有重大的意义。
锂虽是金属元素中最轻的一个,且6Li和7Li间相对质量差较大,但分离却较困难,主要原因是:第一,锂有机化合物或络合物数目较少;第二,锂只有零价和正一价两个价态,利用变价来提高单级分离系数的适用性较小;第三,Li+具有很高的水合能,利用异相间水合数的差别来增加同位素效应较困难。锂同位素分离常见的方法有锂汞齐法、液液萃取法、离子交换色层法、分级结晶和分级沉淀法、分子蒸馏法、熔盐电解法、激光法、电磁法等。但目前应用于工业大规模生产的只有锂汞齐法,由于锂在水相和汞齐相具有不同的价态,因此该法具有较高的单级分离系数(α可达1.023~1.065[3]),此外该体系容易形成两相逆流交换,有利于工艺流程设计和级联;两相锂容量均较大,易实现工业化量产;交换速率快,半交换期只有几秒;容易分相和倒相。美国橡树岭Y-12车间在1950—1966年期间用Colex流程分离锂同位素时使用了大量汞,这些汞在生产过程中部分流失,处理也较草率,对周边环境和居民安全造成了巨大威胁,1983年Y-12车间周边的汞污染被公开报道,此后Colex建筑被逐渐拆除,由此造成的汞污染还在处理中[4-5]。由于汞齐法毒性大、耗能大,因此许多国家都在寻找一种绿色高效的分离方法替代汞齐法。
1967年Pedersen[6]首先报道了二苯并-18-冠-6等大环聚醚的合成,并且发现这类冠醚能与碱金属和碱土金属阳离子形成稳定的、能溶于某些有机溶剂的络合物,此后,具有相似结构和特性的冠醚陆续被合成,这些冠状化合物都含有重复的—Y—CH2—CH2—基本单元,其中Y—是供电子原子,如果是氧,则该大环化合物称为冠醚,如果环中的氧部分或全部被—NH或—NR取代,称为氮冠,被S取代称为硫冠。文献[7]首先合成了穴醚,这是一类由两个氮联结的具有三维结构的双环或三环化合物,它对金属离子具有较强的络合能力,甚至大于单环冠醚。部分冠醚和穴醚的分子结构示于图1。1979年,Jepson和Carins[8]首先利用穴醚[2,2,1]萃取分离锂同位素,获得了1.026~1.041的单级分离系数,冠状化合物突出的特性及较高的单级分离系数使其在锂同位素分离中得到了广泛地研究。本工作现将近40年来冠状化合物分离锂同位素的研究成果进行系统地归类和总结,以为该领域的进一步研究提供参考。
1 穴醚在锂同位素分离中的应用
1.1 液/液萃取法
目前用于锂同位素分离研究的穴醚主要为双环穴醚,它的基本结构是在两个氮原子之间以三个带有氧原子的桥相联,它的俗称以桥链上氧原子数来命名,如穴醚[2,2,1]其三个桥链上各有2、2、1个氧原子。此外,有的双环穴醚桥链的两个氧原子间带有边基,如带苯并的则在相应命名的数字下方标注缩写B。由于穴醚具有三维立体结构,且参与配位的氧氮原子均匀分布,因而能与金属离子形成较强的选择络合作用。
1979年Jepson和Carins[8]用穴醚[2,2,1]通过无价态变化的液液交换反应对锂同位素进行了萃取分离,锂盐在水相和含穴醚有机相中的交换平衡为:

该式的平衡常数K即为锂同位素交换平衡的单级分离系数α:
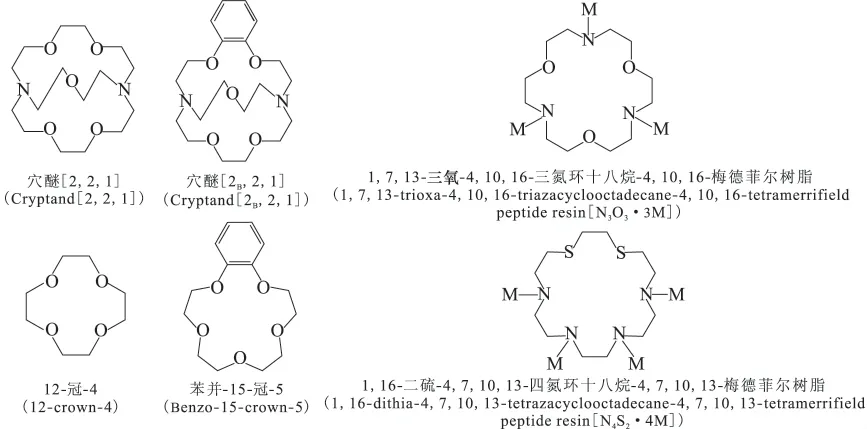
图1 穴醚和冠醚的分子结构Fig.1 Molecular structures of cryptand and crown ether
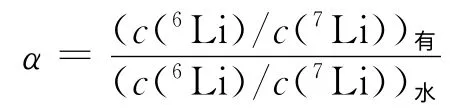
实验测得LiBr、LiTFA和LiTFA+HTFA在该体系中的单级分离系数α分别为1.026、1.035和1.041,6Li富集在有机相,该体系的同位素效应与锂汞齐体系的较为接近,成为有望取代汞齐法的新交换体系。此后支克正等[9]对Jepson的主要成果进行了验证,结果表明三氟乙酸锂/穴醚[2,2,1]/氯仿体系单级分离系数的平均值约为1.037,因而该体系的确具有显著的同位素效应,此外,他们还对不同穴醚的同位素效应进行了比较,发现空穴尺寸稍大于锂离子直径的穴醚[2,2,1]具有最大的同位素效应,与锂离子直径最为配合的穴醚[2,1,1]则次之,该发现为穴醚的选择提供了一定的参考。
1.2 固/液离子交换法
1983年,Fujine等[10]首次用穴醚[2B,2,1]树脂,通过置换色谱法对锂同位素分离进行了全回流操作,该体系中锂同位素在液相和固定相中的交换平衡为:

其中L代表穴状配体,R代表树脂。下角标liq、solid分别代表液相、固相。结果表明,6Li富集在吸附带后部而7Li富集在前部,40℃时的单级分离系数α为1.014。为了提高分离效果,必须改变冠醚树脂的性质,如减小树脂的粒径,增大树脂的交换容量。随后Nishizawa等[11]选用了粒径更小的穴醚[2B,2,1]树脂富集卤化锂甲醇溶液中的锂同位素,发现0℃下LiCl的α高达1.047±0.002,富集系数比通常的离子交换树脂高出了10倍,然而与液液萃取体系相比,该体系中不同锂盐阴离子对同位素效应的影响差别不大,二者的差异可能是由水和甲醇不同的溶剂化效应引起的,为了研究该体系真实的阴离子效应,他们又将LiCl、LiBr和LiI分别溶于不同甲醇-水比的混合液中,结果表明随着甲醇-水溶液中水含量的增加,分离系数逐渐减小,在100%甲醇溶液中,不同锂盐间分离系数相近,而在100%水中不同锂盐间分离系数有显著差异[12]。
不管是液液萃取法还是固液置换色谱法,穴醚对锂同位素都能获得很高的单级分离系数,但穴醚合成复杂,价格昂贵,水溶性较大,难以应用于工业生产,因此国内外对穴醚分离锂同位素的研究没再深入开展。
2 冠醚在锂同位素分离中的应用
冠醚是一种具有柔性醚键结构的多配位中性配体,与穴醚相比,某些冠醚不仅对锂具有较高的选择性,而且能溶于多种有机物,难溶于水,单环结构的冠醚合成也较容易,价格较便宜,这些特性让冠醚成为了锂同位素分离的研究热点。
2.1 液/液萃取法
1983年支克正等[13]首次对锂盐-冠醚两相交换体系的锂同位素效应进行了研究,发现15-冠-5及其衍生物具有较好的分离效果,且两相交换平衡时间小于10s,其中三氟乙酸锂/环己基-15-冠-5/硝基苯体系的α高达1.030±0.005,饱和的八甲基四氧Quaterene体系的α为1.016±0.002,开链冠醚体系的α为1.012左右;并进一步讨论了冠醚空穴大小、冠醚类型和边环及边环上取代基对锂同位素分离的影响。Nishizawa等[14]深入研究了不同锂盐/苯并-15-冠-5/氯仿体系的锂同位素效应,得出LiI具有较高的分配系数和单级分离系数(1.044±0.003),最适于液液萃取体系,研究还表明在高浓苯并-15-冠-5体系中锂离子与冠醚的络合比为1∶2,而低浓时为1∶1,通过热力学讨论得出冠醚体系较高的分离系数可能是由较高的焓变和熵变引起的,当有机相中冠醚浓度较大时锂-冠醚络合离子的水合作用将不再是影响分离效果的主要因素。盛怀禹等[15]也对锂盐/苯并-15-冠-5/氯仿体系中阴离子效应进行了研究,结果显示属于软碱的SCN-、Br-、I-的α值均显著高于硬碱Cl-、、CClCOO-、CF3COO-的值,因此选择软度较高的阴离子有利于提高锂同位素分离的α值。姜延林等[16]研究了8种冠醚液液交换体系的锂同位素效应,其中4甲基-苯并-15-冠5体系为首次发表且具有较高的单级分离系数;该研究发现空穴孔径与锂离子最为匹配的苯并-12-冠-4的α仅为1.014,而孔径略大的15-冠-5及其衍生物则获得了1.027~1.042的单级分离系数;该研究也证实两相化合物中的键强差愈大分离效果愈好,采用介电常数稍高的1,2-二氯乙烷作溶剂更有利于分离。而Nishizawa等[17]对5种冠醚液液萃取体系的研究显示,12-冠-4的单级分离系数高于苯并-15-冠-5,达1.057,从冠醚空穴角度来看,这与姜延林等[16]的结论有所背离,但该文中也指出苯并-15-冠-5体系同位素交换平衡的焓变较大,在合适的条件下可能会获得更高的分离系数。方胜强等[18]研究了锂盐/4-叔丁基苯并-15-冠-5/碘苯体系的锂同位素效应,结果显示该体系的α达1.035±0.003,锂同位素交换速率快,反萃较易,温度效应大,低温有利于同位素分离;此外,他们对4-甲基-苯并-15-冠-5和对甲苯氧基联苯桥联双苯并-15-冠-5液液体系的锂同位素效应进行了研究,结果表明4-甲基-苯并-15-冠-5与4-叔丁基苯并-15-冠-5具有相同的锂同位素分离能力,而对甲苯氧基联苯桥联双苯并-15-冠-5的分离能力小于单冠的苯并-15-冠-5[19-20]。他们还分析总结了冠醚萃取体系中影响锂同位素效应的各种因素,发现当温度和相比固定时,冠醚内部结构、冠醚侧基、冠醚浓度、有机溶剂、锂盐阴离子和锂盐浓度的改变都会影响体系的分离系数,并单独深入研究了盐浓效应和混合锂盐效应,确证α随LiBr浓度的增加而增大,选用混合锂盐可比选用单一锂盐获得更大的单级分离系数[21-23]。金建南等[24]用不同锂盐/开链冠醚PAIV/40%正辛醇-60%磺化煤油体系分离锂同位素,得出LiI的α最高,为1.033。
Davoudi等[25]开创性地将分散液液微萃取应用到锂同位素分离中,该H2O/C2Cl4/C3H6O体系以苯并-15-冠-5为萃取剂,四氯乙烯为溶剂,丙酮为分散剂,获得的α为1.082±0.0021,是迄今公开报道的液液萃取体系中最高的锂同位素分离系数,虽然该法分离量较小,主要是针对锂同位素分析的一种分离富集方法,但对大容量液液萃取体系的研究也有一定的借鉴意义。
2.2 固/液交换法
1991年Kim等[26]合成了4-氨基苯并-15-冠-5树脂,并将其填充到长25cm、直径0.9cm的色谱柱中,以含水5%(体积分数)的乙腈为淋洗液分离LiCl,得到的α达1.053±0.005,6Li富集在树脂相而7Li富集在液相,随后他们将4-氨基苯并-15-冠-5结合到Merrifield树脂上,以NH4Cl为淋洗剂得到的α为1.026,但6Li和7Li的富集方向发生了改变,重同位素7Li富集到了树脂相,这可能是由于淋洗剂溶剂化作用的差异引起的[27]。Ban等[28]合成了苯并-15-冠-5硅树脂,以含30%甲醇和70%12mol/L盐酸的混合液为淋洗剂,获得的α为1.012 7,6Li富集在树脂相,7Li富集在液相。Otake等[29]将苯并-15-冠-5结合到苯酚树脂上,并将该树脂填充到5根1m长的色谱柱中连续分离,同样以30%甲醇和70%12mol/L盐酸的混合液为淋洗液,锂同位素的单级分离系数达1.033,与Ban等[28]的研究相比增加柱的数量(长度)可显著提高其分离系数。Zhou等[30]最近发表的研究显示,将结合了离子液体和苯并-15-冠-5的介孔硅胶用于锂同位素分离,可得到较好的分离效果,单级分离系数达1.046±0.002,值得注意的是该体系的分配比D可达1.55,与液液分离体系相比高了3~5个数量级。X光晶体结构分析显示,锂盐与冠醚以[(Li0.5)2(B15)2(H2O)]+复合物的形式吸附到固体硅胶上。不过该固液分离体系的萃取平衡时间相对较长,材料特性还需进一步改进。
3 杂冠化合物在锂同位素分离中的应用
与穴醚和冠醚相比,杂冠化合物同样含有供电子原子,因此理论上与金属离子也能形成稳定的络合物,并可通过改变环的大小、供电原子的数量、取代基的类别等来改变其对金属离子的选择性。1995年Kim等[31]合成了杂氮冠醚DBPDA和RDBPDA,并与Merrifield树脂结合用以分离锂同位素,结果表明具有低供电子数和溶剂化作用的乙腈能增加螯合树脂对Li+的吸附,以乙腈为洗脱液得到的锂单级分离系数分别为1.034和1.035。1997年Kim等[32]又合成了[N3O3·3M]杂氮冠醚树脂(其中氧分布在环的1、7、13位,氮在4、10、16位),以NH4Cl为洗脱液,分离锂同位素获得的α高达1.068,6Li富集在树脂相,7Li富集在液相,而其同分异构体[N3O3·3M](其中氧分布在环的1、13、16位,氮在4、7、10位)的分离系数仅为1.018,且7Li富集在树脂相[33]。之后他们又合成了一系列杂环冠醚树脂并研究了其对锂同位素的分离效果,[N4O·4M]获得的单级分离系数α为1.001 27[34],NTOE的为1.024 2[35],[N3O2·3M]的为1.001 04[36],AB18C6的为1.009 5[37],这些分离系数均不高,且7Li富集在树脂相,而6Li富集在液相;具有相似结构的杂氮冠醚树脂[N4O2·4M]和硫氮杂冠螯合树脂[N4S2·4M]分离锂同位素的α分别为1.034和1.038[38-39]。
最近,Grote等[40]用3种含不同取代基的12-金属冠-3化合物萃取分离锂同位素,与通常液液萃取不同的是,他们先将金属冠状化合物溶入含锂盐的甲醇溶液,1h后蒸发浓缩,再用氯仿萃取锂盐络合物,根据不同的计算方法,金属冠状化合物([(CeMe6)-Ru(C5H3NO2)]3)得 到 的α为0.958±0.009或0.945±0.009,富集度约为5%,该化合物倾向于结合离子半径更小的7Li+,这可能是由于环上取代基六甲基苯的π-配体阻止了半径较大的6Li+进入结合位点,从而6Li+被排挤在了液相。
4 总结与展望
上述冠状化合物皆为中性络合物,它的外侧为有机基团,内侧为亲水的杂原子(O、N、S等),构成了一个外壁疏水内腔亲水的结构,因此能溶解在多种有机溶剂中,通过改变外侧基团、杂环空穴大小、杂原子类型等可改变其对锂同位素的选择性,因此该类冠状化合物对锂同位素分离具有较大的适应性,且无论在液液萃取体系还是液固交换体系,在合适的体系下均能够获得较理想的单级分离系数(α可达1.05左右,与汞齐法相当),同时还具有平衡时间短、反萃或洗脱容易等优点,是一类在锂同位素分离中具有较高研究和应用价值的化合物。其中苯并-15-冠-5水溶性小,易于获得,对锂选择性好,单级分离系数高,因此以它为基体的系列冠醚或树脂最有望应用于工业上锂同位素的分离。且在众多非汞体系的锂同位素分离方法中,冠醚-液液萃取体系从分离过程上来说最接近于成熟的锂汞齐法,两者均通过两相逆流接触进行同位素交换,均可以通过倒相实现连续操作,因此最有望成为替代汞齐法的工业分离方法。
然而,目前冠状化合物应用于锂同位素分离的研究还处在初级阶段,主要侧重于对体系单级分离系数的考察,这些体系应用于工业生产还存在许多技术问题,如体系的交换容量较小,远达不到工业生产需求;所采用的有机溶剂如氯仿、1,2-二氯乙烷等易燃易爆且有一定毒性,存在安全隐患;冠醚在水相中的溶解度使得分相过程不彻底;回流倒相不够简便,能耗大、成本高等。2003—2006年期间,中国原子能科学研究院杨恩波带领的团队针对前期研究过程中遇到的问题对已有的冠状化合物分离锂同位素交换体系进行了改进,提高了锂盐和冠醚的稳定性,并解决了交换体系上部回流和下部回流的关键技术。经过改进的交换体系,不仅具有较高的单级分离系数(α=1.037),而且两相中锂的分配比达0.40~0.45,有机相中锂浓度达0.5mol/L,在回流方法的研究中解决了易乳化体系的分相问题和冠醚-锂盐络合物易氧化的问题,使上、下回流锂盐转化率均达到99.9%,使冠状化合物分离锂同位素技术向工业化应用迈开了一大步。
在已有的技术研究基础上,锂同位素分离体系的改进还可以从以下几个方面来考虑。选用合适的冠醚一般都能达到生产所需的单级分离系数,因此单级分离系数并非工业生产上优先考虑的问题,实际生产中需要选择和优化条件,使体系获得较大的交换容量以达到高产的目的;此外,体系需具有较高的稳定性和安全性,而传统的有机溶剂很难满足要求,因此可考虑选用绿色新型且性能优良的稀释剂,如离子液体。此外,目前大环化合物分离锂同位素的理论研究也不够深入,没有形成完整的分离理论体系,一些现象没有得到充分的解释,如不同冠醚在相似条件下为何6Li和7Li的富集方向不同;不同锂盐阴离子、不同溶剂或淋洗剂如何改变分配系数和分离系数;不同条件下萃取和同位素交换机理如何改变等。因此,还需从理论和技术上对该类体系进行深入研究和不断完善,使其成为有望取代汞齐法的高效绿色环保体系。
[1]Symons E A.Lithium isotope separation:a review of possible techniques[J].Sep Sci Technol,1985,20(9-10):633-651.
[2]李廷伍.化学交换法分离锂同位素[J].原子能科学技术,1990,24(2):87-90.
[3]Palko A A,Drury J S,Begun G M.Lithium isotope separation factors of some two-phase equilibrium systems[J].J Chem Phys,1976,64(4):1828-1837.
[4]Lanning J M.Aqueous mercury treatment technology review for NPDES Outfall 49Y-12Plant,Y/DZ-1043[R].TN(USA):Oak Ridge Y-12Plant,1993.
[5]Sollenberger M L,Sparkman D E,Reynolds R.Building 9201-4at the Oak Ridge Y-12Site annual surveillance and maintenance report 1994,Y/WM-224[R].TN(USA):Oak Ridge Y-12Plant,1995.
[6]Pedersen C J.Cyclic polyethers and their complexes with metal salts[J].J Amer Chem Soc,1967,89(10):2495-2496.
[7]Dietrich B,Lehn J M,Sauvage J P.Les Cryptates[J].Tetrahedron Lett,1969,10(34):2889-2892.
[8]Jepson B E,Carins G A.Lithium isotope effects in chemical exchange with(2,2,1)cryptand,MLM-2622[R].OH(USA):USAEC,1979.
[9]支克正,窦富全,朱建华,等.冠醚分离锂同位素研究Ⅰ:锂盐-穴醚两相交换体系的锂同位素效应[J].原子能科学技术,1982,16(6):686-690.
[10]Fujine S,Saito K,Shiba K.Lithium isotope separation by displacement chromatography using cryptand resin[J].J Nucl Sci Technol,1983,20(5):439-440.
[11]Nishizawa K,Watanabe H,Ishino S,et al.Lithium isotope separation by cryptand(2B,2,1)polymer[J].J Nucl Sci Technol,1984,21(2):133-138.
[12]Nishizawa K,Watanabe H.Intrinsic isotope effect of cryptand(2B,2,1)to Li-6and Li-7[J].J Nucl Sci Technol,1986,23(9):843-845.
[13]支克正,窦富全,杨坤山,等.冠醚分离锂同位素研究Ⅱ:锂盐-冠醚两相交换体系的锂同位素效应[J].原子能科学技术,1983,17(3):347-339.
[14]Nishizawa K,Ishino S,Watanabe H,et al.Lithium isotope separation by liquid-liquid extraction using benzo-15-crown-5[J].J Nucl Sci Technol,1984,21(9):694-701.
[15]盛怀禹,李树森,陈耀焕,等.冠醚萃取分离锂同位素的阴离子效应[J].有机化学,1984(6):217-220.
[16]姜延林,张心祥,钱建华,等.锂盐-冠醚络合物化学交换体系中的同位素效应[J].原子能科学技术,1986,20(1):2-8.
[17]Nishizawa K,Takano T,Ikeda I,et al.Extractive separation of lithium isotopes by crown ethers[J].Sep Sci Technol,1988,23(4-5):333-345.
[18]方胜强,支克正,傅立安,等.4-叔丁基苯并-15冠-5液-液萃取法分离锂同位素[J].核化学与放射化学,1987,9(3):142-147.
[19]方胜强,傅立安.4-甲基苯并-15-冠-5分离锂同位素的能力[J].核化学与放射化学,1991,13(2):87-90.
[20]方胜强,傅立安,高志昌.对甲苯氧基联苯桥联双苯并-15-冠-5-分离锂同位素的能力[J].核化学与放射化 学,1992,14(2):111-113.
[21]傅立安,方胜强.多醚液-液萃取体系中各种因素对锂的热力学同位素效应的影响[J].核化学与放射化学,1989,11(3):142-148.
[22]方胜强,傅立安.多醚萃取体系中锂的同位素效应:盐浓效应[J].同位素,1991,4(3):166-173.
[23]方胜强,傅立安.冠醚萃取体系中锂的同位素效应:混合锂盐效应[J].同位素,1994,7(3):168-171.
[24]金建南,王全基,孟明礼,等.用开链冠醚PAIV溶剂萃取分离锂同位素[J].四川大学学报(自然科学版),1999,36(5):903-906.
[25]Davoudi M,Mallah M H.Enrichment of6Li using dispersive liquid-liquid microextraction as a highly efficient technique[J].Ann Nucl Energy,2013,62:499-503.
[26]Kim D W,Jeon Y S,Eom T Y,et al.Lithium isotope separation on a monobenzo-15-crown-5resin[J].J Radioanal Nucl Chem,1991,150(2):417-426.
[27]Kim D W,Kim H J,Jeon J S,et al.Separation of lithium isotopes by a aminobenzo-15-crown-5bonded merrifield resin[J].J Radioanal Nucl Chem,2000,245(3):571-574.
[28]Ban Y,Nomura M,Fujii Y.Chromatographic separation of lithium isotopes with silica based monobenzo-15-crown-5resin[J].J Nucl Sci Technol,2002,39(3):279-281.
[29]Otake K,Suzuki T,Kim H J,et al.Novel syntheses method of phenol type benzo-15-crown-5ether resin and its application for lithium isotope separation[J].J Nucl Sci Technol,2006,43(4):419-422.
[30]Zhou W,Sun X L,Gu L,et al.A green strategy for lithium isotopes separation by using mesoporous silica materials doped with ionic liquids and benzo-15-crown-5[J].J Radioanal Nucl Chem,2014,300(2):843-852.
[31]Kim D W,Jeon Y S,Jeong Y K,et al.Lithium isotope separation by chemical exchange with polymer-bound azacrown compounds[J].J Radioanal Nucl Chem,1995,189(2):219-227.
[32]Kim D W,Hong C P,Kim C S,et al.Lithium isotope separation on an ion exchange resin having azacrown ether as an anchor group[J].J Radioanal Nucl Chem,1997,220(2):229-231.
[33]Kim D W,Lee N S,Kim C S,et al.Syntheses and separating properties of triazacrown and AM18C6 bonded merrifield peptide resins[J].Eur Polym J,2002,38:2101-2108.
[34]Kim D W,Kim B K,Park S R,et al.Separation of lithium isotope by azacrown tetramerrifield peptide resin[J].J Radioanal Nucl Chem,1998,232(1-2):257-259.
[35]Kim D W,Park S R,Kim S J,et al.Separation of lithium isotope by NTOE compound[J].J Radioanal Nucl Chem,1998,229(1-2):165-168.
[36]Kim D W,Park H K.Kim C S,et al.Separation of lithium isotopes with the N3O2trimerrifield peptide resin[J].J Radioanal Nucl Chem,1999,242(3):769-772.
[37]Kim D W,Kang B M,Jeon B K,et al.Separation of lithium isotopes by elution chromatography with an AB18C6bonded merrifield peptide resin[J].J Radioanal Nucl Chem,2003,256(1):81-85.
[38]Kim D W,Jang Y H,Lee N S,et al.Separation of lithium isotopes by N4O2azacrown ion exchanger[J].J Radioanal Nucl Chem,1999,240(1):155-158.
[39]Kim D W,Kim C S,Jeon J S,et al.Separation of lithium isotopes by N4S2azacrown ion exchanger[J].J Radioanal Nucl Chem,1999,241(2):379-382.
[40]Grote Z,Wizemann H D,Scopelliti R,et al.Lithium isotope separation by 12-metallacrown-3complexes[J].Z Anorg Allg Chem,2007,633:858-864.
