含噁二唑大环冠醚的合成、结构及金属离子识别性能
2020-03-12杨福群甄小丽韩建荣刘守信
田 霞,杨福群,袁 伟,赵 雷,姚 雷,甄小丽,韩建荣,刘守信
(1. 河北科技大学理学院,2. 河北省药用分子化学重点实验室,石家庄 050018)

Scheme 1 Structures and synthsis routes of the target molecules
冠醚作为第一代超分子主体化合物,因其结构简单、易于衍生化且与多种阳离子具有选择性络合作用而备受关注. 含有生色基团或荧光基团的冠醚因具有有色及络合离子的双重性能而在超分子化学中具有重要研究价值. 生色基团和荧光基团不仅因冠醚络合离子后分子内电子云密度改变而发生颜色的变化,而且这种变化也因金属离子的不同而存在差异,因此,设计合成含有不同生色基团或荧光基团的冠醚用于金属离子的选择性键合一直是化学领域的研究热点之一. 1,3,4-噁二唑及其取代衍生物是一类重要的生物活性物质[1~5],而某些取代的噁二唑也是重要的光敏物质[6,7],可作为荧光剂、激光材料和闪烁剂,因此研究人员对该类化合物的合成进行了广泛而深入的研究. 2,5-二芳基-1,3,4-噁二唑[8~10]是广泛使用的一类电子传输材料,其结构中的噁二唑基团具有突出的三维亲电子性能,并且具有较高的荧光量子效率. 关于二苯联噁二唑大环化合物的合成及其结构研究已有较多报道[11~14],而对于含有不同氧原子的冠醚类化合物的离子识别能力的研究尚未见报道. 本文合成了含有不同数目氧原子数目的噁二唑大环冠醚: 2,3,11,12-二苯并-4,7,10,16-四氧-14,15-二氮杂双环[11.2.1]-十六烷-13,15-二烯(2)、2,3,14,15-二苯并-4,7,10,13,19-五氧-17,18-二氮杂双环[14.2.1]-十九烷-16,18-二烯(3)和2,3,17,18-二苯并-4,7,10,13,16,22-六氧-20,21-二氮杂双环[17.2.1]-二十二烷-19,21-二烯(4)(Scheme 1),对其晶体结构进行了表征,利用荧光光谱测定了冠醚2~4对不同金属离子的键合行为及选择性.
1 实验部分
1.1 试剂与仪器
氢氧化钾和无水硫酸镁购于天津大茂化学试剂厂; 正丁醇、邻苯二酚、二乙二醇、二缩三乙二醇、水杨酸、乙二醇单甲醚、乙酸乙酯、石油醚、二氯甲烷、甲醇、盐酸、高氯酸盐、N,N-二甲基甲酰胺(DMF)和碳酸钾(K2CO3)购于国药集团化学试剂有限公司; 五氧化二磷购于天津永大化学试剂有限公司; 磷酸和二氯亚砜购于麦克林生化科技有限公司; 三缩四乙二醇购于阿拉丁试剂有限公司. 所用试剂均为分析纯.
Bruker Avance Ⅱ 500 MHz核磁共振波谱(NMR)仪,瑞士Bruker公司; X-4型数字显微熔点测定仪,科瑞仪器有限公司; Hitachi F-7000型荧光光谱仪,天美科学仪器有限公司; 单晶X射线衍射分析使用标准的Siemens Smart CCD面探系统收集X衍射线强度数据,利用MoKα射线(λ=0.07173 nm)和石墨单色器,在2.0 kW(50 kV,40 mA),T=293(2) K条件下操作,晶体结构以直接法解出,采用全矩阵最小二乘法对F2进行修正; Bruker VPEⅫ型高分辨质谱(ESI)仪,德国Bruker公司. 采用SHELXTL(Siemens,Version 5.04)软件包进行结构计算.
1.2 实验过程
1.2.1 2,5-二(2-羟苯基)-1,3,4-噁二唑的合成 参照文献[14]方法制备2,5-二(2-羟苯基)-1,3,4-噁二唑.
1.2.2 2,5-二[2-(2-甲氧乙氧基)苯基] -1,3,4-噁二唑(1)的合成 参照文献[15]方法制备了开链冠醚1.
1.2.3 冠醚(2)和冠醚(3)的合成 向250 mL四口瓶中加入1.52 g(6 mmol)2,5-二(2-羟苯基)-1,3,4-噁二唑和80 mL DMF,再加入2.4 g K2CO3(18 mmol),加热至140 ℃,电磁搅拌反应0.5 h; 然后,将含7 mmol一缩二乙二醇二对甲苯磺酸酯(或二缩三乙二醇二对甲苯磺酸酯)的40 mL DMF溶液分2次加入反应瓶中,于140 ℃反应48 h,减压蒸馏除去DMF,加入20 mL 10%盐酸酸化,用120 mL乙酸乙酯萃取、过滤; 用蒸馏水洗涤滤液,分离出有机相,水相再用乙酸乙酯萃取5~6次(每次10 mL),收集有机相,用无水硫酸镁干燥,过滤,旋转蒸发除去溶剂,经分离提纯得到冠醚2或3.
以一缩二乙二醇二对甲苯磺酸酯为原料合成了冠醚2. 采用100~200目硅胶色谱柱,以乙酸乙酯/石油醚混合溶液(体积比4∶1)为展开剂进行洗脱,得到1.8 g冠醚2,产率为55.6%,熔点178~180 ℃.1H NMR(500 MHz,CDCl3),δ: 8.10(d,2H,J=1.5 Hz,J=6.0 Hz,Ar—H),7.46(m,2H,Ar—H),7.01(m,4H,Ar—H),4.27(m,4H,2ArOCH2—),3.97(m,4H,2OCH2CH2O—).13C NMR(125 MHz,CHCl3),δ: 70.45(2),72.31(2),113.21(2),114.85(2),121.23(2),131.80(2),132.98(2),157.10(2),164.72(2). HRESI-MS,m/z: 计算值[M+1]+325.1188,实测值[M+H]+325.1190.
以二缩三乙二醇二对甲苯磺酸酯为原料合成了冠醚3. 采用100~200目硅胶色谱柱,以乙酸乙酯/石油醚/醋酸混合溶液(体积比600∶400∶1)为展开剂进行洗脱,得到1.5 g冠醚3,产率为40.7%,熔点125~128 ℃.1H NMR(500 MHz,CDCl3),δ: 7.92(dd,2H,J=1.5 Hz,J=6.0 Hz,Ar—H),7.49(m,2H,Ar—H),7.07(m,4H,Ar-H),4.27(m,4H,2ArOCH2—),3.89(m,4H,2OCH2CH2O—),3.62(s,4H,2OCH2CH2O—).13C NMR(125 MHz,CHCl3),δ: 69.39(2),69.68(2),70.97(2),113.48(2),114.79(2),121.16(2),131.71(2),132.92(2),157.30(2),164.67(2). HRESI-MS,m/z: 计算值[M+1]+369.1450,实测值[M+H]+369.1447.
1.2.4 冠醚4的合成 将1.09 g(8 mmol)2,5-二(2-羟苯基)-1,3,4-噁二唑溶于100 mL正丁醇中,加入含4.0 g(0.1 moL)NaOH的正丁醇溶液(25 mL),于80 ℃反应0.5 h,此时反应物为白色乳状液体; 加入2.24 g(6 mmol)二氯代三缩四乙二醇和120 mL正丁醇,回流反应72 h; 反应结束后趁热过滤,将滤液蒸干,加入10 mL 3%盐酸,用120 mL乙酸乙酯萃取,合并有机层,用水洗涤至呈中性,用无水硫酸镁干燥,抽滤,减压蒸馏除去溶剂; 采用100~200目硅胶色谱柱,以DCM/甲醇混合溶液(体积比100∶1)作为展开剂进行洗脱,得到冠醚4,熔点124~126 ℃.1H NMR(500 MHz,CDCl3),δ: 7.88(dd,2H,J=1.5 Hz,J=6.0 Hz,Ar—H),7.48(m,2H,Ar—H),7.08(m,4H,Ar—H),4.28(t,4H,J=4.0 Hz,2ArOCH2—),3.89(t,4H,J=4.0 Hz ,2OCH2CH2O—),3.65(t,J=5.0 Hz ,4H,2Ar-OCH2CH2OCH2—),3.51(t,4H,J=5.0 Hz,2Ar-OCH2CH2OCH2CH2—).13C NMR(125 MHz,CHCl3),δ: 69.64(2),69.68(2),70.38(2),71.64(2),113.70(2),114.36(2),121.01(2),130.67(2),132.77(2),157.60(2),163.11(2). HRESI-MS,m/z: 计算值[M+1]+413.1713,实测值[M+H]+413.1709.
1.3 单晶的制备
将开链冠醚1和冠醚2~4分别溶解于适量的乙酸乙酯中配成饱和溶液,过滤除去不溶物,于室温下缓慢挥发溶剂,得到各化合物单晶.
1.4 荧光光谱滴定实验
为了定量研究开链冠醚1和冠醚2~4与不同金属离子的键合能力,采用荧光光谱滴定法测定了主-客体间的键合行为[16]. 利用Lineweaver-Burk方程和双对数回归方程进行直线拟合得到冠醚与各种金属离子的键合常数[17].
2 结果与讨论
2.1 化合物的合成
在合成冠醚2~4时,为了提高环合产率,通过模板效应加入不同的碱时所得产物的收率不同. 采用半径较小的Na+和K+离子(Na2CO3和K2CO3)作碱的阳离子时,所得冠醚2~4的收率高,而用阳离子半径较大的Cs2CO3作碱时,所得冠醚2~4的产率降低. 这可能是由于较小的离子半径与环的大小匹配有利于关环,因此得到高收率的产物.
2.2 晶体结构
表1列出了开链冠醚1和冠醚2~4的晶体结构数据. 由表1可知,开链冠醚1和冠醚3属于单斜晶系,而冠醚2和冠醚4属于正交晶系. 由图1所示晶体结构可见,开链冠醚1和冠醚2~4中2个芳环与噁二唑环之间的二面角不同,并且噁二唑环中2个N原子的位置也不同. 在内径较大的冠醚4中,成环后2个N原子位于大环冠醚内,O原子位于环外,而内径较小的冠醚2和冠醚3中2个N原子位于环的外侧而O原子位于环内,这有利于缓解环张力,从而增加化合物的稳定性.

Table 1 Crystal data and structure refinement for crown ethers 1—4
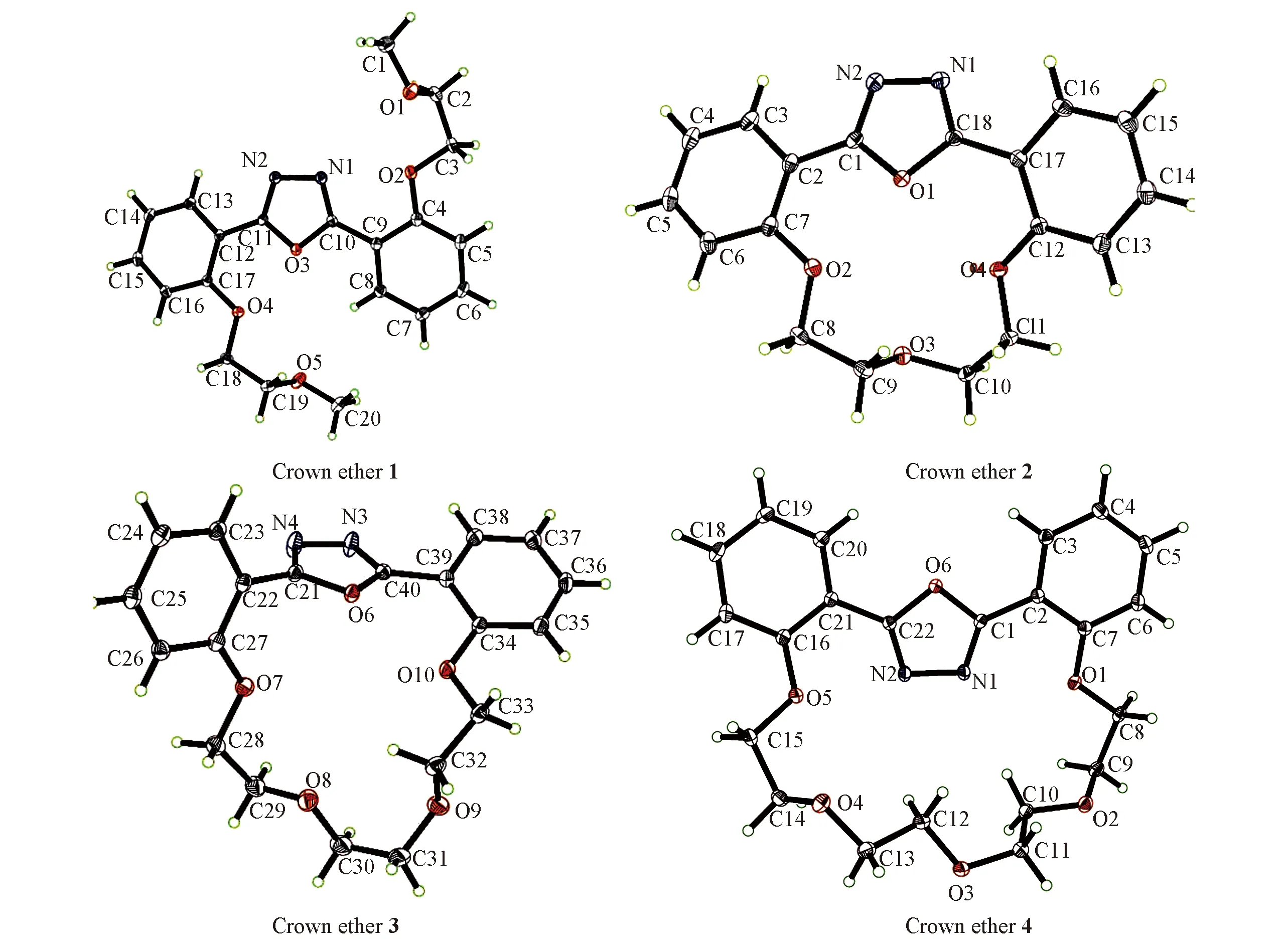
Fig.1 Molecular structures of crown ethers 1—4
对于同一晶系的冠醚2和4,噁二唑环与其中一个苯环(C2—C7)几乎在同一平面,而与另一个苯环的二面角分别为25.9°和20.2°; 而开链冠醚1和冠醚3中,噁二唑环与2个苯环均不在同一平面. 对于开链冠醚1,2个侧链位于噁二唑环的两侧,可能是为了降低两侧链间的相互作用; 对于冠醚2~4,分子中O原子的数目不同,环的空腔大小也不同,冠醚2环的平均空腔直径为0.38 nm,冠醚3环的平均空腔直径为0.4703 nm,冠醚4环的平均空腔直径为0.547 nm.
在4个化合物的堆积图(图2)中,都存在C—H…O或C—H…N的非经典分子间氢键(表2)和π-π相互作用,这些氢键和π-π相互作用将分子连接成三维空间结构.
2.3 键合能力和选择性
由于2,5-二-(2-羟苯基)-1,3,4-噁二唑中的2个苯环与噁二唑形成共轭体系且具有较强的刚性结构,因此具有较强的荧光发射峰,而以其为底物合成的含有该结构的冠醚2~4也表现出同样的性质. 为了比较环状结构与开链结构对金属离子键合的差异,合成了开链冠醚1作为对比. 由于冠醚与金属离子具有较好的键合能力,当主体与金属离子作用时其相对荧光强度也会发生变化. 利用这种光谱变化来测定了开链冠醚1和冠醚2~4与金属离子的键合常数(见表3).
实验中发现,不同主体加入同一离子或同一主体加入不同金属离子的荧光强度变化不同. 向开链冠醚1(1×10-6mol/L)的乙腈溶液中加入碱金属离子Li+,Na+,K+和Rb+时,其荧光强度随着金属离子的浓度增加而增强. 其中,加入Na+离子时,开链冠醚1的荧光强度变化较大; 加入其它3种金属离子时,虽然荧光也增强,但变化幅度很小,以至于无法计算其键合常数. 在与Na+键合时,1/(F-F0)与1/[G]呈现良好的线性关系[图3(A)插图],表明开链冠醚1与Na+作用的摩尔比为1∶1. 向开链冠醚1中加入不同的碱土金属离子时,其荧光强度发生不同的变化. 加入Mg2+和Ca2+离子时,开链冠醚1的荧光强度随着离子浓度的增强而降低; 且加入Ca2+时,荧光强度急剧下降,当Ca2+的浓度增大到开链冠醚1的3.5倍时[图3(B)],荧光完全猝灭,继续滴加Ca2+荧光强度不再发生变化. 因此,开链冠醚1对Ca2+具有良好的识别能力; 对于该滴定曲线,无法通过Lineweaver-Burk方程进行双倒数法拟合,而通过双对数拟合可证明开链冠醚1与Ca2+作用的摩尔比为1∶2,其键合常数lgKs=14.69.
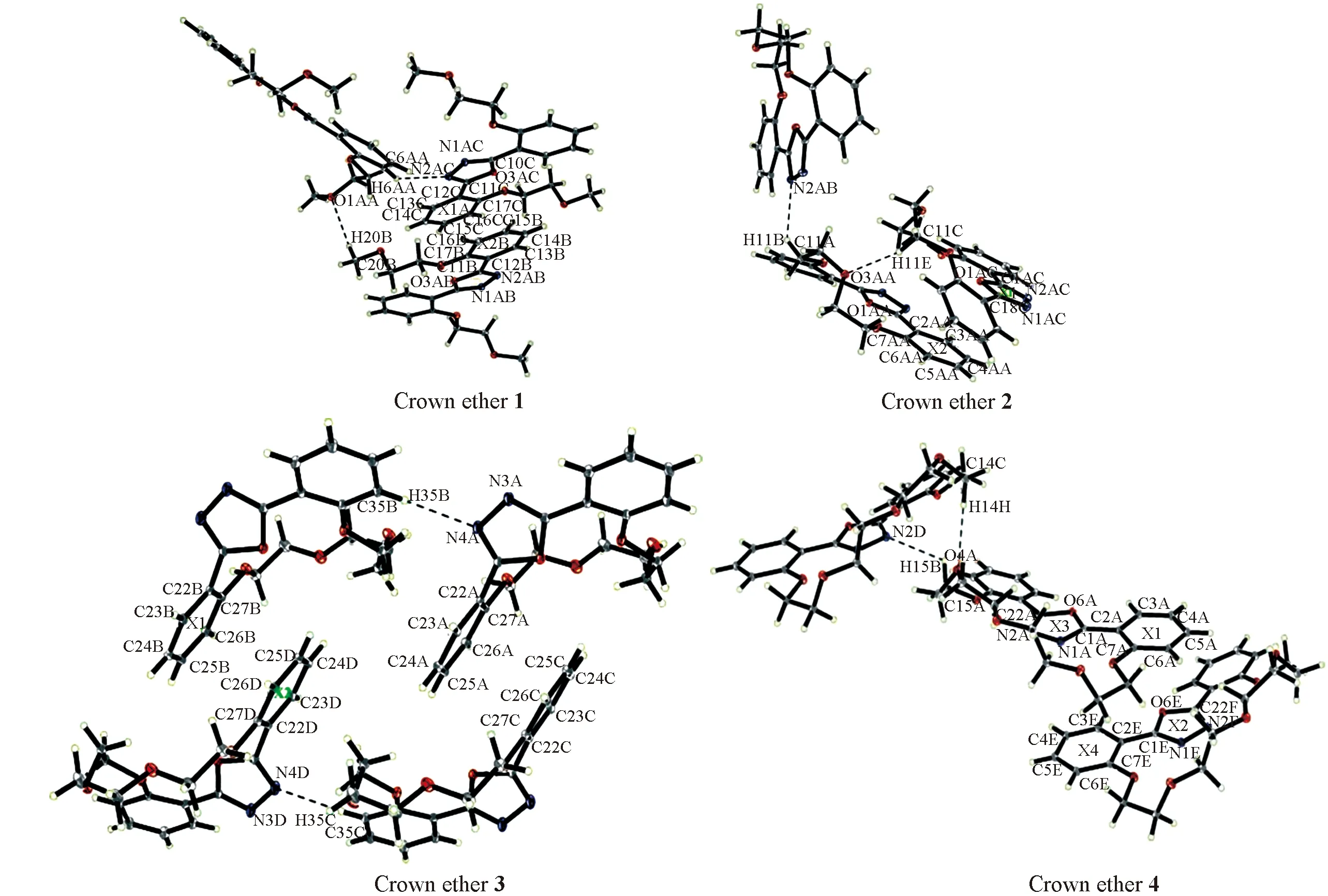
Fig.2 Packing diagram of crown ethers 1—4
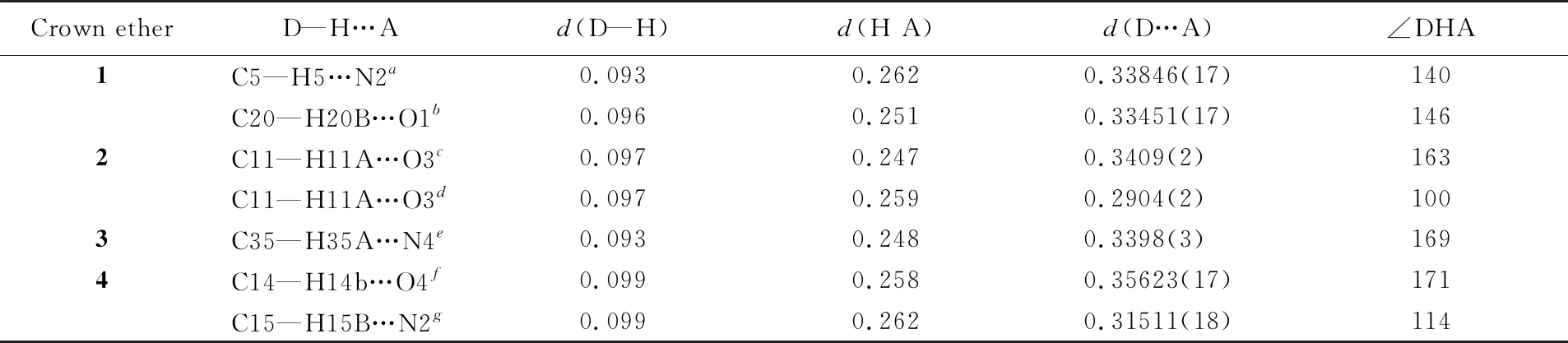
Table 2 Hydrogen bond lengths(nm) and bond angles(°) of crown ethers 1—4*
* Symmetry codes:a. -1+x,0.5-y,-0.5+z;b. 1-x,0.5+y,0.5-z;c. 0.5+x,1.5-y,z;d. -x,1-y,0.5+z;e.x,-1+y,z;f. -0.5-x,-0.5+y,z;g. 0.5-x,1.5+y,z.

Table 3 Complex stability constant(Ks) of crown ethers 1—4 with alkali metal andalkaline earth metal ions in CH3CN at room temperaturesa
a. Prepared solutions were determined after 20 min;b. fluorescence changes were too small to measure.

Fig.3 Fluorescence spectra of crown ether 1(1.0×10-6 mol/L) in the presence of differeat concentrations of sodium perchlorate(A) and calcium perchlorate(B) in CH3CN(A) 106c(sodium perchlorate)/(mol·L-1),a—u: 0,0.1,0.4,0.5,0.6,0.7,0.8,0.9,1.0,1.5,2.0,2.5,3.0,4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5. Inset: the linear fit plot of the 1/(F-F0) as a function of 1/[G] to calculate the complex stability constants. (B) 106c(calcium perchlorate)/(mol·L-1),a—k: 0,0.2,0.3,0.4,0.5,0.6,1.1,1.6,2.1,2.6,5.6. Inset: the linear fit plot of lg[(F0-F)/F] as a function of lg[G] to calculate the complex stability constants. λex=300 nm.
固定冠醚2的浓度为1×10-6mol/L,其荧光强度随不同金属离子的加入而增强,且随金属离子浓度的增大荧光强度也增强. 对于所有的离子来说,荧光强度增强的幅度均很小[图4(A)和(B)]. 加入金属离子Li+,Rb+和Mg2+后,冠醚2的荧光强度变化非常小,以至于不能通过直线拟合的方法得到键合常数. 冠醚2对金属离子K+表现出最好的键合能力,但相对于其它冠醚来说冠醚2对Na+/K+的选择性较差.

Fig.4 Fluorescence spectra of crown ether 2(1.0×10-6 mol/L) in the presence of different concentrations of sodium perchlorate(A) and calcium perchlorate(B ) in CH3CN(A) 106c(sodium perchlorate)/(mol·L-1),a—m: 0,0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0,4.5,5.0,5.5,6.0; (B) 106c(calcium perchlorate)/(mol·L-1),a—p: 0,1.5,2.0,2.5,3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5,8.0,9.0. Insets: the linear fit plot of the 1/(F-F0) as a function of 1/[G] to calculate the complex stability constants. λex=300 nm.
向冠醚3中加入不同的金属离子时,随着金属离子浓度的增加其荧光强度均增强[图5(A)]. 与冠醚2相比,随着环的空腔增大,除了K+和Mg2+以外,冠醚3对其它离子均表现出较好的键合能力. 由表3可见,冠醚3对Rb+表现出最强的键合能力,这可能是增大的环空腔与半径较大的Rb+的尺寸匹配,从而键合能力相应增强.

Fig.5 Fluorescence spectra of crown ether 3(1.0×10-6 mol/L) in the presence of different concentrations of sodium perchlorate in CH3CN(A) and fluorescence spectra of crown ether 4(5.0×10-7 mol/L) in the presence of different concentrations of magnesium perchlorate in CH3CN(B)(A) 106c(sodium perchlorate)/(mol·L-1),a—p: 0,1,2,3,4,5,6,7,8,9,10,20,30,40,50,60. (B) 103c(magnesium perchlorate)/(mol·L-1),a—j: 0,2.0,3.0,4.0,5.0,6.0,6.5,7.0,8.0. Inset: the linear fit plot of the 1/(F-F0) as a function of 1/[G] to calculate the complex stability constants. λex=300 nm.
与小环的冠醚2和3不同,当向冠醚4中加入碱金属离子时其荧光强度增加[图5(B)]; 而加入碱土金属离子时则与开链冠醚1相似,随着离子浓度的增加冠醚4的荧光强度降低. 从其结构看,具有较大环空腔的冠醚4与开链冠醚1类似,分子内的张力小,灵活性强,因此更有利于与碱土金属离子键合. 另外,由冠醚4的晶体结构可见,噁二唑环中的2个N原子在大环冠醚的内侧,更有利于与相对较软的碱土金属键合. 与开链冠醚1不同的是,开链冠醚1与Ca2+离子键合时,不能通过Lineweaver-Burk方程进行双倒数法拟合,说明开链冠醚1与Ca2+离子不是形成摩尔比1∶1的络合物. 通过双对数方程进行拟合可知,其与Ca2+形成了摩尔比1∶2的键合物,这可能是2个侧臂与噁二唑中的氧和氮分别络合1个Ca2+离子所致. 而冠醚4与Ca2+键合时,可以通过Lineweaver-Burk方程进行线性拟合,环中的氮和氧与Ca2+键合形成摩尔比1∶1的络合物. 开链冠醚1和冠醚4与碱土金属键合使荧光强度降低,可能是与碱土金属离子键合时噁二唑环中的N参与了配位,从而降低了噁二唑环中的电子云密度,使噁二唑环的荧光发射峰的强度降低.
从表3可以看出,开链冠醚1对碱金属Li+/Na+,Na+/K+具有较好的离子选择性,且对碱土金属Ca2+离子具有良好的识别性能. 冠醚2对Na+,K+和Ca2+离子表现出良好的键合性能,对碱金属K+表现出最佳的键合能力,对Na+/K+的选择性较差. 这可能与环的大小、环中N原子的位置及环中芳环的共轭程度有关. 冠醚4对Li+表现出最佳的键合能力,对Li+/Na+的选择性较差,但对碱土金属离子均表现出荧光猝灭,且具有优良的Mg2+/Ca2+的离子选择性. 这可能是由于在冠醚4中虽然具有较大的环空腔,但噁二唑中的2个N原子在空腔内,而N与较硬的碱金属配位能力很差,推测在与碱金属离子配位时环中的2个N原子不发生配位,从而其与较小的Li+和Na+离子具有较强的键合能力,而与较大的K+和Rb+键合能力很弱. 当加入碱土金属离子时,2个N原子参与了配位,从而使其荧光强度降低,且由于Ca2+离子相对较软,与N原子的键合相对增强,从而表现出对Mg2+/Ca2+较好的离子选择性.
3 结 论
含有2,5-二芳基-1,3,4-噁二唑的开链冠醚1及环状冠醚2~4均表现出强的荧光发射性能. 晶体结构分析表明,由于环的大小不同及空间位阻的不同,4个化合物结构上存在较大的差异,因此在加入不同的碱金属或碱土金属离子时表现出不同的荧光光谱变化. 开链冠醚1和冠醚4在加入碱土金属Mg2+和Ca2+离子时荧光发生猝灭,而加入碱金属离子时荧光增强,且开链冠醚1和冠醚4对Ca2+均具有良好的键合能力和选择性; 冠醚2和3在加入所有测定的离子时荧光强度均增强,而冠醚2对Na+和K+表现出好的键合能力,但其Na+/K+的选择性较差. 本文结果表明,冠醚环内径的不同以及结构上的差异对离子的键合能力和选择性具有较大的影响,对于设计合成具有高选择性和键合能力的化合物具有指导意义.
