钚沉淀母液中残留草酸根的分析
2015-12-25付建丽邓惟勤谈树苹吴继宗赵立飞
付建丽,邓惟勤,谈树苹,吴继宗,赵立飞
中国原子能科学研究院 放射化学研究所,北京 102413
在Purex流程中,钚产品液通常采用草酸作为钚的沉淀剂,经草酸沉淀后的母液中仍含有微量钚,需要返回钚线萃取流程进一步回收。但母液中存在的草酸对钚的回收率以及钚线的铀、钚分离效率影响很大,需尽可能地将草酸除去。工艺中采用高锰酸钾破坏草酸,要求破坏后母液中草酸浓度低于10mg/L。因此,需要建立一种微量草酸的测量方法,监测草酸破坏效果。
草酸的浓度可通过对草酸根的测定来定量。目前,草酸根的测定方法主要有滴定法[1]、分光光度法[2-4]、比色法[5-6]、酶法[7-8]、色谱法[9-11]等。滴定法作为一种经典方法仍在广泛使用,目前中试厂采用的是高锰酸钾滴定法,但此方法灵敏度低,测量下限远远不能达到要求。分光光度法利用草酸根对某些反应的催化作用或褪色作用来检测草酸含量,灵敏度较高,但测量时间长且干扰因素较多。酶法检测草酸根是一种新型的方法,灵敏度较高,但草酸氧化酶造价高,制备方法有待改进。离子色谱法测定草酸根是一种较为普遍的方法,具有灵敏度高、准确性好、简单快速等特点。高蕙文等[12]用离子色谱对龙虾中草酸含量进行了分析,指出草酸浓度在0.05~0.8mg/L范围内呈线性,方法的最低检出浓度为0.01mg/L。施超欧等[13]采用Dionex IonPac AS11-HC阴离子分析柱,18mmol/L NaOH作为淋洗液,离子色谱法测定了甘草提取物中草酸的含量,对草酸根的检出限为0.012mg/L。沈敏等[14]采用壳聚糖预分离富集-离子色谱法对痕量草酸根进行了测定,草酸根的检出限为4.3μg/L,0.05mg/L草酸根6次平行测定的相对标准偏差为7%。
国内对草酸根的分析技术已经较为成熟,但由于草酸钚沉淀母液含有浓度约为3mol/L的硝酸,以及Mn2+、Na+、Pu(Ⅳ)、K+、等金属离子,组成复杂,仍然没有可行的分析方法。采用离子色谱分析草酸根含量时,硝酸浓度过高会引起分离柱过载,影响草酸根正常出峰。由于离子色谱法测定草酸多采用碱性体系,溶液中存在的Mn2+等生成部分沉淀,造成柱效降低。本工作采用氮吹-蒸发的方法去除硝酸的干扰,稀释-过H柱的方法对体系中的干扰金属离子进行分离,以建立草酸钚沉淀母液中微量草酸根含量的分析方法。
1 实验部分
1.1 仪器与试剂
DIONEX-ICS-5000型离子色谱仪,美国Thermo公司;IRIS Advantage ICP-AES,美国热电公司;1mL和2.5mL H型强酸性阳离子交换柱,天津博纳艾杰尔科技公司;Talboys电热磁力搅拌器,上海安谱科学仪器有限公司;硝酸、碳酸钠、碳酸氢钠、盐酸,均为分析纯,北京化工厂;草酸:质量分数为99.9%~100.1%,上海同纳环保科技有限公司。钠、钾、锰标准溶液,钢研纳克检测技术有限公司;铀、钍标准溶液,核工业北京地质研究院;4.5g/L草酸标准储备液,由草酸基准物质配制。实验中所用到的草酸溶液均由标准储备液配制;实验用水为超纯水。
1.2 色谱条件
分析柱:美国Dionex公司IonPac AS11-HC阴离子交换柱(250mm×φ4mm)及IonPac AG11-HC保护柱(50mm×φ4mm);淋洗液发生器,美国Thermo Scientific公司;流速为1.5mL/min;抑制电导检测器检测;抑制电流:112mA;自循环模式;25μL定量管,实验数据的采集处理和系统操作均用Peaknet7.0色谱工作站控制。
1.3 实验方法
H柱处理:15mL 1mol/L HCl以2mL/min的流速过H柱,将柱中杂质离子洗掉。然后用30mL去离子水清洗柱子,放置平衡10min待用。
取0.5mL模拟样品,用水稀释至5mL,加入一定量羟基脲溶液,还原体系中的高锰酸钾。然后将样品以2mL/min的流速过处理好的H柱,用5mL去离子水洗H柱,将溶液收集于烧杯中,55℃加热-5L/min氮气吹扫至溶液蒸干。用去离子水多次洗涤烧杯,将收集的溶液定容于10mL容量瓶中,离子色谱测定。
2 结果与讨论
2.1 离子色谱法测定草酸根
2.1.1 分离柱的选择 研究了AS11-HC、AS14、AS15及AS23几种阴离子色谱分离柱对草酸根的分离能力。由于AS11-HC分离柱柱容量大,以KOH作为淋洗液,较/为淋洗液的体系背景电导低、灵敏度更高。因此本工作选择IonPac AS11-HC柱作为草酸根的分离柱。
2.1.2 标准曲线及检出限 以IonPac AS11-HC作为分离柱,30mmol/L KOH为淋洗液,对0.01~50mg/L进行标准曲线绘制,结果示于图1。草酸根标准曲线的线性方程为y=0.183x+0.149 6,r2=0.996,表明在选择的分离柱和淋洗液条件下,草酸根在0.01~50mg/L范围内具有良好的线性。依据检出限公式:
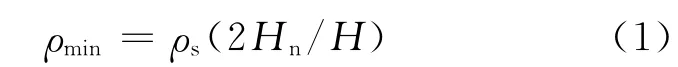
式中:ρmin为最小检出质量浓度;ρs为检测离子质量浓度;Hn为基线噪声(不小于30min基线);H为检测离子峰高。待仪器稳定后,在30mmol/L KOH淋洗液条件下,测定30min离子色谱的基线噪声,然 后 测 定0.5mg/L,将0.5mg/L的峰高及离子色谱30min的基线噪声代入公式(1)计算得出草酸根的检出限为5.3μg/L。

图1 草酸根的标准曲线Fig.1 Standard curve of
2.1.3 柱温的影响 实验考察了AS11-HC色谱柱柱温变化对草酸根和硝酸根分离度的影响,结果列于表1。如表1所示,当柱温25℃时,草酸根保留时间提前到4.6min,而硝酸根的保留时间不变,为了提高草酸根和硝酸根的分离度,实验选择柱温25℃作为测定草酸根的条件。
2.2 体系中硝酸的影响
2.2.1 硝酸的影响 草酸钚沉淀母液中含有较高浓度的硝酸(约3.0mol/L),采用AS11-HC分离柱、30mmol/L KOH淋洗液对硝酸的影响进行了研究,结果示于图2。如图2(a)所示,硝酸浓度为0.03mol/L时,硝酸根掩盖了草酸根的峰。当硝酸浓度降至0.003mol/L之后,可与草酸根完全分开(图2(b))。草酸钚沉淀母液中硝酸浓度约为3mol/L,若稀释1 000倍,草酸根质量浓度低至10μg/L,接近检测下限,使测定结果不准确。因此,在分析样品中草酸根含量之前,在保证离子色谱法准确测定草酸根浓度的情况下,必须选择简单、有效的方法去除体系中的硝酸。
表1 柱温对和保留时间的影响Table 1 Retention time ofandunder different column temperature

表1 柱温对和保留时间的影响Table 1 Retention time ofandunder different column temperature
阴离子(Anions)保留时间(Retention time)/min 30℃ 25℃C2O2-4 5.0 4.6 NO-3 5.6 5.6
2.2.2 硝酸去除方法研究 硝酸是一种低沸点酸(沸点83℃),易挥发,而草酸常温下是固状结晶或白色粉末,在100℃以上逐渐升华,在100℃以下稳定存在。依据两者物理性质的差异,可以采取低温蒸发的方式,使溶液中的硝酸挥发而保留草酸,消除硝酸的干扰。蒸发过程既要去除硝酸的干扰,又要保证草酸根稳定而较高的回收率,还要尽量缩短加热的时间,保证整个分析过程快速高效。经研究,当溶液中仅存在硝酸和草酸、溶液温度保持在65℃以内时,草酸根回收率在85%以上。而当温度超过70℃时,回收率小于80%,原因可能是在较高温度下草酸与具有氧化性的硝酸反应而损失。加热蒸发耗时过长,为了缩短时间,在加热溶液时,引入氮气对溶液上表面进行吹扫,加速硝酸的蒸发。氮气流量控制在5L/min,引入氮气吹扫后,10mL样品蒸发时间与单独蒸发过程耗时对比结果列于表2。由表2结果可知,引入氮气对样品进行吹扫后,样品蒸发时间显著缩短。采用蒸发-5L/min氮气吹扫,对3mol/L HNO3体系中草酸根进行处理后,C2O2-4色谱图示于图3。图3结果表明,硝酸根浓度明显降低,对草酸根的测定无干扰。

图2 HNO3介质中色谱图Fig.2 Chromatogram of in HNO3medium

表2 蒸发与氮吹-蒸发过程样品耗时对比Table 2 Time consumed for evaporation and evaporation-nitrogen purge

图3 氮吹-蒸发后色谱图Fig.3 Chromatogram ofby means of evaporation-nitrogen purge
2.3 其它干扰因素
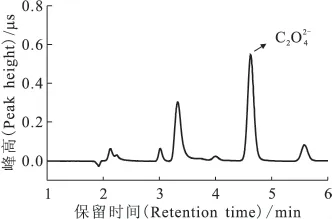
图4 含羟基脲的溶液经加热后的色谱图Fig.4 Chromatogram of in the presence of hydroxyurea after evaporation-nitrogen purge
2.3.2 金属离子的影响及去除 实验中发现,Mn2+会催化硝酸和草酸之间反应,草酸作为还原剂被消耗。因此,在蒸发除硝酸之前,必须将Mn2+除去。草酸钚沉淀母液中除含Mn2+之外,还含有较大量的Na+及微量的K+、Pu(Ⅳ)、U(Ⅵ)等阳离子,在加热-氮吹除硝酸过程中,会与硝酸根结合形成盐而使大量的硝酸根留在溶液中难以去除,影响草酸根的分析测定。因此,必须尽可能地去除体系中的阳离子。离子交换树脂在化学分析中可用于物质的分离和纯化。本工作选用IC-H型阳离子交换柱去除阳离子。IC-H柱去除体系中的阳离子有明显的优势。首先,草酸钚沉淀母液中的阳离子在IC-H柱的选择系数均大于H+,IC-H柱负载H+,无须转换体系可直接将体系中的阳离子吸附在柱子上。其次,置换出的H+进入溶液中,在加热蒸发过程中可直接去除。IC-H柱属于磺酸基强酸性阳离子交换树脂,磺酸基强酸性阳离子交换树脂是以磺酸基(—SO3)作为功能基,酸性较强,在酸性介质中显示了较强的交换能力。文献[15]指出,酸度对树脂吸附金属离子的影响较大。随着溶液酸度增加,强酸性树脂对金属离子的吸附性能逐渐降低。因此,实验研究了不同酸度条件下H柱对金属离子的去除效率,采用ICP-AES分析过柱后溶液中金属离子,计算去除效率,结果示于表3。

表3 不同酸度下H柱对金属离子的去除率Table 3 Removal rate of metal ions at different acidities by H column
硝酸浓度在0.3mol/L以内时,没有检测出阳离子,说明在硝酸浓度小于等于0.3mol/L时,H柱对这几种阳离子有很好的去除效果。当硝酸浓度大于0.5mol/L时,溶液中残留有K+和Na+,因此本工作选择将样品稀释10倍后,即硝酸浓度为0.3mol/L过IC-H柱去除阳离子。配制含金属离子的模拟溶液,采用2.5mL的H柱处理,经过加热-氮吹后,草酸根的回收率列于表4。如表4所示,用2.5mL H柱去除阳离子之后,草酸根的回收率均在90%以上。说明样品稀释10倍后,IC-H柱对阳离子有较好的去除效果,对草酸根测定不产生影响。
表4 草酸根的回收率Table 4 Recovery of

表4 草酸根的回收率Table 4 Recovery of
No.保留时间(Retention time)/min峰面积(Peak area)/(μs·min)回收率(Recovery)/%标准(Standard) 4.6 0.074 2 -1 4.6 0.071 5 96 2 4.6 0.069 1 93 3 4.6 0.073 2 99 4 4.6 0.071 2 96
2.4 模拟样品蒸发温度的优化
模拟样品稀释后酸度降低,成分比较复杂,需要对处理过程中的蒸发温度重新优化。取0.5mL模拟样品,按流程进行处理,改变溶液温度,考察不同温度下草酸根回收率,结果列于表5。由表5结果可知,当溶液温度超过60℃时,草酸根回收率小于80%。这可能是由于溶液中残存的金属离子在达到此温度时,对草酸与硝酸的反应产生催化,消耗了少量的草酸。因此,为了保证较高的回收率,同时缩短加热时间,在以5L/min氮气吹扫条件下,选择55℃对模拟样品进行加热除酸。
2.5 模拟样品的测定
配制模拟样品,模拟样品组分及含量列于表6。
取模拟样品0.5mL,用去离子水稀释到5mL,加一定量羟基脲溶液还原破坏,然后过H柱去除阳离子,再用5mL水洗H柱,将溶液收集于烧杯中,5L/min氮吹-55℃加热蒸发溶液,待溶液蒸干后,用去离子水多次洗涤烧杯,将收集的溶液定容于10mL容量瓶中,离子色谱仪进行检测。样品处理流程示于图5。处理后色谱图示于图6。从图6可以看出,依据建立的样品处理流程对模拟样品进行处理后,硝酸根浓度显著降低(降低了103倍),对草酸根测定没有影响。
表5 溶液温度对模拟样品中草酸根回收率的影响Table 5 Effect of solution temperature on the recovery ofin simulative sample

表5 溶液温度对模拟样品中草酸根回收率的影响Table 5 Effect of solution temperature on the recovery ofin simulative sample
No. 溶液温度(Solution temperature)/℃蒸发时间(Evaporation time)/min峰面积(Peak area)/(μs·min)回收率(Recovery)/%1 42 160 0.064 9 92 2 48 115 0.064 2 91 3 55 60 0.064 1 91 4 58 50 0.059 6 85 5 60 48 0.055 4 72 6 65 50 0.053 6 76标准(Standard)--0.070 1 -

表6 模拟样品的成分及含量Table 6 Compositions and their concentrations in the simulative sample
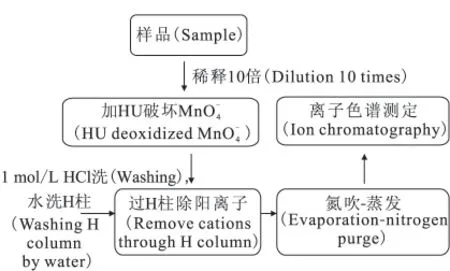
图5 样品处理流程图Fig.5 Flow chart of sample
采用建立的样品处理方法,对模拟样品进行6次平行测定,样品处理过程中,草酸根浓度稀释了20倍,理论值即为0.5mg/L。因此配制0.5mg/L标准草酸根溶液进行对比,结果列于表7。表7结果表明,模拟样品采用稀释-还原-过H柱-加热氮吹的前处理方法,6次测定0.5mg/L草酸根的回收率均在87%以上,sr=4.0%,样品处理和检测可在1h内完成。依照以上样品处理方法,对模拟样品进行重加回收实验,结果列于表8。表8结果表明,草酸根的回收率在88%~92%之间。
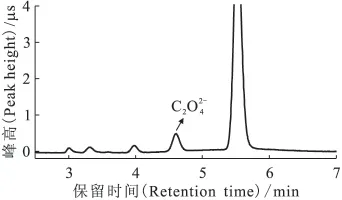
图6 模拟样品按流程处理后色谱图Fig.6 Chromatogram ofafter the simulative sample was disposed
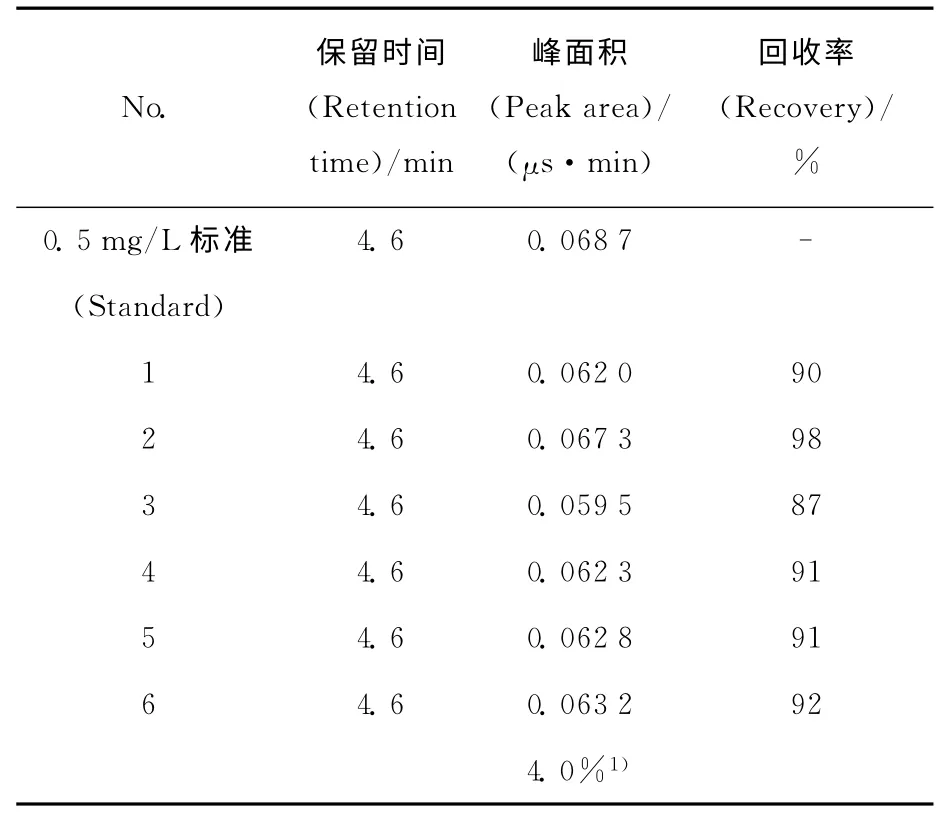
表7 模拟样品回收率及精度Table 7 Recovery and precision determination for the simulative samples

表8 模拟样品重加回收结果Table 8 Determination results of the simulative samples
3 结 论
离子色谱法测定模拟草酸钚沉淀母液中的微量草酸根,体系中高浓度硝酸(约3mol/L)对测定干扰较大。工作中采用5L/min氮吹-55℃加热蒸发的方法,使体系中硝酸根含量降低了103倍,去除了硝酸的干扰。同时对体系中易干扰的阳离子进行稀释-过H柱的方法去除。采用建立的方法对模拟草酸钚沉淀母液进行重加回收实验,草酸根的重加回收率在88%~92%之间,0.5mg/L草酸根6次测定的sr=4.0%,样品处理及检测在1h之内完成。该方法简单、易于操作、灵敏度高,适于草酸钚沉淀母液中微量草酸根的分析。
[1]丁亚平,吴庆生.示波电位滴定法测定僵蚕中草酸铵[J].分析试验室,1997,16(5):14-16.
[2]Jiang Z L,Zhao M X,Liao L X.Catalytic spectrophotometric methods for the determination of oxalic acid[J].Anal Chim Acta,1996,320(1):139-143.
[3]Tabe M,Fujimoto T,Nakahara R,et al.Spectrophotometric determination of oxalate ion with N,N′-diethyl-N,N′-[4,4′-dihydroxy-1,1′-binaphthalene]-3,3′-diyl]bisbenzamide and copper(Ⅱ)[J].Anal Sci,2007,23(5):601-604.
[4]Hassouna M E M.Determination of oxalate based on its enhancing effect on the oxidation of Mn(Ⅱ)by periodate[J].Talanta,2002,56(1):193-202.
[5]陈军浩,顾光煜,王以立.高锰酸钾褪色法测定尿液草酸[J].临床检验杂志,1999,17(9):266-268.
[6]孟泽,徐骏,曹红琴.比色法测定尿中草酸[J].临床检验杂志,1996,14(1):5-7.
[7]Honow R,Bongartz D,Hesse A.An improved HPLC-enzymed reactor method for the determination of oxalic acid in complex matrices[J].Clin Chim Acta,1997,261(2):131-139.
[8]Reddy S M,Higson S P,Vadgama P M.Amperometric enzyme electrode for the determination of urine oxalate[J].Anal Chim Acta,1997,343(1-2):59-68.
[9]Del Nozal M J.Determination of oxalate,sulfate and nitrate in honey and honeydew by ion chromatography[J].J Chromatography A,2000,881(1-2):629-638.
[10]俞乐,彭新湘,杨崇,等.反相高效液相色谱法测定植物组织及根分泌物中草酸[J].分析化学,2002,30(9):1119-1122.
[11]林燕春.用离子色谱法测定环境样品中甲酸、乙酸、草酸[J].分析测试学报,2000,19(2):83-85.
[12]高蕙文,宋淑文,罗崇延,等.离子色谱法测定龙虾中草酸含量的研究[J].中国卫生检验杂志,2009,19(12):2835-2836.
[13]施超欧,栾绍嵘,王洁姮.离子色谱法测定甘草提取物中草酸的含量[J].化学分析计量,2005,14(3):38-39.
[14]沈敏,田莉,薛爱芳,等.壳聚糖预分离富集-离子色谱法测定痕量草酸根[J].分析科学学报,2008,24(3):299-302.
[15]朱屯.萃取与离子交换[M].北京:冶金工业出版社,2005.
