不孕症患者子宫内膜细胞线粒体DNA 缺失研究
2015-12-24蔡学泳赵京卉陈燕刁瑞英
蔡学泳,赵京卉,陈燕,刁瑞英*
(1.深圳市第二人民医院生殖医学科,深圳 518035;2.山西省儿童医院,太原 030013)
不孕症是指以育龄期女子婚后或末次妊娠后,夫妇同居1年以上,男方生殖功能正常,未避孕而不受孕为主要表现的疾病。婚后1年以上从未受孕为原发性不孕;曾有过生育或流产史,又连续1年以上不孕,称为继发性不孕。不孕症的发生率约占育龄妇女的8%~17%,平均10%左右[1]。除受精卵、输卵管和精液等重要因素外,子宫因素如内膜功能和代谢障碍在反复种植失败和不明原因引起的不孕症发生中也起到重要作用[2-3]。
线粒体是除细胞核以外唯一携带DNA 的细胞器,也是细胞能量产生的来源和场所。线粒体DNA(mtDNA)有37 个基因,编码2 种rRNA 分子、22种tRNA 分子和13 种线粒体氧化磷酸化(OXPHOS)复合体亚基;mtDNA 的蛋白质编码能力有限,只编码细胞色素氧化酶Ⅰ-Ⅲ亚基、细胞色素酶b(Cyt b)、NADH 脱氢酶1-6(ND 1-6)和ND 4L 亚基以及ATP酶6和8亚基[4]。
参与编码OXPHOS的mtDNA 组分出现问题,将会导致线粒体功能障碍,引起细胞代谢改变和能量生成下调,最后导致组织衰老、发育障碍或癌症发生[5-6]。文献报道,mtDNA 拷贝数与成熟卵母细胞的正常分裂密切相关,而采用微注射移植年轻供者的线粒体可以明显改善卵母细胞的受孕成功率[7-8]。目前,有关不孕症子宫内膜细胞中mtDNA 缺失率,关注相对较少。因此,本研究拟探讨不孕症患者子宫内膜细胞中的mtDNA 缺失率及能量变化,旨在探明子宫内膜细胞mtDNA 缺失在不孕症发生中的可能作用。
资料和方法
一、研究对象及分组
研究对象为2012年7月至2013年12月期间在深圳市第二人民医院就诊的不孕症患者。
病例组的纳入标准:原发性不孕组为育龄期妇女婚后有正常性生活,未经避孕1年以上从未妊娠者;继发性不孕组为曾有过妊娠而后未避孕1年以上不孕者。
病例组的排除标准:先天性生理缺陷或畸形、器质性病变所致不孕;遗传因素所致不孕;男方生殖功能异常;合并有心血管、肝、肾、造血系统等严重原发性疾病;精神病患者。
对照组的纳入标准:月经周期正常的育龄女性因男性因素就诊者,病理检查除外子宫内膜病变。
常规检查夫妻双方肝功能,排除丈夫及第三者乙肝、丙肝、HIV、梅毒等传染病。本研究获得深圳市第二人民医院医学伦理委员会的批准,并经每位受试者知情同意。
年龄是影响mtDNA 缺失的重要因素,因此各组进一步按年龄分为<35岁和≥35岁组。其中,原发性不孕症<35岁和≥35岁组分别为14和16例,共30例;继发性不孕症<35和≥35岁组分别为13和14例,共27例;对照组<35和≥35岁组分别为12和14例,共26例。
二、子宫内膜取材
黄体形成后,在孕激素作用下,子宫内膜呈分泌反应,称为分泌期。排卵后7~8d(相当于月经周期第22天左右),黄体体积达最高峰。在子宫内膜分泌期中期(又名黄体中期)即月经周期第20~23天,进行子宫内膜取材。此时,在卵巢分泌的黄体酮影响下,子宫内膜维持高分泌活动和增厚状态,恰与囊胚植入同步,可为受精卵种植和发育准备条件。取材体位为排尿后取膀胱截石位;常规消毒后,用阴道窥器暴露宫颈,以刮匙刮取子宫内膜少许,将标本置-80℃冰箱中保存备用。
三、DNA 提取和巢式PCR
采用DNA 提取试剂盒(D3591-02,Omega,美国)提取子宫内膜组织细胞中的DNA,进行巢式PCR 反应。表1 示巢式PCR 引物对的位置和序列[9],图1示引物在线粒体上的大体位置。
第一轮PCR 采用的引物对为H1+L4,程序为:95℃5 min 变性;95℃40s,58℃40s,72℃6 min,35个循环;最后延伸72℃7min,保存在4℃。如存在mtDNA重排时,将PCR产物5μl作为模板,进行第二轮PCR,采用的引物对分别为H1+L1、H3+L2、H1+L3、H1+L2及H2+L3,条件同第一轮。PCR产物采用1.5%琼脂糖凝胶电泳及测序分析。

表1 人mtDNA 片段缺失总体筛查引物

图1 巢式PCR 引物在人mtDNA 上的大体位置
四、Real-time PCR检测mtDNA 拷贝数
采用Real-time PCR方法检测线粒体基因ND1及核基因HGB(cytoglobin,细胞球蛋白)含量,以ND1与HGB拷贝数的比值计算组织细胞中mtDNA 拷贝数的相对含量。采用SYBR Green master mix 试剂盒(Takara,大连),检测仪器使用ABI PRISM 7500 荧 光 定 量PCR 仪(Applied Biosystems,美国),反应体系20μl。
引 物 序 列 为:(ND1-F)5′-CCCTAAAACCCGCCACATCT-3′ 和 (ND1-R)5′-GAGCGATGGTGAGAGCTAAGGT-3′;(HGB-F)5′-GTGCACCTGACTCCTGAGGAGA-3′和(HGB-R)5′-CCTTGATACCAACCTGCCCAG-3′。线粒体基因ND1的扩增条件是95℃10min,95℃15s,60℃1min,40个循环;核基因HGB 的扩增条件是95℃10 min,95℃15s,56℃1min,40个循环。
五、组织ATP(adenosine 5′-triphosphate)含量测定
各组取绿豆粒大小约20mg子宫内膜组织(各组n=10),加入200μl裂解液。匀浆裂解后4℃12 000 r/min离心5~10min,取上清用于后续的测定。
ATP检测试剂盒(S0026,上海碧云天)的检测原理是萤火虫荧光素酶催化荧光素产生荧光时需要ATP提供能量。采用荧光分光光度计(Berthold LB 9501luminometer,德国)测算化学发光,制备标准曲线,并测算样品中的ATP 浓度。本实验每组重复3次。
六、统计学处理
结 果
一、不孕症患者子宫内膜细胞mtDNA 缺失率增加,且随年龄增加而增多
对mtDNA 缺失的检测采用表1中提供的引物对进行巢式PCR 扩增及测序分析。结果发现mtDNA 存在多种片段类型的缺失,其中仅4 977bp缺失具有统计学意义。原发和继发性不孕症子宫内膜细胞mtDNA 在这一区域的缺失率分别为86.67%(26/30)和78.78%(21/27),均 明 显 高 于 对 照 组(38.46%)(P<0.05);原发和继发性不孕两组间比较,无统计学差异(P>0.05)(表2)。
进一步对各组内按年龄分组的数据进行分析,发现对照组≥35岁的mtDNA 4 977bp缺失率略高于<35岁组,但可能由于样本量有限,两者并无统计学差异(P>0.05);原发和继发性不孕≥35岁组的mtDNA 4 977bp缺失率均显著高于<35岁组(P<0.05),提示年龄因素对mtDNA 4 977bp缺失率的重要影响(表2)。
二、不孕症患者子宫内膜细胞中mtDNA 拷贝数增加,ATP含量下降
本研究采用Real-time PCR 检测线粒体基因ND1与细胞核基因HGB 表达水平,以ND1/HGB比值来反映子宫内膜细胞中mtDNA 拷贝数的变化。以对照组为基准进行统计,原发性不孕组子宫内膜细胞mtDNA 拷贝数相对含量为(1.47±0.35),继发性不孕组为(1.50±0.26),分别比对照组[(1.00±0.14)]高48.49%和51.01%(P<0.01)(图2A)。而不孕症患者子宫内膜细胞的ATP 含量则较对照组明显下降,原发性不孕组子宫内膜细胞ATP相对含量为(0.44±0.07),继发性不孕组(0.39±0.06),分别比对照组[(1.00±0.19)]低57.00%和61.29%(P<0.01)(图2B)。
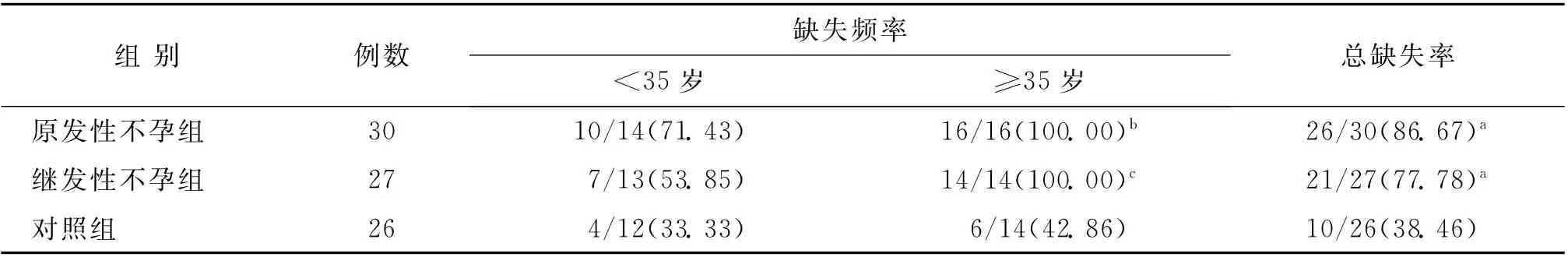
表2 线粒体mtDNA 4 977bp缺失频率分析[n(%)]

图2 子宫内膜细胞mtDNA 拷贝数(A)和ATP相对含量检测(B)
讨 论
人mtDNA 上任何基因的突变,都可能影响线粒体OXPHOS的功能,参与细胞分化、细胞衰老、神经退行性变、家族性耳聋、肿瘤的发生和进展[10]。卵巢功能低下(POI)、卵巢早衰(POF)及子宫内膜异位症患者都存在mtDNA 缺失率增加[11-12]。对于为受精卵种植和胚胎发育提供场所和能量的子宫内膜,在黄体中期时受黄体酮影响维持其高营养、高能量的状态。因此,从子宫内膜mtDNA 缺失角度探寻不孕症发生的机理,将有较好的临床指导意义。
随着年龄增加,自由基增多引起DNA 突变、蛋白损伤和端粒缩短,细胞氧化呼吸能力下降,导致线粒体内活性氧增加;广泛的氧化应激损伤,进而引发线粒体内细胞色素C 和凋亡启动因子的释放[13-14]。有研究证实,高龄女性卵母细胞mtDNA 4 977bp的突变率显著高于年轻者[15]。本研究发现,不孕症组mtDNA 缺失率较对照组显著增高。其中,mtDNA 4 977bp缺失最常见,其位于H1(np 8285-8304)+L1(np13650-13631)引 物 对 即np 8304-13631之间。此外,因为年龄是影响mtDNA 缺失及功能的关键因素,本研究进一步以35岁为界将对照组、原发性不孕组和继发性不孕组各分成两个亚组,研究发现≥35岁组别中,原发性不孕(16 例)和继发性不孕患者(14例)均存在mtDNA 4 977bp的缺失,且随着年龄增加,不孕症患者子宫内膜4 977 bp缺失的发生率显著增加。现在许多寻求辅助生殖技术助孕的妇女年龄相对偏大,因此往往存在一定程度的线粒体功能改变。Seifer等[16]发现来自年龄大于38岁妇女的颗粒细胞中存在高水平的mtDNA缺失。随着年龄增加细胞内的自由基活性增强,不孕症患者子宫内膜中mtDNA 4 977bp缺失率增加,可能参与不孕症发生。
过量氧化应激(OS)的存在,导致mtDNA 缺失率 增 加,mtDNA 拷 贝 数 增 多[17]。因 此,过 多 的mtDNA 拷贝数可能由于过量OS 压力和OS 清除障碍,进而参与疾病或癌症发生[18]。如在子宫内膜癌中,mtDNA 拷贝数和微卫星不稳定性(MSI)显著增加[19]。癌症组织mtDNA 中,常见的编码基因缺失突变有Cytb、ND2和ATPase 8[10]。人为地在正常人泌尿上皮SV-HUC-1细胞中过表达突变Cytb基因序列,将导致细胞内mtDNA 拷贝数增加,并通过抑制细胞色素C 释放进而抑制凋亡途径[20]。因此,mtDNA 拷贝数越多,可能提示线粒体呼吸链障碍和线粒体异常。本研究采用mtDNA 编码的ND1作为线粒体的标志,以核编码的HGB 相对表达量作为细胞核的标志,采用Real-time PCR 检测ND1/HGB比值作为mtDNA 拷贝数的衡量指标。结果证明,不孕症组子宫内膜细胞中mtDNA 拷贝数比正常生育组显著增加。
细胞内ATP 水平,是细胞内能量水平的监控指标,其含量下降提示线粒体的功能受损或下降。本研究进一步发现,不孕症组样本中的ATP 含量显著低于对照组。因为线粒体正常功能的发挥对受孕期间子宫内膜稳态非常关键[21],因此mtDNA 缺失以及能量异常必将会影响到子宫内膜正常能量代谢,进而干扰或抑制受精卵种植和继续发育。
子宫内膜若存在mtDNA 缺失和功能障碍,将导致内膜细胞能量代谢异常,可能参与不孕症的发生。OS介导的子宫内膜损伤及能量产生障碍,亦可能参与不孕症的发生发展。因此,提早检测和关注子宫内膜能量代谢情况,并早期进行药物和物理干预或保护,将对受精卵成功着床及胚胎正常发育至关重要。
[1] Miller JH,Weinberg RK,Canino NL,et al.The pattern of infertility diagnoses in women of advanced reproductive age[J].Am J Obstet Gynecol,1999,181:952-957.
[2] Ishii T,Miyazawa M,Takanashi Y,et al.Genetically induced oxidative stress in mice causes thrombocytosis,splenomegaly and placental angiodysplasia that leads to recurrent abortion[J].Redox Biol,2014,2:679-685.
[3] Kebbi-Beghdadi C,Cisse O,Greub G.Permissivity of Vero cells,human pneumocytes and human endometrial cells to Waddlia chondrophila[J]. Microbes Infect,2011,13:566-574.
[4] Spiropoulos J,Chinnery PF,Turnbull DM.Pathogenic mitochondrial DNA mutations and human reproduction[J].Hum Fertil(Camb),1999,2:133-137.
[5] Govatati S,Deenadayal M,Shivaji S,et al.Mitochondrial displacement loop alterations are associated with endometriosis[J].Fertil Steril,2013,99:1980-1986.
[6] Gomes AP,Price NL,Ling AJ,et al.Declining NAD(+)induces a pseudohypoxic state disrupting nuclearmitochondrial communication during aging[J].Cell,2013,155:1624-1638.
[7] Dumollard R,Duchen M,Carroll J.The role of mitochondrial function in the oocyte and embryo[J].Curr Top Dev Biol,2007,77:21-49.
[8] May-Panlou PP,Chretien MF, Malthiery Y,et al.Mitochondrial DNA in the oocyte and the developing embryo[J].Curr Top Dev Biol,2007,77:51-83.
[9] Hsieh RH,Tsai NM,Au HK,et al.Multiple rearrangements of mitochondrial DNA in unfertilized human oocytes[J].Fertil Steril,2002,77:1012-1017.
[10] Guney AI,Javadova D,Kirac D,et al.Detection of Y chromosome microdeletions and mitochondrial DNA mutations in male infertility patients[J].Genet Mol Res,2012,11:1039-1048.
[11] Govatati S,Tipirisetti NR,Perugu S,et al.Mitochondrial genome variations in advanced stage endometriosis:a study in South Indian population[J].PloS one,2012,7:e40668.
[12] Bonomi M,Somigliana E,Cacciatore C,et al.Blood cell mitochondrial DNA content and premature ovarian aging[J].PloS one,2012,7:e42423.
[13] Liu M,Yin Y,Ye X,et al.Resveratrol protects against ageassociated infertility in mice[J].Hum Reprod,2013,28:707-717.
[14] Tatone C,Amicarelli F,Carbone MC,et al.Cellular and molecular aspects of ovarian follicle ageing[J].Hum Reprod Update,2008,14:131-142.
[15] 汤江静,邵敬於,段涛,等.辅助生殖技术中卵母细胞线粒体功能对胚胎发育的影响[J].国际生殖健康/计划生育杂志,2013,32:464-467.
[16] Seifer DB,DeJesus V,Hubbard K.Mitochondrial deletions in luteinized granulosa cells as a function of age in women undergoing in vitro fertilization[J].Fertil Steril,2002,78:1046-1048.
[17] Zhang S,Wen G,Huang SX,et al.Mitochondrial alteration in malignantly transformed human small airway epithelial cells induced by alpha-particles[J].Int J Cancer,2013,132:19-28.
[18] Samper E,Morgado L,Estrada JC,et al.Increase in mitochondrial biogenesis,oxidative stress,and glycolysis in murine lymphomas[J].Free Radic Biol Med,2009,46:387-396.
[19] Wang Y,Liu VW,Xue WC,et al.The increase of mitochondrial DNA content in endometrial adenocarcinoma cells:aquantitative study using laser-captured microdissected tissues[J].Gynecol Oncol,2005,98:104-110.
[20] Dasgupta S,Hoque MO,Upadhyay S,et al.Forced cytochrome B gene mutation expression induces mitochondrial proliferation and prevents apoptosis in human uroepithelial SV-HUC-1cells[J].Int J Cancer,2009,125:2829-2835.
[21] Nikitin AG, Lavrikova EY, Chistiakov DA . The heteroplasmic 15059 G>A mutation in the mitochondrial cytochrome b gene and essential hypertension in type 2 diabetes[J].Diabetes Metab Syndr,2012,6:150-156.
