红茶菌发酵精制茶皂素的工艺研究
2015-12-24王静梁慧玲杨秀芳涂云飞
王静,梁慧玲,杨秀芳*, 涂云飞
(1.中华全国供销合作总社杭州茶叶研究院,浙江杭州 310016;2.浙江省茶资源跨界应用技术重点实验室,浙江杭州 310016)
茶皂素(Tea Saponin),又称茶皂甙,是一类天然糖甙化合物,主要由配基(C30H50O6)、糖体和有机酸的基本结构构成的一种五环三萜类皂素。油茶饼粕中茶皂素含量较高,达10%~15%,是茶皂素的一个重要来源[1]。茶皂素具有较强的发泡、乳化、分散、湿润等作用,是一种性能优良的非离子表面活性剂,可广泛应用于日化、医药、建材、农药以及其它一些领域,经济价值较高[2]。
茶皂素的早期提取是以水为溶剂 (称水浸法),水浸法所得茶皂素纯度低,颜色深,黏度大,纯度不高,限制了茶皂素的应用[3]。目前茶皂素的提取多采用醇提法[4]或有机溶剂提取法[5]。
红茶菌是用糖茶水为原料,经过乳酸菌、酵母菌、醋酸菌等微生物共同发酵,而制成的酸甜味饮料。在红茶菌中含有的酵母菌、乳酸菌和醋酸菌等微生物共同作用下,可将可溶性的多糖转变成为菌膜,因此红茶菌的发酵过程会使原料液中的糖类成分含量下降而转变成为较易去除的菌膜。同时,根据前期研究发现,茶籽饼粕水溶液中接种红茶菌发酵后,对茶皂素具有絮凝沉淀的作用。因此在茶籽饼粕中接种红茶菌进行发酵,有望开发成一种精制茶皂素的新方法。
本研究采用正交实验,对培养方式、发酵时间、种子液量和发酵液浓度四个因素进行分析,同时也对精制后的茶皂素进行了薄层层析和品质鉴定,最后结合获得的最佳发酵条件,使用80%乙醇进一步浸提,获得纯度较高、颜色较浅的茶皂素。
1 材料与方法
1.1 实验材料及试剂
茶籽饼粕:购自新昌县益生茶业科技有限公司,茶皂素含量约为25%;茶皂素粗品:纯度约为50%,市售;红茶菌:浙江省茶资源跨界应用重点实验室保留菌种;浓硫酸,无水乙醇,甲醇,香草醛,乙酸乙酯,α-萘酚,醋酸铅,醋酸酐和正丁醇:均为分析纯。
1.2 实验设备
AL-204型电子天平,梅特勒-托利仪器 (上海)有限公司;DK-S24型电热恒温水浴锅,上海精宏试验设备有限公司;DHG-9070A型电热恒温鼓风干燥箱,上海精宏试验设备有限公司;KQ-250DE型超声波清洗器,昆山市超声仪器有限公司;UV-2102PC型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;ZHWY-2012C型生化培养箱,上海智城分析仪器制造有限公司;LD-IIB型低速离心机,无锡市瑞江分析仪器有限公司。
1.3 正交设计
由于茶皂素具有一定的抑菌作用,因此浓度较高的茶皂素可能会抑制红茶菌的生长[6]。预实验研究发现10%的茶籽饼粕水提液(离心去除沉淀)接种红茶菌后,发酵情况较好,因此正交实验设计了三个不同的茶籽饼粕水提液浓度,分别为8%、10%和12%,实验中所使用的培养基体积均为50 mL。本实验较之前的研究加大了红茶菌的接种量,分别加入红茶菌种子液10 mL、20 mL 和30 mL,因此猜测对茶皂素的絮凝沉淀会更快达到平衡,设立了24 h 和48 h 两个发酵时间。红茶菌为一类好氧菌,之前研究均使用静置培养(利于形成菌膜),本研究中采用了两种培养方式,摇床和静置培养两种方式。正交因素水平表如表1所示。
茶籽饼粕接种红茶菌液后在28℃下培养。
在前期研究中,分别对发酵一段时间之后的上清液及沉淀中的茶皂素含量进行了测定,结果表明95%以上的茶皂素存在于絮凝沉淀中。因此在本研究中,发酵结束后,去除菌膜,离心取沉淀,并测定沉淀的干重作为衡量指标。

表1 正交实验因素水平表Table 1 Orthogonaldesign
1.4 茶皂素的测定方法
茶皂素的测定方法采用香草醛-硫酸法[7]。
1.5 组分比较
对所制得的茶皂素定性鉴定采用硅胶薄层层析技术,展呈体系为乙酸乙酯∶甲醇∶正丁醇∶水=3∶2∶5∶10 的上相,展呈完毕用5%的浓硫酸乙醇溶液喷雾显色,对微生物精制所得茶皂素与市售茶皂素粗品进行比较。
1.6 定性鉴定
Molish 反应[8]:配制好一定浓度的油茶皂素溶液,取少许于比色管中,滴加少量10%α-萘酚乙醇溶液,将比色管适当倾斜后小心注入浓硫酸,然后观察液面的分层处是否出现紫红色的现象。
Libermann Burchard 反应[8]:取少许油茶皂素粗品,置于比色管中,加入5 mL 醋酐,再添加几滴浓硫酸进行反应,观察颜色的改变。
沉淀反应[8]:取配制好的油茶皂素溶液少量加入醋酸铅,振荡后看是否有沉淀产生。
1.7 乙醇沉淀进一步精制
使用正交实验所得的优化发酵条件,进行茶皂素的生物精制,所得的絮凝沉淀部分随后使用乙醇进行进一步的精制。根据预实验发现,80%的乙醇对于茶皂素的精制效果最佳,因此后续研究使用80%的乙醇作为进一步精制的提取剂。
1.8 数据处理
实验数据应用Excel 2007 软件分析,正交实验由Matlab 设计。
2 结果与分析
2.1 正交实验结果
根据正交实验所得到茶皂素沉淀量分析结果如表2所示。四个因素对茶皂素沉淀量的影响因素大小排序为:D 发酵液浓度>B 发酵时间>C种子液量>A 培养方式。
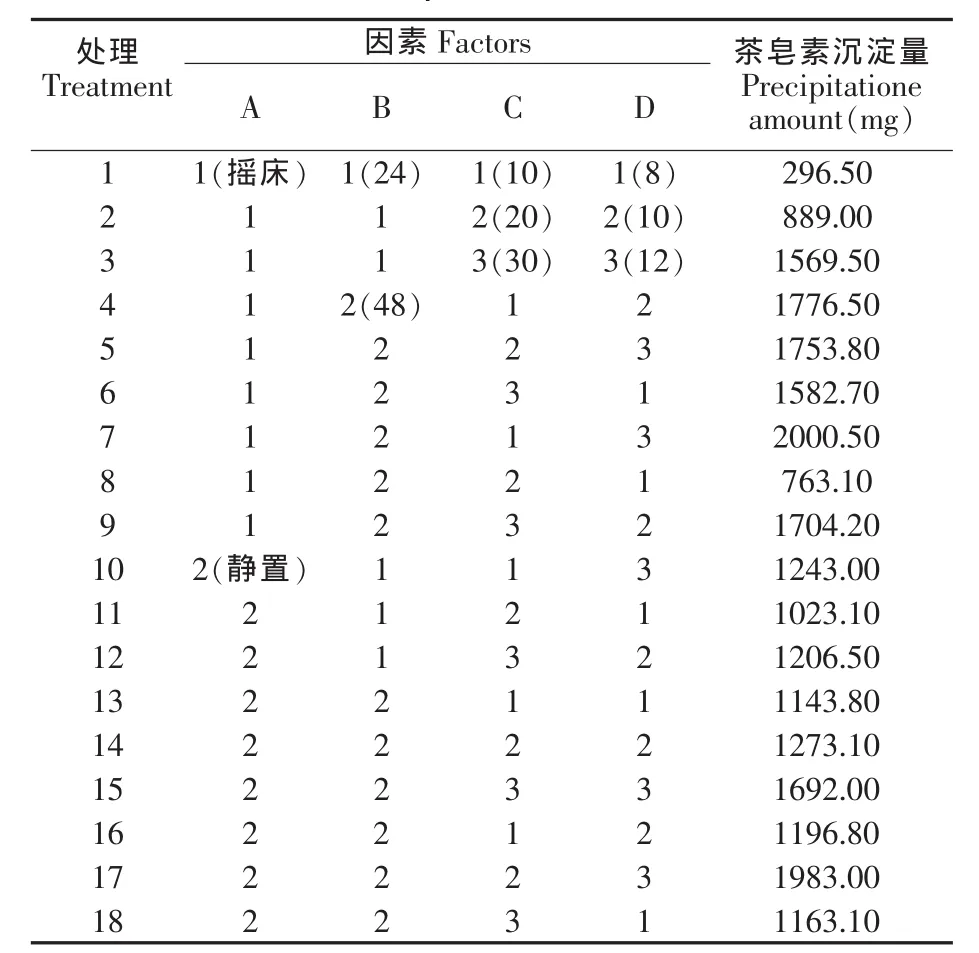
表2 正交实验结果分析Table 2 The result and analysis of orthogonal experiments

表3 正交实验极差分析Table 3 Range analysis of orthogonal experiments
根据之前的研究表明,溶液中95%的茶皂素会被红茶菌絮凝沉淀,因此为了获得较大量的茶皂素,茶皂素的沉淀较多为宜。由表3可以看出,A1(摇床培养)、B2(发酵 48 h)、C3(接种种子液量30 mL)和D3(发酵液浓度12%)条件下可以获得的茶皂素沉淀含量最大。在实验过程,由于摇床培养会造成红茶菌菌膜难以形成,离心也难以去除,且经实验结果表明,培养方式对于茶皂素沉淀的影响较小,因此静置培养可能较为适合。
2.2 茶皂素组分分析
微生物精制茶皂素与市售茶皂素薄层层析结果如图1所示,微生物精制的茶皂素成分组成与市售茶皂素粗品基本一致,表明红茶菌发酵,对茶皂素的结构并无影响。

图1 微生物精制茶皂素与市售粗品硅胶薄层层析比较Fig.1 The comparison of thin layer chromatography between purification and crudetea saponin
2.3 茶皂素定性鉴定
茶皂素品质鉴定结果如表4 和图2所示,微生物精制的茶皂素和市售的茶皂素粗品品质保持一致,表明微生物发酵不会改变茶皂素的品质。

表4 品质鉴定实验结果Table 4 The results of characterization tests

图2 精制茶皂素与市售茶皂素粗品的品质鉴定比较Fig.2 The comparison of characterization tests between purification and crudetea saponin
2.4 乙醇进一步精制结果
使用正交实验所得的最佳发酵条件进行发酵,所获得的发酵液离心后获得的茶皂素絮凝沉淀使用80%的乙醇进行进一步纯化,所得茶皂素含量及纯度如表5所示,精制后经喷雾干燥后的成品如图3所示。结果表明,经微生物发酵后,进一步采用80%的乙醇精制,可获得85%左右纯度的茶皂素。从图3 中可以看出,精制后的茶皂素色泽较浅。

表5 经80%乙醇进一步纯化后茶皂素得率和纯度Table 5 The yield and purity of tea saponin with 80%ethanol purified

图3 微生物精制茶皂素与市售粗品颜色比较Fig.3 The comparison of color between purification and crudetea saponin
3 讨论
茶皂素是一种天然表面活性剂,在医药、日化、农药等领域都有广阔的应用前景。红茶菌作为一种复合益生菌,具有代谢多糖的功效;同时,由于微生物的发酵,使发酵液中的pH 值下降,而茶皂素在酸性条件下易沉淀,因此也产生了絮凝、沉淀茶皂素的特点。本研究将红茶菌接种到茶皂素水溶液中,通过正交实验,优化了红茶菌在茶皂素水溶液中的发酵工艺,并已申请发明专利[9]。结果表明,12%的茶籽饼粕水提液中接种30 mL种子液,静置的方式培养48 h可以获得较大量的茶皂素絮凝沉淀。
通过薄层层析及定性鉴定实验,将微生物发酵絮凝获得的茶皂素与市售茶皂素进行了比较,从结果可以看出,微生物发酵的过程并未对茶皂素的结构及性质产生影响。
随后进一步采用乙醇浸提的方式精制茶皂素。通过正交所得的最佳发酵条件下絮凝的茶皂素沉淀粗品,在80%的乙醇提取后纯度可达85%左右。
本研究通过微生物发酵结合乙醇浸提的方式,对茶籽饼粕中的茶皂素进行了精制。在精制过程中避免使用有机试剂,且生产工艺简单,成本较低,同时也提高了生产过程和产品的安全性,所得产品可在日化等领域广泛使用。
[1]温柳娟,严志云.茶籽皂素的提取及应用研究[J].广州化工,2009, 37(1):13-16.
[2]胡平平,李加兴,李忠海,等.油茶饼粕茶皂素与多糖综合提取工艺[J].食品科技, 2012, 30(2):196-204.
[3]张星海,杨贤强.茶皂素性质及应用研究近况[J].福建茶叶,2003(2):17-19.
[4]谢多,赵俭,许小彤,等.油茶饼粕中茶皂素醇提工艺条件优化[J].食品与机械, 2013, 29(3):129-133.
[5]李运涛,赵艳娜.茶皂素提取工艺的研究[J].陕西科技大学学报, 2005, 23(4):41-43.
[6]刘蓉,张利蕾,范亚苇,等.茶渣中粗茶皂素的纯化及其抗氧化和抑菌活性[J].南昌大学学报:工科版,2013,35(1):17-21,28.
[7]涂云飞,杨秀芳,孔俊豪.碱性水饱和正丁醇萃取体系联合大孔树脂纯化茶皂素研究[J].茶叶科学,2010,30(z1):556-560.
[8]王金元.油茶皂素的提取及纯化技术的优化[D].北京:中国林业科学研究院,2012.
[9]中华全国供销合作总社杭州茶叶研究所.一种微生物发酵纯化茶皂素的方法:中国,201410231368.9[P].2014-09-10.
