不同发酵程度茶叶的体内与体外抗氧化功能比较
2015-12-24东方揭国良何普明
东方,揭国良,何普明
(1.广东食品药品职业学院食品学院,广东广州 510520;2.浙江大学茶学系,浙江杭州 310058)
茶叶是世界上最受欢迎的饮料之一。根据茶叶加工过程中多酚类物质氧化 (即茶学界称之为“发酵”)的程度,可将茶叶分为不发酵的绿茶,微发酵的白茶,轻发酵的黄茶,半发酵的青茶,全发酵的红茶和后发酵的黑茶等六大类[1]。目前国内外有关绿茶和红茶的抗氧化作用及机理研究报道很多。近年来,普洱茶的抗氧化等生物活性也已开始受到人们的重视[2-3]。
大量的研究报道证实了茶叶中的多酚类物质具有抗氧化、抗癌、抗突变、降血脂、降血压、杀菌、消炎等多种保健功能,是茶叶中最主要的有效成分[4]。绿茶的多酚类物质主要是未经氧化的儿茶素类,红茶的多酚类物质则主要是儿茶素类经酶促氧化或非酶促氧化形成的聚合物如茶黄素和茶红素(大分子的未知结构物)等[5]。普洱茶由于有微生物参与作用,在漫长的温、湿环境下其多酚类的变化更为复杂。已有研究机构从普洱茶中分离得到一种高氧化的黑茶素类化合物,为普洱茶中存在特异多酚类物质提供了有力证据[6]。本文选用了绿茶、红茶、普洱茶等3种不同发酵程度的茶叶,研究其多酚类组成及其含量,测定其体外清除自由基的能力,同时选用8~12月龄正常小鼠为模型,观察这三种茶对小鼠的丙二醛(MDA)含量、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSHPX)的影响,旨在探明不同发酵工艺所产生活性成分及其抗氧化功效的差异性。
1 材料与方法
1.1 动物及饲喂条件
昆明小鼠,清洁级,体重30 g 左右,雌性,由浙江省实验动物中心提供。动物饲养于定时交换空气(每小时 6次)、恒温(23±2 ℃)、定时适当亮度的照明(6:30~18:30)、相对湿度 50%~60%的动物实验室。小鼠自由摄食、饮水。基础饲料为浙江省实验动物中心提供的用于鼠类生长发育期的固体饲料。
1.2 茶粉与试剂
普洱茶粉,自制,取普洱茶(由浙江省茶叶进口公司提供,产地云南)以 1∶10,1∶5 的茶水比例在沸蒸馏水中30 min 浸提2次,浸提液合并,真空冷冻干燥后得普洱茶粉。绿茶粉与红茶粉购自浙江省龙游茗皇天然食品开发有限公司 (各茶粉均为该茶类的水提物喷雾干燥)。表没食子儿茶素没食子酸酯(EGCG,纯度>98%)与茶多酚(TP,纯度TP>95%,EGCG>40%)由浙江大学茶叶科技开发有限公司提供。二苯基苦基偕腙肼(DPPH)、儿茶素标样与茶黄素标样均购自Sigma公司。甲醇、乙腈均为色谱纯,购自天津四友有限公司。其余试剂均为国产A.R 级。
1.3 方法
1.3.1 各茶粉中化学成分组成及含量测定
茶多酚测定:酒石酸铁比色法[7];黄酮类测定:三氯化铝法[7];没食子酸、儿茶素及茶黄素测定:HPLC 法[8-9]。
1.3.2 体外自由基(DPPH)测定[10]
将溶于甲醇的DPPH (浓度为1 ×10-3mol/L)0.8 mL,与2.4 mL 不同浓度的三类茶粉的甲醇溶液混合,充分混匀后在室温、暗室中放置30 min,测定517 nm 下吸光值ODsample。以甲醇代替各样品溶液作为对照得 (ODck),计算清除率:%DPPH scavenging rate= (ODck-ODsample)×100/ODck。
1.3.3 动物分组及给药
动物试验按卫生部1996年文件“保健食品功能学评价程序和检验方法的测定”[11]进行。随机分成4组,设对照组、绿茶组、红茶组与普洱茶组。采用灌胃给药,各茶组剂量为 0.9 g·kg-1·d-1,对照组灌胃相当量的对照液(蒸馏水)。每天记录各组小鼠的体重变化。给药3周后断头取血与肝组织,进行三项指标测定:MDA 含量 (采用四乙氧基丙烷对照法)、SOD 活性(采用氯化硝基四氮唑蓝法,酶活定义:抑制NBT 光化还原反应的50%为一个酶活力单位)与GSH-PX 活性(采用DTNB 法,鼠血清GSH-PX 活力单位定义:规定每1 mL 血清,每分钟扣除非酶反应的1 g[GSH]降低后,使1 g[GSH]降低1 为一个酶活力单位;肝脏GSH-PX 比活力单位:规定肝脏每毫克蛋白质,每分钟扣除非酶反应,使GSH 降低1 μmol 为一个酶活力单位。
1.3.4 统计方法
采用SAS System for Windows V8 进行数据统计,表示方法为平均值±标准误差(mean±S.E.)。采用两样本均数t 检验。
2 结果与分析
2.1 各茶粉的化学成分组成及含量
由表1可知,绿茶中的多酚含量均高于红茶与普洱茶,而黄酮类含量则低于红茶与普洱茶。红茶与普洱茶具有相当量的没食子酸,且含量均高于绿茶。在绿茶与普洱茶中仅检测到少量的茶黄素,红茶中的茶黄素含量高于绿茶与普洱茶。由表2可知,绿茶的儿茶素以EGC 与EGCG 为主,约占总量的70%以上,非酯型儿茶素高于酯型儿茶素,且儿茶素总量高于红茶与普洱茶。GC 为红茶与普洱茶的主要儿茶素,分别占各自总量的47%与89%。红茶与普洱茶中儿茶素也以非酯型为主,且红茶儿茶素总量高于普洱茶。
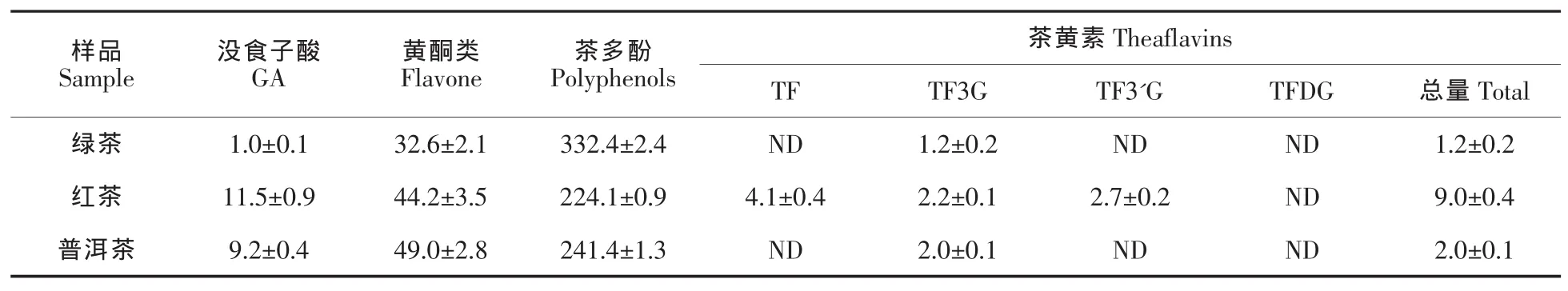
表1 各茶粉化学成分组成及其含量(单位:mg/g)Table 1 Chemical compositions of green tea,black tea and pu-erh tea(Unit:mg/g)
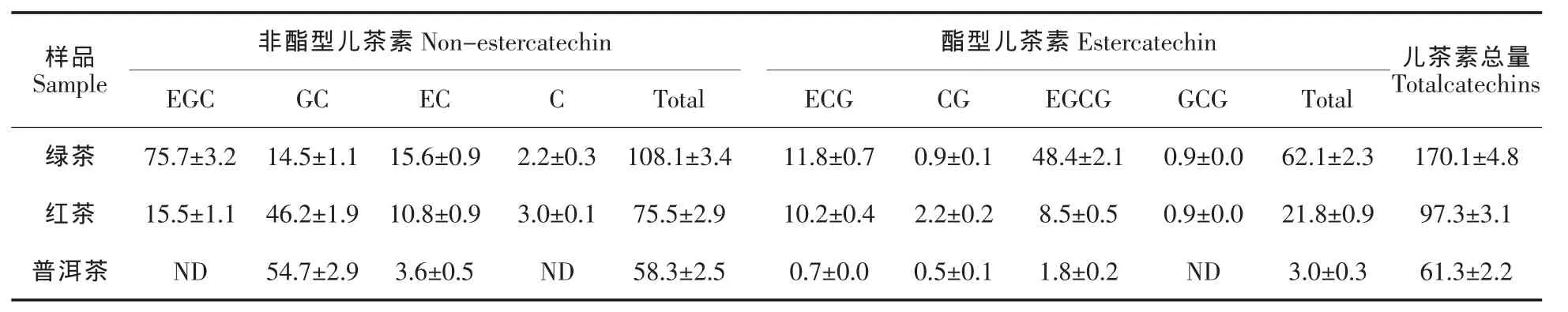
表2 各茶粉儿茶素组成及其含量(单位:mg/g)Table 2 Catechins in green tea,black tea and pu-erh tea(Unit:mg/g)
2.2 各茶粉体外清除DPPH 的能力
由表3可知,在DPPH 反应体系中,各茶粉浓度的对数与清除率存在着线性关系(P<0.01)。由线性方程得出的抑制50%DPPH 时所需浓度(IC50),可知各茶粉对DPPH 自由基的清除效果由强到弱依次为绿茶>红茶>普洱茶。
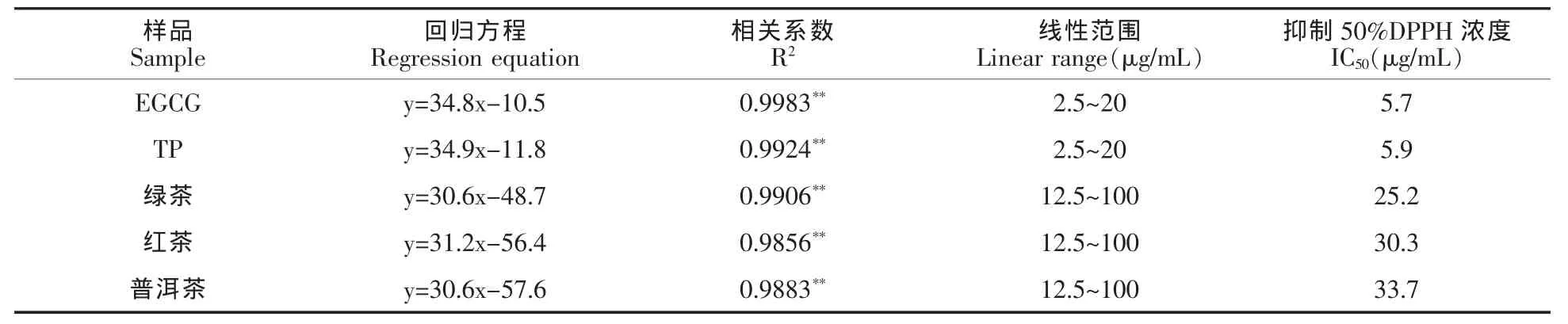
表3 各茶粉清除DPPH 自由基能力Table 3 DPPH-scavenging activity of green tea,black tea and pu-erh tea
2.3 各茶粉对小鼠体重变化的影响
小鼠分组时的体重与实验末期时体重结果见表4。由于小鼠为成龄小鼠,生长缓慢。从表4 中可以看出,各组老鼠在实验末期体重略有下降,但与实验初期比较并无显著性差异(P>0.05),说明各茶粉的灌胃方式未对小鼠产生体重上的影响。

表4 实验期间小鼠体重变化(单位:g)Table 4 Changes of body weight(BW)and BW change of each tested group in experimental period (Unit:g)
2.4 各茶粉对小鼠血清及肝组织中MDA 含量的影响
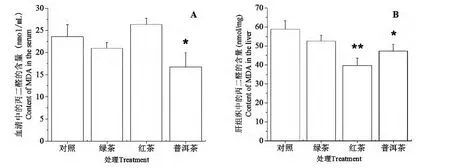
图1 各茶粉对小鼠血清及肝组织中丙二醛含量的影响Fig.1 Effect of green tea,black tea and pu-erh tea on the content of MDA in the serum and liver of rats
由图1A可知,与对照组相比,普洱茶组能显著降低小鼠血清中MDA 含量(P<0.05),绿茶组与红茶组均无显著性差异(P>0.05)。图1B 的结果表明红茶组(P<0.01)与普洱茶组(P<0.05)均能降低小鼠肝组织中MDA 的含量,绿茶组与对照组相比,无显著性差异(P>0.05)。
2.5 各茶粉对小鼠肝组织中SOD 活力的影响
由图2可知,绿茶组与红茶组能提高小鼠肝组织中的SOD 活性,与对照组相比达到极显著差异 (P<0.01),而普洱茶组则对小鼠肝组织中的SOD 活性则具有一定的抑制作用。这三组茶提取物处理对小鼠血清中的SOD 活性与对照组比较无显著性影响。
2.6 各茶粉对小鼠血清及肝组织中GSH-PX 活力的影响
图3A 表明绿茶组与红茶组均能显著提高小鼠血清中GSH-PX 活性,与对照组相比达到极显著差异 (P<0.01),普洱茶组对小鼠血清中GSHPX 活性无显著性影响 (P>0.05)。肝组织中的GSH-PX 活性结果表明(图3B),三类茶组均能提高小鼠肝脏中GSH-PX 活性,与对照组相比,绿茶组与红茶组达到显著差异(P<0.05),普洱茶组则达到极显著差异(P<0.01)。
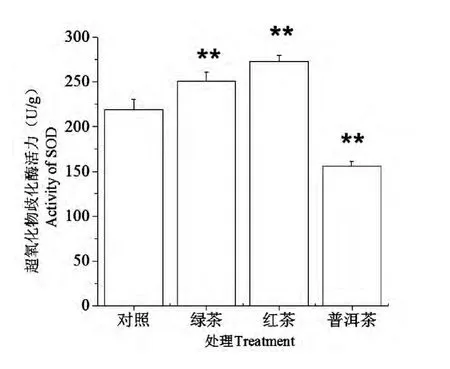
图2 各茶粉对小鼠肝组织中超氧化物歧化酶活力的影响Fig.2 Effect of green tea,black tea and pu-erh tea on the activity of SOD in the liver of rats

图3 各茶粉对小鼠血清及肝组织中谷胱甘肽过氧化物酶活性的影响Fig.3 Effect of green tea,black tea and pu-erh tea on the activity of GSH-PX in the serum and liver of rats
3 讨论
不同的发酵程度影响了绿茶、红茶与普洱茶的多酚组成与含量差异。绿茶杀青加工过程中,利用高温钝化酶的活性,在短时间内制止由酶引起的一系列氧化反应,因此绿茶中多酚类物质主要是未经氧化的儿茶素类。红茶与普洱茶均属于“发酵茶”,二者的化学成分具有一定的相似之处,如具有相当量的没食子酸与未参加多酚氧化反应的GC 等。但由于二者的发酵方式及条件不同,也存在诸多化学成分的差异[12],红茶的多酚类物质还存在一些儿茶素类经酶促氧化(PPO 与POD)或非酶促氧化形成的聚合物如TF 等[13]。普洱茶由于有微生物参与作用,在漫长的温、湿环境下其多酚类的变化更为复杂,且具有一定量的黄酮化合物。在本次研究中,红茶(水提物)有约1%茶黄素,可能是大部分茶黄素已进一步氧化转化为茶红素或茶褐素等物质。普洱茶中大多数儿茶素已被氧化,仅存在一定量的GC(约占水提物的5.4%),且高于绿茶与红茶。尽管普洱茶中多酚的含量比绿茶类少,但用超滤分离法得到的普洱水提物经分析后得出高分子量物质(MW>3000 Daltons)多于50%(w/w),且普洱茶中没食子酸的含量高于绿茶[14]。已有研究报道从云南省普洱茶中分离得到11种化合物分别为GC、EC、C、杨梅素、没食子酸、山奈酚、山奈酚-3-O-beta-D-葡萄糖甙、山奈酚-3-O-芦丁糖甙、槲皮素、槲皮素-3-O-beta-D 葡萄糖甙以及2,5-二羟基苯甲酸,其中确定没食子酸为普洱茶中的主要生物活性成分之一[15-16]。
研究表明茶叶中多酚类化合物清除自由基的能力远超过维生素C 和E 等抗氧化剂[17]。绿茶中的儿茶素具有较强的清除自由基和抗氧化活性[4-5]。红茶在加工过程中由于酶促作用产生的茶黄素与茶红素等也具有较强的抗氧化活性[18]。现有研究报道表明普洱茶提取物在Fenton 反应体系中清除自由基作用,抑制巨噬细胞中脂多糖诱导产生NO 的能力与螯合铁离子作用均强于绿茶、红茶、乌龙茶提取物[19]。此外笔者利用化学发光法和可见分光光度法比较了两类发酵茶红茶与普洱茶水提物在水相和油相中的抗氧化性,结果表明:普洱茶在水相中的抗氧化能力略低于红茶;两类茶水提物对某些油脂具有较好的抗氧化性[20]。本研究结果表明体外清除DPPH 自由基能力大小依次为绿茶>红茶>普洱茶。由此可以看出,抗氧化剂在不同的体系中抗氧化性的强弱也不同,因此需采用不同的抗氧化作用机理的方法在不同的条件下测定,才能全面评价待测物的抗氧化活性。
SOD 与GSH-PX 是机体内清除自由基的重要抗氧化酶,对机体的氧化与抗氧化平衡起着至关重要的作用[11]。本研究结果表明红茶与绿茶均能有效提高SOD 活性,且红茶略高于绿茶,表明了发酵茶中一些未鉴定的物质可能具有绿茶主要活性分子EGCG 相当或更强的功效。然而普洱茶对SOD 活性则起抑制作用,Kuo 等[21]也报道了类似的结果,表明了普洱茶中除了一些功效成分物质外,一些具负面影响的物质也需要受到关注。三种茶对GSH-PX 的活性均有促进作用,且普洱茶对肝组织中的GSH-PX 活性促进作用均强于绿茶与红茶。MDA 是氧自由基攻击生物膜中的不饱和脂肪酸而形成的脂质过氧化物,可反映出机体内脂质过氧化和机体细胞受自由基攻击的损伤程度[11]。研究报道表明当增至一定浓度时,普洱茶水提物抑制脂质过氧化能力强于绿茶与红茶[19,22],这可能解释了在本研究中与对照组相比普洱茶显著降低了MDA 的含量,绿茶则无显著性差异。普洱茶一些特殊保健功能可能与存在的特异多酚类物质如儿茶素的寡聚体等密切相关。曾经报道在普洱茶乙酸乙酯萃取层中分离出的E8 层在清除羟自由基、超氧阴离子的能力及其对H2O2诱导HPF-1 细胞损伤的保护作用均强于EGCG,同时在E8 中未检测到没食子酸、儿茶素及茶黄素[23]。这也表明普洱茶发酵过程中产生的一些未知的高分子量多酚类物质如儿茶素衍生物或聚合物可能具有与EGCG 相当甚至更强的抗氧化功效。因此,有必要从化学组成和结构及抗氧化机理等方面对这些物质进行研究,一方面可以丰富自由基生物医学和茶叶化学的理论,为天然抗氧化剂、特种茶及茶多酚的后续研究与开发提供理论依据;另一方面可以利用这些活性物质研制开发具有我国特色的天然药物和功能食品,使传统的茶叶生产向精深加工领域发展,为振兴华茶和促进国民经济发展作出贡献。
[1]Lin J K,Lin C L,Liang Y C,et al.Survey of catechins,gallic acid, and methylxanthines in green, oolong, pu-erh and black teas[J].Journal of Agricultural and Food Chemistry, 1998, 46(9):3635-3642.
[2]东方,何普明,林智.普洱茶的抗氧化活性研究进展[J].食品科学, 2007, 28(5):363-365.
[3]揭国良,何普明,丁仁凤.普洱茶抗氧化特性的初步研究[J].茶叶, 2005, 31(3):162-165.
[4]杨贤强.茶多酚化学[M].上海:上海科学技术出版社,2003.
[5]宛晓春,主编.茶叶生物化学(第三版)[M].北京:中国农业出版社,2003.
[6]周志宏,杨崇仁.云南普洱茶原料晒青毛茶的化学成分[J].云南植物研究, 2000, 22(3):343-350.
[7]钟萝.茶叶品质理化分析[M].上海:上海科技出版社,1989:258-261,303-304.
[8]Liang Y R,Lu J L,Zhang L Y.Comparative study of cream in infusions of black tea and green tea[Camellia sinensis (L.)O.Kuntze][J].International Journal of Food Science&Technology,2002, 37(6):627-634.
[9]Tu Y Y,Xu X Q,Xia H L,et al.Optimization of theaflavin biosynthesis of tea polyphenols using an immobilized enzyme system and response surface methodology[J].Biotechnology Letters, 2005, 27(4):269-274.
[10]Zhu Q Y,Robert M H,Jodi L E,et al.Antioxidative activities of oolong tea[J].Journal of Agricultural and Food Chemistry,2002, 50(23):6929-6934.
[11]凌关庭.抗氧化食品与健康[M].北京:化学工业出版社,2004.
[12]朱旗,Clifford M N,毛清黎,等.LC-MS 分析普洱茶与红茶成分的比较研究[J].茶叶科学,2006,26(3):191-194.
[13]邵宛芳,Clifford M N,Powell C.红茶及普洱茶主要成份差异的初步研究[J].云南农业大学学报,1995,10(4):285-292.
[14]Lu C H,Hwang L S.Safety,biological activity and the active components of Pu-er tea [C]//International Tea Symposium,2005:272-279.
[15]吕海鹏.普洱茶的化学成分分析及其抗氧化活性的研究[D].北京:中国农业科学院,2005.
[16]林智,吕海鹏,崔文锐,等.普洱茶的抗氧化酚类化学成分的研究[J].茶叶科学, 2006, 26(2):112-116.
[17]Kaufmann J A,Bickford P C,Taglialatela G.Free radicaldependent changes in constitutive nuclear factor kappa B in the aged hippocampus J.Neuroreport, 2002, 13(15):1917-1928.
[18]Luczaj W,Skrzydlewska E.Antioxidative properties of black tea J.Preventive Medicine, 2005, 40(6):910-918.
[19]Duh P D,Yen G C,Yen W J,et al.Effects of Pu-erh tea on oxidative damage and nitric oxide scavenging[J].Journal of Agricultural and Food Chemistry, 2004, 52(26):8169-8176.
[20]东方,揭国良,陈飞,等.普洱茶与红茶抗氧化特性比较研究[J].茶叶, 2006, 32(4):202-205.
[21]Kuo K L, Weng M S, Chiang C T, et al.Comparative studies on the hypolipidemic and growth suppressive effects of oolong,black, pu-erh, and green tea leaves in rats[J].Journal of Agricultural and Food Chemistry, 2005, 53(2):480-489.
[22]Lin Y S, Tsai Y J, Tsay J S, et al.Factors affecting the levels of tea polyphenols and caffeine in tea leaves[J].Journal of Agricultural and Food Chemistry, 2003, 51(7):1864-1873.
[23]Jie G L, Lin Z, Zhang L Z, et al.Free radical scavenging effect of pu-erh tea extracts and their protective effect on oxidative damage in human fibroblastcells[J].Journal of Agricultural and Food Chemistry, 2006, 54(21):8058-8064.
