液-质联用分析金线莲中4种黄酮类化合物
2015-12-19黄丽萍黄丽英林守二俞晓玲
黄丽萍,黄丽英,林守二,俞晓玲
金线莲(Anoectochilusroxburghii,A.roxburghii)系兰科开唇兰属草本植物,主要分布于亚洲的中国、日本、斯里兰卡和印度等国,在中国以福建、浙江为主产地,素有“神药”、“金草”、“药王”等美称,具有清热凉血解毒、固肾平肝、降血糖、降血压和消炎等功效,民间多用于治疗糖尿病、高血压、乙型肝炎等疾病[1-7]。据报道,金线莲中含有甾体化合物、糖苷类化合物、有机酸、黄酮类及黄酮苷类化合物、生物碱和核苷类物质等[8-14]。
黄酮类化合物广泛分布于植物界中,是许多中药的有效成分,具有抗菌消炎、扩张冠状动脉、防治高血压及脑出血等多方面的生物活性[15]。异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素和异鼠李素是中药中常见的黄酮类化合物[15],其中异鼠李素-3-O-新橙皮糖苷具有强烈的刺激动脉内皮细胞产生前列环素和组织多肽抗原(tissue polypeptide antigen,tPA)的活性,同时对家兔体内、外血小板聚集功能有明显的抑制作用[16];异槲皮苷具有一定的抗氧化、抗肿瘤和抗血小板凝集作用及抗抑郁作用[17-18];槲皮素具有抗氧化及清除自由基的作用,还具有抗癌、抗炎、抗菌、抗病毒、降糖降压、免疫调节及心血管保护作用等[19];异鼠李素具有止咳祛痰、消食化滞和活血散瘀等作用[20]。
笔者应用反相高效液相色谱(reverse phasehigh performance liquid chromatography,RP-HPLC)法梯度洗脱测定金线莲中上述的4种具有重要药理活性的黄酮类物质,电喷雾电离/离子阱质 谱 法 (electro-spray ionization/ion trap mass spectrometry,ESI/MS)对提取物中这4种黄酮类化合物进行鉴别,首次发现金线莲中含有异鼠李素-3-O-新橙皮糖苷,为金线莲的药理作用提供物质基础和佐证。
1 材料与方法
1.1 材料
1.1.1 药材 金线莲干燥全草(福州同春药业有限公司),产地广西和福建,经福建医科大学药学院天然药物化学系张永红教授鉴定。
1.1.2 试剂 异鼠李素-3-O-新橙皮糖苷(批号:111571-200402,中国药品生物制品检定所);异槲皮苷(批号:43089,阿拉丁试剂公司);槲皮素(批号:1216002,阿拉丁试剂公司);异鼠李素(批号:35961,阿拉丁试剂公司);甲醇(色谱纯)、乙酸(分析纯)、氨水(分析纯)(国药集团化学试剂有限公司);实验用水皆为实验室自制二次蒸馏水。
1.1.3 仪器 倾倒式粉碎机(DJ-10A,上海淀久中药机械制造有限公司);旋转蒸发仪(RE-52AA)、自动三重纯水蒸馏器(SZ-97)(上海亚荣生化仪器厂);紫外可见分光光度计(752PC,上海光谱仪器有限公司);电子天平(BS 110S,北京塞多利斯仪器系统有限公司);医用数控超声清洗器(KQ-250DE,昆山市超声仪器有限公司);HPLC-MSD高效液相色谱-质谱联用仪(1200型)、Agilent TC-C18色谱柱(4.6mm×250mm,5μm)(美国 Agilent公司);高效液相色谱仪(LC-20A,日本岛津公司);循环水式多用真空泵(SHB-III,郑州长城科工贸有限公司);低速多管离心机(80-2型,常州国华电器有限公司)。
1.2.1 色谱条件色谱柱:Agilent TC-C18柱(250mm×4.6mm,5μm);流动相:A 为0.8%乙酸+0.2%氨水溶液,B为甲醇;流速:1.0mL/min;梯度洗脱:0~10min,50%~58%B,10~30min,65%B;检测波长368nm,柱温30℃,进样量20μL。
1.2.2 质谱条件 离子源为电喷雾离子源(ESI源),正离子监测,ESI(+);喷雾气和干燥气都是氮气,帘气(喷雾气):30psi;碰撞气(CAD)流速15mL/min;源喷射电压(IS):4000V;源温度(TEM):350℃;加热气(GS2):60psi。扫描范围:异鼠李素-3-O-新橙皮糖苷的质荷比(m/z)为50~700;其他3种物质为50~500。
1.2.3 对照品溶液的配制 分别精确称取异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素、异鼠李素对照品0.010 0,0.010 0,0.010 5,0.010 0g,用少量甲醇超声溶解后定容至10mL容量瓶中,异鼠李素定容至50mL容量瓶中,制得浓度分别为1.00,1.00,1.05,0.20mg/mL对照品储备液,于4 ℃冰箱保存,备用。临用时稀释成系列标准溶液。
1.2.4 供试品溶液的配制 精确称取金线莲样品1g,置小烧杯中,用20mL甲醇超声萃取30min,提取温度为45℃,3 000r/min离心10min,取上清液。滤渣重复提取2次,合并上清液,置于50℃旋转蒸发仪减压浓缩,浓缩萃取液少量多次用甲醇溶解,并定容于5mL容量瓶中,即得供试品溶液,待测。
1.2.5 精密度试验 取混合对照品溶液(其中异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素、异鼠李素浓度分别为50,40,42,50μg/mL)在上述色谱条件下,重复进样3次,测其峰面积。
1.2.6 稳定性试验 吸取同一供试品溶液,分别于0,2,4,8,12,24h进样,测待测组分的峰面积。
1.2.7 重现性试验 按供试品溶液制备方法制备5份供试品溶液,分别进样20μL,按上述色谱条件测定峰面积。
3.3 记忆力 记忆力主要指识记、保持、再认识、重现客观事物所反映出来的内容及经验的能力,其是认知功能研究的重要方面,良好的睡眠可有效促进新记忆的保存及巩固,而失眠患者往往受到睡眠缺失的影响,无法进行正常的记忆巩固,导致失眠患者的记忆能力受损,通常表现为记忆巩固功能受损、学习能力下降、长时记忆受损等。失眠患者对记忆的保存及整合能力受损的主要因素是慢波睡眠减少,而快速动眼期在失眠患者的记忆巩固中发挥重要作用。许良和王博[21]对1 954例失眠患者进行调查,结果发现伴有记忆力减退的患者约占80.71%。
1.2.8 加样回收率试验 精确称取12份已知含量的金线莲样品,平分为4组,按高、中、低水平分别精密加入4种黄酮物质的标准品溶液,按样品溶液制备的方法操作及前述色谱条件测定峰面积。
2 结 果
2.1 标准溶液和金线莲提取物的HPLC-UV分析
在上述选择的色谱条件下,采用UV法得到4种黄酮类混合标准品、金线莲超声萃取物的HPLC分离的色谱图。图1为标准品的色谱图,其中异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素、异鼠李素的保留时间分别为6.534,7.913,14.498,18.622min。根据色谱的保留时间和加入标准品于样品中,样品中对应标准品相应保留时间处峰高增高,图2中1~4号峰初步鉴定为异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素和异鼠李素。

图1 混合对照品的色谱图Fig 1 Chromatograms of mixing standard solution
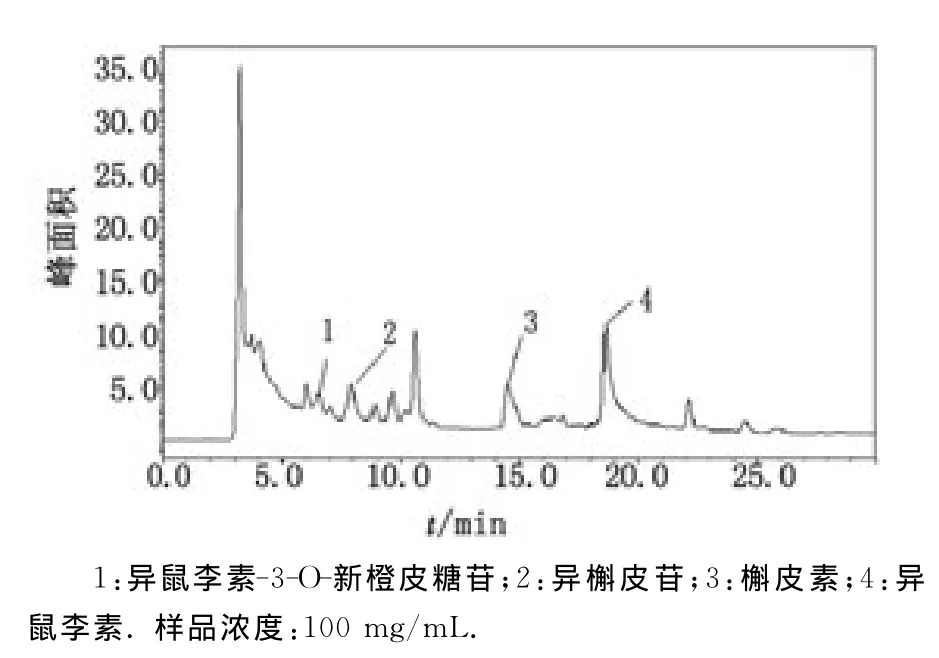
图2 样品的色谱图Fig 2 Chromatograms of the sample
2.2 LC-MS分析 在上述1.2.2质谱条件下,对异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素、异鼠李素对照品和保留时间分别6.534,7.913,14.498和18.622min样品的色谱峰进行质谱分析,对照品质谱图见图3。金线莲超声提取物色谱图对应1~4号色谱峰的ESI/MS质谱图见图4,4种黄酮主要二级质谱碎片归属见表1。

图3 异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素、异鼠李素对照品的电喷雾离子源质谱图Fig 3 ESI/MS of isorhamnetin-3-O-neohesperidoside and isoquercitrin and quercetin and isorhamnetin standard substance

图4 样品中异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素、异鼠李素的电喷雾离子源质谱图Fig 4 ESI/MS of isorhamnetin-3-O-neohesperidoside and isoquercitrin and quercetin and isorhamnetin in sample
基于质谱的m/z值推断,异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素、异鼠李素的可能裂解途径见图5。
2.3 标准曲线的制备及线性关系的考察 分别精密移取上述储备液各1.0mL(异鼠李素5.0mL)于10mL容量瓶中,用甲醇稀释到刻度,混匀配成混合标准品溶液,各浓度依次为100,100,105,100μg/mL。按等比对半稀释原则分别置于10mL的容量瓶中,甲醇定容,得到一系列混合对照品溶液(浓度见表2),在上述色谱条件下进样20μL,测定3次,得峰面积平均值。以峰面积为纵坐标y,对照品浓度为横坐标x(μg/mL),进行线性回归,分别绘制标准曲线,并计算回归方程,结果见表3。
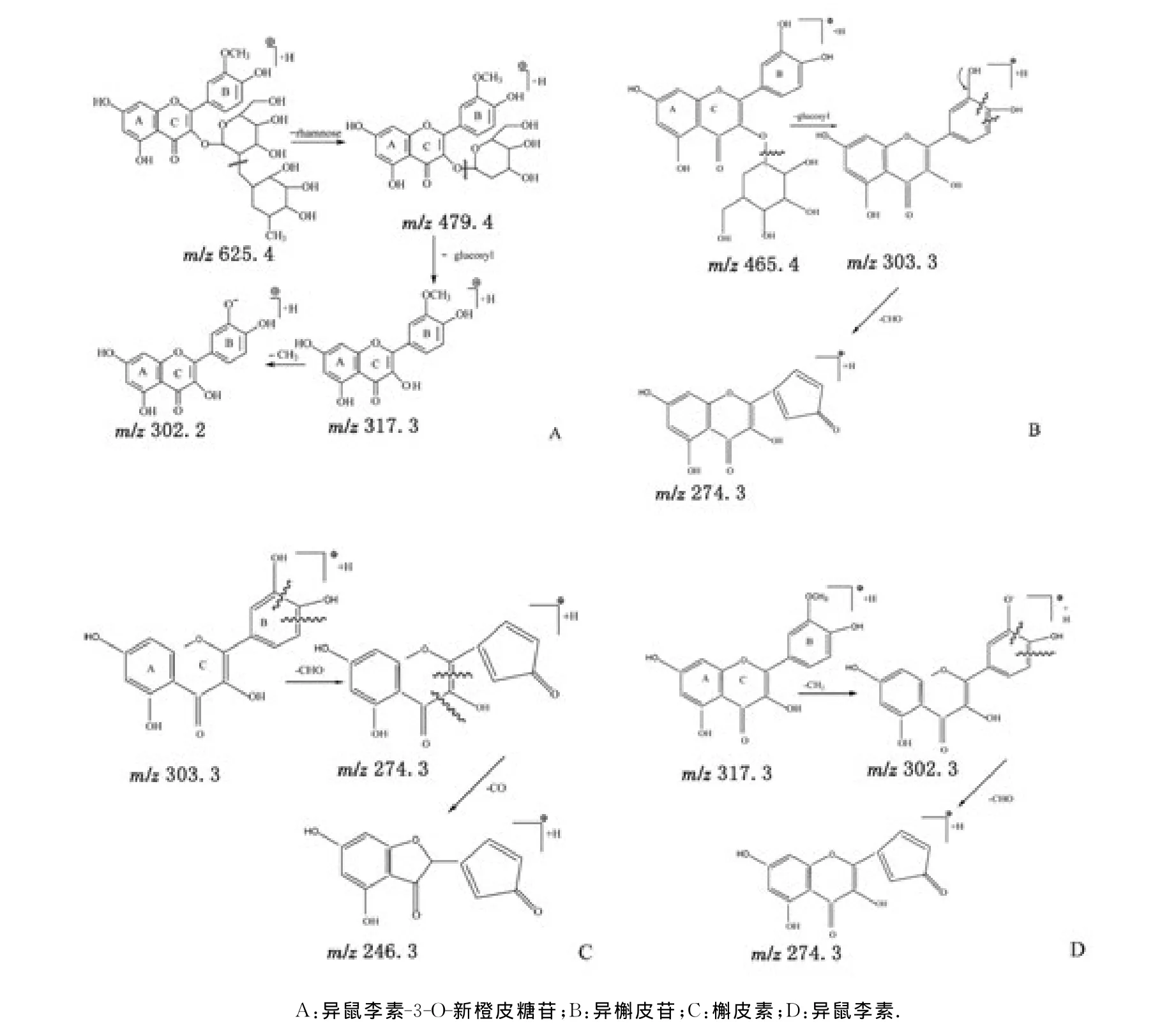
图5 异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素、异鼠李素裂解途径Fig 5 A tentative pathway for the mass spectral fragmentation of sorhamnetin-3-O-neohesperidoside and isoquercitrin and quercetin and isorhamnetin

表1 4种黄酮主要二级质谱碎片归属Tab 1 The second class mass spectrum relegation of the four kinds of flavonoids
2.4 方法学考察
2.4.1 精密度试验 测得异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素和异鼠李素峰面积的相对标准偏差 (RSD)分 别 为 3.51%,2.92%,2.69% 和2.06%。
2.4.2 稳定性试验 测得异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素和异鼠李素峰面积的RSD分别为2.64%,2.12%,2.83%和2.89%,表明供试品溶液在24h内稳定性良好。
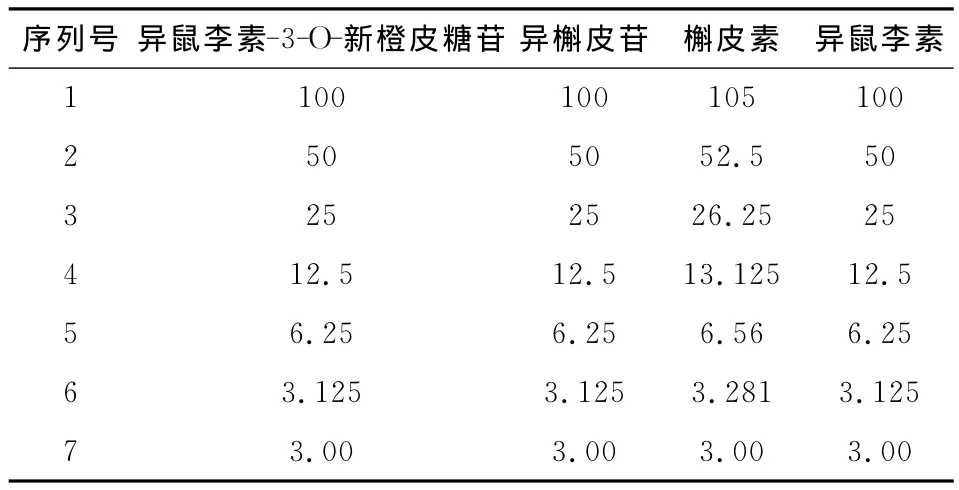
表2 系列混合对照品溶液浓度Tab 2 Series of mixed reference solution concentration table μg/mL

表3 4种组分的回归方程、相关系数和线性范围Tab 3 Regression equation,correlation coefficient and linear range of the four constituents
2.4.3 重现性试验 测得异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素和异鼠李素峰面积的RSD分别为1.58%,2.67%,2.35%,2.94%。
2.4.4 加样回收率试验 测得异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素和异鼠李素的平均回收率分别为94.26%,95.86%,96.31%,95.46%;RSD分别为0.87%,0.80%,0.95%,1.27%。
2.5 样品测定 取福建和广西2个产地金线莲细粉,按供试品溶液制备方法各制备5份供试品溶液,按上述色谱条件进样测定峰面积,以外标法计算含量,测得异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素和异鼠李素含量分别为福建产地0.094,0.053,0.039 和 0.070mg/g,广 西 产 地0.089,0.067,0.042和0.061mg/g。
3 讨 论
3.1 检测波长的选择 异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素、异鼠李素的标准品分别溶于甲醇中,用紫外可见分光光度计,在200~400nm的波长范围内进行扫描,4种物质有2个吸收峰,峰位分别在254和368nm附近。检测波长设定在254nm时,样品峰多,干扰组分的测定,检测波长为368nm时,各组分与干扰能很好分开,所以实验时确定最佳检测波长为368nm。
3.2 流动相及梯度洗脱条件的选择 为了得到较好的色谱图和适宜的出峰时间,曾比较不同体系或比例的流动相,实验表明,乙腈-水体系分离效果较差,很难将所测的4种黄酮类物质分开;甲醇-水体系可以基本将所测的4种黄酮类物质分开,但是异鼠李素-3-O-新橙皮糖苷、异槲皮苷分离度不高且槲皮素、异鼠李素峰形不好,难以使两者达到较好的检测水平,所以采用梯度洗脱并加入乙酸调节pH能得到较好的峰形和分离度,经比较0.6%乙酸和0.8%乙酸,发现0.8%乙酸并加入0.2%氨水最适宜,再进一步以甲醇和0.8%乙酸与0.2%氨水作流动相进行流动相配比试验,最终选定的方案为0~10min,50%~58%B;10.01~30min,65%B,分离度较好,保留时间和峰形都较佳。异鼠李素-3-O-新橙皮糖苷与异槲皮苷、异槲皮苷与槲皮素、槲皮素与异鼠李素的分离度分别为1.74,4.76,1.98,此时这4种黄酮类物质可以完全分离。
3.3 提取条件的选择 本实验通过甲醇和乙醇超声提取,表明甲醇超声提取率较乙醇高。而用甲醇回流和甲醇超声其提取率相当,但考虑到超声提取实验较简便,则选择甲醇超声提取法提取金线莲中4种黄酮类化合物。
3.4 质谱定性 基于m/z值、色谱保留时间、对照品和文献数据进行比较和分析[21-24],图2中1~4号峰分别鉴定为异鼠李素-3-O-新橙皮糖苷、异槲皮苷、槲皮素、异鼠李素。
综上所述,不同产地金线莲中这4种具有重要药理活性黄酮类化合物含量的差异不大,为金线莲的药理作用和开发应用的研究提供实验方法和理论基础。
[1]蔡文燕,肖华山,范秀珍.金线莲研究进展[J].亚热带植物科学,2003,32(3):68-72.
[2]Shyur L F,Chen C H,Loa C P,etal.Induction of apoptosis in MCF-7human breast cancer cells by phytochemicals from Anoectochilus formosanus[J].BiomedSci,2004,11:928-939.
[3]陈少卿,张桂才,李泽贤,等.广东药用植物手册[M].广州:广东人民出版社,1982:720.
[4]Takuya K,Naoto I,Yasuhiro K,etal.Antioxidant flavonol glycosides in mulberry(Morus alba L.)leaves isolated based on LDL antioxidant activity[J].FoodChemistry,2006,9(7):25-31.
[5]Shyur L F,Yang N S,Chen C H,etal.Use of Anoectochilus formosanus plant extracts and their derived fractions herbal medicines or nutraceut-ical supplements for chemoprevention or treatment of human malignancis[J].USPatApplPubl,2004,25(10):424.
[6]鲁成巍,冉景丞.金线莲研究进展及保护利用研究[J].农技服务,2010,27(8):1040-1042.
[7]王 航.金线莲有效成分的降血糖作用及其机制的研究[J].海峡药学,2009,21(12):46-48.
[8]Du X M,Ning Y,Nobuto I,etal.Glycoside constituents from Anoectochilus formosanus [J ].Chemical & PharmaceuticalSciences,2000,48(11):1803-1804.
[9]Wang S Y,Kuo Y H.Profiling and characterization antioxidant activities in Anoectochilus formosanus Hayata [J].J AgriFoodChem,2002,50(7):1859-1865.
[10]曹扬远,朱壁洁,王 勇,等.RP-HPLC测定金线莲超声-微波协同萃取物中3种活性成分的含量[J].中国现代药物应用,2007,1(5):1-3.
[11]张婷婷,周劲松,王 强.HPLC法测定柴胡属植物地上部分黄酮含量(Ⅲ)[J].中国天然药物,2010,8(2):107-113.
[12]何春年,王春兰,郭顺星,等.福建金线莲的化学成分研究[J].中国药学杂志,2005,40(8):581-583.
[13]何春年,王春兰,郭顺星,等.福建金线莲的化学成分研究(Ⅲ)[J].天然产物研究与开发,2005,17(3):259-262.
[14]吴萍萍.金线莲活性物质分析及药材质量评价[D].福州:福建医科大学,2013.
[15]吴立军,吴继洲,王锋鹏,等.天然药物化学[M].5版.北京:人民卫生出版社,2007:169-180.
[16]李志浩,孙新建,瞿京红,等.高效液相色谱法测定复方蒲黄片中香蒲新苷与异鼠李素-3-O-新橙皮糖苷含量[J].医药导报,2012,31(4):503-505.
[17]Feng S L,He L,Wang M,etal.Studies on the chemical constituents of flower of David Lily[J].ChinaJChineseMaterMed,1994,(9):611.
[18]张利斌,张晓庆,李玉平.异槲皮苷抗抑郁作用实验研究[J].药学实践杂志,2011,29(4):272-273.
[19]孙 涓,余世春.槲皮素的研究进展[J].现代中药研究与实践,2011,25(3):85-87.
[20]唐光明,柯立坚.HPLC法测定蒲黄片中异鼠李素的含量[J].中国药事,2008,22(8):678-694.
[21]马红飞.蒲黄炒炭化学成分研究[D].北京:北京中医药大学,2005.
[22]孙 兰,余竞光,周立东,等.中药砂仁中的黄酮苷化合物[J].中国中药杂志,2002,27:36-38.
[23]张淑敏,曲桂武,解飞霞,等.蒲黄化学成分研究[J].中草药,2008,39(3):351-354.
[24]杨念云,段金戚,李 萍,等.金钱草中黄酮类化合物的分离与结构鉴定[J].中国药学杂志,2006,41(21):1621-1625.
