异鼠李素抗UUO大鼠肾脏纤维化作用及机制
2021-11-26李艺文唐志书宋忠兴王昌利马虎强
李艺文, 唐志书*, 张 珍*, 宋忠兴, 王昌利,2, 马虎强
[1.陕西中医药大学,陕西省中药资源产业化省部共建协同创新中心/秦药特色资源研究开发国家重点实验室(培育)/陕西中药产业技术研究院,陕西 咸阳 712083;2.内蒙古海天制药有限公司,内蒙 通辽 028000]
肾脏纤维化是所有慢性肾脏病病变发展至终末期肾脏疾病的最后共同通路,是慢性肾脏病的主要病理基础。目前临床上用于治疗的一线药物主要有血管紧张素转换酶抑制剂(ACEI)和血管紧张素受体拮抗剂(ARB)等,尽管有这些药物,但是仍不能有效阻止肾纤维化发生发展,还会出现一系列的不良反应,如ACEI所致咳嗽和严重的高血钾症等[1]。因此,寻找有效减缓肾脏纤维化进程的活性成分已成为抗肾脏纤维化治疗的关键。
异鼠李素是从银杏、沙棘等药用植物中分离提纯的黄酮类化合物,研究表明,异鼠李素具有广泛的药理作用,在治疗心脑血管疾病、抑制脂肪细胞分化、抗病毒、抗炎、耐缺氧、降糖等方面扮演了较为重要的角色[2]。近年来,有关异鼠李素的研究越来越多。Yang等[3]发现异鼠李素通过抑制TGF-β/Smad信号转导和减少氧化应激,从而减缓肝脏纤维化;Zheng等[4]发现异鼠李素通过抑制内质网应激和上皮细胞-间充质转化(EMT)的形成保护争光霉素诱导的肺纤维化;Liu等[5]人发现异鼠李素通过TGF-β1/Smad3和TGF-β1/p38 MAPK通路抑制自噬和细胞外基质(ECM)的形成进而抑制肝脏纤维化,也有研究报道异鼠李素可减轻小鼠非酒精性脂肪肝炎引起的脂肪变性和肝脏纤维化[6]。异鼠李素具有抗肺纤维化和肝纤维化的作用,那么是否具有抗肾脏纤维化的作用研究还未见报道,本研究建立单侧输尿管梗阻(unilateral ureteral obstructive,UUO)大鼠肾脏纤维化和NRK-52E细胞纤维化模型,从体内和体外研究了异鼠李素对肾脏纤维化的作用及其机制。
1 材料
1.1 细胞株 大鼠肾小管上皮细胞NRK-52E,购自中国科学院上海生命科学研究院细胞研究所。
1.2 动物 雄性SD大鼠,体质量(200±10)g,购自成都达硕实验动物有限公司,动物生产许可证号SCXK(川)2020-030。
1.3 试剂与药物 异鼠李素对照品,中国食品药品检定研究院(批号110860-2016115,纯度99.8%)。血管紧张素Ⅱ(批号4474-91-3),购自美国Medcham Express公司;α-SMA、E-cadherin、Connexin 43(货号14968s、14472s、3512s),购自美国Cell Signaling Technology公司;β-actin(货号361438ws),购自美国CMCTAG公司;TGF-β1(货号21898-1-AP),购自美国Proteintech公司;山羊抗小鼠二抗、山羊抗兔二抗(HRP标记,货号102618190226、121918190213),购自上海碧云天生物技术有限公司;ROS/超氧化物检测试剂盒,购自美国Enzo Life Sciences公司;内源性H2S检测试剂盒(货号A146-1-1),购自南京建成生物工程研究所。
1.4 仪器 311型细胞培养箱(美国Thermo公司);SW-CJ-2FD型超净工作台(江苏苏净集团有限公司);DSZ2000X型倒置显微镜(重庆澳浦光电技术有限公司);LD5-2A型低速离心机(北京雷博尔离心机有限公司);Thermo Multiskan GO多功能酶标仪(美国Thermo公司);Western blot曝光仪器ChemiDoc XRS+(美国Bio-Rad公司)。
2 方法
2.1 造模、分组及给药 造模组用1%戊巴比妥钠(35 mg/kg)麻醉大鼠,在腹部左侧切口,分离左侧输尿管,输尿管在近端中上1/3处双结扎,然后在2个结扎处之间将输尿管剪断,最后逐层缝合腹腔;假手术组只需将输尿管分离出来,不进行结扎和剪断输尿管操作。实验分为假手术组、UUO组、依那普利+UUO组、异鼠李素(10、30 mg/kg)+ UUO组,每组10只,手术前3天给药,术后连续给药2周。
2.2 取材 术后2周,用1%戊巴比妥钠(35 mg/kg)麻醉大鼠,摘除眼球采血,分离血清,密闭保存于-80 ℃冰箱。摘取肾脏,除去肾包膜,用4 ℃生理盐水冲洗,从中间纵切,1/2固定于4%多聚甲醛缓冲液,1/2制备蛋白匀浆。
2.3 肾组织形态学观察
2.3.1 肾脏皮质厚度测量 将固定后的1/2肾脏取出,观察UUO导致大鼠肾脏大小和肾盂扩张情况,肾脏纵切面测量肾皮质厚度。
2.3.2 Masson染色 大鼠肾组织用4%多聚甲醛缓冲液固定24 h,石蜡包埋、切片,进行Masson染色。观察肾小管扩张、管型形成和间质细胞外基质沉积,并采用Image J软件对胶原纤维的蓝色阳性染色进行定量分析。
2.3.3 免疫组化 石蜡切片脱蜡、水化后,置于枸橼酸缓冲液中煮沸15 min,置3% H2O2中灭活,3% BSA室温封闭1 h,孵育α-SMA一抗,置于4 ℃冰箱中过夜,室温孵育二抗1 h,按DAB显色试剂盒说明配制显色液,滴加后镜下控制反应时间,洗涤、苏木素复染、脱水、透明、封片,阳性表达呈棕黄色或深棕色染色。采用Image J软件,对阳性表达进行定量分析。
2.4 细胞培养 NRK-52E细胞置于含5%胎牛血清的高糖DMEM培养基中,加入双抗(青霉素100 U/mL、链霉素0.1 mg/mL),置于37 ℃、5% CO2饱和湿度培养箱内常规培养。
2.5 细胞增殖检测 取对数生长期NRK-52E细胞,以2.5×108/mL密度接种在96孔培养板中,培养24 h至细胞贴壁并长满。加入异鼠李素(0、1、2.5、5、10、25、50 μmol/L),72 h后每孔加入10 μL CCK-8检测溶液,显色后采用多功能酶标仪在450 nm处检测各孔吸光度,进行统计分析。
2.6 Western blot检测 将细胞接种于12孔培养板中,长满后加药刺激,刺激结束后加入含蛋白酶抑制剂的RIPA裂解液,提取总蛋白,采用BCA试剂盒定量,取50 μg蛋白样品,经10%SDS-PAGE电泳、转膜、封闭,一抗4 ℃过夜,PBST洗膜,加入二抗,孵育1 h,洗膜后ECL发光试剂显影,凝胶成像系统拍照。采用Image J软件,对所得条带进行定量,以β-actin为内参,实验重复3次。
2.7 血清H2S水平检测 取600 μL血清,按照内源性H2S检测试剂盒说明操作,显色后在665 nm波长处检测吸光度,并进行统计分析。
2.8 活性氧、超氧化物水平检测 将细胞接种于96孔培养板中,长满后加药刺激24 h,加入活性氧(ROS)检测试剂(绿色)或超氧化物检测试剂(橙色)与细胞孵育20 min,按照试剂盒说明书进行后续操作,在荧光显微镜下拍照。采用多功能酶标仪,检测ROS(490/525 nm)、超氧化物(550/620 nm)水平。

3 结果
3.1 异鼠李素改善UUO大鼠肾组织形态和皮质厚度 表1、图1显示,UUO大鼠肾脏增大、肾盂扩张、皮质变薄,在造模第14天更明显;给予异鼠李素干预后,可显著改善大鼠肾脏形态和皮质厚度(P<0.01)。

表1 异鼠李素对UUO大鼠肾脏皮质厚度的影响
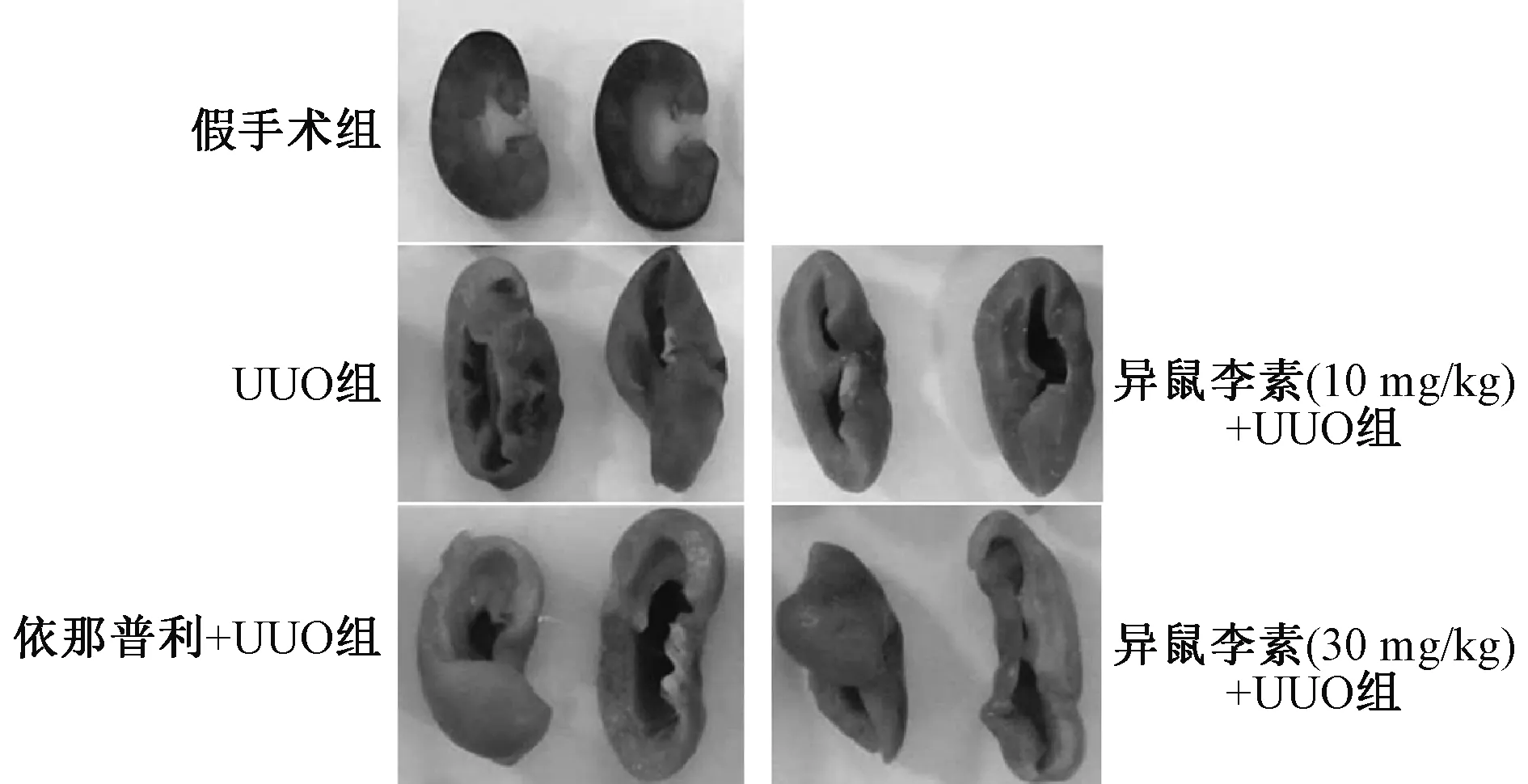
图1 异鼠李素对UUO大鼠肾脏形态的影响
3.2 异鼠李素减少UUO大鼠胶原纤维的沉积 图2显示,与假手术组比较,UUO组大鼠肾脏胶原纤维大量沉积(P<0.01),表明造模成功;与UUO组比较,异鼠李素高、低剂量组大鼠胶原纤维减少(P<0.01),其中高剂量组效果优于依那普利组(P<0.05)。

注:a~e分别为假手术组、UUO组、依那普利组、异鼠李素(10 mg/kg)组、异鼠李素(30 mg/kg)组。与假手术组比较,##P<0.01;与UUO组比较,**P<0.01;与依那普利组比较,◆P<0.05。
3.3 异鼠李素抑制UUO大鼠α-SMA蛋白表达 图3显示,与假手术组比较,UUO组大鼠肾脏组织α-SMA表达升高(P<0.05);与UUO组比较,异鼠李素高、低剂量组大鼠肾脏组织α-SMA表达降低(P<0.05),其中高剂量组效果优于依那普利组(P<0.05)。

注:a~e分别为假手术组、UUO组、依那普利组、异鼠李素(10 mg/kg)组、异鼠李素(30 mg/kg)组。与假手术组比较,#P<0.05;与UUO组比较,*P<0.05;与依那普利组比较,◆P<0.05。
3.4 异鼠李素升高UUO大鼠血清H2S水平 图4显示,与假手术组比较,UUO组大鼠血清H2S水平下降(P<0.01);与UUO组比较,异鼠李素组大鼠血清H2S水平上升(P<0.05)。
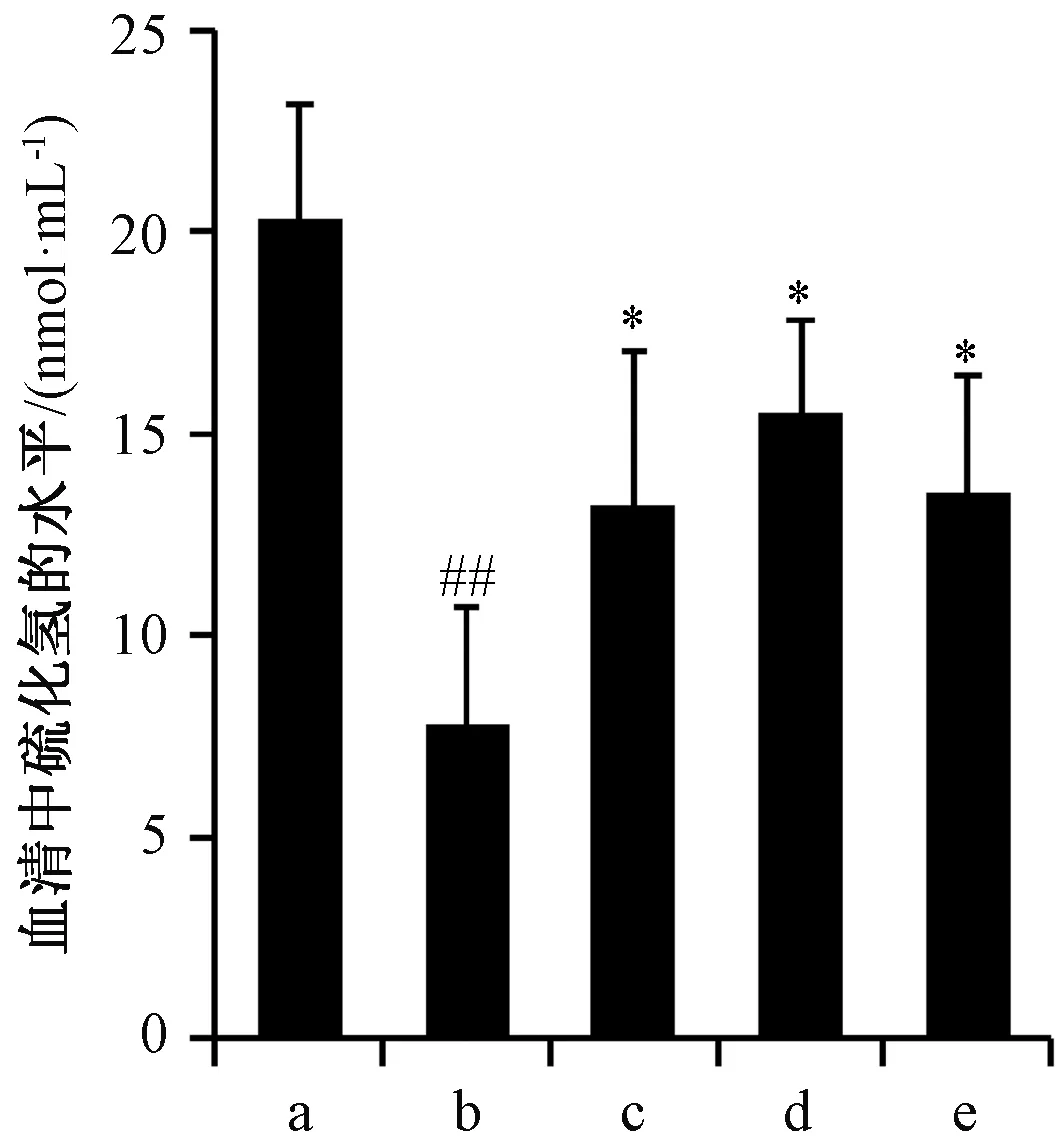
注:a~e分别为假手术组、UUO组、依那普利组、异鼠李素(10 mg/kg)组、异鼠李素(30 mg/kg)组。与假手术组比较,##P<0.01;与UUO组比较,*P<0.05。
3.5 异鼠李素抑制UUO大鼠NRK-52E细胞的增殖 图5显示,与对照组比较,2.5~50 μmol/L异鼠李素对UUO大鼠NRK-52E细胞有抑制作用(P<0.05,P<0.01),在50 μmol/L下最明显。

注:与对照组(异鼠李素0 μmol/L)比较,*P<0.05,**P<0.01。
3.6 异鼠李素抑制NRK-52E细胞上皮细胞-间充质转化的形成 图6A~6C显示,不同浓度(1.0×10-9、1.0×10-8、1.0×10-7mol/L)AngⅡ能升高α-SMA表达,降低E-cadherin表达(P<0.05,P<0.01),表明模型建立成功;图6D~6F显示,10、25、50 μmol/L异鼠李素干预后,可抑制α-SMA表达升高、E-cadherin表达降低(P<0.01);图6G~6H显示,异鼠李素能降低TGF-β1表达(P<0.01)。

注:与血管紧张素Ⅱ(0 μmol/L)组比较,#P<0.05,##P<0.01。a~d分别为血管紧张素Ⅱ(1.0×10-8 mol/L)组、血管紧张素Ⅱ(1.0×10-8 mol/L)+异鼠李素(10 μmol/L)组、血管紧张素Ⅱ(1.0×10-8 mol/L)+异鼠李素(25 μmol/L)组、血管紧张素Ⅱ(1.0×10-8 mol/L)+异鼠李素(50 μmol/L)组。与a组比较,*P<0.05,**P<0.01。
3.7 异鼠李素降低NRK-52E细胞活性氧水平 图7显示,异鼠李素干预24 h后可抑制ROS的产生(P<0.05,P<0.01),并呈剂量依赖性,但对超氧化物水平无明显影响(P>0.05)。

注:A为细胞活性氧和超氧化物荧光染色,B为细胞活性氧水平,C为细胞超氧化物水平,a~d分别为血管紧张素Ⅱ(1.0×10-8 mol/L)组、血管紧张素Ⅱ(1.0×10-8 mol/L)+异鼠李素(10 μmol/L)组、血管紧张素Ⅱ(1.0×10-8 mol/L)+异鼠李素(25 μmol/L)组、血管紧张素Ⅱ(1.0×10-8 mol/L)+异鼠李素(50 μmol/L)组。与a组比较,*P<0.05,**P<0.01。
4 讨论
在肾脏纤维化进展过程中,许多细胞因子和信号通路参与其中,其中TGF-β1在纤维化的进展中起关键作用。TGF-β1主要介导TGF-β1/Smads和非Smad信号通路的激活,从而引起EMT的形成,它的形成表现为上皮标志物E-cadherin表达下降,肌成纤维细胞标志α-SMA表达增加,使系膜细胞和肾小管上皮细胞等转化成肌成纤维细胞,最终导致ECM进行性积聚,而ECM的降解减少,将导致肾小球硬化、肾小管间质纤维化,最终导致肾功能丧失[1,7]。
3.8 异鼠李素抑制NRK-52E细胞中Cx43的表达 图8显示,异鼠李素能抑制细胞间隙连接蛋白Cx43表达(P<0.05),并呈剂量依赖性。

注:a~d分别为血管紧张素Ⅱ(1.0×10-8 mol/L)组、血管紧张素Ⅱ(1.0×10-8 mol/L)+异鼠李素(10 μmol/L)组、血管紧张素Ⅱ(1.0×10-8 mol/L)+异鼠李素(25 μmol/L)组、血管紧张素Ⅱ(1.0×10-8 mol/L)+异鼠李素(50 μmol/L)组。与a组比较,*P<0.05。
肾脏纤维化是所有慢性肾脏病主要病理基础,本研究建立经典的大鼠UUO模型,通过单侧结扎大鼠输尿管,造成一个典型的肾间质纤维化病理变化。异鼠李素给予干预,结果表明异鼠李素抑制UUO大鼠肾脏组织中胶原纤维的形成和α-SMA的表达,其中异鼠李素高剂量(30 mg/kg)组效果强于异鼠李素低剂量(10 mg/kg)组,且高、低剂量组效果均强于阳性药依那普利(10 mg/kg),提示异鼠李素可有效抑制EMT的形成和ECM的沉积,具有抗肾脏纤维化的作用。
H2S是继一氧化氮、一氧化碳后被发现的第三种人体内重要的气体信号分子。临床研究表明慢性肾脏病患者血清H2S水平下降[8],动物实验研究表明UUO大鼠的H2S水平相比于假手术组降低,H2S具有显著的抗肾脏纤维化作用[9]。本研究发现异鼠李素可上调UUO大鼠血清H2S水平,异鼠李素对H2S相关酶表达的影响以及如何通过上调H2S具有抗肾脏纤维化的作用还需进一步的研究。
肾小管上皮细胞在肾脏纤维化的形成中起重要作用。因此,本研究建立AngⅡ诱导的肾小管上皮细胞NRK-52E细胞纤维化模型,明确异鼠李素对NRK-52细胞纤维化的影响及其机制。结果表明异鼠李素抑制肾小管上皮细胞NRK-52E的增殖,抑制α-SMA的表达,上调E-cadherin的表达,10~50 μmol/L浓度范围内呈剂量依赖性,提示异鼠李素抑制AngⅡ诱导的NRK-52E细胞EMT的形成。除此之外,异鼠李素降低TGF-β1的表达。但是异鼠李素抗肾脏纤维化作用是否通过TGF-β1/Smads信号通路或者其他途径还需进一步的研究证实。
氧化应激是引起肾脏纤维化的重要因素。肾脏在各种诱因(感染、损伤、化学物质和辐射等)下引起自由基和超氧化物等的过度生成诱导各种细胞因子的分泌和释放,进而引发肾脏纤维化的发生发展[10]。异鼠李素是否影响氧化应激而具有抗肾脏纤维化的作用,本研究检测异鼠李素对ROS和超氧化物的影响,结果发现在异鼠李素刺激24 h时,可显著抑制ROS的产生,但对超氧化物无明显影响。表明异鼠李素可能通过抑制氧化应激而具有抗肾脏纤维化的作用。
细胞间隙连接或称缝隙连接,广泛分布于多种细胞,影响细胞的代谢、繁殖、迁移和生存,在维持组织完整性中起重要的作用。Cx43蛋白是主要的间隙连接组成蛋白[11]。1989年Beyer等[12]首次在大鼠肾脏中发现Cx43的存在,从此开启了Cx43与肾脏疾病的相关研究。近年来有研究证实Cx43在高血压性肾病和梗阻性肾病的早期表达增加,抑制Cx43表达降低了炎症细胞浸润和肾纤维化,并明显改善了肾脏的结构和功能,Cx43被认为是治疗慢性肾脏病的新靶点[11, 13-15]。本研究中发现异鼠李素剂量依赖地抑制AngⅡ诱导的Cx43表达,表明异鼠李素抗肾脏纤维化作用很可能是通过Cx43调控。除此之外,异鼠李素对Cx43的调节作用,也提示异鼠李素很可能对Cx43介导的其他相关疾病也有治疗作用,如心血管疾病、肿瘤、创伤愈合及某些生殖、消化、神经系统相关疾病等。
综上所述,异鼠李素对大鼠UUO模型肾间质纤维化及AngⅡ诱导的NRK-52E细胞纤维化具有保护作用,主要通过抑制EMT的形成和降低ECM的沉积。本研究发现异鼠李素抗肾脏纤维化作用可能与降低TGF-β1的表达,升高内源性H2S水平和抑制氧化应激有关。异鼠李素有可能发展为潜在的抗肾脏纤维化的治疗药物。
