术中B超实时监测在幕上病变精准手术中的临床应用
2015-12-19郑树法余良宏林章雅江常震陈剑舞吴喜跃康德智
郑树法,庄 勇,余良宏,林章雅,江常震,陈剑舞,吴喜跃,康德智
颅内病变的定位以及手术切除边界的确定是颅内病变手术的关键,切除位于功能区附近、皮质下的深部病变对神经外科医师是一种挑战。立体定向技术以及术中MRI推动了精准神经外科的发展,可辅助术者安全且最大程度地切除位于功能区附近的颅内病变以及大脑深部病变,但也存在局限性,如立体定向技术手术参数是通过术前CT或MRI获得的,且术中的影响如脑组织漂移使肿瘤的定位及边界发生移位,所以立体定向技术除了价格昂贵外,还缺乏“实时性”。术中颅内病变的移位虽可通过术中MRI辅助手术[1],但由于价格昂贵且术中使用器械需经消磁,难以在经济落后区域或发展中国家普及。而术中B超已是一种成熟的技术,可定位颅内病变,确定病变的边界,辅助术者最大程度且安全地切除病灶,且价格相对低廉,并具有实时性,可应用于监测幕上病变的精准切除。2006年1月-2014年12月,笔者科室应用术中B超实时监测进行辅助手术治疗50例幕上病变患者,现回顾性分析其临床资料,并报道如下。
1 资料与方法
1.1 一般资料 50例中,男性28例,女性22例,年龄(46±15)岁(21~73岁),病程l周~3年,病变的直径0.5~6.0cm。病变部位:颞叶9例,额叶15例,顶叶12例,颞顶叶4例,枕顶叶4例,岛叶5例,大脑后动脉P3段巨大动脉瘤1例;病理性质:胶质瘤35例(胶质母细胞瘤15例,星形细胞瘤Ⅲ级10例、Ⅱ级8例、Ⅰ级2例),海绵状血管瘤8例,脑膜瘤3例,转移瘤3例,动脉瘤1例。
1.2 仪器 颅脑术中扇形凸阵探头(美国Sonosite公司),直径9mm×22mm,发射频率10MHz,具有接触面小、显示面大的特点,并可做术中测量。
1.3 方法 全麻,按照术前MRI定位或神经导航确定患者手术体位及切口,常规消毒铺巾后,开颅翻开骨瓣并悬吊硬膜于骨窗缘上。B超探头涂满耦合剂,用无菌透明塑料套套上术中探头及导线,清除探头与无菌套之间的残余气体后用皮筋扎紧。不同位置的肿瘤应注意调节视野深度,硬膜外探查时应持续冲水,确保B超探头和硬脑膜间无空气填充,变换探头的角度和位置,确认病灶的位置、形态、大小以及距离皮层的深度,以指导硬膜剪开的位置和大小。若病灶在非功能区,选择离皮层最近的部位切开脑皮层;若病灶在神经功能区,则选择远离功能区的皮层切口潜行到达病灶。病灶切除后再次行B超检查了解切除程度,如显像不清,可在B超探头与切除后瘤腔之间持续冲水。B超探头移开后,如疑有残留肿瘤组织,但又无法准确定位时,可置一小棉片于可疑残留肿瘤的位置上,轻微拖动棉片即可定位,继续切除残余的肿瘤。
1.4 疗效判定 胶质瘤、转移瘤以及脑膜瘤患者于术后72h常规复查头部增强MRI,对比手术前后增强MRI影像资料,进行肿瘤的残余量分析,评估肿瘤的切除范围;海绵状血管瘤术后第1d常规行MRI复查;颅内巨大动脉瘤术后行颅脑CTA复查。
2 结 果
2.1 手术结果 35例胶质瘤患者,准确定位及精准切除30例(图1),余5例术后复查MRI显示肿瘤有残余,其中2例低级别胶质瘤在剪开脑膜后肉眼无法确定边界,在B超辅助下(其中1例为功能区胶质瘤,术中使用电生理监测避开功能区)定位,于显微镜下顺利切除,复查术中B超未发现肿瘤残留。8例海绵状血管瘤均顺利切除,其中1例在神经导航引导下设计手术切口并确定骨窗的位置,硬膜剪开后脑脊液的流失以及脑组织移位导致病变部位的漂移,于术中B超监测下定位并安全切除(图2)。3例凸面小脑膜瘤及3例转移瘤均成功定位并切除。1例大脑后动脉巨大动脉瘤于术中B超实时监测下顺利行孤立术,即载瘤动脉夹闭术,由于载瘤动脉位于动脉瘤的深部,显微镜下无法明确其远心端及与动脉瘤的相对位置,术中B超的使用除了可显示瘤腔内存在血栓,明确了载瘤动脉的相对位置及该动脉瘤远端且无重要动脉,最终找到载瘤动脉并成功夹闭(图3)。术中B超辅助定位准确率达100%,无术中B超相关并发症,如伤口感染、伤口愈合不良、脑挫裂伤等。所有患者术后影像学复查均提示病变切除满意,术后神经功能保存良好,未出现明显并发症,无手术死亡病例。

图1 术中B超实时监测下左顶叶功能区胶质瘤手术前后影像学检查结果对比Fig 1 The comparision of the images of the glioma in the left parietal lobe before and after surgical resection
2.2 术中B超声像特点 低级别胶质瘤表现为边界清晰的高回声区,与脑组织结构回声类似,形态较为规整,内部回声较均匀,可伴有点状强回声的钙化点;高级别胶质瘤多表现不均匀的强回声区,形态多数不规则,内部回声较为杂乱,因肿瘤具有浸润性故其边界显示不清,周边的水肿带表现为低回声。瘤内部坏死者可出现无回声的液化灶,瘤内囊性变或钙化出现强回声,血供丰富的肿瘤瘤内或周边可探及稍丰富的彩色血流信号。脑膜瘤呈一均匀回声结节,境界清;转移瘤呈混合回声结节,境界尚清,内回声不均;海绵状血管瘤呈高回声结节,境界尚清,内回声不均;颅内巨大动脉瘤呈一混合回声包块,界清,内回声不均,瘤内因血流的流动呈彩色血流信号,可探及动脉瘤载瘤动脉的相对位置。
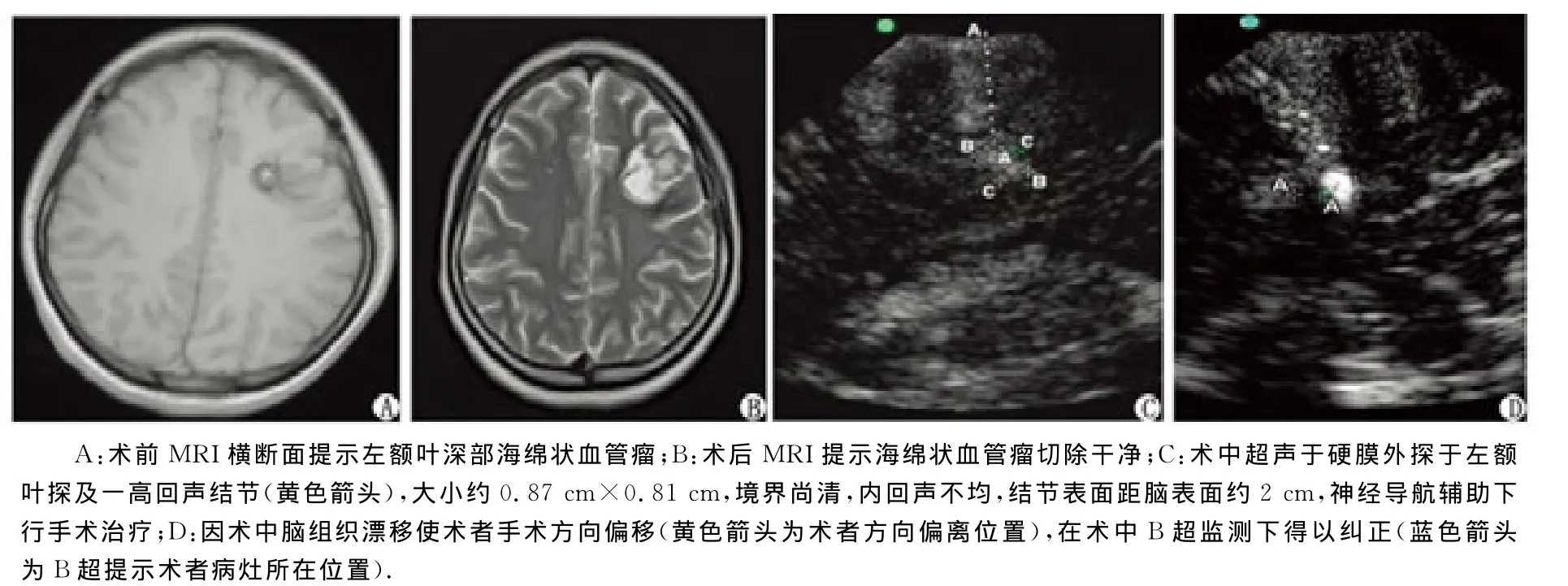
图2 左额叶深部海绵状血管瘤术切除前后影像学检查结果对比Fig 2 The comparision of the images of the cavernous hemangiomas in the left frontal lobe before and after surgical resection
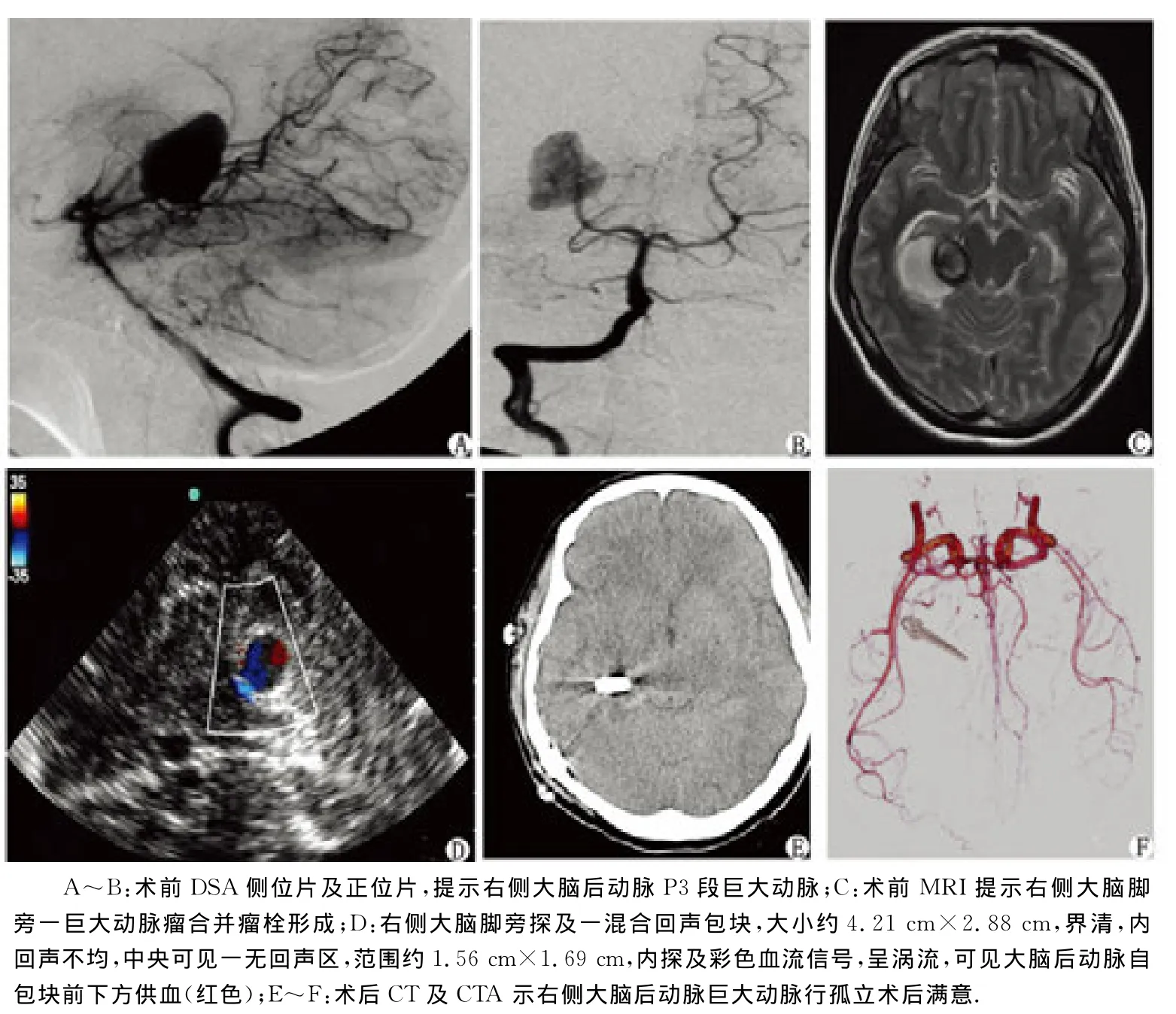
图3 右侧大脑后动脉P3段巨大动脉瘤孤立前后影像学检查结果对比Fig 3 The comparision of the images of a giant aneurysm in the P3segment of the right posterior cerebral artery before and after surgical clipping
3 讨 论
在传统的神经外科手术中,医师主要是根据术前CT和MRI等影像学资料定位病灶,并设计手术方案;开颅后主要是依靠肉眼观察局部脑组织即脑沟、脑回的形态及颜色的变化,再结合术者触摸脑皮层的异常感觉来判断病灶。但对于边界不清特别是低级别的胶质瘤,单纯靠肉眼和手感并不能准确定位,更谈不上精准切除。精准神经外科对颅内病灶的精准切除赋予新的定义,当病灶准确定位后,以脑沟、脑回为边界,沿肿瘤边缘白质纤维束走向解剖性切除病灶,最大程度切除肿瘤并保护神经功能。术中MRI作为精准神经外科的时代标志物之一,可辅助术者安全且最大程度地切除位于功能区附近的颅内病变以及大脑深部病变,但因其价格昂贵且术中使用的器械需经消磁,难以在经济落后的区域或发展中国家普及。超声是一种在CT和MRI诞生之前已广泛应用于临床的影像技术,但由于坚硬的颅骨阻碍了超声进入颅内,限制了其在神经外科领域的应用。当手术将颅骨翻开,上述这种障碍去除后,超声将在神经外科领域充分发挥其作用。Rubin和Dohrmann首次报道B超在神经外科的应用[2],此后众多研究探讨其在脑和脊髓肿瘤手术中的应用价值[3-11],尤其适用于转移瘤和恶性胶质母细胞瘤的定位,甚至适用于CT上难以发现或术中肉眼无法辨认的低度恶性弥漫性胶质瘤的定位。它可辨认肿瘤的水肿带、浸润边界以及正常脑组织等结构;能够很好地鉴别实性或囊性肿瘤;对于肿瘤的活检、分流或脑室内、囊腔内导管的放置可进行实时引导[12-14]。
本研究发现,术中B超在颅脑手术中具有便捷、实时监测的特点,能够精准定位颅内病变,辅助术者切除病灶。总结术中B超的特点:(1)对于确定翻开颅骨骨瓣后硬脑膜的剪开位置和设计进入病变内皮层的途径具有引导作用,如可根据B超显示的大脑凸面小脑膜瘤所附着的硬脑膜基底的位置和大小设计脑膜剪开的位置和大小;(2)对于进入病变的脑沟、脑回的定位具有指导作用,特别是功能区的胶质瘤,B超与神经电生理的配合辅助使用具有明显的神经功能保护作用[15];(3)如颅内肿瘤大部分切除后,B超提示瘤壁上有残留,但探头移开后肉眼不能对残留肿瘤的瘤壁位置进行准确定位时,可放置一小棉片于可疑位置上,轻微拖动棉片即“棉片拖动法”明确残留位置;(4)切除病变后,术中B超若对肿瘤切除界面显示不够清楚,可利用温水缓慢冲洗B超探头下方的瘤腔,动态观察瘤腔内的流动界面即可明确界面;(5)开颅后,由于颅骨骨瓣的移开、脑脊液的流失和脑组织的移位等因素的影响,容易造成病变漂移,这种病变漂移特别是位于深部的小病灶可造成立体定向及单纯的神经导航辅助技术无法精确定位病灶,而术中B超可对此进行实时纠错且可精准定位。本组图2的患者为靠近中央前回额叶深部的海绵状血管瘤,大小约0.5cm,术中因病变漂移使得神经导航无法精准定位,后在B超引导下成功切除病灶,且术后无明显神经功能障碍。(6)本组图3的患者为右侧大脑后动脉P3段巨大动脉瘤,由于动脉瘤体较大,遮挡了载瘤动脉的远心端,显微镜下无法判断载瘤动脉与动脉瘤的相对位置,于B超下明确,并确认瘤内是否存在附壁血栓及远端有无重要动脉,在B超引导下成功夹闭载瘤动脉。(7)对于术中不明原因的脑膨出可利用术中B超明确是否存在远隔部位的血肿以及具体的部位[16]。
术中B超亦有局限性。本研究显示,35例胶质瘤中有5例术后MRI复查提示肿瘤残瘤,其中3例为功能区胶质瘤,因考虑到肿瘤全切可能会遗留严重的神经功能障碍,所以仅行大部切除;余2例术后残留考虑与术中B超图像质量不够高有关。除此之外,术中B超还有以下局限性:(1)对于功能区等重要结构并不能识别,需要结合颅脑MRI或神经电生理监测才能判断;(2)如病灶与探头的距离超过5cm,直径<5mm,超声对病变定位的准确性会下降;(3)超声图像并非临床CT或 MRI常见的断层显像,需要术者对超声图像有较深的认识才能熟练使用。
综上所述,正确使用术中B超可提高患者的手术疗效和生存质量,且不会产生不利的影响包括增加机械性脑损伤以及术后感染率等,更重要的是它的费用远远低于神经导航及术中 MRI,具有易掌握、便捷、可靠、实时以及广泛使用性等特点。随着超声图像质量的提高以及三维超声的出现,术中颅脑B超与术中MRI比较,是否更适合应用于脑肿瘤手术,有待进一步研究探讨[17-18]。本研究收集的病例样本量不够大,所得的结论有待进一步收集病例加以验证。
[1]Rubin J M,Quint D J.Intraoperative US versus intraoperative MR imaging for guidance during intracranial neurosurgery[J].Radiology,2000,215(3):917-918.
[2]Rubin J M,Dohrmann G J.Use of ultrasonically guided probes and catheters in neurosurgery[J].SurgNeurol,1982,18(2):143-148.
[3]Kumar P,Sukthankar R,Damany B J,etal.Evaluation of intraoperative ultrasound in neurosurgery[J].AnnalsAcadMed Singapore,1993(3Suppl),22:422-427.
[4]Cengiz C,Keramettin A.Intraoperative ultrasonographic characteristics of malignant intracranial lesions[J].NeurolIndia,2005,53(2):208-212.
[5]Machi J,Sigel B,Jafar J J,etal.Criteria for using imaging ultrasound during brain and spinal cord surgery[J].JUltrasoundMed,1984,3(4):155-161.
[6]Sun H,Zhao J Z.Application of intraoperative ultrasound in neurological surgery[J].MinimInvasiveNeurosurg,2007,50(3):155-159.
[7]Reinacher P C,van Velthoven V.Intraoperative ultrasound imaging:practical applicability as a real-time navigation system[J].ActaNeurochirSuppl,2003,85:89-93.
[8]Erdoean N,Tucer B,Mavili E,etal.Ultrasound guidance in intracranial tumor resection:correlation with postoperative magnetic resonance findings[J].ActaRadiol,2005,46(7):743-749.
[9]Renner C,Lindner D,Schneider J P,etal.Evaluation of intra-operative ultrasound imaging in brain tumor resection:a prospective study[J].NeurolRes,2005,27(4):351-357.
[10]Ray W Z,Barua M,Ryken T C.Anatomic visualization with ultrasound-assisted intracranial image guidance in neurosurgery:a report of 30patients[J].JAmCollSurg,2004,199(2):338-343.
[11]Unsgaard G,Gronningsaeter A,Ommedal S,etal.Brain operations guided by real-time two-dimensional ultrasound:new possibilities as a result of improved image quality[J].Neurosurgery,2002,51(2):402-411.
[12]Hammoud M A,Ligon B L,El Souki R,etal.Use of intraoperative ultrasound for localizing tumors and determining the extent of resection:a comparative study with magnetic resonance imaging[J].JNeurosurg,1996,84(5):737-741.
[13]Le Roux P D,Berger M S,Ojemann G A,etal.Correlation of intraoperative ultrasound tumor volumes and margins with preoperative computerized tomography scans:an intraoperative method to enhance tumor resection[J].JNeurosurg,1989,71(5Pt 1):691-698.
[14]Le Roux P D,Winter T C,Berger M S,etal.A comparison between preoperative magnetic resonance and intraoperative ultrasound tumor volumes and margins[J].JClinUltrasound,1994,22(1):29-36.
[15]Nossek E,Korn A,Shahar T,etal.Intraoperative mapping and monitoring of the corticospinal tracts with neurophysiological assessment and 3-dimensional ultrasonography-based navigation.Clinical article[J].JNeurosurg,2011,114(3):738-746.
[16]廖驭国,黄传平.重型颅脑损伤术中B超对迟发性颅内血肿的诊治[J].中国临床神经外科杂志,2010,15(10):597-599.
[17]梁思泉,亢建民.术中B超在精准切除胶质瘤中的价值[J].中华医学杂志,2013,93(33):2671-2673.
[18]张家墅,陈晓雷,李昉晔,等.高场强术中磁共振对低级别胶质瘤切除程度的影响[J].中华医学杂志,2012,92(25):1738-1741.
