探讨雷帕霉素靶向抑制mTOR对大鼠心瓣膜细胞钙化的影响及其作用机制
2015-12-16谭焱王继业易仁亮邱健
谭焱,王继业,易仁亮,邱健
探讨雷帕霉素靶向抑制mTOR对大鼠心瓣膜细胞钙化的影响及其作用机制
谭焱,王继业,易仁亮,邱健
目的:探讨雷帕霉素靶向抑制mTOR对大鼠心瓣膜细胞钙化的影响及其作用机制。
方法:体外分离大鼠心瓣膜间质细胞后培养并鉴定;细胞共分为4组:正常对照组、钙化诱导组、雷帕霉素组、钙化诱导+雷帕霉素组;采用流式细胞术检测各组细胞凋亡率;采用茜素红S染色并观察钙沉积的变化,对细胞进行钙化结节计数;蛋白免疫印迹法(Western blot)检测各组细胞中骨形成蛋白-2(bmp-2),骨钙素(osteocalcin),骨调素(osteopontin),smad同源物1(smad1)及半胱氨酸蛋白酶(caspase-3)的表达水平。
结果:成功分离获得大鼠心瓣膜间质细胞;各组细胞凋亡率没有明显差异(P>0.05);钙化诱导组细胞钙化结节数明显高于正常对照组(P<0.05);钙化诱导组细胞钙化结节计数(0.471±0.091)较正常对照组(0.104±0.023)多,钙化诱导+雷帕霉素组细胞钙化结节计数(0.237±0.039)明显少于钙化诱导组,差异均有统计学意义(P<0.05);钙化诱导组细胞的骨形成蛋白-2,骨钙素、smad同源物1和骨调素蛋白的表达水平明显高于正常对照组(P<0.05),钙化诱导+雷帕霉素组的骨钙素、smad同源物1和骨调素蛋白的表达水平明显低于钙化诱导组(P<0.05),但3个实验组间caspase-3蛋白表达水平差异均无统计学意义(P>0.05)。
结论:mTOR抑制剂雷帕霉素通过抑制mTOR后下调其靶蛋白骨形成蛋白-2、骨钙素、smad同源物1和骨调素蛋白的表达水平,从而抑制大鼠心瓣膜细胞的钙化,即细胞钙化变缓很可能与mTOR通路被抑制有密切的关系。
mTOR;雷帕霉素;心瓣膜细胞;细胞钙化
Methods: The rat’s valvular interstitial cells were isolated and the cells were cultured in 4 groups: ①Normal control group, ②Calcification group, ③Rapamycin group and ④Calcification + rapamycin group. The apoptosis rates of valvular interstitial cells were detected by flow cytometry, calcium deposition was observed by Alizarin S staining, the calcified nodules were counted and the protein expressions of bmp-2, osteocalcin, osteopontin, smad-1 and caspase-3 were examined by Western blot analysis.
Results: The rat's valvular interstitial cells were suceessfully isolated; the cell apoptosis rates were similar among different groups, P>0.05. The calcified nodule in Calcification group (0.471 ± 0.091) was more than Normal control group (0.104 ± 0.023), while the nodule in Calcification + rapamycin group (0.237 ± 0.039) was less than Calcification group, all P<0.05. Compared with Normal control group, the protein expression levels of bmp-2, osteopontin and smad-1 were obviously increased in Calcification
group, P<0.05, and compared with Calcification group, the above indexes were obviously lower in Calcification + rapamycin group, P<0.05. The protein expression levels of caspase-3 were similar among 3 experimental groups, P>0.05.
Conclusion: Rapamycin may down-regulate the targeting protein expressions of bmp-2, osteopontin and smad-1 via inhibiting mTOR, therefore, reducing the valvular interstitial cell calcification which might be related to mTOR pathway suppression in experimental rats.
(Chinese Circulation Journal, 2015,30:900.)
钙化性主动脉瓣狭窄(Calcific aortic valve stenosis, CAVS)是一类多发的老年退行性疾病,发病率随着年龄的增长而逐渐增高[1]。钙化是CAVS最常见且重要的病理特征之一,近年来临床研究发现,在退行性主动脉瓣病变患者的瓣膜间质钙化区域中,成骨细胞相关的特异基因表达增加[2]。瓣膜间质细胞在CAVS各种发病机制中均被活化,出现不正常的增殖、分化,说明其在CAVS发生发展过程中具有重要作用,抑制其增殖、分化可能成为CAVS治疗的新切入点[3]。mTOR (mammalian target of RAPA)是抗癌药物雷帕霉素(RAPA)的靶物质[4],也是细胞生长的中枢控制因子,它根据细胞环境的营养条件做出相应的应答,参与调控蛋白激酶和蛋白磷酸酯酶的活性,从而控制与蛋白质合成相关基因的表达[5]。因此在调节细胞生长与分化方面起着关键作用[6]。多数疾病的发生与mTOR信号通路调控异常密切相关[7]。在肿瘤方面,与之密切相关的生理过程如细胞的增殖、分化等均受mTOR的调控,抑制mTOR通路可以有效阻断各种生长因子异常信号的转导,抑制癌症的发生和发展[8]。本文利用雷帕霉素靶向抑制mTOR并研究其影响大鼠心瓣膜细胞钙化的过程及机制,为mTOR靶向抑制在心脏瓣膜、肿瘤等疾病的应用及新药开发的靶点方面提供一定的理论依据。
1 材料与方法
材料:雷帕霉素(RAPA)购自美国sigma公司;蛋白免疫印迹法(Western blot)检测所用抗体兔抗鼠成骨相关蛋白如骨形成蛋白-2(bmp-2)、骨钙素(osteocalcin)、骨调素(osteopontin)、smad同源物1(smad1)、半胱氨酸蛋白酶-3(caspase-3)及甘油醛-3-磷酸脱氢酶(GAPDH)购自美国Abcam公司;茜素S染色试剂购自美国Sigma公司;BCA蛋白浓度检测试剂盒购自南京凯基;钙化培养基成分(含10 mmol/Lβ-甘油磷酸,50 μg/ml维生素C,100 nmol/L地塞米松的标准培养基)购自美国Sigma公司;DMEM培养基和胎牛血清购自美国GIBCO;PBS缓冲液: NaCl 8.0 g,KCl 0.2g,KH2PO40.24 g,Na2HPO4·12H2O 3.628 g,溶于800 ml蒸馏水中,用盐酸调pH值为7.4,蒸馏水定容至1 000 ml,高压灭菌,室温保存备用;Tris-HCl缓冲盐溶液(TBS):浓度1 mol/L Tris-HCl 10 ml,加入NaCl 8.8 g,用盐酸调pH值为7.4,蒸馏水定容至1 000 ml备用。
大鼠心瓣膜间质细胞分离培养、鉴定及分组:采用胶原酶消化法体外分离大鼠心瓣膜间质细胞并传代培养于含10%胎牛血清,1% L-glutamine,100 mg/L链霉素,1×105U/L青霉素的DMEM培养基中,于37℃下,置于5% CO2培养箱中培养。待细胞足量后,用免疫荧光化学法检测α-平滑肌肌动蛋白(α-SMA)、波形蛋白(vimentin)的表达,进行细胞鉴定。经鉴定后,将细胞分为4组:正常对照组:细胞不做任何处理;钙化诱导组:细胞接受钙化培养基行钙化诱导培养;雷帕霉素组:细胞接受100 nmol/L雷帕霉素培养;钙化诱导+雷帕霉素组:细胞接受钙化培养基与100 nmol/L雷帕霉素培养。
大鼠心瓣膜间质细胞凋亡率流式检测:细胞加药培养24 h后,每组处理取3个复孔, 用0.25%胰酶消化,于1 000 r/min离心5 min后收集细胞,以PBS洗液洗2次,细胞悬于PI-Annexin v凋亡双染试剂盒中的缓冲液中,浓度为每毫升1×106个细胞,400目筛网过滤,准确吸取0.5 ml细胞悬液于上样管中,再加入5 μl Annexin v-FITC和PI染液,于室温避光染色10 min后,上机检测,用CellQuest软件获取1×104个细胞,分析活细胞、早期凋亡细胞及死亡细胞的百分率。
大鼠心瓣膜间质细胞茜素红S染色:细胞经培养7 d后,以70%乙醇固定细胞1 h,以双蒸水洗3次后,茜素红S溶液染色30 min。染色后以双蒸水洗3遍,经钙化诱导培养7 d后,经茜素红S染色在瓣膜间质细胞的胞外基质中可见钙结节形成,经
随机在各实验组各抽取5孔比较,置于显微镜下观察并进行钙化结节计数。
Western blot分析: 大鼠心瓣膜间质细胞经培养7 d后,检测培养细胞中骨形成蛋白-2、骨钙素、骨调素、smad同源物1、caspase-3蛋白的表达水平[9]。按照说明书操作进行总蛋白定量。SDSPAGE电泳后PVDF膜转膜和孵育抗体,5 %脱脂奶粉-TBS封闭,一抗1:1 500,室温,反应2 h。TBS洗涤PVDF膜5 min×5次,二抗1:5 000,室温反应1 h,TBS洗5 min×5次,化学发光,显影,定影,采用Quantity One v 4.4.0软件对目的蛋白及GAPDH所对应条带进行光密度分析。
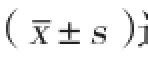
2 结果
大鼠心瓣膜间质细胞免疫荧光鉴定结果(图1):分离培养的大鼠心瓣膜间质细胞中波形蛋白、α-平滑肌肌动蛋白均为阳性表达,证实分离培养的细胞为主动脉瓣膜间质细胞。
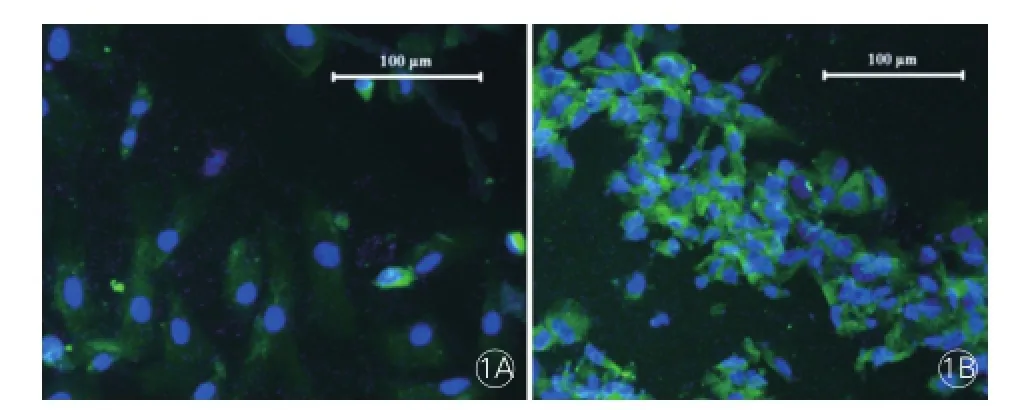
图1 大鼠心瓣膜间质细胞的免疫荧光鉴定图
大鼠心瓣膜间质细胞凋亡测定结果:正常对照组(3.87±0.44)、雷帕霉素组(4.15±0.47)、钙化诱导组(3.06±0.65)和钙化诱导+雷帕霉素组(4.21±0.71)大鼠心瓣膜间质细胞的凋亡率比较差异均无统计学意义(P>0.05)。
大鼠心瓣膜间质细胞钙化结节定量分析(图2):钙化诱导组细胞钙化结节计数(0.471±0.091)明显较正常对照组(0.104±0.023)多(P<0.05),钙化诱导+雷帕霉素组细胞钙化结节计数(0.237±0.039)明显少于钙化诱导组,差异均有统计学意义(P<0.05)。
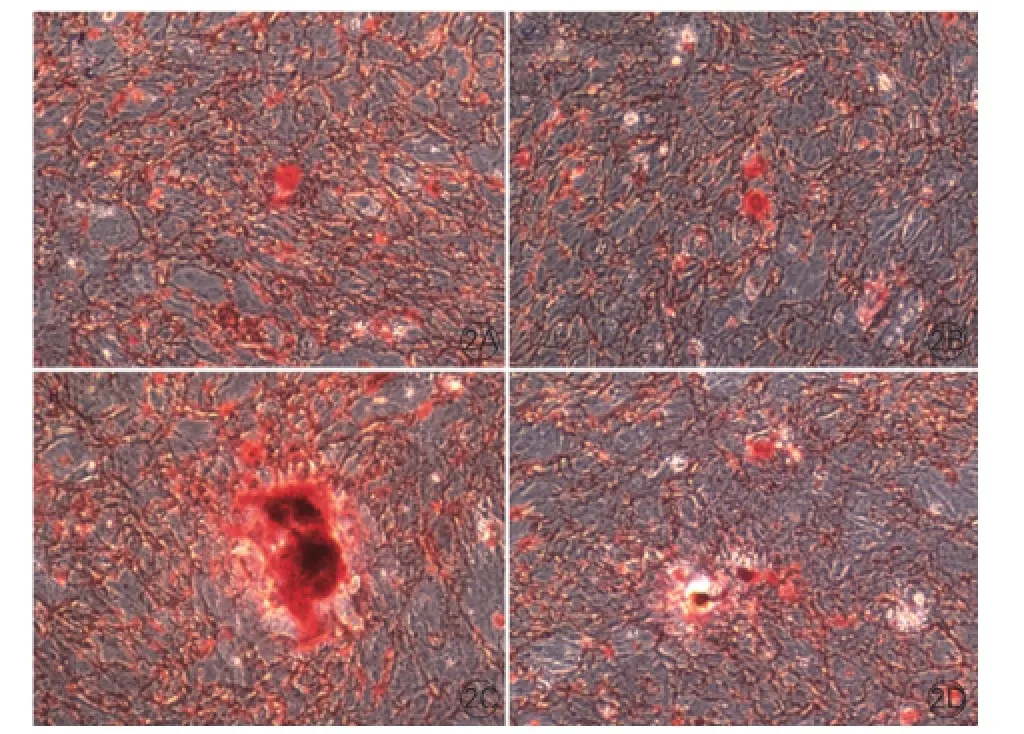
图2 大鼠心瓣膜间质细胞茜素红S染色
大鼠心瓣膜间质细胞成骨相关蛋白表达水平的变化(图3、表1):钙化诱导组细胞的骨形成蛋白-2、骨钙素、smad同源物1和骨调素蛋白表达水平较正常对照组均升高(P<0.05); 钙化诱导+雷帕霉素组的骨钙素、smad同源物1和骨调素蛋白表达水平较钙化诱导组均降低,差异均有统计学意义(P<0.05)。3个实验组间caspase-3蛋白表达水平比较差异无统计学意义(P>0.05)。
图3 大鼠心瓣膜间质细胞成骨相关蛋白表达水平
表1 大鼠心瓣膜间质细胞成骨相关蛋白表达水平检测
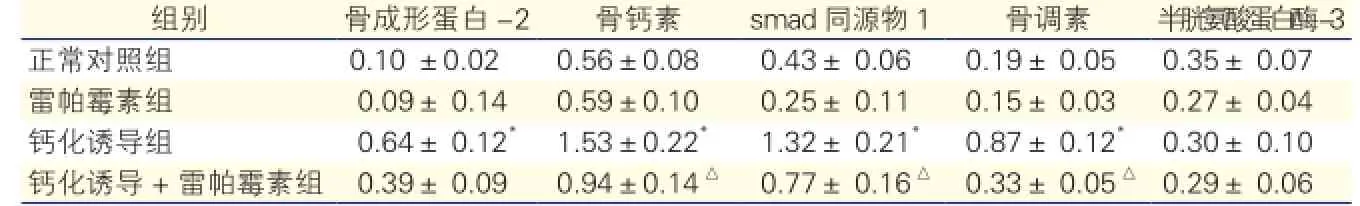
表1 大鼠心瓣膜间质细胞成骨相关蛋白表达水平检测
注:与正常对照组比较*P<0.05;与钙化诱导组比较△P<0.05
?
3 讨论
主动脉瓣瓣膜钙化可引起主动脉瓣狭窄、关闭不全等疾病,是导致老年退行性瓣膜病的重要病理改变[10]。既往普遍认为瓣膜钙化是被动的退行性钙磷沉积的过程,而现在研究者明确该过程是一种普遍存在且高度保守的细胞通路介导的主动性过程[11]。mTOR是雷帕霉素进入细胞后的靶物质,细胞中高度保守的FPR1基因编码胞质蛋白FKBPl2是雷帕霉素的直接受体[12]。mTOR抑制剂在心脏瓣膜、肿瘤等疾病方面的应用有一定的前景,其衍生的新一代的化合物有雷帕霉素、依维莫司、坦西莫司等,均具有抗生素、免疫抑制及抗肿瘤的作用[13]。目前已有的研究证实雷帕霉素具有抗动脉粥样硬化的作用,但是,mTOR信号通路在钙化性主动脉瓣狭窄发生、发展过程中的研究尚少有报道。以往体内诱导动物瓣膜钙化方法繁琐且需时较长,稳定性差[14],因此建立简易、有效、稳定的体外瓣膜钙化模型非常必要。
本研究采用胶原酶消化法从大鼠主动脉瓣中分离并体外培养瓣膜间质细胞,以含有β-甘油磷酸的钙化诱导培养基诱导钙化,从而实现瓣膜细胞体外对大鼠瓣膜间质细胞的钙化诱导培养。我们早期的实验结果显示,在主动脉钙化狭窄瓣膜病患者的瓣膜组织中,mTOR下游底物核糖体蛋白S6磷酸化较正常瓣膜组织中明显升高,说明mTOR在CAVS瓣膜组织中异常活化。因此,我们推测mTOR信号通路活化参与钙化性主动脉瓣狭窄的发生发展,其抑制剂雷帕霉素可能通过抑制瓣膜间质细胞分化从而阻断CAVS的发生发展。
以往的研究表明,mTOR抑制剂可能通过间接调控细胞的凋亡,影响主动脉瓣瓣膜钙化过程[15],但在实验中我们发现,各实验组细胞的凋亡率均没有明显差别(P>0.05),说明mTOR抑制剂雷帕霉素不是通过影响细胞凋亡来抑制细胞钙化过程。通过进一步实验分析发现,mTOR抑制剂雷帕霉素抑制细胞钙化,是通过抑制mTOR后,下调骨形成蛋白-2、骨钙素、骨调素和smad同源物1 的表达水平而引起的,因此细胞钙化与mTOR通路被抑制有密切的关系。瓣膜钙化与骨组织钙化类似,为主动可调控过程,瓣膜间质细胞表型激活向成骨细胞转化可能为瓣膜钙化的病理基础。针对瓣膜间质细胞表型转化中的关键作用基因,进行针对性治疗,可能是未来瓣膜病治疗的方向。
[1] Rajamannan NM, Gersh B, Bonow RO. Calcific aortic stenosis: from bench to bedside-emerging clinical and cellular concepts. Heart, 2003, 89: 801-805.
[2] Zhou Y, Wang D, Gao X, et a1. mTORC2 phosphorylation of Akt1: a possible mechanism for hydrogen sulfide-induced cardioprotection. PLoS One, 2014, 9: e99665.
[3] Hao S, Sharp JW, Ross-Inta CM, et a1. Uncharged tRNA and sensing of amino acid deficiency in In mammalian piriform cortex. Science, 2005, 307: 1776-1778.
[4] Schramm C, Fine DM, Edwards MA, et a1. The PTPN11 loss-offunction mutation Q510E-Shp2 causes hypertrophic cardiomyopathy by dysregulating mTOR signaling. Am J Physiol Heart Circ Physiol, 2012 , 302: 231-243.
[5] 陈洪菊, 屈艺. mTOR信号通路的生物学功能. 生命的化学, 2010, 30: 555-560.
[6] 关键, 孙妍, 孙筱璐, 等. 阿托伐他汀对小鼠病毒性心肌炎心肌细胞凋亡的影响研究. 中国循环杂志, 2011, 3: 220-223.
[7] Lin Z, McDermott A, Shao L, et a1. Chronic mTOR activation promotes cell survival in Merkel cell carcinoma. Cancer Letters, 2014 , 344: 272-281.
[8] Dormond O, Madsen JC, Briscoe DM. The effects of mTOR-Akt interactions on anti-apoptotic signaling in vascular endothelial cells. J Bio Chem, 2007, 282: 23679-23686.
[9] 王志钢, 吴应积, 旭日干. mTOR信号通路与细胞生长调控. 生物物理学报, 2007, 23: 333-342.
[10] Vijapurkar U, Robillard L, Zhou S. mTOR kinase inhibitor potentiates apoptosis of PI3K and MEK inhibitors in diagnostically defined subpopulations. Cancer Lett, 2012, 30: 168-175.
[11] Avruch J, Long X, 0niz-Vega S, et a1. Amino acid regulation of TOR complex 1. Am J Physiol Endocril Metab, 2009. 296: E592-E602.
[12] Zaytseva YY, Valentino JD, Gulhati P, et a1. mTOR inhibitors in cancer therapy. Cancer Letters, 2012, 319: 1-7.
[13] 李晓涛, 王乐丰, 杨新春, 等. 可降解聚合物涂层雷帕霉素洗脱支架在治疗冠状动脉弥漫性长病变中的临床研究. 中国循环杂志, 2014, 9: 670-673.
[14] 彭利静, 李慧, 李超. 大鼠动脉钙化诱导过程中炎症小体复合物分子的变化. 生物技术通讯, 2014, 3: 388-390.
[15] Burkhalter MD, Fralish GB, Premont RT, et a1. Grk5l controls heart development by limiting mTOR signaling during symmetry breaking. Cell Rep, 2013, 4: 625-632.
Effect and Mechanism of Rapamycin Inhibiting mTOR on Heart Valve Cell Calcification in Experimental Rats
TAN Yan, WANG Ji-Ye, YI Ren-liang, QIU Jian.
Department of Cardiology, Southern Medical University, Guangzhou (510515), Guangdong, China
Objective: To investigate the effect and mechanism of rapamycin inhibiting mammalian target of RAPA (mTOR) on heart valve cell calcification in experimental rats.
Mammalian target of RAPA; Rapamycin; Heart valve cell; Cell calcification
2015-05-21)
(编辑:曹洪红)
广东省科技计划项目(2012B031800418);广州市科技计划项目(2013J4100117)
510515 广东省广州市,南方医科大学(谭焱、邱健)、 广州军区广州总医院 心内科(谭焱、 王继业、易仁亮、邱健 )
谭焱 主治医师 博士研究生 主要从事冠心病的早期诊治和退行性瓣膜病研究 Email:yantan1123@163.com 通讯作者: 邱健
Email: jianqiu81@163.com
R541
A
1000-3614(2015)09-0900-04
10.3969/j.issn.1000-3614.2015. 09.018
