探讨微小核糖核酸-455在压力超负荷诱导的心肌肥厚小鼠模型中的作用机制
2015-12-16吴春涛李拥军刘苏王智勇
吴春涛,李拥军,刘苏,王智勇
探讨微小核糖核酸-455在压力超负荷诱导的心肌肥厚小鼠模型中的作用机制
吴春涛,李拥军,刘苏,王智勇
目的:通过结扎小鼠主动脉弓导致主动脉缩窄(TAC)两周后建立心肌肥厚的模型,旨在探讨微小核糖核酸-455(miR-455)在心肌肥厚中细胞与分子学机制。
方法:选用18只昆明种小鼠,随机分为TAC+miR-455组(n=6,尾静脉注射包被miR-455 的腺病毒)、TAC+绿色荧光蛋白(GFP)组(n=6,TAC+GFP组,尾静脉注射包被GFP的腺病毒)和假手术组(n=6,尾静脉注射包被GFP的腺病毒)。术后两周测量小鼠血流动力学及超声心动图指标;对心肌组织进行苏木素-伊红(HE)染色和马松(MASSON) 染色观察心肌组织病理学变化;应用荧光定量逆转录聚合酶链反应(qRT-PCR)方法检测心肌肥厚基因与纤维化基因的表达;免疫蛋白印迹法(Western blot)分析凋亡蛋白;qRT-PCR与Western blot分析miR-455的靶基因和蛋白。
结果:造模两周时,与假手术组比较,TAC+GFP组小鼠心重/体重值增加[(9.78±0.20) mg/g vs(8.25±0.22) mg/g,P<0.01],左心室舒张期前壁厚度明显增加[(1.782±0.058) mm vs (1.457±0.050) mm,P<0.05],左心室舒张期内径变小[(3.027±0.052)mm vs (3.142±0.050)mm,P<0.05],左心室射血分数增加[(84.167 ±4.167)% vs(77.000±3.347)%,P<0.05];心肌肥厚基因(心房钠尿因子、骨骼肌肌动蛋白和β肌球蛋白重链)和心肌纤维化基因(转化生长因子β1和结缔组织生长因子)表达的明显增加(P均<0.05);抗凋亡蛋白有明显降低,促凋亡蛋白明显升高(P均<0.05)。与TAC+GFP组比较,TAC+miR-455组小鼠的心重/体重值增加[(12.04±0.11)mg/g vs (9.78±0.20)mg/g,P<0.01],左心室舒张期前壁厚度增加[(1.908±0.062) mm vs (1.782±0.058)mm,P<0.01],左心室舒张期内径变小 [(2.893±0.069)mm vs(3.027±0.052) mm,P<0.01],但两组在左心室射血分数方面差异无统计学意义(P>0.05);心肌肥厚基因表达增加(P均<0.05),但心肌纤维化基因表达水平两组差异无统计学意义(P>0.05);抗凋亡蛋白Bcl-2虽降低但差异无统计学意义(P>0.05),促凋亡蛋白Bax无明显升高。Western blot 分析,TAC+GFP组与假手术组比较,钙网蛋白(CALR)和葡萄糖调节蛋白78 (GRP78)蛋白水平都有升高(P均<0.01),TAC+miR-455组与TAC+GFP组比较,GRP78水平差异无统计学意义(P>0.05),而CALR水平却有了明显下降(P<0.01);qRT-PCR结果显示CALR水平下降同时也有CALR mRNA的下降(P<0.01)。
结论:短期压力负荷后小鼠出现了代偿性心肌肥厚的特征,表现为心室壁的增厚,心室腔的缩小,心重/体重比值增加以及心脏收缩功能的增强;病理学出现明显心肌细胞增大,伴随出现心肌肥厚相关的胎儿期基因的重新激活。miR-455通过降解靶mRNA使CALR降低这条途径,使得心肌细胞进一步增大,心肌肥厚更加明显。
微小核糖核酸;心肌肥厚;钙网蛋白
Methods: The mice model of cardiac hypertrophy was established by transverse aorta constriction (TAC), and 18 male kunming TAC mice were randomly divided into 3 groups:①TAC + miR-455 group,②TAC + GFP (green fluorescence protein)
group and ③Sham group (sham operation + GFP). n=6 in each group and all animals were treated for 2 weeks. The hemodynamic and echocardiographic indexes were examined, histo-pathological changes of myocardial tissue were observed by HE and Masson staining. The hypertrophic and fibrosis gene expressions were measured by RT-PCR, the apoptosis protein level was detected by Western blot analysis. The expressions of miR-455 targeting gene and protein were also determined.
Results: Upon 2 weeks modeling, compared with Sham group, TAC+GFP group had increased ratio of heart weight/ body weight (9.78 ± 0.20) mg/g vs (8.25 ± 0.22) mg/g, P<0.01, increased left ventricular diastolic (LVD) wall thicknesses (1.782 ± 0.058) mm vs (1.457 ± 0.050) mm, P<0.05, decreased LVD diameter (3.027 ± 0.052) mm vs (3.142±0.050) mm, P<0.05, increased LVEF (84.167 ± 4.167) % vs (77.000 ± 3.347) %, P<0.05; increased gene expressions of cardiac hypertrophy and fibrosis, all P<0.05, decreased anti-apoptosis protein and increased promoting apoptosis protein, all P<0.05. Compared with TAC+GFP group, TAC+miR-455 group presented increased ratio of heart weight/body weight (12.04 ± 0.11) mg/g vs (9.78 ± 0.20) mg/g, P<0.01, increased LVD wall thicknesses (1.908 ± 0.062) mm vs (1.782 ± 0.058) mm, P<0.01, decreased LVD diameter (2.893 ± 0.069) mm vs (3.027 ± 0.052) mm, P<0.01, while LVEF was similar between 2 groups, P>0.05; increased gene expression of cardiac hypertrophy, P<0.05, while gene expression of cardiac fibrosis was similar between 2 groups, P>0.05; the anti-apoptosis protein and promoting apoptosis protein expressions were similar between 2 groups. Compared with Sham group, TAC+GFP group had increased expressions of calreticulin (CALR) and glucose-regulated protein 78 (GRP78), all P<0.01. Compared with TAC+GFP group, TAC+miR-455 group had decreased mRNA and protein expressions of CALR, both P<0.01, while GRP78 protein expression was similar between 2 groups, P>0.05.
Conclusion: miR-455 may promote cardiac hypertrophy induced by short-term overload pressure via targeting CALR in experimental mice.
(Chinese Circulation Journal, 2015,30:889.)
近年来在多种生命体内发现了一种新的小分子核糖核酸(RNA),即微小核糖核酸(miRNA)。miRNA是一类由内源基因编码的15~22 bp的非编码单链RNA分子,通过结合靶基因mRNA的3'非编码区而对其表达进行转录后表达调控[1]。最近发现miRNA通过转录后负性调节目的蛋白质参与许多心血管病,例如miRNA-34a、miRNA-21、miRNA-23a、miRNA-24、miRNA-133、miRNA-208/miRNA-195和miRNA-199与心肌肥厚有关[2-5],miRNA-29 和miRNA-21与心肌纤维化有关[6,7],miRNA-210 和miRNA-494与缺血性心脏病有关[8,9]。事实上关于微小核糖核酸-455(miR-455)的研究很少,PubMed 上仅有4篇关于miR-455的文章[10-13],而且其中并没有miR-455与心肌肥厚的研究。通过计算机计算miR-455 的5'端有6个核苷酸,被称为种子序列(Seed sequence),与钙网蛋白(CALR)匹配完好(图1),而CALR与心肌肥厚关系密切,因此可以大胆推测miR-455在心肌肥厚中起着重要作用。我们通过小鼠结扎主动脉弓导致主动脉缩窄(TAC))建立了心肌肥厚的模型,旨在探讨miR-455在心肌肥厚中的细胞与分子学机制。
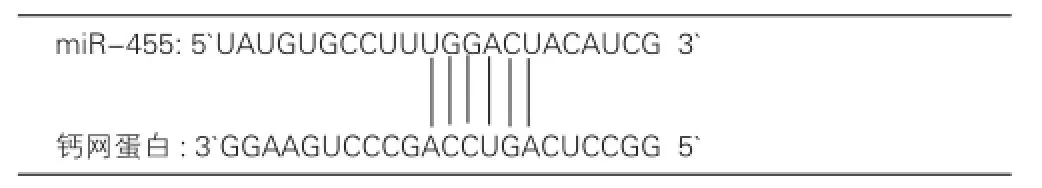
图1 miR-455与钙网蛋白的碱基互补
1 材料与方法
实验动物与分组:选用18只4周龄健康雄性昆明种小鼠(购自河北医科大学),体重约(20±2)g,随机分为主动脉缩窄(TAC)+miR-455组(TAC+miR-455组),TAC+绿色荧光蛋白(GFP)组(TAC+GFP组)和假手术组,每组6只。TAC+miR-455组小鼠于主动脉弓结扎术后第1天,第8天尾静脉注射包被miR-455 的腺病毒0.1 ml(5.0×109ifu/ml,Invitrogen,中国上海);TAC+GFP组小鼠于主动脉弓结扎术后第1天,第8天尾静脉注射包被GFP的腺病毒0.1 ml(1.0×109ifu/ml,Invitrogen,中国上海) ;假手术组小鼠于手术后第1天,第8天尾静脉注射包被GFP的腺病毒0.1 ml(1.0×109ifu/ml,Invitrogen,中国上海)。
动物模型制作:小鼠麻醉后找到左胸骨边缘约2 mm处,沿第二肋间隙打开胸腔,游离主动脉弓,于锁骨下动脉(第一分支)和左颈总动脉(第二分支)间穿0号线备用,平行于主动脉弓放置27-gauge(直径0.4 mm)针头,一同结扎后抽出针头,使主动脉狭窄65%~70%。假手术组手术同上,但不结扎主动脉弓。
超声心动图检查:应用超声心动图于手术前、术后2周评估心功能。测量左心室舒张期内径
(LVIDd)、左心室舒张期前壁厚度(LVAWd)、左心室射血分数(LVEF)。
血流动力学检测:术前、术后2周三组小鼠行微导管术进行血流动力学检测,测量并记录动脉收缩压、左心室收缩末压(LVESP)、左心室舒张末压(LVEDP)。
病理组织学检测:血流动力学测定之后,迅速取出心脏,放入冰生理盐水后泵出心腔余血,滤纸吸干水分精密天平称重,计算心重/体重值(mg/ g)。取心室肌,置于4%多聚甲醛中,梯度乙醇脱水,石蜡切片,进行苏木素-伊红(HE)染色和马松(MASSON) 染色,应用Motic 6.0分析软件(中国厦门)显微镜下观察。
心肌组织miR-455、mRNA的测定:Trizol法提取总RNA,使用Applied Biosystems 7300型PCR基因扩增仪进行荧光定量逆转录聚合酶链反应(qRT-PCR)。miR-455以U6为内参(All-in-One miRNA qPCR Detection System,GeneCopoeia,马里兰州,美国),miR-455 引物序列:ATGTGCCTTTGGACTACATCGAA;U6引物序列:TCGTGAAGCGTTCCATATTTTTAA;通用下游引物:TTACTACGTCATGACTAGTAA。mRNA以β-肌动蛋白(β-actin)为内参(赛百盛,中国北京),采用ΔCt(ΔCt目的-ΔCt内参)法进行相对定量分析,以2-ΔCt作为目的基因的相对表达量。引物序列见表1。

表1 引物序列表
免疫蛋白印迹法分析:提取心肌细胞总蛋白,用Lowry蛋白定量试剂盒测定蛋白含量[14],用5X样品Buffer处理后分装-70℃贮存。取上述细胞蛋白样品(含蛋白75 μg)进行聚丙烯酰胺凝胶电泳(SDS-PAGE,10%分离胶),将电泳分离后的蛋白质电转移至PVDF膜上(Millipore Immobion-P,Millipore,马塞诸塞州,美国),经封闭、洗脱后分别加入抗CALR:1:500;抗Bax:1:500;抗Bcl-2:1:1000(博士德,中国武汉)4℃孵育过夜,洗膜后以相应荧光二抗孵育1 h,并以兔抗人甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体(1:5000,BioWorld,中国南京)同上操作,作为内对照。抗原—抗体复合物用双色红外激光扫描仪进行扫膜采用Image-Pro Plus(Version 4.1,Media Cybernetics,LP,美国)软件分析蛋白条带积分光密度值(IOD),以靶蛋白IOD 与GAPDH 的IOD比值反映靶蛋白相对表达水平。
统计学处理:采用SPSS 19.0统计分析软件进行分析。实验数据用均数±标准差表示,组间及组内比较用方差分析(ANOVA)。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-455在小鼠体内的转染(图2)
造模2周后,与假手术组相比,TAC+GFP组小鼠体内miR-455表达明显降低。与TAC+GFP组相比,TAC+miR-455组小鼠体内miR-455表达明显升高(P均<0.01),说明miR-455在小鼠体内转染成功。
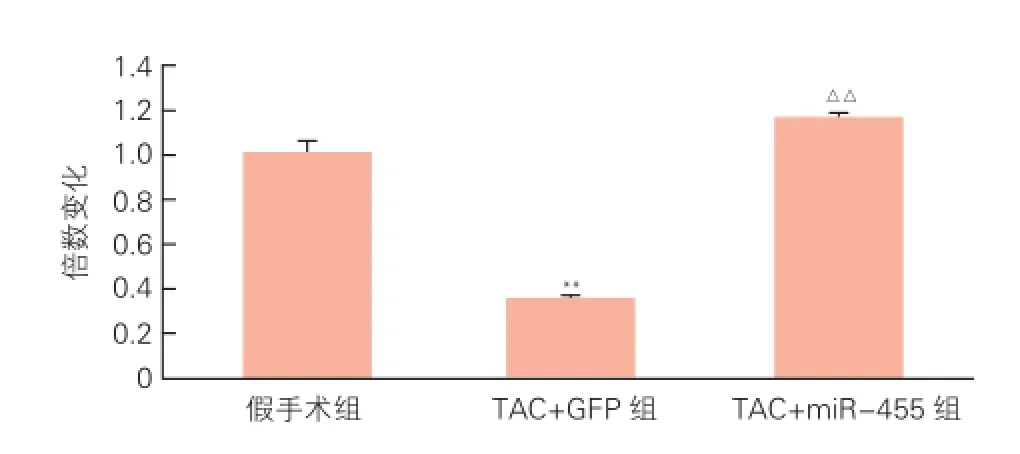
图2 小鼠心肌组织miR-455的表达
2.2 miR-455对小鼠血流动力学、超声心动图参数、心肌肥厚和心肌纤维化基因及心肌组织病理学的影响(表2)
造模2周后,与假手术组相比,右侧颈动脉血压测定显示,TAC+GFP组和TAC+miR-455组小鼠动脉收缩压和LVESP明显升高(P均<0.01),但是
LVEDP差异无统计学意义(P均>0.05),说明小鼠高血压模型成功,正处于高血压后心肌肥厚状态,未进入心力衰竭。
与假手术组相比,TAC+GFP组小鼠的心重/体重值增加(P<0.01),LVAWd明显增加,LVIDd变小,LVEF增加(P均<0.05)。TAC+miR-455组较TAC+GFP组心重/体重值增加(P<0.01),LVAWd增加,LVIDd减小(P均<0.01)。TAC+miR-455组较TAC+GFP组LVEF增加, 但差异无统计学意义(P>0.05)。
miR-455对心肌肥厚基因表达的影响:造模两周时,与假手术组比较,TAC+GFP组小鼠心肌组织中心房钠尿因子、骨骼肌肌动蛋白和β肌球蛋白重链基因表达有明显增加(P均<0.01)。与TAC+GFP组比较,TAC+miR-455组心房钠尿因子、骨骼肌肌动蛋白和β肌球蛋白重链的基因表达有进一步增加(P均<0.05)。
miR-455对心肌纤维化基因表达的影响:与假手术组比较,转化生长因子β1(TGFβ1)和结缔组织生长因子(CTGF)在TAC+GFP组和TAC+miR-455组的表达都有明显上升(P均<0.05),但两者比较差异无统计学意义(P>0.05)。说明TAC 2周时心肌纤维化已开始出现,但miR-455对纤维化的影响未明显显现出来。
造模2周时,心室壁HE染色显示,假手术组可见心室壁厚度正常,TAC+GFP组心室壁厚度增厚,TAC+miR-455组较TAC+GFP组心室壁厚度进一步增厚。心肌细胞HE染色显示,假手术组可见心肌细胞呈红色,心肌细胞排列整齐,大小正常,胞浆均匀,胞核染色均匀。TAC+GFP组心肌细胞横截面积增大。TAC+miR-455组较TAC+GFP组心肌细胞进一步增大,心肌细胞排列紊乱,细胞浆浓染,细胞间距增大,细胞核空染增多。心肌纤维MASSON染色显示,假手术组可见少量胶原纤维散在分布于心肌细胞间隙中,呈现蓝色,较之于假手术组,TAC+GFP组和TAC+miR-455组心肌胶原纤维明显增加(图3)。
表2 三组小鼠血流动力学、超声心动图参数及心肌肥厚基因和心肌纤维化基因的表达比较
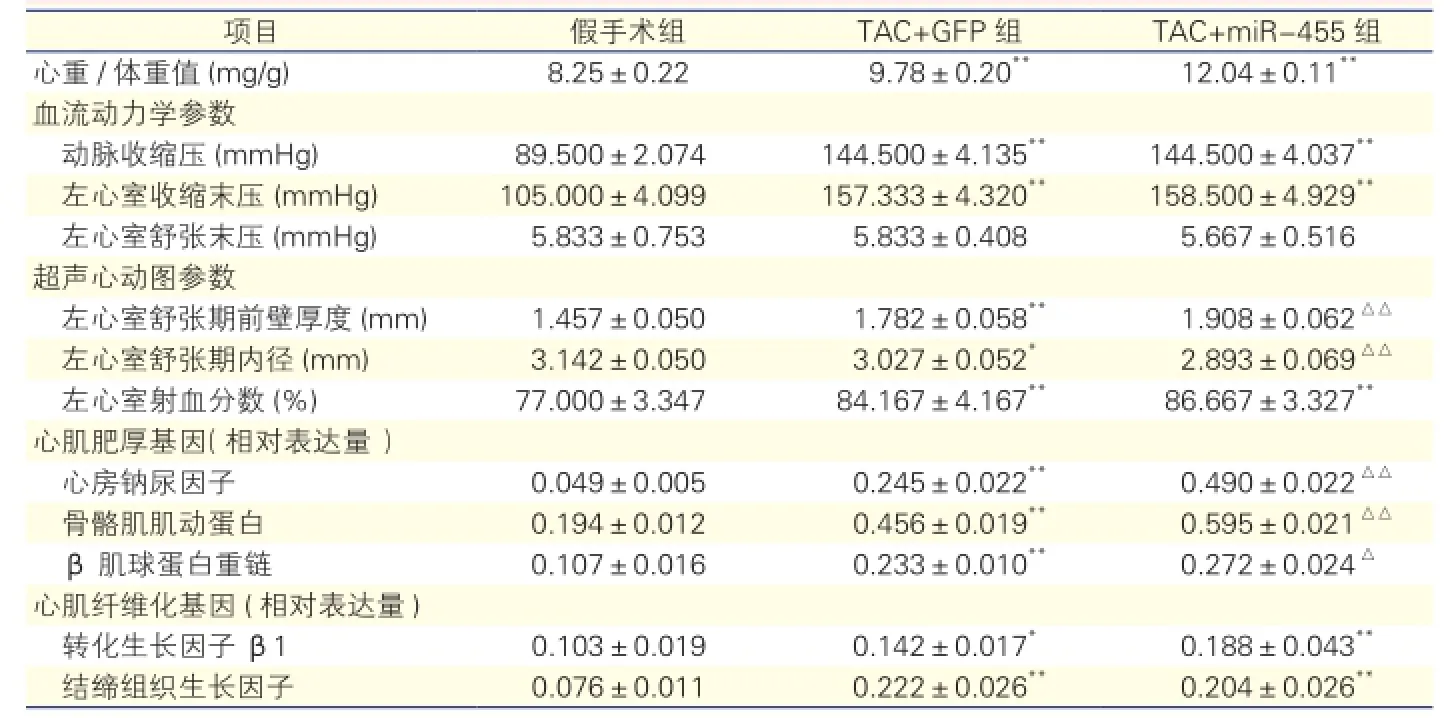
表2 三组小鼠血流动力学、超声心动图参数及心肌肥厚基因和心肌纤维化基因的表达比较
注:1 mmHg=0.133 kPa。与假手术组比*P<0.05**P<0.01;与TAC+GFP组比△P<0.05△△P<0.01。余注见图2
?
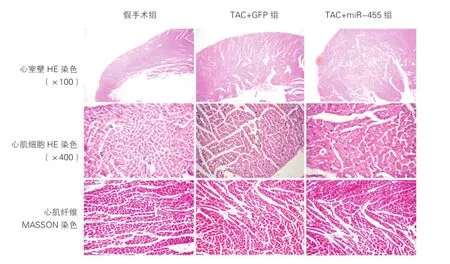
图3 心肌HE及MASSON染色结果
miR-455 对心肌细胞凋亡的影响(图4):Western blot 示造模两周时,与假手术组相比,TAC+GFP组促凋亡蛋白Bax水平有明显上升(P<0.05),TAC+miR-455组变化不明显(P>0.05)。对于抗凋亡蛋白Bcl-2,与假手术组比较,TAC+GFP组和TAC+miR-455组有所下降(P<0.01),但后两者比较差异无统计学意义(P>0.05)。
miR-455的靶基因分析(图5):Western blot 分
析,TAC+GFP组小鼠心肌CALR和GRP78蛋白水平升高(P均<0.01),但经过了miR-455的干扰,TAC+miR-455组GRP78水平依然升高(P<0.01),而CALR水平却有了明显下降(P<0.01),说明CALR是miR-455的靶蛋白之一。qRT-PCR提示CALR水平下降同时也有小鼠心肌CALR mRNA的表达下降,说明miR-455对CALR的调节是通过降解mRNA来抑制蛋白翻译。
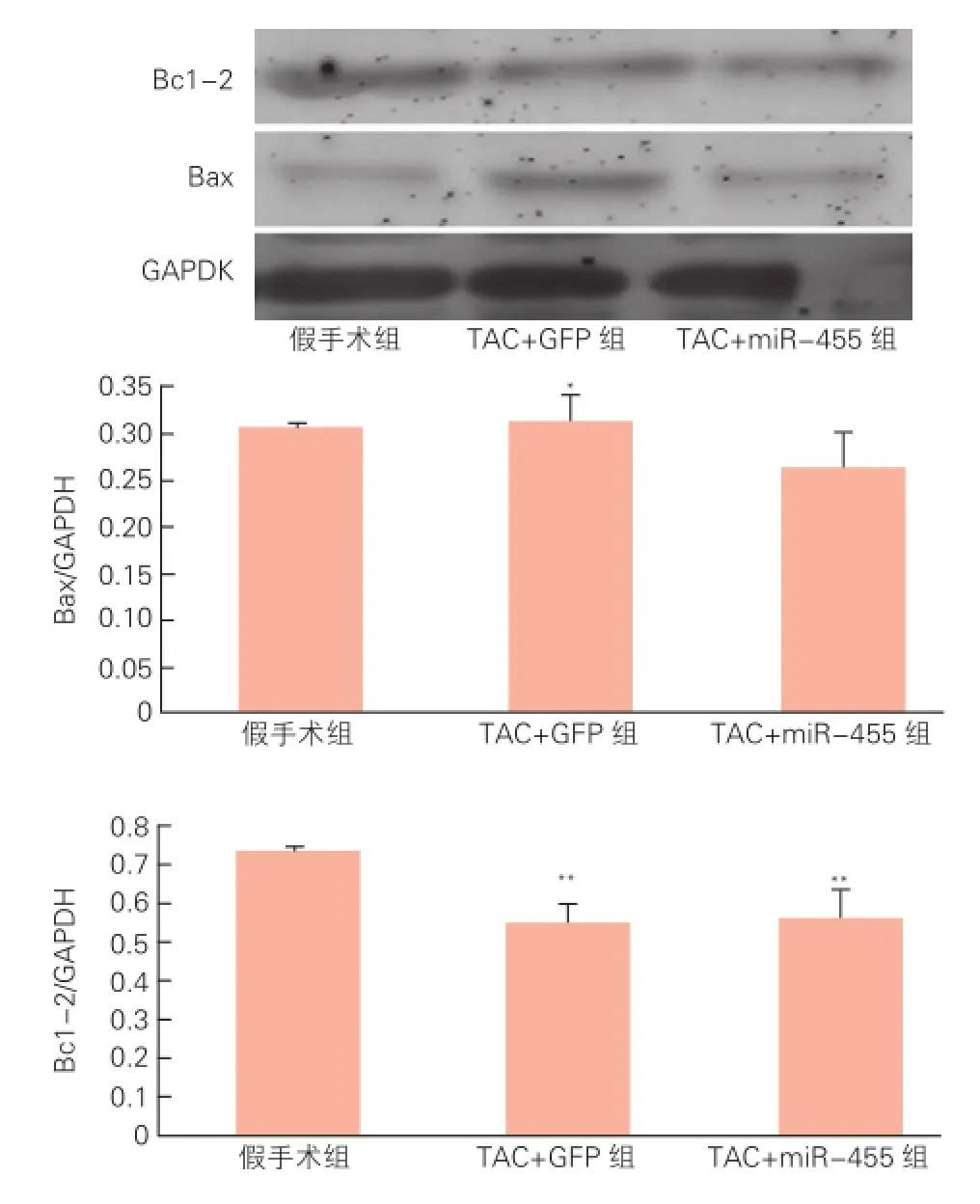
图4 免疫蛋白印迹法分析小鼠心肌组织凋亡蛋白表达
3 讨论
在实验中,首先利用TAC成功构建了压力超负荷致小鼠心肌肥厚模型,两周后小鼠出现了明显的代偿性的向心性心肌肥厚,伴随有心室壁的增厚以及心室腔的缩小。升主动脉缩窄后,会出现血流动力学上的改变,心脏后负荷增加,改变了一系列神经激素分泌,出现心肌肥厚。在这一过程中,会出现一些与心肌肥厚相关的胎儿期基因的表达升高,例如心房钠尿因子、骨骼肌肌动蛋白和β肌球蛋白重链基因等分子。
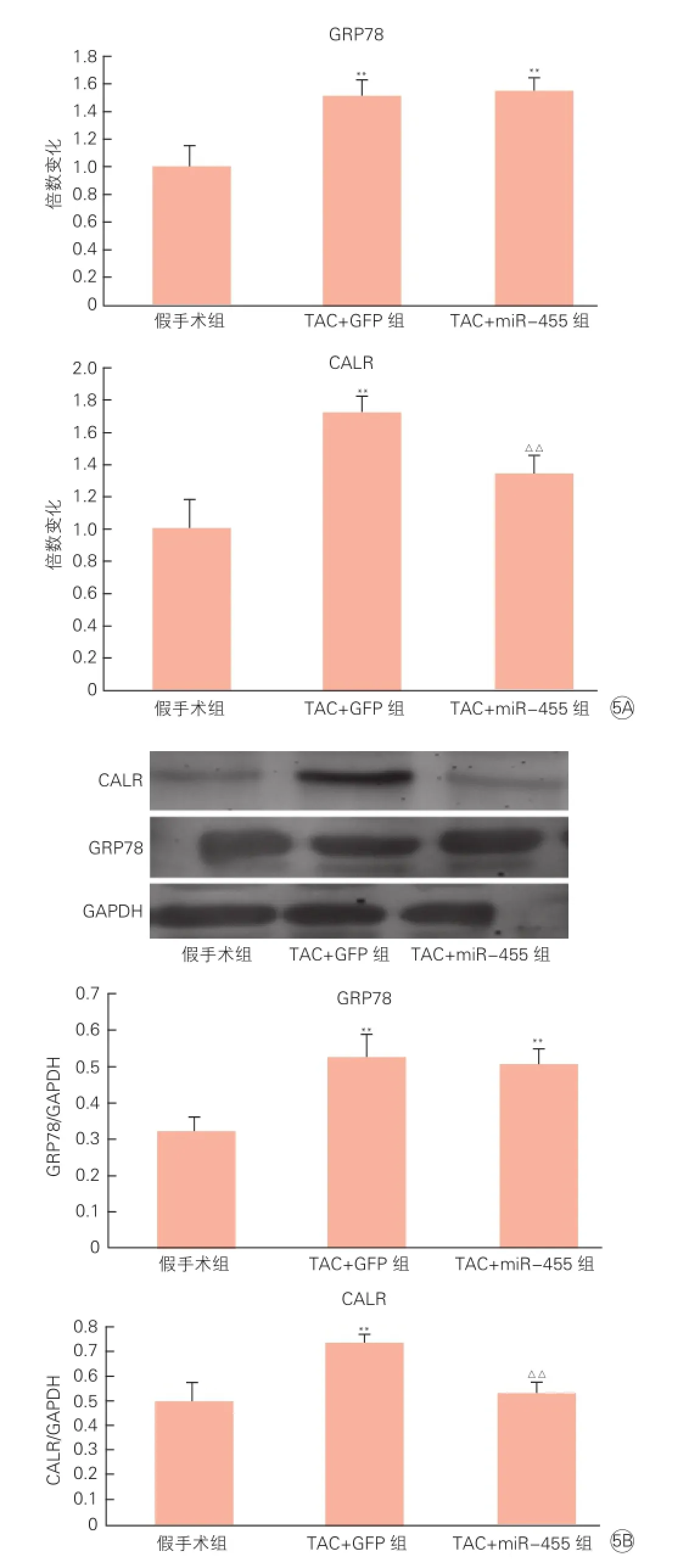
图5 荧光定量逆转录聚合酶链反应和免疫蛋白印迹法分析小鼠心肌miR-455的靶基因及靶蛋白表达
在这里第一次证明了在压力超负荷诱导的心肌肥厚小鼠体内miR-455是下调的。如果上调miR-455,会加速了小鼠的心肌肥厚,这与miR-455调控的靶mRNA——CALR密切相关。CALR是一种Ca2+结合分子伴侣,在维持细胞Ca2+稳态和协助蛋白质正确折叠上有关键调控,在成熟心脏中保持在低水平,一旦其基因转录再次活化,蛋白水平升高说明出现了心肌肥大等病理状态。
Tsutsui等[15]应用腹主动脉狭窄的方法,塑造了压力超负荷型的心肌肥厚大鼠模型,对大鼠进行心功能检查与CALR检测,发现大鼠心肌收缩力降低,肌浆网/内质网Ca2+-ATP酶(SERCA)蛋白水平降低,CALR表达上调;应用免疫组化方法,在对照组大鼠心脏中找到了CALR主要分布在间质成纤维细胞。
张振英等[16]发现腹主动脉狭窄可诱导大鼠心肌肥厚,与对照组比较,术后7天模型组大鼠内质网分子伴侣CALR mRNA 表达于术后1天即发生显著上调,较对照组增加136%,而蛋白在术后7天开始出现显著变化,较对照组升高69.2% 。我们的研究与以往研究相一致,即心肌肥厚会伴随CALR升高。实验中下调CALR导致心肌肥厚的加重,Lee等[17]发现CALR可以抑制去甲肾上腺素诱导心肌细胞肥厚,为我们的发现提供了有力的支持。下调CALR后,β肌球蛋白重链有明显增加,但仍可以看出LVEF有所升高,这种表现似乎与β肌球蛋白重链的作用不吻合。已知β-MHC与肌动蛋白的亲和力低于a肌球蛋白重链,故以β肌球蛋白重链为主的心肌收缩力弱,收缩速度减慢而导致心肌收缩功能减退,而本实验仅仅是TAC后两周,β肌球蛋白重链虽然升高,但并不能保证β肌球蛋白重链在肥厚心肌中的作用已超过α肌球蛋白重链,有可能两者最终的作用仍是α肌球蛋白重链为主,至于miR-455对TAC后长期心功能的影响尚需进一步实验证实。并且本实验进一步得出,CALR受到miR-455的调控,即CALR是miR-455的靶蛋白之一,如果上调miR-455那么CALR表现出下调的趋势,而且这种下调是通过降解靶mRNA实现,而非通过抑制其翻译实现。因此,可以通过下调miR-455使得心肌肥厚得到减轻,从而延缓心力衰竭的进程。
通常明显的心肌纤维化和凋亡多发生在慢性心衰的后期,此实验主要探讨短期TAC后miR-455的作用,虽然已出现心肌纤维化和凋亡发生,但miR-455尚未有显著作用,因此miR-455对长期TAC后心肌肥厚的影响还需要进一步实验证实。
[1] 陆永光.微小核糖核酸与冠心病关系的研究进展.中国循环杂志, 2010, 25: 484-486.
[2] 杨蕊珂, 杨丽红, 王淑辉, 等. 微小核糖核酸-34a对大鼠肥厚心肌组织肌球蛋白重链a基因表达的调控. 中国循环杂志, 2014, 29: 28-32.
[3] Carè A, Catalucci D, Felicetti F, et a1. MicroRNA-133 controls cardiac hypertrophy. Nat Med, 2007, 13: 613-618.
[4] van Rooij E, Sutherland LB, Liu N, et a1. A signature pattern of stressresponsive microRNAs that can evoke cardiac hypertrophy and heart failure. Proc Natl Acad Sci USA, 2006, 103: 18255-18260.
[5] van Rooij E, Sutherland LB, Qi X, et a1. Control of stress-dependent cardiac growth and gene expression by a microRNA. Science, 2007, 316: 575-579.
[6] Thum T, Gross C, Fiedler J, et a1. MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts. Nature, 2008, 456: 980-984.
[7] van Rooij E, Sutherland LB, Thatcher JE, et a1. Dysregulation of microRNAs after myocardial infarction reveals a role of miR-29 in cardiac fibrosis. Proc. Natl Acad Sci USA, 2008, 105: 13027-13032.
[8] Hu S, Huang M, Li Z, et a1. MicroRNA-210 as a novel therapy for treatment of ischemic heart disease. Circulation, 2010, 122: S124-S131.
[9] Wang X, Zhang X, Ren XP, et a1. MicroRNA-494 targeting both proapoptotic and antiapoptotic proteins protects against ischemia/ reperfusion-induced cardiac injury. Circulation, 2010, 122: 1308-1318.
[10] Belmont PJ, Chen WJ, Thuerauf DJ, et al. Regulation of microRNA expression in the heart by the ATF6 branch of the ER stress response. J Mol Cell Cardiol, 2012, 52: 1176-1182.
[11] Ujifuku K, Mitsutake N, Takakura S, et a1. miR-195, miR-455-3p and miR-10a(*) are implicated in acquired temozolomide resistance in glioblastoma multiforme cells. Cancer Lett, 2010, 296: 241-248.
[12] Walden TB, Timmons JA, Keller P, et a1. Distinct expression of muscle-specific microRNAs (myomirs) in brown adipocytes. J Cell Physiol, 2009, 218: 444-449.
[13] Panguluri SK, Bhatnagar S, Kumar A, et a1. Genomic profiling of messenger RNAs andmicroRNAs reveals potential mechanisms of TWEAK-induced skeletal muscle wasting in mice. PLoS One, 2010, 5: e8760.
[14] 段惠军, 朱德荣主编. 现代医学实验技术. 北京:人民卫生出版社, 2011: 651-652.
[15] Tsutsui H, Ishibashi Y, Imanaka-Yoshida K, et a1. Alterations in sarcoplasmic reticulum calcium-storing proteins in pressure overload cardiac hypertrophy. Am J Physiol, 1997, 272: Hl68-H175.
[16] 张振英, 刘秀华, 孙胜, 等. C/EBP 同源蛋白介导的内质网应激相关凋亡途径参与腹主动脉狭窄致大鼠心肌肥厚. Acta Physiologica Sinica, 2009, 61: 161-168.
[17] Lee KH, Lee N, Lim S, et al. Calreticulin inhibits the MEK1,2-ERK1,2 pathway in alpha 1-adrenergic receptor/Gh-stimulated hypertrophy of neonatal rat cardiomyocytes. J Steroid Biochem Mol Biol, 2003, 84: 101-107.
miR-455 Promotes Cardiac Hypertrophy Induced by Short-term Overloaded Pressure in Experimental Mice
WU Chun-tao, LI Yong-jun, LIU Su, WANG Zhi-yong.
Intensive Care Unit, The Third Hospital of Hebei Medical University, Shijiazhuang (050051), Hebei, China
Objective: To investigate the role of miR-455 in cardiac hypertrophy with its potential cellular and molecular mechanism in mice.
microRNA; Cardiac hypertrophy; Calreticulin
2014-08-20)
(编辑:许 菁)
050051 河北省石家庄市,河北医科大学第三医院 重症医学科(吴春涛、王智勇);河北医科大学第二医院 心内科(李拥军),心外科(刘苏)
吴春涛 副主任医师 博士 主要从事重症医学研究 Email:twbeer126@163.com 通讯作者:吴春涛
R54
A
1000-3614(2015)09-0889-06
10.3969/j.issn.1000-3614.2015.09.016
