内源性硫化氢与心血管疾病发生发展的研究进展
2015-12-16李贞李凯综述陈颖慧审校
李贞 、李凯综述,陈颖慧审校
内源性硫化氢与心血管疾病发生发展的研究进展
李贞 、李凯综述,陈颖慧审校
内源性硫化氢(H2S)是一种神经活性物质,其在人体多个系统中均发挥着重要的作用,属于在人体内被发现的第三类气体信号分子。在心血管系统中内源性H2S参与了多个生物学过程,与高血压、动脉粥样硬化、心肌缺血及心力衰竭密切相关,起到了保护心脏作用。现对内源性H2S与心血管疾病关系的最新研究进展做一综述。
内源性硫化氢;心力衰竭;高血压;动脉粥样硬化;心肌缺血
内源性硫化氢(H2S)是一种神经活性物质,其在心血管系统、消化系统、神经系统以及泌尿系统均发挥着重要的作用,属于继一氧化氮(NO)和一氧化碳(CO)后的第三类气体信号分子[1]。内源性H2S最早在20世纪90年代被发现,其能够舒张血管、抑制血管平滑肌及心肌负性肌力[2]。大量研究发现其在心血管疾病中具有调节作用,可抑制心力衰竭的发生,保护心脏[3]。心力衰竭作为心血管系统疾病的终末期表现,其经历了各种生理病理过程,现对内源性H2S在心血管疾病的发生发展中的研究做一综述。
1 内源性H2S的生物学特性
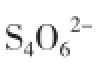
2 内源性H2S与心血管疾病
2.1 内源性H2S与高血压
高血压是心血管系统的常见病,以动脉血压升高为特征,造成心肌负荷过重代偿性肥厚。在高血压的发病生理病理学研究中血管重构为主要因素,大量研究发现内源性H2S具有舒张血管,调节血管平滑肌的作用[7], 内源性H2S通过兴奋三磷酸腺苷(ATP)敏感性钾通道(KATP),增加KATP通道电流,使细胞膜出现超极化从而舒张血管平滑肌,并且通过对主动脉平滑肌的调节抑制促分裂原活化蛋白激酶信号途径,激活半胱氨酸蛋白酶(caspase-3)途径维持血管结构及功能,抑制血管的重构,从而控制了血压。Yang等[8]在对小鼠CSE合成基因研究中发现内源性H2S在高血压的发病中具有重要作用。Lu等[9]发现内源性H2S可抑制血管紧张素转换酶的活性,降低肾素水平,抑制血管重构。内源性H2S不仅可以通过抑制促分裂素原活化蛋白激酶(MAPK)号途径抑制细胞增殖,也可以通过该途径EPK激活Caspase-3达到对细胞凋亡的调控[10]。
2.2 内源性H2S与动脉粥样硬化
动脉粥样硬化是冠心病的一个重要过程,发生机制尚未明确,可能与炎症反应相关,各种炎性因子参与动脉粥样硬化及心力衰竭的过程,内源性H2S通过抑制体内白细胞的迁移、黏附从而抑制核因子的激活并降低炎性因子的产生,发挥抗炎作用。有研究表明内源性H2S能够下调CX3CR1受体的表达和趋化,从而抑制炎性细胞的趋化作用[11,12]。在对小鼠载脂蛋白E(apoE)基因研究中发现,炔丙基甘氨酸能够通过抑制CSE活性降低内源性H2S水平,从而促进apoE-/-小鼠动脉粥样硬化的发生发展,扩大了硬化斑块,提升了脂质含量[13]。氯化高铁血红素介导的低密度脂蛋白的产生在动脉粥样硬化中有重要表现,在心肌损伤模型接受NaHS后,脂质过氧化物水平明显下降,可能是由于内源性H2S抑制了该过程从而阻滞了动脉粥样硬化的过程[14]。
2.3 内源性H2S与心肌缺血
急性心肌缺血会出现心肌细胞凋亡,心肌细胞属于细胞分化的终末期阶段不可再生。内源性H2S能够促进化学修饰、激活通路,对抗心肌缺血的发生[15]。有研究表明内源性H2S水平与心肌缺血严重程度可能负相关[16]。但有研究表明内源性H2S水平只在一定范围内参与心肌保护,当超过这一范围则保护作用消失[17]。内源性H2S对于心肌的保护作用通过多条途径,一是抑制核因子kB(NF-kB)活化,减少相关蛋白
的表达抑制炎性作用;其次通过调节抗氧化因子的水平;再次通过激活各种信号途径,调节细胞凋亡[18]。Grimm等[19]在大鼠心肌缺血模型中发现,CSE活性降低,内源性H2S含量明显减少,给予NaHS后提高了心肌灌注量,内源性H2S通过降低过氧化反应达到了改善心肌损伤的作用。
2.4 内源性H2S与心力衰竭
心力衰竭作为心血管系统疾病终末期表现,对其防治尤为重要,其可能与机体炎症反应、氧化应激过程以及心肌细胞的凋亡都紧密联系,内源性H2S可抑制炎性因子从而对抗炎症反应,还可通过抗氧化作用抑制心血管中过多的活性氧(ROS)导致的病变,并且可以通过调节细胞的增殖及凋亡,抑制心肌细胞凋亡,从而达到改善心功能的目的。大量研究均表明内源性H2S与心力衰竭相关。Liu等[20]研究发现,内源性H2S通过上调内皮型NO可以减缓压力负荷,对心力衰竭起到保护作用。有研究表明不同浓度内源性H2S可明显降低巨噬细胞COX-2的表达及泡沫化,250 μmol/L作用最为明显[21]。在对老年缺血性心力衰竭患者体内内源性H2S水平的检测中发现其明显低于正常老年人水平,且与心功能分级呈负相关。Kovacic等[22]发现纽约心脏协会(NYHA)心功能分级Ⅳ级血清内源性H2S水平最低,且内源性H2S低水平为心力衰竭患者死亡的高危险因素。
3 展望及意义
内源性H2S参与了机体多种生理病理过程,机体对其血清浓度水平非常敏感,对于内源性H2S的药物性使用研究有待展开。单纯H2S属于有毒气体,水溶液性质不稳,NaHS也极易分解,均不能直接作为药物使用。英国学者与2008年发现的H2S缓释剂GYY4137,国内于芳等[23]发现该缓释剂较稳定,毒副作用相对较低,仅适用于急性动物实验。在随后进一步研究中发现了大量衍生物均可作为内源性H2S的供体,如ATB-337、ATB-343、ACS67等,且部分药物进入临床试验阶段[24,25],ATB-337、ATB-343及ACS67均属于非甾体类抗炎药,前两者是以双氯芬酸及吲哚美辛为母体的衍生物结合内源性H2S所得,后者是拉坦前列腺素的衍生物,都可作为载体进入体内释放出内源性H2S。
综上,内源性H2S研究对心血管系统疾病意义显著,从病理生理方面揭示了该类疾病发生发展的机制,为临床的应用提供了依据。但内源性H2S相关研究的时间还较短,大量生物学效应及与各疾病的关系尚待进一步研究,对深入了解更多疾病的发病机制及治疗方案具有重要价值。
[1] Szabo G, Veres G, RadovitsS T, et al. Cardioprotective effects of hydrogen sulfide. Nitric Oxide, 2011, 25: 201-210.
[2] Qipshidze N, Metreveli N, Paras K, et al. Hydrogen sulfide mitigates cardiac remodeling during myocardial infarction via improvement of angiogenesis. Int J Biol Sci, 2012, 8: 430-441.
[3] Huang J, Wang DM, Zheng JB, et al. Hydrogen sulfide attenuates cardiac hypertrophy and fibrosis induced by abdominal aortic coarctation in rats. Mol Med Rep, 2012, 5: 923-928.
[4] 耿彬, 闫辉, 钟光珍, 等. 硫化氢—心血管功能调节的新型气体信号分子. 北京大学学报(医学版). 2004, 36: 106.
[5] Furne J, Springfield J, Koenig T, et al. Oxidation of hydrogen sulfide and methanethiol tothiosulfate by rat tissues: A specialized function of the colonicmucosa. Biochem Pharmacol, 2001, 62: 255-259.
[6] Singh S, Banerjee R. PLP-dependent H2S biogenesis. Biochim Biophys Acta, 2011, 1814: 1518-1527.
[7] Streeter E, NG HH, Hart JL. Hydrogen sulfide as a vasculoprotective factor. Med Gas Res, 2013, 3: 9.
[8] Yang G, Wu L, Jiang B, et al. H2S as a physiologic vasorelaxant Hypertension in mice with deletion of cystathionine r-lyase. Science, 2008, 322: 587-590.
[9] Lu M, Liu YH, Goh HS, et al. Hydrogen sulfide inhibits plasma renin activity. Am Soc Nephrol, 2010, 21: 993-1002.
[10] Hamid T, Guo SZ, Kingery JR, et al. Cardiomyocytc NF-kB p65 promotes adverse remodelling, apoptosis, and endoplasmic reticulum stress in heart failure. Cardiovase Res, 2010, 89: 129-138.
[11] 孙余华, 裴卫东. 炎症与动脉粥样硬化基础和临床研究的新进展.中国循环杂志, 2003, 3: 74-77.
[12] Zhang H, Guo C, Wu D, et al. Hydrogen sulfide inhivits the development of atherosclerosis with suppressiong CX3CR1 and CX3CL1 expression. PloS One, 2012, 7: e41147.
[13] Wang Y, Zhao X, Jin H, et al. Role of hydrogen sulfide in the development of atherosclerotic lesions in apolipoprotein E knockout mice. Arterioscler Thromb Vasc Biol, 2009, 29: 173-179.
[14] 王文, 朱曼璐, 王拥军, 等. 《中国心血管病报告2012》概要. 中国循环杂志, 2013, 6: 408-412.
[15] Lynch SM, Campione AL, Moore MK. Plasma thiols inhibit hemindependent oxidation of human low-density lipoprotein. Biochim Biophys Acta, 2000, 1485: 11-22.
[16] 韩文章, 蔡尚郎. 冠心病患者血浆硫化氢含量变化. 实用医药杂志, 2007, 24: 13-16.
[17] Johansen D, Ytrehus K, Baxter GF. Exogenous hydrogen sulfide protects against regional myocmdial ischemia-reperfusion injuryevidence for a role of K ATP channels. Basic Res Cardiol, 2006, 101: 53-60.
[18] Calvert JW, Coetzee WA, Lefer DJ. Novel insights into hydrogen sulfide-mediated cytoprotection. Antioxid Redox Signal, 2010, 12: 1203-1217.
[19] Grimm D, Elsner D, Schunkert H, et al. Development of heart failure following isoproterenol administration in th rat: role of the reninangiotensin system. Cardiovase Res, 1998, 37: 91-100.
[20] Liu YH, Lu M, Xie ZZ, et al. Hydrogen sulfide prevents heart failure development via inhibition of renin release from mast cells in isoproterenol-treated rats. Antioxid Redox Signal, 2014, 20: 759-769. [21] 梁小燕, 周红, 戚晓红, 等. H2S显著减少巨噬细胞COX-2表达和泡沫化. 南京医科大学学报(自然科学版), 2014, 2: 139-143.
[22] Kovacic D, Glavnik N, Marinsek M, et al. Total plasma sulfide in congestive heart failure. J Card Fail, 2012, 18: 541-548.
[23] 于芳, 赵晶, 唐朝枢, 等. 自行合成硫化氢缓释供体 GYY4137 对细胞活力的影响及其释放的硫化氢在小鼠体内的分布. 北京大学学报(医学版), 2010, 42: 493-497.
[24] 杨雪, 刘洁, 吴晓明, 等. H2S气体分子及相关药物研究进展. 药学与临床研究, 2014, 2: 128-133.
[25] Perrino E, Uliva C, Lanzi C, et al. New prost agland in derivative for glaucoma treatment. Bioorg Med Chem Lett, 2009, 19: 1639-1642.
2014-12-28)
(编辑:曹洪红)
710021 陕西省西安市,西安医学院 外科教研室(李贞);西安医学院第一附属医院 心内科(李凯);陕西省人民医院 (陈颖慧)
李贞 讲师 硕士 研究方向为外科、急危重症教学工作 E mail:: sxlilala@163.com 通讯作者:陈颖慧 E mail: Limingxuanli@163.com
R541
A
1000-3614(2015)09-0922-02
10.3969/j.issn.1000-3614.2015. 09.024
