心肾综合征模型建立及肾素原受体信使核糖核酸表达的研究
2015-12-16王蕾王梓郝迪李旭袁玲刘洪斌
王蕾,王梓,郝迪,李旭,袁玲,刘洪斌
心肾综合征模型建立及肾素原受体信使核糖核酸表达的研究
王蕾,王梓,郝迪,李旭,袁玲,刘洪斌
目的:通过“腹主动脉缩窄(CAA)合并肾脏急性缺血再灌注损伤(RIRI)”建立大鼠心肾综合征(CRS)模型,并观察肾素原受体信使核糖核酸的表达。
方法:将42只Wistar大鼠按照体重随机分成4组(每组10只,造模过程中死亡2只):假手术组、CAA组、RIRI组、CAA+ RIRI组。术后观察16周。酶联免疫法测定血清B型利钠肽(BNP),苦味酸法测定血肌酐(Cr),酶偶联速率法测定血清尿素氮(BUN),放射免疫法测定血浆肾素活性、血管紧张素-Ⅰ(Ang-Ⅰ)和Ang-Ⅱ、醛固酮含量;小动物超声心动图监测大鼠心脏舒张末期室间隔厚度(IVS)、舒张末期左心室后壁厚度(LVPW)、左心室射血分数(LVEF);记录心室重量指数、全心重量指数、肾脏重量指数,苏木素-伊红(HE)染色观察心肌、肾脏组织病理变化;荧光定量聚合酶链式反应法测定心室肌、肾脏组织肾素原受体信使核糖核酸表达。
结果:CAA、RIRI、CAA+RIRI三组血清BNP均较假手术组明显升高(P<0.05);CAA+RIRI组血清Cr、BUN较CAA组显著升高(P<0.01),血浆醛固酮含量较假手术组和RIRI组均明显升高(P均<0.05);CAA+RIRI组的肾素活性较CAA组明显升高(P<0.05),但三个术式组血浆Ang-Ⅰ、Ang-Ⅱ无明显升高(P>0.05)。CAA+RIRI组IVS和LVEF变化程度较CAA组更明显(P均<0.01),CAA+RIRI组心室肥厚较RIRI组明显(P<0.05)。CAA+RIRI组心室和全心重量明显高于RIRI组(P<0.05),HE染色可见心肌细胞束的间隙稍增宽;左肾指数减小程度最明显,肾小管重度萎缩,部分肾小球萎缩。荧光定量聚合酶链式反应结果显示,假手术组大鼠心室肌和肾脏组织中均有肾素原受体表达,CAA、RIRI、CAA+RIRI三组大鼠肾素原受体表达均较假手术组减弱。
结论:CAA+RIRI复合术式对心肌和肾脏同时构成损伤,损伤程度较CAA或RIRI单一术式更严重,手术方法可控性好、一致性高。该方法为肾素原受体用于CRS的治疗新途径研究提供了方法学参考。
肾素原受体;心肾综合征;肾脏急性缺血再灌注损伤;腹主动脉缩窄
Methods: A total of 42 Wistar rats were randomly divided into 4 groups: Sham group, CAA group, RIRI group and CAA+RIRI group. n=10 in each group, 2 rats died during the modeling and all animals were treated for 16 weeks. Blood levels of BNP, creatinine (Cr), urea nitrogen (BUN), the activity of rennin, the contents of angiotensin-I (AT-I), AT-II and aldosterone were examined by laboratory test. The diastolic end inter-ventricular septum thickness (DEIVST), DELVPT, LVEF, ventricular weight index (VWI) and cardiac weight index were detected by small animal echocardiography. The histological changes of myocardium and kidney tissue were measured by HE staining, and the mRNA expressions of pro-renin receptor in myocardium and kidney tissues were measured by RT-PCR.
Results: Compared with Sham group, blood levels of BNP were increased in the other 3 groups, P<0.05; compared with CAA group, CAA+RIRI group had increased levels of Cr and BUN, P<0.01; compared with Sham group and RIRI group, CAA+RIRI group showed increased blood level of aldosterone, P<0.05. Compared with CAA group, CAA+RIRI group presented increased rennin activity, P<0.05. Blood levels of AT-I and AT-II were not significantly increased among 3 operation groups, P>0.05. Compared with CAA group, CAA+RIRI group had more obvious changes of DEIVST and LVEF, P<0.01. Compared with RIRI group, CAA+RIRI group had more obvious ventricular hypertrophy, higher VWI and cardiac weight index, all P<0.05. HE staining presented that CAA+RIRI group had broadening of myocardial cell bundle space, decreased left renal index, severe tubular atrophy and partial glomerular atrophy. RT-PCR demonstrated that compared with Sham group, the mRNA expressions of pro-renin receptor in myocardium and kidney tissues were decreased in the other 3 groups.
Conclusion: Combined CAA+RIRI method may damage the cardial and renal tissues at the same time which was more severe than either CAA or RIRI. While CAA+RIRI model has better controllability and higher consistency that provides a methodological reference for pro-renin receptor in treating CRS in experimental rat’s model.
(Chinese Circulation Journal, 2015,30:895.)
心肾综合征(CRS)是心脏和肾脏衰竭的终末期阶段,在已报道的动物模型中,难以实现“心损及肾、肾损及心”或“心肾共损”的病理程度,一定程度上限制了CRS的研究。本研究旨在通过腹主动脉缩窄(CAA)+肾脏急性缺血再灌注损伤(RIRI)造模方法来增加心脏和肾脏的损伤程度,实现心肾功能共损、互损,模拟临床CRS病变特点。
肾素原受体广泛存在于心脏、脑、肾脏、胚胎和肝脏,肾素原与肾素原受体结合后构象发生变化,使血管紧张素原向血管紧张素-Ⅰ(Ang-Ⅰ)转化的效率提高至4倍[1,2]。肾素原受体还具备亚细胞功能[3],可以激活细胞内信号转导途径[2],在糖尿病肾病和心脏纤维化的研究中具有重要意义[4,5]。本研究观察CRS大鼠模型心室肌和肾脏中肾素原受体表达情况,以阐明肾素原受体对心肾共损的介导作用,为肾素原受体用于CRS的治疗新途径研究提供方法学参考。
1 材料和方法
材料和分组:Wistar大鼠42只,雌雄各半,体重290~300 g,购自中国军事医学科学院卫生学环境医学研究所实验动物中心[许可证号:SCXK(军)2009-0003和SCXK(京)2006-0009],随机分为4组(每组10只):假手术组、CAA组、RIRI组、CAA+ RIRI组(造模过程中死亡2只)。
造模方法:假手术组大鼠仅开腹,腹腔内滴入庆大霉素预防感染,分层关闭腹腔。CAA组建立慢性心力衰竭大鼠模型。大鼠经腹腔注射戊巴比妥钠45 mg/kg麻醉后,暴露分离后腹膜,在左肾动脉上方游离腹主动脉,将腹主动脉缩窄成直径为0.7 mm的残腔。RIRI组建立急性肾损伤-慢性肾脏病模型。大鼠经腹腔注射戊巴比妥钠45 mg/kg麻醉后,阻断肾蒂结扎30 min后,恢复血流。CAA+RIRI组大鼠先行RIRI手术,恢复血流后即刻行CAA手术,建立CRS模型。
试剂和设备:2×NI-RT Master Mix(目录号:306503),×Real Master Mix (SYBR GreenI)(目录号:308101),I-DNA Marker Ⅰ(目录号: A01103)。Visual Sonic Vevo®2100小动物超声成像系统;全自动双探头放射免疫γ计数器(SN-697);科华360酶标仪;Bio-rad IQ5 实时定量PCR仪;日本Fisher Model 266 MP自动石蜡包埋机;西德Leica RM2135切片机;日本OLYMPUS B071型显微摄影器材;IDA-2000高清晰度数码显微图像分析系统;偏振光显微镜(日本奥林巴斯公司,型号:OLYMPUS BX53)。
大鼠血清B型利钠肽(BNP)、血清尿素氮(BUN)、血肌酐(Cr)的测定:术后16周,大鼠经腹主动脉采血,2 500 r/min离心15 min,分离血清。酶联免疫法测定BNP含量,酶偶联速率法测定BUN,苦味酸法测定血Cr。
大鼠肾素—血管紧张素—醛固酮系统相关指标测定:大鼠全血分别置特殊抗凝及肝素抗凝,放射免疫法测定肾素活性、Ang-Ⅰ、Ang-Ⅱ、醛固酮含量。
大鼠超声心动图检查:大鼠麻醉后,固定于小动物解剖台上,分别测量心脏舒张末期室间隔厚度(IVS)、舒张末期左心室后壁厚度(LVPW)、左心室射血分数(LVEF),各个值分别取3个心动周期的平均值。
大鼠全心、心室、肾脏重量指数:将大鼠心脏及双侧肾脏取出,分离心室,称量全心湿重、心室
湿重、左肾湿重、右肾湿重,计算全心重量指数(全心肌湿重×100%/体质量)、心室重量指数(心室肌湿重×100%/体质量)、左侧和右侧肾脏重量指数(肾脏湿重×100%/体质量)。
大鼠心肌、肾脏组织病理苏木素-伊红(HE)染色:10%福尔马林液固定大鼠心脏、肾脏组织标本,常规取材,酒精梯度脱水,Leica EG1150H自动生物组织包埋机包埋,Leica RM2255切片机制片,HE染色,OLYMPUS显微镜观察,IDA-2000高清晰度数码显微图象分析系统采图。
大鼠心室肌和肾脏肾素原受体信使核糖核酸(mRNA)表达:(1)RNA提取[1]:mRNA逆转录合成反向转录脱氧核糖核酸(cDNA)、聚合酶链式反应扩增肾素原受体。用GAPDH作为内参。大鼠肾素原受体上游引物:TGACCTGCTATTTCTTTCTG;下游引物:TCTTCTCCATAACGCTTCC,产物长度为150 bp。大鼠GAPDH上游引物:TTCAACGGCACAGTCAAG;下游引物:CCACGACATACTCAGCAC,产物长度为124 bp。肾素原受体 mRNA相对表达量计算方法:目的基因量=2-△△Ct(2-△△Ct表示的是实验组目的基因的表达相对于对照组的变化倍数);△△Ct=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组。
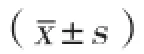
2 结果
四组大鼠血清BNP、Cr、BUN比较(表1):与假手术组比较,CAA、RIRI、CAA+RIRI三组大鼠血清BNP均明显升高(P<0.05),CAA组大鼠血清BUN和Cr明显升高,RIRI组大鼠术后16周血清BUN和Cr恢复至正常水平,CAA+RIRI组大鼠血清BUN和Cr升高,与CAA组间的差异均有统计学意义(P<0.01)。
四组大鼠肾素—血管紧张素—醛固酮系统相关指标的比较(表2):肾素活性在三个手术组表现不一致,CAA组肾素活性不升高,RIRI组与CAA+RIRI组肾素活性升高不明显,但CAA+RIRI组肾素活性较CAA组明显升高(P<0.05)。三个手术组Ang-Ⅰ和Ang-Ⅱ均未明显升高。CAA+RIRI组醛固酮水平较假手术组(P<0.05)和RIRI组(P<0.01)均明显升高。
表1 四组大鼠血清B型利钠肽、尿素氮和肌酐的比较(

表1 四组大鼠血清B型利钠肽、尿素氮和肌酐的比较(
注:CAA:腹主动脉缩窄;RIRI:肾脏急性缺血再灌注损伤。与假手术组比较*P<0.05**P<0.01;与CAA组比较△P<0.05;与RIRI组比较▲P<0.01
?
表2 四组大鼠肾素—血管紧张素—醛固酮系统相关指标的比较
注:与假手术组比较*P<0.05;与CAA组比较△P<0.05;与RIRI组比较▲P<0.01。余注见表1
?
四组大鼠超声心动图检查结果比较(表3):与假手术组比较,CAA组与CAA+RIRI组大鼠心脏舒张末期IVS和LVPW明显增高(P均<0.01),LVEF明显降低(P<0.01),而上述指标在RIRI组与假手术对照组之间的差异无统计学意义。CAA+RIRI组大鼠心脏舒张末期IVS和LVEF变化程度较CAA组更明显(P均<0.01)。
表3 四组大鼠超声心动图检查结果比较
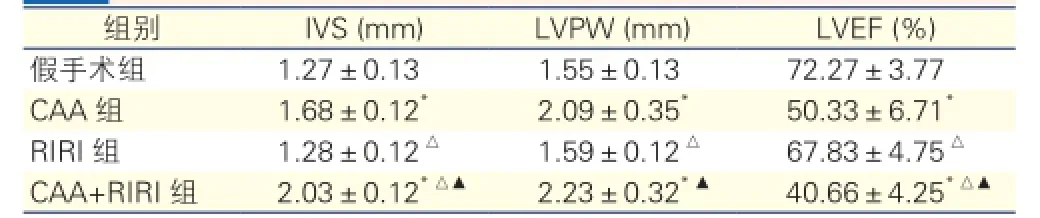
表3 四组大鼠超声心动图检查结果比较
注:IVS:室间隔厚度; LVPW:左心室后壁厚度; LVEF:左心室射血分数。与假手术组比较*P<0.01;与CAA组比较△P<0.01;与RIRI组比较▲P<0.01。余注见表1
?
四组大鼠心脏和肾脏重量指数比较(表4):(1)心脏重量指数变化:CAA组与CAA+RIRI组大鼠全心和心室重量指数均明显高于假手术组(P<0.01),RIRI组大鼠心脏重量指数较假手术组无明显增加(P>0.05)。CAA+RIRI组大鼠较RIRI组心室明显肥大(P<0.05),但与CAA组间的差异无统计学意义(P>0.05)。(2)肾脏重量指数变化:与假手术组相比,RIRI组大鼠左肾未明显缩小,CAA组和CAA+RIRI组大鼠左肾重量指数均明显减小(P均<0.01),CAA+RIRI组变化较CAA组更明显。CAA、RIRI、CAA+RIRI三组大鼠右肾重量指数较假手术组均明显增加(P均<0.01),CAA+RIRI组右肾代偿最明显,与CAA组和RIRI组比较均有显著差异(P均<0.01)。
表4 四组大鼠心脏和肾脏重量指数比较
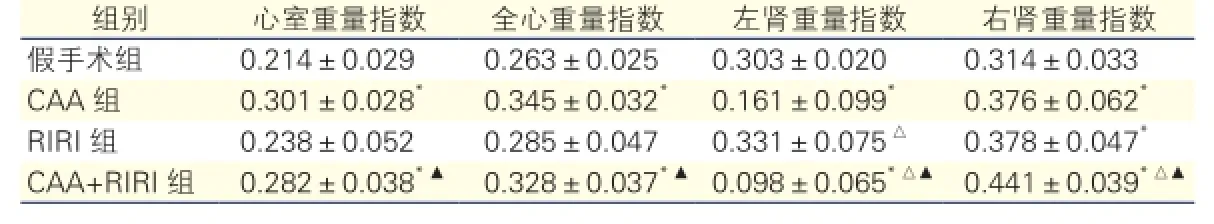
表4 四组大鼠心脏和肾脏重量指数比较
注:与假手术组比较*P<0.01;与CAA组比较△P<0.01;与RIRI组比较▲P<0.01。余注见表1
?
大鼠心肌和肾脏HE染色(图1):CAA组心肌间隙增宽,RIRI组肾组织病理改变不明显,而CAA+RIRI组大鼠心肌和肾脏均有病理性改变,左肾肾小管重度萎缩,部分肾小球萎缩,可见管型(图1A),肾实质见大片坏死并有脂褐素沉着(图1B);心肌细胞束的间隙稍增宽,心肌细胞着色不均(图1C)。

图1 CAA+RIRI组大鼠心脏和肾脏苏木素-伊红染色(×200)
四组大鼠心室肌和肾脏组织中肾素原受体mRNA的表达情况(图2):荧光定量聚合酶链式反应检查结果显示,假手术组大鼠心室肌和肾脏组织中均有肾素原受体 mRNA表达,CAA、RIRI、CAA+RIRI三组大鼠肾素原受体 mRNA表达均较假手术组减弱(P<0.01),差异有统计学意义。
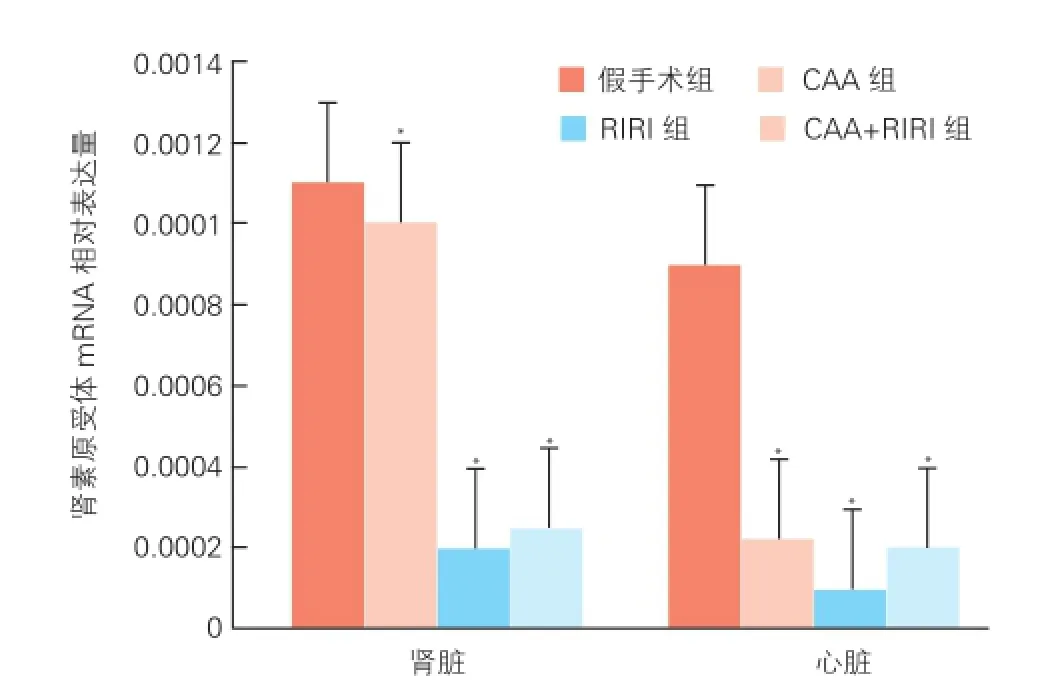
图2 四组大鼠肾脏和心肌中肾素原受体信使核糖核酸相对表达量(n=10)
3 讨论
目前较为经典的慢性心力衰竭动物造模方法有:手术致心脏前、后负荷加重,冠状动脉结扎致缺血性心肌病,心肌毒性化学物质,基因敲除及转基因动物等;肾脏衰竭造模多采用单侧全肾或部分肾组织切除、肾蒂或肾动脉永久结扎或缺血再灌、化学物质合并肾脏切除术等方法。以上各方法均可模拟不同程度的心脏、肾脏功能损伤,但在“心肾共损”程度上难以满足基础研究需要。已报道的CRS造模方法大多为大鼠急性心肌缺血合并肾组织切除术[6-9],且这种方法对心肾损伤的程度,既往报道不一致。此次我们采用CAA法致慢性心力衰竭、RIRI法致慢性肾脏病,其病生理过程更模拟人类疾病的发展特点。
大鼠肾脏RIRI模型手术操作简单,不出血,手术过程可控性好,一致性强[10]。在RIRI致急性肾脏损伤转归为慢性肾脏病的报道中,可见肾脏缺血再灌注24 h内,肾脏血流量下降50%~75%,同时伴随血清Cr急剧升高,术后1~2周恢复至正常水平[7],2~4周内肾小管结构分化重建[11]。蛋白尿和肾间质纤维化改变是由急性肾脏损伤向慢性肾脏病转变的内在修复过程[12],管周毛细血管稀疏是肾脏纤维化前的恢复阶段,但可加重缺氧,从而向慢性肾脏病发展。我们的研究证实,急性肾脏损伤可造成肾脏缺血、纤维化、坏死。RIRI合并CAA术式可明显加重肾脏损伤程度。
肾素原受体的功能主要有Ang-Ⅱ依赖和非Ang-Ⅱ依赖两方面,目前对肾素原受体治疗机制的研究热点集中在后者。肾素和肾素原与肾素原受体结合后,肾素原受体可诱导丝氨酸和络氨酸残基的磷酸化(MAPK),激发MAPK细胞外信号调节激酶(ERK1/2)的转导途径,使纤溶酶原激活物抑制剂(PAI-1)生成增加[4]。ERK1/2细胞信号转导作用即使在Ang-Ⅱ受体拮抗剂(ARB)氯沙坦存在的情况下亦能被激活[13],表明这一作用是不依赖于Ang-Ⅱ的产生,而是通过受体直接介导的。Huang等[13]的研究证实,在大鼠巨噬细胞中,肾素可以通过肾素原受体增强ERK磷酸化,从而增加转化生长
因子-β1、纤维连接蛋白、Ⅰ型胶原和PAI-1的表达,进而引起肾脏纤维化,而血管紧张素转换酶抑制剂和ARB无法抑制这一信号传导通路。有研究报道,ERK1/2的表达和活化可能参与了糖尿病肾病小鼠肾纤维化的发病过程[14]。因此,肾素原受体在CRS大鼠心脏和肾脏的表达是对肾素原受体介导MAPK信号通路对CRS进行调控的实验基础。本研究表明,肾素原受体 mRNA在假手术组大鼠心室肌和肾脏组织中均有表达,而在CAA、RIRI、CAA+RIRI三组大鼠中的表达均减弱,CAA+RIRI组大鼠心肌和肾脏纤维化明显。
综上所述,CAA+RIRI手术方法操作简单、可控性好、一致性高,可在不同程度加剧慢性心力衰竭和慢性肾脏病进展。该方法建立的CRS模型可用来研究肾素原受体介导的心肌和肾脏纤维化的调控作用机制,为肾素原受体用于CRS的治疗新途径研究提供了方法学参考。
[1] 贺明, 黄娅林, 张琳, 等. 肾素(原)受体在大鼠肾小球系膜细胞和肾脏的表达. 生理学报, 2007, 59:796-804.
[2] Nguyen G, Delarue F, Burckle C, et al. Pivotal role of the reninprorenin receptor in angiotensin Ⅱ production and cellular responses to renin. J Clin Invest, 2002, 109: 1417-1427.
[3] Sihn G, Burckle C, Rousselle A, et al. (Pro)renin receptor: subcellular localizations and functions. Front in Biosci, 2013, 1: 500-508.
[4] Ichihara A, Hayashi M, Kaneshiro Y, et al. Inhibition of diabetic nephropathy by a decoy peptide corresponding to the “handle” region for nonproteolytic activation of prorenin. J Clin Invest, 2004, 114: 1128-1135.
[5] Ichihara A, Kaneshiro Y, Takemitsu T, et al. Nonproteolytic activation of prorenin contributes to development of cardiac fibrosisi in genetic hypertension. Hypertension, 2006, 47: 894-900.
[6] Szymanski MK, de Boer RA, Navis GJ, et al. Animal models of cardiorenal syndrome: a review. Heart Fail Rev, 2012, 17: 411-420. [7] Basile DP. The endothelial cell in ischemic acute kidney injury: implications for acute and chronic function.Kidney Int, 2007, 72: 151-156.
[8] Dikow R, Kihm LP, Zeier M, et al. Increased infarct size in uremic rats: reduced ischemia tolerance? J Am Soc Nephrol, 2004, 15: 1530-1536.
[9] 王蕾, 郝迪, 李旭, 等. 心肾综合征动物模型研究进展. 中国药理学通报, 2013, 29: 1496.
[10] Li YW, Zhang Y, Zhang L, et al. Protective effect of tea polyphenols on renal ischemia/reperfusion injury via suppressing the activation of TLR4/NF-κB p65 signal pathway. Gene, 2014, 542: 46-51.
[11] Venkatachalam MA, Griffin KA, Lan R, et al.Acute kidney injury: a springboard for progression in chronic kidney disease. Am J Physiol Renal Physiol, 2010, 298: F1078-1094.
[12] Basile DP. Rarefaction of peritubular capillaries following ischemic acute renal failure: a potential factor predisposing progressive nephropathy. Curr Opin Nephrol Hypertens, 2004, 13: 1-13.
[13] Huang Y, Wongamorntham S, Kasting J, et al. Renin increases mesangial cell TGF-β1and matrix proteins through receptormediated, angiotensin II-independent mechanisms. Kindney Int, 2006, 69: 105-113.
[14] 常巨平, 祝胜郎, 余学清, 等. ERK1/2信号蛋白在糖尿病小鼠肾组织中的表达. 中国病理生理杂志, 2007, 23: 1804-1807.
Establishment of Cardio-renal Syndrome and the mRNA Expression of Pro-renin Receptor in Experimental Rat’s Model
WANG Lei, WANG Zi, HAO Di, LI Xu, YUAN Ling, LIU Hong-bin.
Tianjin Institute of Medical and Pharmaceutical Sciences, Tianjin (300020), China
Objective: To establish the cardio-renal syndrome (CRS) model by coarctation of abdominal aorta (CAA) with renal ischemia reperfusion injury (RIRI), and to observe the mRNA expression of pro-renin receptor [(P)RR] in experimental rats.
Pro-renin receptor; Cardio-renal syndrome; Acute renal ischemia reperfusion injury; Coarctation of abdominal aorta
2015-01-30)
(编辑:朱柳媛)
国家自然科学基金青年科学基金项目(81202801);天津市中医药管理局中医、中西医结合专项(13180)
300020 天津市医药科学研究所
王蕾 副研究员 硕士 主要研究方向为心脑血管药理学 Email: zws9905@sina.com 通讯作者:刘洪斌 Email: jtss@sina.com
R54
A
1000-3614(2015)09-0895-05
10.3969/j.issn.1000-3614.2015.09.017
