BikDD肿瘤靶向基因治疗抑制淋巴瘤细胞生长研究*
2015-12-06李建璜
曹 军,罗 宁,李建璜△
1.中南大学湘雅医学院附属肿瘤医院 胸部内二科(长沙 410013);2.中南大学湘雅医院 肿瘤科(长沙 410008)
恶性淋巴瘤是危害人类健康的重要疾病之一,其主要治疗方法为化学药物治疗和放射治疗,但上述方法对于进一步提高其生存率作用有限。随着基因工程技术的飞速发展,基因治疗已成为淋巴瘤治疗研究的热点,并取得了较多的成果,但目的基因表达靶向性差及表达效率低是限制其临床应用的关键问题。本课题组成员前期研究已成功构建出能在淋巴瘤细胞中高效特异性表达目的基因的S-VISA载体[1],很好地解决了以上问题。因而,如何选择有效的治疗基因成为淋巴瘤基因治疗的关键。
细胞凋亡通路障碍是淋巴瘤发生发展过程中最重要的分子事件之一,因此,诱导肿瘤细胞凋亡成为淋巴瘤基因治疗的思路之一。Bcl-2家族包括凋亡抑制蛋白Bcl-2、Bcl-XL、Bcl-w、Mcl-1等,促凋亡蛋白质如 Bik、Bad、Bax等[2]。Bik(Bcl-2interacting killer)作为Bcl-2家族中一种仅含BH3结构域的促凋亡蛋白质,能结合的Bcl-2家族凋亡抑制蛋白最多,且与 Bcl-2及 Mcl-1的结合力最强[3]。既往研究[4-6]表明,将Bik的第33位苏氨酸残基和第35位丝氨酸残基替换为门冬氨酸,使其成为突变型Bik(BikDD),BikDD在肺癌、乳腺癌及前列腺癌等恶性肿瘤中促进细胞凋亡和抑制细胞生长的能力比野生型Bik更强。
本实验拟构建含BikDD、Survivin启动子及VISA系统的表达质粒S-VISA-BikDD,将其转染淋巴瘤细胞株,研究其在淋巴瘤细胞中的作用。
1 材料与方法
1.1 材料
1.1.1 质粒 pGL3-Survivin质粒由本科室唐友红博士惠赠[7],pCMVgDWPRE质粒由意大利帕尔马大 学 Dr Gaetano Donofrio 惠 赠[8],TSTA-NSN质粒由美国加州大学洛杉矶分校医学院Dr Mike Carey惠 赠[9],pGL3-CMV、pGL3-Basic质 粒 购 自Promega公司。
1.1.2 细胞 人淋巴瘤 Ramos、U937、Raji细胞株购自上海麦莎生物科技有限公司,人肝细胞株Chang Liver购自中科院上海生命科学院细胞所。
1.1.3 试剂 实验所用内切酶均为NEB产品,连接酶(宝灵曼B.M 公司),DNA连接酶、luciferase assay system试剂盒(美国Promega公司)。新生小牛血清(杭州四季青生物公司),DMEM、RPMI 1640培养基(美国Gibco公司),质粒小量提取试剂盒(美国Omega公司)、胶回收试剂盒(TaKaRa公司),基因定点突变试剂盒(碧云天生物技术研究所),鼠抗人Bik单克隆抗体(台湾Abnova公司)。
1.2 方法
1.2.1 pGL3-Bik载体的构建 根据 GenBank的Bik基因序列设计引物,上游引物序列为:5'CGAAGATCTATGTCTGAAGTAAGACC 3'(包含起始密码子,并在5'端引入BgiⅡ酶切位点);下游引物序列为:5'CCAAGCTTTCACTTGAGCAGC AGGT 3'(在5'端引入 HindⅢ酶切位点),引物由上海英骏生物技术有限公司合成。Trizol法提取人类肠基因组RNA,以此为模板,PCR扩增Bik基因,反应条件:94℃预变性4min,94℃30s,53℃30 s,72℃30s,30个循环,72℃延伸8min。PCR产物用1.0% 琼脂糖电泳检测,观察结果。用BgiⅡ/HindⅢ对PCR产物进行双酶切后纯化回收,连入同样用BgiⅡ/HindⅢ双酶切的pGL3-Basic载体,构建成pGL3-Bik载体。利用PCR及 HindⅢ/BgiⅡ双酶切鉴定后送上海英骏生物技术有限公司纯化测序。
1.2.2 pGL3-BikDD 载体的构建 根据 GenBank的Bik基因序列,为实现将Bik基因编码蛋白第33位苏氨酸残基和第35位丝氨酸残基替换为门冬氨酸,对其编码基因进行定点突变,分别将第33位苏氨酸残基编码基因ACT突变为GAC,第35位丝氨酸残基编码基因TCT突变为GAT。引物设计如下:上游引物5'GTTCTTGGCATGGACGAC GATGAAGAGGACC3',下游 引物 5'GGTCCTCT TCATCGTCGTCCATGCCAAGAAC 3'。以 pGL3-Bik质粒为模板,对Bik基因编码序列进行PCR扩增,反应条件:95℃预变性1min,95℃40s,60℃60s,68℃5min,18个循环,72℃延伸8min。扩增产物转化感受态大肠杆菌DH5α,氨卞抗性筛选后提取质粒,KpnI/NheI酶切鉴定,进一步测序证实pGL3-BikDD构建成功。
1.2.3 pGL3-CMV-BikDD载体的构建 BgiⅡ和HindⅢ双酶切pGL3-BikDD和pGL3-CMV载体,回收约500bp的BikDD片段和约5.4kb的pGL3-CMV载体片段。用T4DNA连接酶连接,构建成pGL3-CMV-BikDD载体。利用Bik引物进行PCR筛选及双酶切(BgiⅡ/HindⅢ)鉴定。
1.2.4 S-VISA-BikDD 载体的构建 1)G5E4TBikDD-WPRE载体的构建:BgiⅡ和HindⅢ双酶切pGL3-BikDD和 G5E4T-WPRE载体,回收约500 bp的BikDD片段和约5.6kb的G5E4T-WPRE载体片段。用T4DNA连接酶连接,构建成G5E4TBikDD-WPRE过渡载体。利用Bik引物进行PCR筛选和双酶切(BgiⅡ/HindⅢ)鉴定。2)S-VISABikDD载体的构建:KpnI和SalI双酶切S-TSTA和G5E4T-BikDD-WPRE载体,回收约4.8kb的STSTA片段(保留Survivin启动子、除G5E4T外的TSTA系统和部分载体序列)和约3.3kb的G5E4T-BikDD-WPRE片段(保留 G5E4T、BikDD、荧光素酶编码基因、WPRE和poly A序列)。用T4 DNA连接酶连接,构建成S-VISA-BikDD载体,分别利用G5E4T和Bik引物进行PCR筛选及双酶切(KpnI/SalI)鉴定。
1.2.5 质粒转染 将培养至对数生长期的Ramos、Raji、U937和chang liver细胞与S-VISA/CMV-BikDD/S-VISA-BikDD/pGL3-basic 质 粒 分别溶于无血清RPMI 1640的电穿孔介质中,将细胞悬液移入石英电转杯中,电转条件:电压270V,穿孔时间14.4ms。电转完成后立即将细胞悬液转移至25cm2培养瓶中,加入含10%胎牛血清的RPMI 1640培养液,置于37℃5%CO2培养箱中,48h后终止培养,收获细胞。
1.2.6 Western blot检测Bik蛋白表达 分别收集质粒转染前及转染48h后各组细胞,加入RIPA蛋白裂解液裂解细胞抽提蛋白,BCA法测定蛋白浓度,蛋白变性后取60μg总蛋白进行10%SDS-聚丙烯酰胺凝胶电泳分离,蛋白通过湿转法转移至硝酸纤维膜上。一抗(鼠抗人Bik单克隆抗体)4℃孵育过夜,TBST洗膜3次,二抗为辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠抗体,室温孵育1h,TBST洗膜3次,化学发光试剂ECL(enhanced chemiluminescence)发光、显影和定影。
1.2.7 流式细胞仪检测Raji细胞凋亡 离心、收集转染S-VISA、CMV-BikDD、S-VISA-BikDD质粒48h后的Raji细胞1×106个/mL,加入PI室温避光孵育40min,流式细胞仪分析检测细胞凋亡率。
1.2.8 MTT 实验取转染S-VISA、CMVBikDD、S-VISA-BikDD质粒48h后的细胞,各孔加入 MTT溶液(5mg/mL)20μL,放入培养箱继续培养4h后弃上清液,再加入DMSO 150μL/孔,充分振荡15min溶解结晶,用酶标仪在570nm波长处测定其吸光度(OD)值。以转染pGL3-basic的细胞为对照组,抑制率=(对照组OD值-质粒转染组OD值)/对照组OD值×100%。
1.3 统计学方法
采用SPSS 19.0统计软件对各组数据进行分析比较。本实验中所有数据均采用均数±标准差(±s)表示。多组间比较采用One-Way ANOVA检验,多个样本均数间两两比较采用S-N-Kq检验法,相关分析采用直相关计算Pearson相关系数,P<0.05为差异有统计学意义。
2 结果
2.1 pGL3-BikDD的鉴定
以人类肠基因组RNA为模版,PCR扩增Bik基因后连入pGL3-basic载体,构建成pGL3-Bik载体。利用定点突变技术将第33位苏氨酸残基编码基因ACT突变为GAC,第35位丝氨酸残基编码基因TCT突变为GAT,即分别将第97~99及103~105位的碱基突变,PCR酶切鉴定结果(图1)。测序结果与GeneBank上公布的Bik基因序列一致。
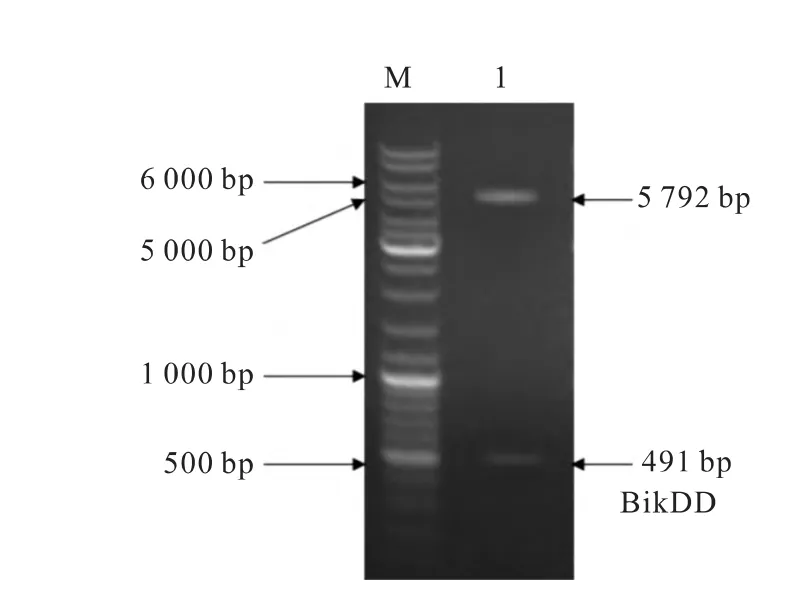
图1 pGL3-BikDD载体酶切鉴定图
2.2 CMV-BikDD载体的鉴定
重组载体CMV-BikDD的酶切鉴定。BgiⅡ和HindⅢ双酶切pGL3-BikDD和pGL3-CMV载体,回收BikDD片段和pGL3-CMV载体片段。用T4 DNA连接酶连接,构建成 pGL3-CMV-BikDD 载体。双酶切鉴定结果(图2)。
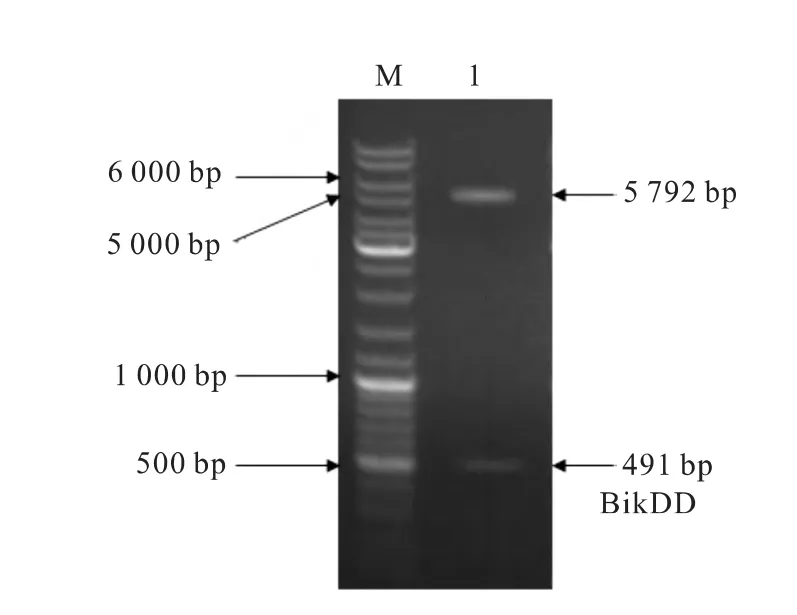
图2 CMV-BikDD载体酶切鉴定
2.3 S-VISA-BikDD载体的构建
重组载体S-VISA-BikDD的构建及酶切鉴定。BgiⅡ和 HindⅢ双酶切pGL3-BikDD和 G5E4TWPRE载体,回收的BikDD片段和G5E4T-WPRE片段用T4DNA连接酶连接,构建成G5E4TBikDD-WPRE过渡载体。再经KpnI和SalI双酶切S-TSTA和G5E4T-BikDD-WPRE载体后,回收到约4.8kb的 S-TSTA片段和约3.3kb 的G5E4T-BikDD-WPRE片段,进一步用T4DNA连接酶连接,PCR双酶切鉴定结果(图3)。
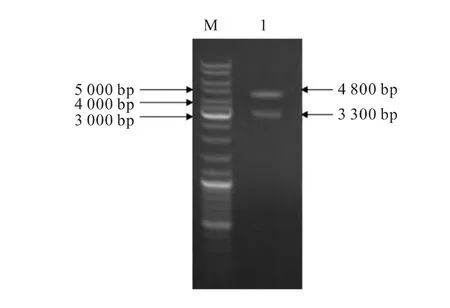
图3 S-VISA-BikDD载体酶切鉴定
2.4 转染前后淋巴瘤细胞和肝细胞的Bik表达水平
收集S-VISA-BikDD转染前、后的淋巴瘤细胞Raji、Ramos和 U937和肝细胞chang liver作Western blot检测。转染前的淋巴瘤细胞中Bik蛋白表达均低于chang liver细胞,转染后的淋巴瘤细胞中Bik蛋白表达均较前有上升,但仍低于chang liver细胞的Bik蛋白表达水平,而chang liver细胞在BikDD处理前后无明显变化(图4)。
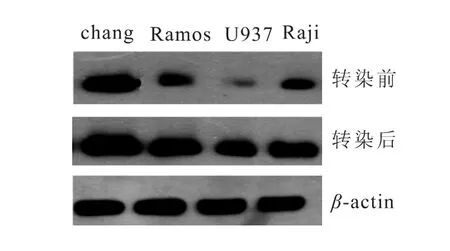
图4 S-VISA-BikDD载体转染前后淋巴瘤细胞和肝细胞的Bik表达水平
2.5 S-VISA-BikDD对淋巴瘤细胞的增殖抑制作用
MTT实验结果显示:转染S-VISA-BikDD对于淋巴瘤细胞Raji、Ramos和U937有明显生长抑制作用,并且均强于CMV-BikDD,差异有统计学意义(P<0.05);对于chang liver细胞无显著生长抑制作用,差异无统计学意义(P>0.05)。转染SVISA对于淋巴瘤细胞Raji、Ramos、U937、hut78和chang liver细胞均无生长抑制作用,差异无统计学意义(P>0.05)。转染CMV-BikDD对于淋巴瘤细胞Raji、Ramos、U937和chang liver细胞均有显著生长抑制作用,差异有统计学意义(P<0.05)(图5)。
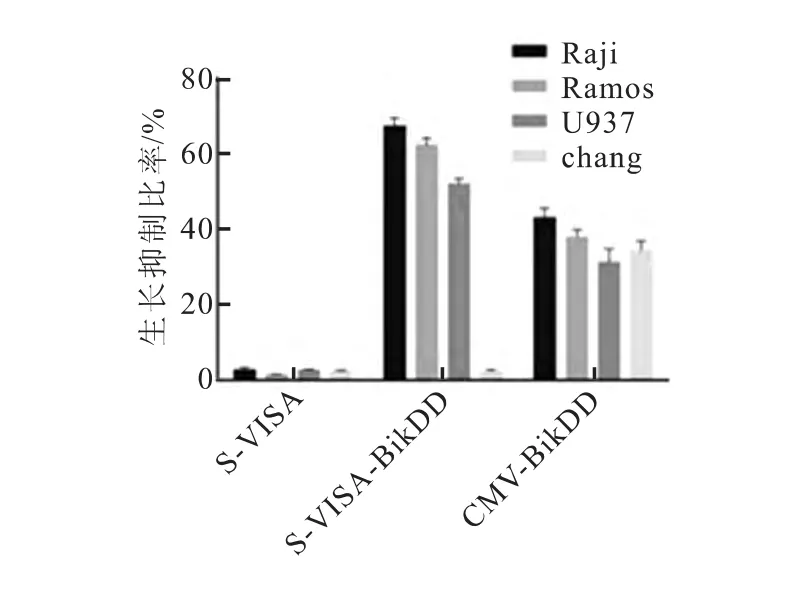
图5 S-VISA-BikDD与CMV-BikDD转染对淋巴瘤和肝细胞的生长抑制作用比较
2.6 流式细胞仪检测细胞凋亡
为探讨上述载体转染对Raji细胞凋亡的影响,笔者用流式细胞仪检测了Raji、Ramos、U937和chang liver 4种细胞的凋亡情况,结果显示:对照组(2.67±0.31)%;S-VISA 组(7.34±0.76)%,SVISA-BikDD组(28.93±4.25)%,CMV-BikDD组(17.62±2.17)%。结果表明,S-VISA-BikDD 及CMV-BikDD转染对淋巴瘤Raji细胞有明显凋亡诱导作用,且S-VISA-BikDD对于Raji细胞的凋亡诱导作用较CMV-BikDD明显,差异有统计学意义(P<0.05)。
3 讨论
Bcl-2家族是细胞凋亡的关键调节因子,Bik是其中一种重要的促凋亡蛋白。最新研究发现,伴随着死亡信号的刺激,Bik磷酸化后,可以与抗凋亡蛋白质结合,从而使其他促凋亡蛋白直接激活Bax。Bax移位到线粒体并形成同源二聚体通道,促进细胞色素c的释放,导致caspase的激活和细胞凋亡[10]。
Sturm等[11]研究显示,Bik高表达于正常肾上皮中,而肾细胞癌中由于染色体22q13.2中的Bik位点杂合性丢失及表观遗传学启动子沉寂而导致Bik基因表达失活。Van Keimpema等[12]阐明弥漫大B细胞淋巴瘤患者的生存率低与Bik蛋白编码基因表达减低相关。Brosseau等[13]发现,治疗套细胞淋巴瘤的一种新的有效药物来那度胺与1α,25-二羟维生素D3联合应用,明显促进了肿瘤细胞死亡,其作用与Bik表达上调相关,这种表达上调与Bik mRNA水平增长有关。Bik基因沉寂阻止了这两种药物诱导的凋亡,证实Bik直接参与细胞死亡。Hong等[14]在 MCF-7和 MDA-MB231人类乳腺癌细胞系中发现植物血凝素与阿霉素联合应用,促进癌细胞凋亡,同时检测到包括Bik蛋白在内的促凋亡蛋白表达上升。Guo等[15]通过对滤泡性淋巴瘤患者基因表达谱的分析,鉴定出包括Bik在内的几种基因在zeste同源物2(EZH2)启动子突变型病例中其mRNA表达水平降低。本实验结果显示,淋巴瘤细胞Raji、Ramos及U937的Bik蛋白表达水平与作为正常对照的肝细胞chang liver相比显著降低,与前述研究结果一致。
Xie等[16]构建了含 BikDD、hTERT 启动子及VISA系统的肿瘤靶向治疗基因T-VISA-BikDD,将其导入多种乳腺癌鼠模型中,发现该治疗基因可引起有效的抗肿瘤效应,延长病鼠生存期。近来,Xie等[17]在前列腺癌鼠模型中进行肿瘤靶向性基因治疗研究,将T-VISA-BikDD载体进一步联合雄激素反应区域(ARR)构建成AT-VISA-BikDD载体,导入前列腺癌鼠模型,抑制了前列腺癌生长并延长病鼠存活期,且对机体无明显毒副作用。以上实验均证实,T-VISA作为启动子的毒性作用明显低于CMV 启动子。本实验将 S-VISA-BikDD、CMVBikDD和对照S-VISA瞬时转染人淋巴瘤细胞Raji、Ramos、U937和肝细胞chang liver后,笔者发现S-VISA-BikDD及CMV-BikDD对于上述3种淋巴瘤细胞均有明显生长抑制作用,S-VISA-BikDD的生长抑制作用强于 CMV-BikDD(P<0.05);SVISA-BikDD转染对于chang liver细胞无明显生长抑制作用(P>0.05),但 CMV-BikDD 对 chang liver细胞表现出抑制作用(P<0.05)。本研究结果表明,S-VISA载体选择性地驱动BikDD在淋巴瘤细胞中的表达,实现了BikDD在淋巴瘤细胞中的高效、特异性表达,避免了对正常细胞的急性毒性作用。凋亡检测的结果进一步证实了S-VISA-BikDD特异性促淋巴瘤细胞凋亡的作用,其作用较CMVBikDD明显增强。因此,对于淋巴瘤的基因治疗而言,S-VISA-BikDD可能比 CMV-BikDD更为有力,且对正常细胞的毒性低,与以上实验结果一致。
综上所述,S-VISA-BikDD载体的成功构建及其促凋亡作用研究,为淋巴瘤基因治疗找到了新的思路及靶标,为进一步开展动物实验和临床实验的可行性及安全性提供了可靠依据,具有重要的理论意义和应用前景。
[1]罗宁,肖志强,李建璜.淋巴瘤特异性高效基因表达载体survivin-VISA的构建与鉴定[J].肿瘤防治研究,2014,41(7):724-727.
[2]Yip KW,Reed JC.Bcl-2family proteins and cancer[J].Oncogene,2008,27(50):6398-6406.
[3]Garg H,Salcedo R,Trinchieri G,et al.Improved nonviral cancer suicide gene therapy using survivin promoter-driven mutant Bax[J].Cancer Gene Therapy,2010,17(3):155-163.
[4]Sher YP,Liu SJ,Chang CM,et al.Cancer-Targeted BikDD Gene Therapy Elicits Protective Antitumor Immunity against Lung Cancer[J].Mol Cancer Ther,2011,10(4):637-647.
[5]Lang JY,Hsu JL,Meric-Bernstam F,et al.BikDD Eliminates Breast Cancer Initiating Cells and Synergizes with Lapatinib for Breast Cancer Treatment[J].Cancer Cell,2011,20(3):341-356.
[6]Xie X,Xia W,Li Z,et al.Targeted Expression of BikDD Eradicates Pancreatic Tumors in Noninvasive Imaging Models[J].Cancer Cell,2007,12(1):52-65.
[7]Tang YH,Zhong MZ,Liu W,et al.To clone human Survivin gene promoter and research the transcriptional activity of it in the lymphoma cells[J].Bai Xue Bing Lin Ba Liu,2010,19(2):84-87.
[8]Donofrio G,Cavirani S,Vanderplasschen A,et al.Recombinant bovine herpesvirus 4(BoHV-4)expressing glycoprotein D of BoHV-1is immunogenic and elicits serumneutralizing antibodies against BoHV-1in a rabbit model[J].Clinical and Vaccine Immunology,2006,13(11):1246-1254.
[9]Zhang L,Adams JY,Billick E,et al.Molecular engineering of a Two-step transcription amplification(TSTA)system for transgene delivery in Prostate cancer[J].Molecular Therapy,2002,5(3):223-232.
[10]Garg H,Salcedo R,Trinchieri G,et al.Improved nonviral cancer suicide gene therapy using survivin promoter-driven mutant Bax[J].Cancer Gene Therapy,2010,17(3):155-163.
[11]Sturm I,Stephan C,Gillissen B,et al.Loss of the tissuespecific proapoptotic BH3-only protein Nbk/Bik is a unifying feature of renal cell carcinoma[J].Cell Death Differ,2006,13(4):619-627.
[12]Van Keimpema M,Grüneberg LJ,Mokry M,et al.FOXP1 directly represses transcription of proapoptotic genes and cooperates with NF-κB to promote survival of human B cells[J].Blood,2014,124(23):3431-3440.
[13]Brosseau C,Dousset C,Touzeau C,et al.Combination of lenalidomide with vitamin D3induces apoptosis in mantle cell lymphoma via demethylation of BIK[J].Cell Death Dis,2014,5:1389.
[14]Hong CE,Park AK,Lyu SY.Synergistic anticancer effects of lectin and doxorubicin in breast cancer cells[J].Mol Cell Biochem,2014,394(1-2):225-235.
[15]Guo S,Chan JK,Iqbal J,et al.EZH2mutations in follicular lymphoma from different ethnic groups and associated gene expression alterations[J].Clin Cancer Res,2014,20(12):3078-3086.
[16]Xie X,Li L,Xiao X,et al.Targeted expression of BikDD eliminates breast cancer with virtually no toxicity in noninvasive imaging models[J].Mol Cancer Ther,2012,11(9):1915-1924.
[17]Xie X,Kong Y,Tang H,et al.Targeted BikDD expression kills androgen-dependent and castration-resistant prostate cancer cells[J].Mol Cancer Ther,2014,13(7):1813-1825.
