不同基质的氟他胺凝胶剂中氟他胺体外透皮特性比较*
2015-12-06曾明辉
陈 璐,曾明辉
1.四川省医学科学院·四川省人民医院(成都 610072);2.邛崃市医疗中心医院(邛崃 610038)
氟他胺(flutamide)是一种口服非甾体抗雄性激素,资料[1-5]表明,氟他胺具有抗雄性激素与抗肿瘤的作用,在治疗与雄性激素相关的前列腺癌、前列腺增生和卵巢癌等疾病有良好前景。经皮给药途径具有避免肝脏首关效应、药物在胃肠道降解与吸收不受胃肠道因素影响以及无胃肠道不良反应等优点。但经皮给药时要求药物有一定透皮速率,该剂型仅适用于少数剂量小和适宜溶解特性的小分子药物[6-8]。本文通过氟他胺透皮吸收剂的不同凝胶基质下氟他胺的累计释放量,比较不同透皮促进剂的释药速率,以优选其最佳处方组成。
1 材料与方法
1.1 材料
Waters2690型高效液相分析仪(美国 Waters公司),Waters996型紫外检测器(美国 Waters公司),Sartorius电子天平(德国),数字式黏度计(上海舜宇恒平科学仪器有限公司),PHSJ-4A酸度计(上海精密科学仪器有限公司),DK-98-Ⅱ型电子恒温水浴锅(天津泰斯特仪器有限公司),透皮扩散仪(上海楷凯科技贸易有限公司)。
氟他胺原料药(江苏天士力帝益药业有限公司,批号20110808,纯度98.6%),氟他胺对照品(中国药品生物制品检定所),卡波姆940(北京奥利化学试剂有限公司),羟丙基甲基纤维素(HPMC,沈阳化学试剂厂),海藻酸钠(化学纯,国药集团化学试剂有限公司),氮酮(北京化学试剂公司),薄荷醇(北京化学试剂公司),三乙醇胺(广东汕头市西陇化工厂),甘油(浙江遂昌惠康药业有限公司),医用酒精(北京市志伟达工贸有限公司),丙二醇(色谱纯),甲醇(色谱纯),其他试剂均为分析纯。
Wistar大鼠,雄性(180~200g),购自四川省医学科学院实验动物中心,实验动物使用许可证号:SYXK(川 )2013-110,实验动物质量合格证NO:0017566。
1.2 HPLC法测定透皮接收液中的氟他胺含量
1.2.1 色谱条件 色谱柱:Diamonsil C18(250 mm×4.6mm,5μm);流动相:甲醇∶水(65∶35);检测波长:227nm;流速:1mL/min;柱温:30℃;进样体积:20μL[9-10]。
1.2.2 测定方法 取氟他胺对照品甲醇溶液和空白透皮接收液,在上述色谱条件下测定。结果表明,氟他胺的保留时间为23.1min,样品液的主峰保留时间与氟他胺对照品溶液一致,且空白液对药物的测定无干扰(图1)。
1.2.3 氟他胺标准曲线的绘制 精密称取氟他胺对照品,配成质量浓度为350μg/mL的甲醇溶液,用甲醇稀释为质量浓度3.5、7、14、21、42、84μg/mL的标准液,按1.2.1项色谱条件取20μL进样,以质量浓度为横坐标,峰面积为纵坐标,进行线性回归,得回归方程:Y=102.3C-13.45(r=0.999 6,n=5)。
1.2.4 精密度与方法回收率 配制低、中、高(4、30、75μg/mL)3个质量浓度氟他胺甲醇溶液,取20μL进样,以测得质量浓度和理论质量浓度比较,计算方法回收率。低、中、高3个质量浓度氟他胺溶液的平均回收率为(97.22±1.53)%,相对标准偏差(RSD)为1.34%,方法回收率较好。低、中、高3个质量浓度日内精密度的RSD值分别为2.89%、1.52%、1.83%(n=6),日间精密度的 RSD值分别为2.09%、1.86%、1.49%(n=6),该方法的精密度较好。
1.2.5 样品透皮接收液前处理方法 精密吸取透皮接收液0.5mL,加甲醇1.0mL,涡旋1min,于14 000r/min离心5min,吸取200μL上清液于进样瓶中,20μL进样测定。
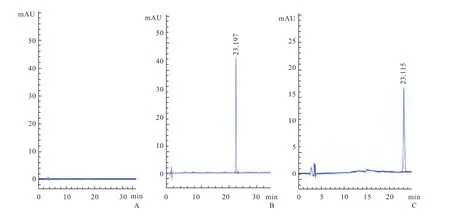
图1 氟他胺空白对照、标准品与透皮接收液HPLC色谱图
1.3 凝胶基质的选择
1.3.1 凝胶基质的制备 参考文献[11-12],称取适量卡波姆940,加入甘油32g润湿研磨,用适量水溶胀24h作为凝胶基质,备用。称取适量HPMC,加水溶解后,冷藏静置至完全溶胀;在搅拌下加入适量注射用水,直至完全溶解形成均一溶液备用。称取适量海藻酸钠加入到一定体积水中,溶解、超声脱气和静置过夜,备用。
1.3.2 氟他胺凝胶基质的制备 精密称取适量氟他胺,用适量水溶解后分别加入以上3种凝胶基质中,缓慢加入乙醇溶液,搅拌均匀,用三乙醇胺调节pH至7~8,加水至100g,研磨均匀,即得乳白色、均匀、细腻和半透明状的氟他胺凝胶。
1.3.3 鼠皮的制备 取雄性 Wistar大鼠,脱颈椎处死后用电动剔毛器将其腹部脱毛,剪下腹部皮肤,小心剥离脂肪层、筋膜,备用。
1.3.4 体外透皮试验 采用改良法Franz扩散池装置(有效扩散面积为3.8cm2),将上述氟他胺凝胶基质分别紧密贴于处理好的鼠皮角质层,排除气泡,固定于渗透扩散装置的扩散室和接收室之间,背衬层向上。接收室加满生理盐水作为扩散介质,使液面恰与鼠皮接触。水浴加热,温度控制在(37±0.2)℃,开动磁力搅拌器,搅拌转速设定为400r/min,分别在1、2、4、6、8h将接收室中的接收液全部倒出,同时补加同样体积的新鲜接收液。取接收液按1.2项方法测定总氟他胺含量,计算累积释放量 Q[13-14]。
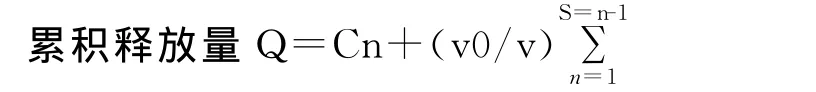
Q:时间t的累积释放量;Cn:时间t的浓度值;v0:每次取样体积;CPS:时间t以前的浓度测量值。
1.4 透皮促进剂的制备
分别以氮酮、丙二醇和薄荷醇为透皮促进剂,加入对氟他胺具有良好渗透性的凝胶基质制备氟他胺透皮吸收剂。
2 结果
2.1 氟他胺凝胶基质
2.1.1 氟他胺凝胶基质的处方优化 依据文献研究结果[1,15-16],分别考察卡波姆940、HPMC 和海藻酸钠的用量。以氟他胺累积透过量为评价指标,评价3种不同浓度的凝胶基质对氟他胺透皮特性的影响。结果表明:比较3种不同基质,确定氟他胺经离体鼠皮的累积释放量差异无统计学意义,卡波姆940凝胶基质较优越,其中以1.5%卡波姆940凝胶基质为最佳。故凝胶基质优化处方确定为1.5%卡波姆940加甘油所成基质(表1、表2)。
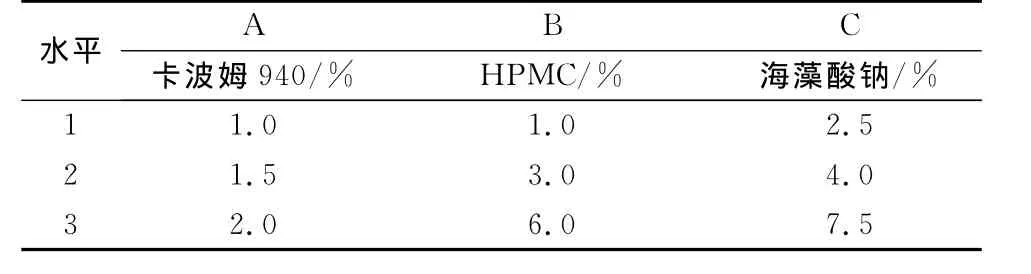
表1 氟他胺透皮吸收剂凝胶基质的处方优化因素与水平表
2.1.2 验证试验 按优选处方的比例进行3批样品的验证试验。结果表明,所确定的优选处方配比适宜,重复性较好,表明该基质处方合理,稳定可行(表3)。

表2 3种凝胶基质的氟他胺经离体鼠皮的累积释放量Q/(μg/mL)(n=3)
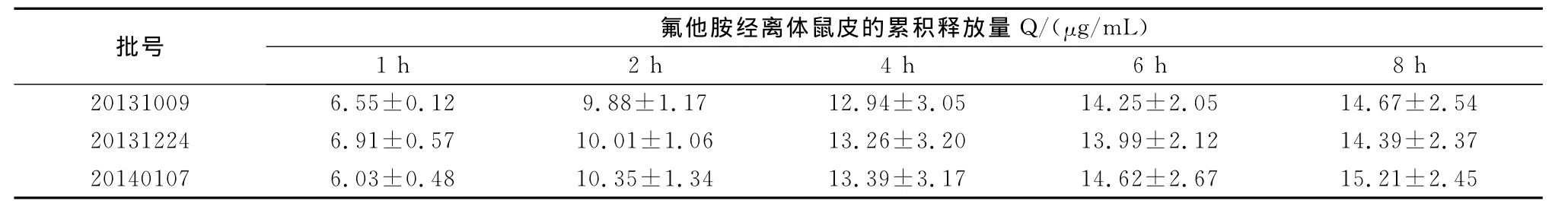
表3 凝胶基质优选工艺的验证试验
2.2 透皮促进剂的选择
将1.4项中3种不同促透剂制成的氟他胺透皮吸收剂,紧密涂布于处理好的鼠皮角质层,按1.3.4项方法操作,接取接收液按1.2项方法测定总氟他胺含量,计算累积释放量Q,将Q对时间t进行回归,得体外透皮动力学方程及透皮速率[17-18]。
稳态流量J=v/A·dQ/dt;渗透系数Kp=J/A·C0
以上公式中,A:皮肤有效面积;dQ/dt:稳态时的斜率;J:稳态流量,单位时间通过单位面积皮肤的药物量;Kp:渗透系数。
体外透皮实验结果说明,以氮酮为促透剂,氟他胺透皮吸收剂的体外经皮渗透Q与t相关性较好,二者呈线性关系,体外经皮渗透均符合零级动力学过程(表4、表5和图2)。
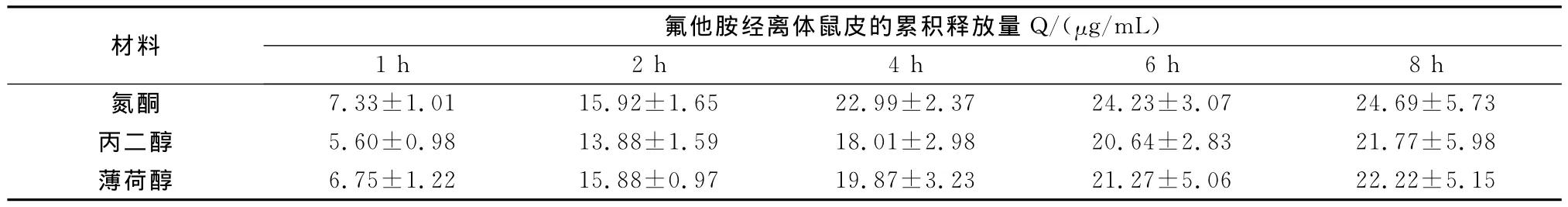
表4 不同促透剂基质的氟他胺经离体鼠皮的累积释放量
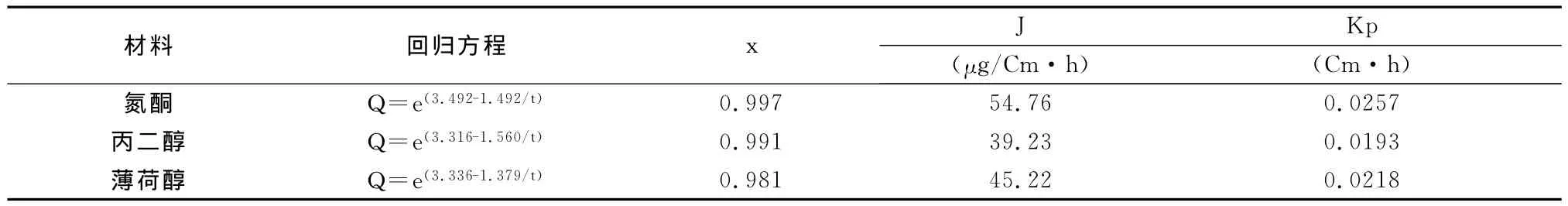
表5 氟他胺体外透皮试验
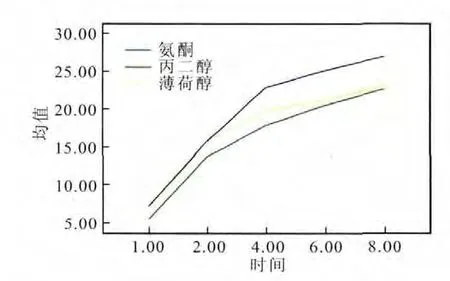
图2 氟他胺体外经皮渗透曲线
3 讨论
氮酮是一种新型经皮渗透促进剂,也是近年来国内外研究较多的透皮吸收促进剂,它能使角质中类脂质生产不规则的排列,同时可溶解皮肤的类脂以增加药物透皮吸收[19]。实验结果证实,该凝胶剂中最佳透皮吸收剂为1%氮酮。
氟他胺口服引起明显的胃肠道刺激如恶心、呕吐和腹泻,与促黄体激素释放激素剂(LHRH)联用时更为多见,且氟他胺存在明显的首过效应。若制成透皮吸收制剂不仅可以避免消化道不良反应,还可以控制血药浓度,降低全身尤其肝脏的不良反应。氟他胺其理化性质符合透皮制剂对药物的基本要求,经皮给药制剂的研究开发必将具有广泛的应用前景以及深远的社会意义。
对氟他胺凝胶剂透皮特性的考察,其目的是优化并确定氟他胺凝胶剂处方,并制备氟他胺凝胶剂,继续考察氟他胺凝胶剂的体外释药过程及其稳定性等特征。更可进一步考察经皮吸收后,氟他胺在大鼠体内的药代动力学过程,以及开展氟他胺凝胶剂体内外血药浓度和药效学的相关性研究。
[1]Neri RO.Studies on the biology and mechanism of action of non-steriod antiandrogens.Androgens and antiandrogens[M].New York:Raven Press,1977:179-1889.
[2]陈丽笙,陈捷,李素敏,等.中西医结合治疗难治性多囊卵巢综合征不孕31例临床分析[J].福建中医药大学学报,2012,22(6):10-12.
[3]Paradisi R,Fabbri R,Battaglia C,etal.Ovulatory effectsof flutamide in the polycystic ovary syndrome [J].GynecolEndocrinol,2013,29(4):391.
[4]Diamanti-Kandarakis E,Dunaif A.Insulin resistance andthe polycystic ovary syndrome revisited:an update onmechanisms and implications[J].Endocr Rev,2012,33(6):981-1030.
[5]刘文彬,林怡.康士得与氟他胺应用于晚期前列腺癌患者的不良反应分析[J].北方药学,2013(1):19-20.
[6]陈映红,刘荣.复方血竭凝胶基质成型工艺分析[J].临床合理用药杂志,2011,4(13):33-34.
[7]宫莉萍,赵怀清.老鹳草凝胶剂制备工艺[J].中国实验方剂学杂志,2011,17(24):19-22.
[8]王志钢,王艳姣,李慧,等.丹葛明目即型凝胶的制备研究[J].中国中药杂志,2012,37(1):46-51.
[9]李静,朱静毅,闻琍毓,等.HPLC法测定氟他胺片含量的不确定度分析[J].药学研究,2014(5):269-271.
[10]崔正华.HPLC测定氟他胺有关物质[J].食品与药品,2013,15(3):191-192.
[11]张朵朵,吴艳丽,危红华,等.荆芥油-苦参素阴道用脂质体温敏凝胶的制备及其性质考察[J].中草药,2014(7):929-934.
[12]杨柳,王爱武,刘帅.凝胶剂研究概况及临床应用[J].辽宁中医药大学学报,2014,16(7):147-150.
[13]彭丽华,刘淑芝,郭春燕,等.两种巴布剂基质的体外经皮渗透性考察[J].中国实验方剂学杂志,2005,11(5):1-3.
[14]卢映,涂星,吴俊洪,等.不同基质和促渗剂对川芎嗪凝胶经皮吸收的影响[J].中药新药与临床药理,2013,24(2):166-169.
[15]Moghetti P,Castcllo R,Negri C,et al.Flutamide in treatment of hirsutism:long-term clinical effects,and androgen receptor behavior[J].Fertil Steril,1995,64(3):511-517.
[16]Tumolo S,Rao BR,Van der Burg ME,et al.PhaseⅡtrial of Flutamide in advanced ovarian cancer:an EORTC gynaccological cancer cooperation group study[J].Eur J Cancer,1994,30(7):911-914.
[17]王兰,顾欣,常相娜,等.双氯芬酸钾软膏的制备及其体外累积释药率的测定[J].陕西科技大学学报:自然科学版,2014,32(4):93-96.
[18]韩莉,王平,刘善新,等.不同促透剂对人参皂苷Rg_1体外透皮吸收的影响[J].药学研究,2014,33(7):391-394.
[19]黄际薇,张永明,黄凤爱,等.促进药物透皮吸收的方法[J].中国医院药学杂志,2000,20(11):680-683.
