伊曲康唑促进结肠癌细胞自噬的作用及机制研究
2015-12-06钟晓辉李灵玲
钟晓辉,李灵玲
1.广汉市人民医院 药剂科(广汉 618300);2.成都市计划生育指导所(成都 610000)
结肠癌是我国高发癌症之一,目前主要通过手术和化学药物治疗,但预后情况不容乐观,迫切需要寻找新的治疗药物。近年来,自噬成为结肠癌肿瘤治疗的新靶点,研究[1]表明,自噬性细胞死亡可能抑制肿瘤新生血管形成,进而抑制肿瘤细胞的生长、侵袭和转移;同时,自噬也可以增强以细胞信号转导为靶点的抗结肠癌药物作用。伊曲康唑是三唑类抗真菌药物,通过抑制14-α-羊毛甾醇脱甲基酶来阻抑真菌中麦角固醇以及哺乳动物中胆固醇的从头合成[2]。近年来研究[3-5]发现,伊曲康唑是一种有效的细胞自噬促进剂,能够抑制PI3K-AKT-mTOR信号通路,通过诱导细胞自噬显著抑制成神经管细胞瘤以及非小细胞肺癌的生长,它有望成为一种潜在的抗结肠癌肿瘤药物。本研究通过对伊曲康唑与结肠癌细胞自噬关系的研究,以了解伊曲康唑潜在的抗肿瘤机制。
1 材料与方法
1.1 材料与试剂
人结肠癌细胞株SW480购于中国科学院细胞库,于-80℃冻存;伊曲康唑、噻唑蓝(MTT)、雷帕霉素(RAPA)、Hoechst 33342购买于Sigma公司;AKT、mTOR、Stat3抗体及其磷酸化抗体购于Cell Signal Technology公司,其余抗体购自Santa Cruz公司;细胞培养基和胎牛血清购于Gibco公司;PVDF膜和ECL显影液购于 Millpore公司;X光胶片购于Kodak公司;其余化学试剂均为分析纯。
1.2 方法
1.2.1 细胞培养 SW480在含10% 胎牛血清DMEM培养基中(100U/mL青霉素,100μg/mL链霉素)于37℃,5%CO2培养箱中培养。
1.2.2 MTT检测细胞增殖情况 将100μL细胞悬液以50 000个/mL的密度接种于96孔板,在CO2孵箱中37℃培养孵育过夜。待细胞贴壁后,加入不同浓度的药物100μL继续培养36h,每组设4个复孔,另设不含细胞仅有培养基的空白孔为空白对照孔。药物处理结束后,加入 MTT(5mg/mL)试剂20μL,37℃5%CO2孵育4h,以空白孔调零,酶标仪检测590nm波长下的吸光值。
1.2.3 Hoechst染色检测细胞凋亡情况 将SW480细胞以10 000个/mL每孔铺在经多聚赖氨酸处理过的盖玻片上,待细胞贴壁后,配置不同浓度的伊曲康唑培养基,继续培养36h。去培养基,PBS缓冲液洗两次,4% 多聚甲醛固定15min,去固定液,PBS洗两次,加入Hoechst 33342染液1mL,染色10min,PBS洗两次,5min/次,加入荧光猝灭剂,封片。荧光显微镜观察。
1.2.4 克隆形成实验 将SW480细胞以100个/孔的量接种至6孔板中,24h后使用不同浓度的伊曲康唑处理细胞。37℃,5%CO2下培养细胞两周,每3d更换一次培养基。弃培养基,PBS洗两次,甲醇固定5min,结晶紫染色15min,PBS洗两次后,观察并统计克隆数。
1.2.5 LC3免疫荧光标记检测自噬体的形成 参考文献[6],将细胞铺在经多聚赖氨酸处理过的盖玻片上,待细胞贴壁后,配置不同浓度的伊曲康唑培养基,继续培养24h。通过LC3抗体免疫荧光检测细胞体内自噬体的形成。
1.2.6 免疫印迹检测 收集经药物处理后的细胞,按1×106细胞浓度加入100μL细胞裂解液,震荡,冰上放置1h,4℃,13 000r/min离心15min,取上清液加上样缓冲液,85℃加热变性10min,样品中蛋白经BCA试剂盒定量,以确保蛋白上样量一致。通过15%SDS-PAGE电泳分离后,转膜至PVDF膜上。分别加入一抗(稀释比例1∶1 000),4℃孵育过夜。用TBST洗膜后,辣根过氧化物酶标记二抗(1∶5 000),37℃孵育1h,TBST 洗涤PVDF膜5次,10min/次,加入ECL显影剂后,通过X光胶片曝光。
1.3 统计学方法
MTT实验数据记录为590nm处的光吸收值,克隆形成实验中数据为细胞克隆个数。采用SPSS 13.0统计学软件进行数据处理,组间数据比较采用成组设计t检验,P<0.05为差异有统计学意义。
2 结果
2.1 伊曲康唑抑制结肠癌细胞增殖
使用不同浓度的伊曲康唑处理结肠癌细胞SW480 36h后,通过MTT实验检测细胞活力。伊曲康唑显著抑制细胞增殖速率,并且抑制程度呈浓度依赖性。此外,克隆形成实验结果表明,与二甲基亚砜(DMSO)处理组相比,伊曲康唑处理组的克隆数明显减少,并且克隆数和伊曲康唑的浓度呈负相关(图1、图2)。
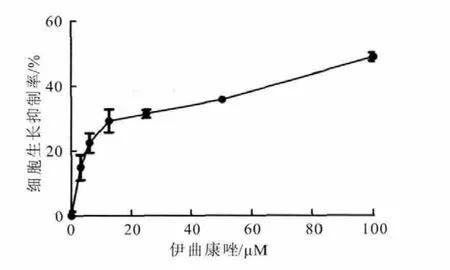
图1 不同浓度伊曲康唑处理SW480细胞36h的抑制率
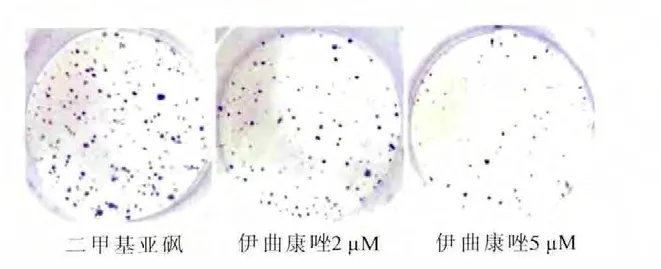
图2 克隆形成实验检测SW480细胞增殖
2.2 伊曲康唑促进结肠癌细胞自噬
使用Hoechst法检测细胞凋亡情况,结果表明,2μM 和5μM 伊曲康唑处理对结肠癌细胞SW480凋亡无明显影响。进一步检测伊曲康唑对其它与细胞生存死亡相关的生物学过程的影响,结果发现,经过2μM和5μM伊曲康唑处理细胞24h后,显微镜下观察,细胞出现了大量囊泡,怀疑细胞出现的囊泡为自噬泡。通过免疫荧光检测LC3表达情况,伊曲康唑促进SW480细胞内LC3的表达,经过12、24、36h3个时间段的观察,5μM 伊曲康唑处理细胞36h时,胞内LC3荧光斑点数最多。此外,Western blot检测3个时间段经过药物处理后胞内LC3活化情况,其结果与免疫荧光结果相符,5μM伊曲康唑处理36h时,胞内LC3活化效果最为明显。Western blot检测经5μM伊曲康唑处理36h时胞内自噬相关标志性蛋白(P62、beclin-1)的表达情况,结果表明,伊曲康唑抑制P62和beclin-1的表达。因此,可以得出,伊曲康唑促进结肠癌细胞SW480自噬(图3、图4、图5、图6和图7)。
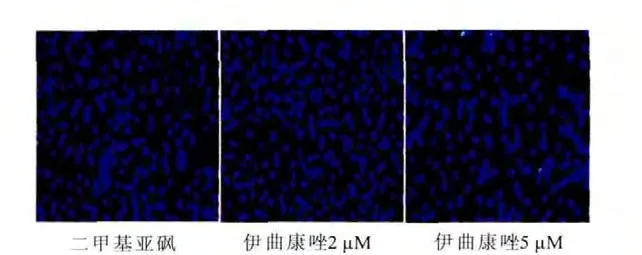
图3 Hoechst检测SW480细胞凋亡
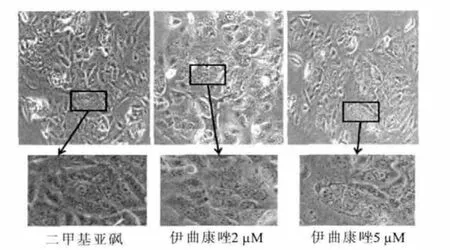
图4 光镜下观察SW480细胞的形态变化

图5 LC3免疫荧光实验
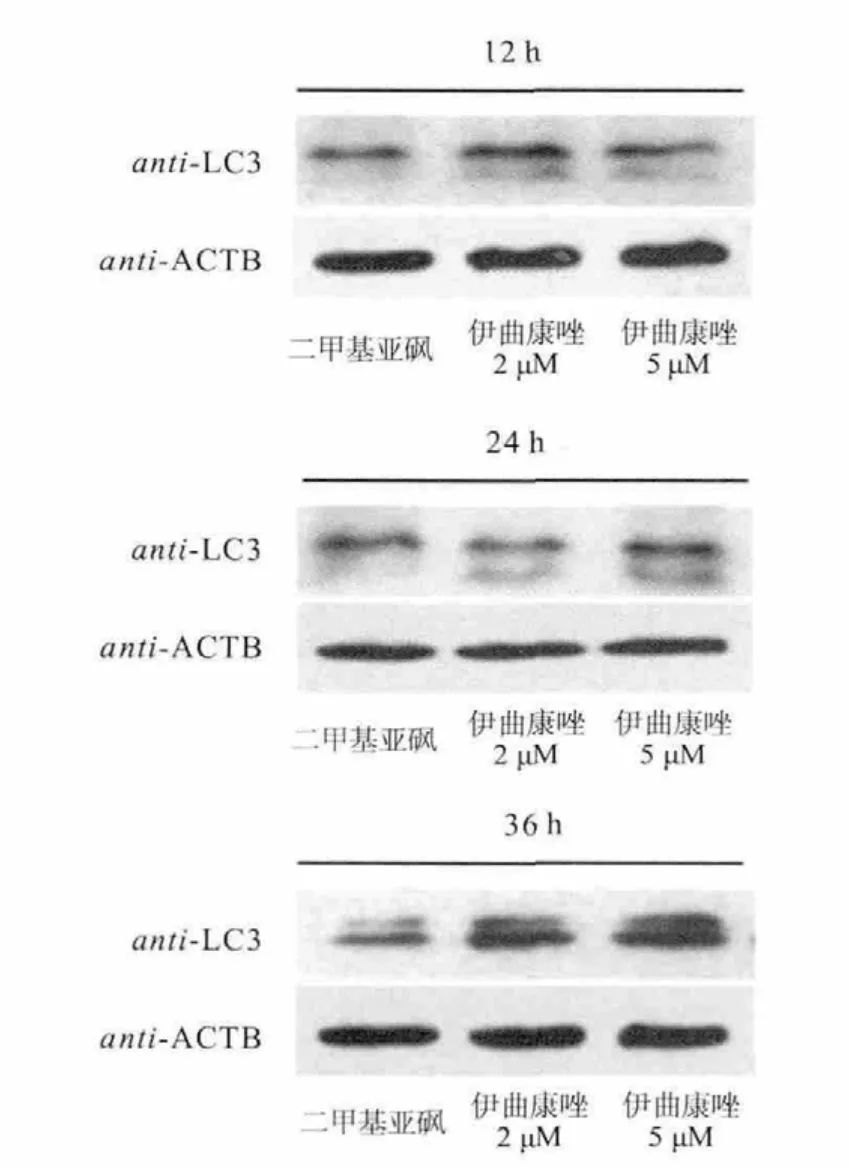
图6 免疫印迹检测LC3的表达
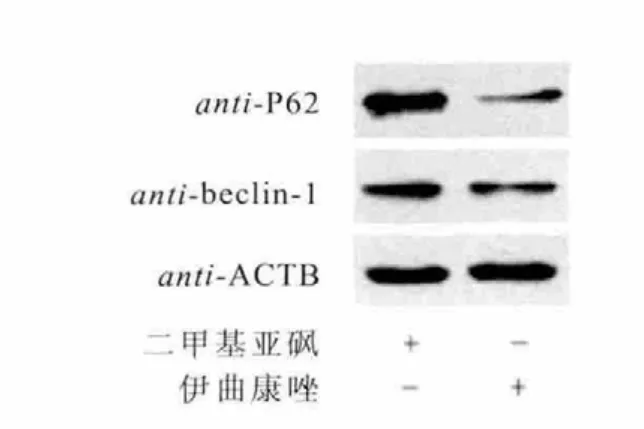
图7 免疫印迹检测自噬标志蛋白
2.3 伊曲康唑抑制细胞内mTOR信号通路
自噬复杂的生物学过程涉及到外部环境的刺激和细胞内关键分子事件的变化,PI3K-AKT-mTOR通路是自噬最重要的上游调控因子[7]。在饥饿、低氧以及某些化疗药物处理的情况下,PI3K-AKT-mTOR通路被抑制,进而导致一系列自噬相关基因(Atg)的级联激活,最终诱发自噬[8-9]。Western blot结果表明,5μM伊曲康唑显著抑制了胞内AKT和mTOR的磷酸化水平。同时,采用mTOR特异性抑制剂RAPA[17]和伊曲康唑共同处理细胞,结果表明,伊曲康唑特异性抑制了胞内mTOR信号通路,进而促进了SW480细胞自噬(图8)。
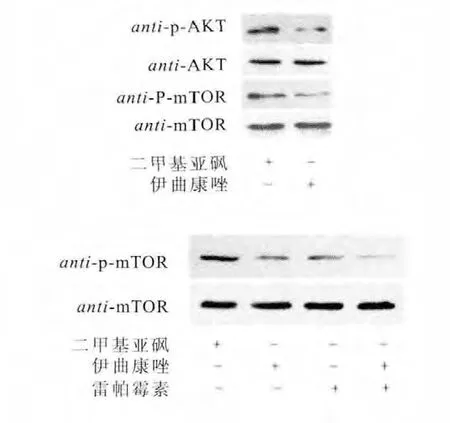
图8 免疫印迹分析AKT和mTOR
3 讨论
自噬是受到Atg严格调控的一种细胞程序性死亡模式,细胞自噬是亚细胞膜结构发生动态变化,并经溶酶体介导,对细胞内蛋白质和细胞器降解的过程[10]。自噬体通过包裹部分胞质和细胞内需降解的细胞器、蛋白质等成分,并与溶酶体融合形成自噬溶酶体,在溶酶体酶的作用下降解其所包裹的内容物,以实现细胞本身的能量代谢需要和某些细胞器的更新[11-12]。随着肿瘤进展阶段的不同,自噬所扮演的角色也不尽相同。在肿瘤发生早期,肿瘤细胞快速增殖生长,合成代谢速率明显大于分解代谢速率[13],此时,自噬发挥肿瘤抑制作用,可降低蛋白降解速率,导致癌前细胞的持续生长[14]。当肿瘤细胞持续分裂增殖呈进展阶段时,自噬帮助处于实体肿瘤内部的癌细胞抵抗缺氧、低营养状态,从而促进肿瘤细胞存活。此外,在抗肿瘤治疗中,自噬也发挥着双重作用。一方面保护某些肿瘤细胞免受放疗、化疗损伤[15-16],另一方面介导肿瘤细胞自噬性死亡[17]。
伊曲康唑于1984年发明,是一种三唑类抗真菌药物,对浅表和深部真菌均有抗菌作用[18],适用于真菌感染的病人。伊曲康唑的作用机制与其他氮唑类抗真菌药物一样,抑制细胞膜色素P450氧化酶介导的麦角固醇的合成[19],而不同之处在于,伊曲康唑还能够抑制刺猬信号通路以及血管发生[20]。最新研究[21]显示,伊曲康唑能够显著抑制成神经管细胞瘤以及非小细胞肺癌的生长,这些研究成果提示,伊曲康唑有望成为一种新的抗肿瘤药物,但是其抗肿瘤的分子机制还有待阐明。
伊曲康唑能抑制结肠癌细胞增殖,并导致出现一系列促进自噬标志的事件,包括细胞内双层膜结构的自噬体增加以及LC3-I向LC3-Ⅱ的转换增强。在自噬过程中,隔离膜的形成依赖于Ⅲ型PI3K激活,诱导PtdIns生成PI3P,而beclin 1/Ⅲ型PI3K复合物的形成又是使Ⅲ型PI3K复合物具有活性的必要前提[22],mTOR通过对其下游靶点p70S6K和4E-BP1的调节来促进细胞增殖和生长[23]。因此,伊曲康唑对mTOR信号通路的阻抑作用可以很好地解释其抑制结肠癌细胞生长的现象。考虑到mTOR途径是自噬上游最重要的调节因子,伊曲康唑对mTOR磷酸化水平的抑制作用表明,mTOR通路在伊曲康唑介导自噬的过程中发挥着关键调控作用。
最新报道[24]称,胆固醇合成及脂代谢与结肠癌的发生发展有着密切联系。研究[25]表明,细胞内胆固醇含量的减少会激发自噬。伊曲康唑以及其他一些吡咯类抗真菌药物都能够有效抑制真菌中催化麦角固醇生物合成的酶类,而且在高浓度条件下,也能够抑制哺乳动物细胞内胆固醇的合成[26]。本研究发现,2μM和5μM伊曲康唑能诱导结肠癌细胞自噬,而文献[27]报道称,伊曲康唑减少总胆固醇含量的最低浓度却是20μM,这些结果表明,低浓度伊曲康唑介导的细胞自噬并不是由于总胆固醇含量降低造成,提示低浓度伊曲康唑促进细胞自噬可能还存在其他分子机制,有待进一步研究。
[1]Selvakumaran M,Amaravadi RK,Vasilevskaya IA,et al.utophagy inhibition sensitizes colon cancer cells to antiangiogenic and cytotoxic therapy[J].Clin Cancer Res,2013,19(11):2995-3007.
[2]Schneider B,Gerdsen R,Plat J,et al.Effects of high-dose itraconazole treatment on lipoproteins in men[J].Int J Clin Pharmacol Ther,2007,45(7):377-384.
[3]Xu J,Dang Y,Ren YR,et al.Cholesterol trafficking is required for mTOR activation in endothelial cells[J].Proc Natl Acad Sci U S A,2010,107(10):4764-4769.
[4]Schneider B,Gerdsen R,Plat J,et al.Effects of high-dose itraconazole treatment on lipoproteins in men[J].Int J Clin Pharmacol Ther,2007,45(7):377-384.
[5]Aftab BT,Dobromilskaya I,Liu JO,et al.Itraconazole Inhibits Angiogenesis and Tumor Growth in Non-Small Cell Lung Cancer[J].Cancer Research,2011,71(21):6764-6772.
[6]Meléndez A,Tallóczy Z,Seaman M,et al.Autophagy genes are essential for dauer development and life-span extension in C.elegans[J].Science,2003,301(5638):1387-1391.
[7]Jung CH,Ro SH,Cao J,et al.mTOR regulation of autophagy[J].FEBS Letters,2010,584(7):1287-1295.
[8]Li J,Liu R,Lei Y,et al.Proteomic analysis revealed association of aberrant ROS signaling with suberoylanilide hydroxamic acid-induced autophagy in Jurkat T-leukemia cells[J].Autophagy,2010,6(6):711-724.
[9]Jung CH,Jun CB,Ro SH,et al.ULK-Atg13-FIP200 complexes mediate mTOR signaling to the autophagy machinery[J].Mol Biol Cell,2009,20(7):1992-2003.
[10]Shintani T,Klionsky DJ.Autophagy in health and disease:a double-edged sword[J].Science,2004,306(5698):990-995.
[11]Joubert PE,Meiffren G,Grégoire IP,et al.Autophagy induction by the pathogen receptor CD46[J].Cell Host Microbe,2009,6(4):354-366.
[12]Levine B,Klionsky DJ.Development by self-digestion:molecular mechanisms and biological functions of autophagy[J].Dev Cell,2004,6(4):463-477.
[13]Kondo Y,Kanzawa T,Sawaya R,et al.The role of autophagy in cancer development and response to therapy[J].Nat Rev Cancer,2005,5(9):726-734.
[14]Cuervo AM.Autophagy:in sickness and in health[J].Trends Cell Biol,2004,14(2):70-77.
[15]Li J,Liu R,Lei Y,et al.Proteomic analysis revealed association of aberrant ROS signaling with suberoylanilide hydroxamic acid-induced autophagy in Jurkat T-leukemia cells[J].Autophagy,2010,6(6):711-724.
[16]Wang K,Liu R,Li J,et al.Quercetin induces protective autophagy in gastric cancer cells:involvement of Akt-mTOR-and hypoxia-induced factor 1alpha-mediated signaling[J].Autophagy,2011,7(9):966-978.
[17]Bursch W,Ellinger A,Kienzl H,et al.Active cell death induced by the anti-estrogens tamoxifen and ICI 164 384in human mammary carcinoma cells(MCF-7)in culture:the role of autophagy[J].Carcinogenesis,1996,17(8):1595-1607.
[18]Kim J,Tang JY,Gong R,et al.Itraconazole,a commonly used antifungal that inhibits Hedgehog pathway activity and cancer growth[J].Cancer Cell,2010,17(4):388-399.
[19]Lepesheva GI,Waterman MR.Sterol 14alpha-demethylase cytochrome P450(CYP51),a P450in all biological kingdoms[J].Biochim Biophys Acta,2007,1770(3):467-477.
[20]Lamb DC,Kelly DE,Waterman MR,et al.Characteristics of the heterologously expressed human lanosterol 14alphademethylase(other names:P45014DM,CYP51,P45051)and inhibition of the purified human and Candida albicans CYP51 with azole antifungal agents[J].Yeast,1999,15(9):755-763.
[21]Kim J,Tang JY,Gong R,et al.Itraconazole,a commonly used antifungal that inhibits Hedgehog pathway activity and cancer growth[J].Cancer Cell,2010,17(4):388-399.
[22]Pattingre S,Tassa A,Qu X,et al.Bcl-2antiapoptotic proteins inhibit Beclin 1-dependent autophagy[J].Cell,2005,122(6):927-939.
[23]Schmelzle T,Hall MN.TOR,a central controller of cell growth[J].Cell,2000,103:253-262.
[24]Zhang Xin,Zhao Xian-wen,Liu Dong-bo,et al.Lipid levels in serum and cancerous tissues of colorectal cancer patients[J].World J Gastroenterol,2014,20(26):8646-8652.
[25]Lajoie P,Guay G,Dennis JW,et al.The lipid composition of autophagic vacuoles regulates expression of multilamellar bodies[J].J Cell Sci,2005,118(9):1991-2003.
[26]Schneider B,Gerdsen R,Plat J,et al.Effects of high-dose itraconazole treatment on lipoproteins in men [J].International Journal of Clinical Pharmacology and Therapeutics,2007,45(7):377.
[27]Liu Rui,Li Jing-yi,Zhang Tao,et al.Itraconazole suppresses the growth of glioblastoma through induction of autophagy:Involvement of abnormal cholesterol tracking[J].Autophagy,2014,10(7):1241-1255.
