白藜芦醇对香烟烟雾提取物诱导的血管内皮细胞早衰的干预作用研究*
2015-12-06曾智,王涛
曾 智,王 涛
广州医科大学第一附属医院 心血管内科(广州 510120)
动脉粥样硬化是冠心病、脑卒中等心脑血管疾病的主要病理基础,严重威胁人类生命健康。吸烟是公认的动脉粥样硬化发展的独立危险因素,可导致内皮功能紊乱、炎症反应增加、血脂代谢异常和血管内血栓形成,易诱发急性心血管事件[1]。近年来研究发现,内皮细胞早衰是动脉粥样硬化等心血管病变的重要风险因子,细胞早衰与线粒体功能密切相关。白藜芦醇属于酚类植物抗毒素,具有调节脂质代谢、改善血管内皮功能和抑制血管炎症反应等作用[2]。此外,白藜芦醇还能调节血管内皮细胞凋亡,但目前研究较少。因此本研究通过设计对照实验,探讨白藜芦醇对吸烟诱导血管内皮细胞早衰的干预作用,现报道如下。
1 材料与方法
1.1 材料
人脐静脉内皮细胞株HuVEes,购自Caseade Biologies公司;浓度为1×10-3mol/L的白藜芦醇,购自Sigma公司;香烟烟雾提取物(CSE),分别配成1%、5%和10%的CSE培养基;DMEM培养基、PBS缓冲溶液、双抗(青霉素100U/mL、链霉素100μg/m)、胎牛血清和胰蛋白酶购自Gibco公司;端粒酶活性检测试剂盒(ELISA)、活性氧(ROS)检测试剂盒和线粒体分离试剂盒购自碧云天生物科技公司;β-半乳糖苷酶染色试剂盒购自南京建成生物技术公司;流式细胞仪购自美国BD公司。
1.2 细胞培养与分组给药
人脐静脉内皮细胞株培养于DMEM培养液中,加入10%胎牛血清,在37℃、5%CO2培养箱中传代培养,每2~3d更换培养液,5~6d细胞达80%~90%融合时传代。本实验使用第3代细胞。人脐静脉内皮细胞以2×105/mL密度接种至6孔板(3mL/孔),实验分为正常对照组(N组)、CSE组(C组)和白藜芦醇组20μM(R组),其中后两组根据CSE培养基浓度不同分为6个小组:C1(1%)、R1(1%)、C2(5%)、R2(5%)、C3(10%)和 R3(10%)。每组培养48h,于12、24和48h作对照研究。实验中各组的每个孔均设4个复孔,重复3次实验。
1.3 观察指标
1.3.1 不同时间点各组细胞增殖情况 以 MTT比色法测定各组内皮细胞增殖率。在培养基中加入MTT溶液(5mg/mL)20μL,培养4h,用枪头吸弃培养基,在每孔中加入150μL DMSO,置于37℃摇床轻摇20min,使DMSO溶解,用酶标仪读取其OD570。按照公式计算细胞增殖抑制率:细胞增殖抑制率=(对照组吸光度-实验组吸光度)/对照组吸光度×100%。
1.3.2 β-半乳糖苷酶染色 将内皮细胞接种于6孔板中,分组干预后,吸除细胞培养液,PBS清洗,0.5%戊二醛固定细胞3~5min。PBS洗3次,各孔加入1mL新配置的X-gal染液,37℃无CO2条件下孵育12~16h,荧光显微镜下每组标本随机选取视野,至少观察1 000个细胞,细胞质蓝染者为衰老细胞,计算阳性细胞占观察细胞总数的百分比。
1.3.3 端粒酶活性 应用PCR-ELISA法检测:以0.25%胰蛋白酶消化、收集2×106个细胞,余步骤按试剂盒说明书操作,酶标仪读数并计算端粒酶的相对活性。
1.3.4 线粒体细胞色素C氧化酶活性 使用标准曲线测定:取0.18mmoL/L Cyt C标准液3mL稀释至30mL,分别取稀释液2、4、6、8和10mL放于试管中,加蒸馏水至15mL,每管加少许连二亚硫酸钠,520nm处测定光密度;以水作为空白对照,以标准品的浓度为横坐标,光密度为纵坐标,绘制标准曲线作为定量依据;取所得的线粒体悬液超声破碎仪破碎3次以破坏线粒体膜,取线粒体悬液1.5mL,加入少许连二亚硫酸钠摇匀,520nm处测定光密度,根据所得标准曲线计算其浓度。
1.3.5 内皮细胞内ROS水平 细胞干预后胰酶消化,使细胞密度为2×106/mL。用无血清培养液按照1∶1 000稀释DCFH-DA,使终浓度为10mol/L。细胞收集后悬浮于稀释好的DCFH-DA中,37℃细胞培养箱内孵育20min。用无血清细胞培养液洗涤细胞3次,流式细胞仪检测至少10 000个细胞的平均荧光强度。
1.4 统计学方法
采用SPSS 18.0软件进行数据分析。计数资料用秩和检验,计量资料用方差分析或t检验,相关性研究采用单因素回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 转染后各组细胞的增殖情况
细胞生长速度随CSE浓度升高而降低(P<0.05),白藜芦醇各组在不同浓度CSE作用下,细胞增殖速度差异无统计学意义(P>0.05),且不同时间点白藜芦醇各组细胞增殖速度优于CSE组,差异有统计学意义(P<0.05)。白藜芦醇在12、24和48h均能改善CSE诱导的内皮细胞增殖抑制,说明白藜芦醇可干预CSE导致的内皮细胞早衰(图1)。
2.2 β-半乳糖苷酶染色检测结果
不同时间点CSE组的β-半乳糖苷酶染色阳性细胞数随浓度升高而增多(P<0.05),而白藜芦醇各组在不同浓度CSE作用下,β-半乳糖苷酶染色阳性细胞数低于CSE组,差异有统计学意义(P<0.05)。白藜芦醇在12、24和48h均能改善CSE诱导的内皮细胞衰老,降低β-半乳糖苷酶染色阳性细胞率(表1)。
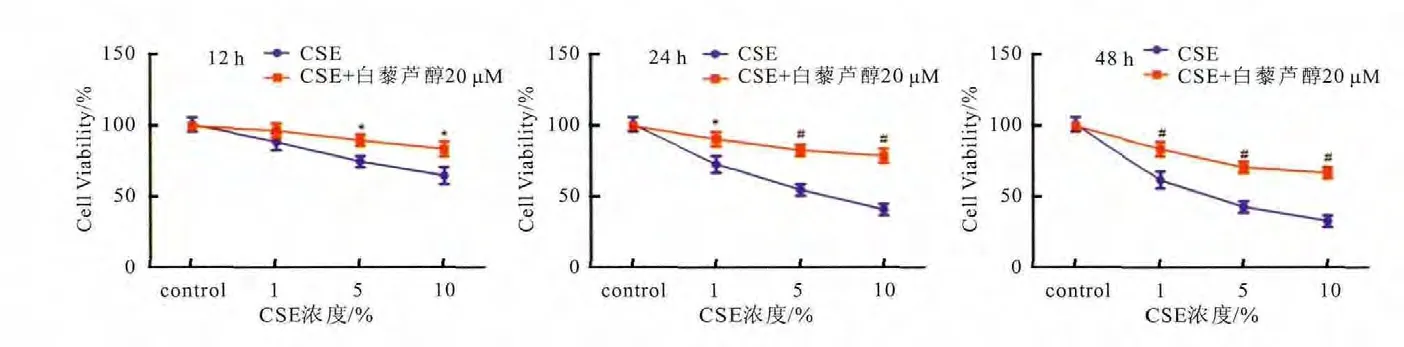
图1 不同时间各组MTT增殖检测结果图
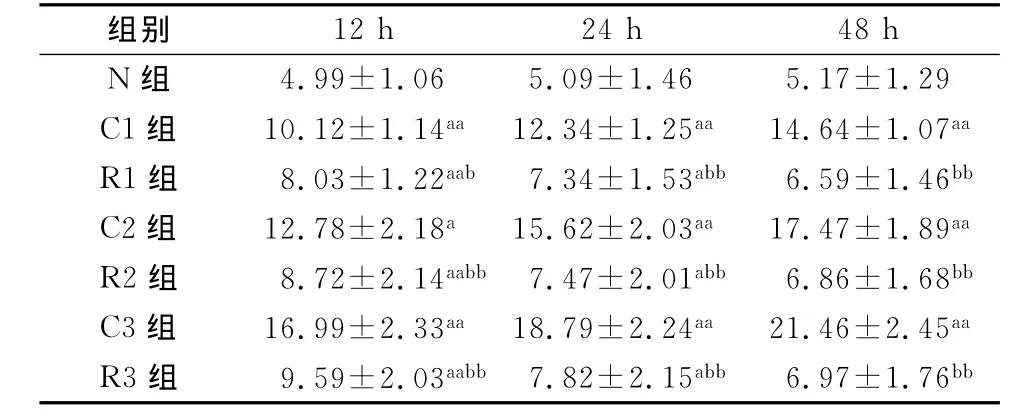
表1 β-半乳糖苷酶染色检测结果
2.3 端粒酶活性检测结果
不同时间点CSE组的端粒酶活性率随CSE浓度升高而降低(P<0.05),而白藜芦醇各组在不同浓度CSE作用下,端粒酶活性率高于CSE组,差异有统计学意义(P<0.05)。白藜芦醇在12、24和48 h均能改善CSE诱导的内皮细胞端粒酶活性的降低(表2)。
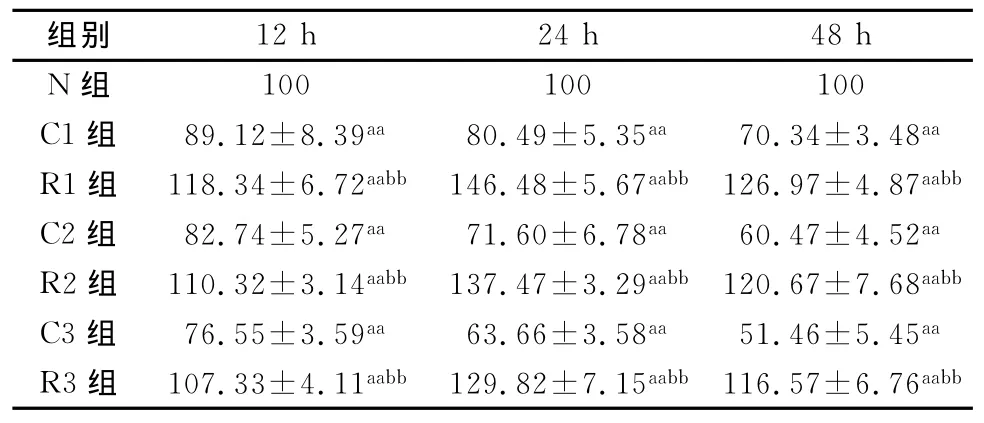
表2 端粒酶活性检测结果(%)
2.4 线粒体细胞色素C氧化酶活性检测结果
不同时间点CSE组的细胞色素C氧化酶活性随CSE浓度升高而降低(P<0.05),而白藜芦醇各组在不同浓度CSE作用下,细胞色素C氧化酶活性高于CSE组,差异有统计学意义(P<0.05)。白藜芦醇在12、24和48h均能改善CSE诱导的内皮细胞色素C氧化酶活性的降低(表3)。
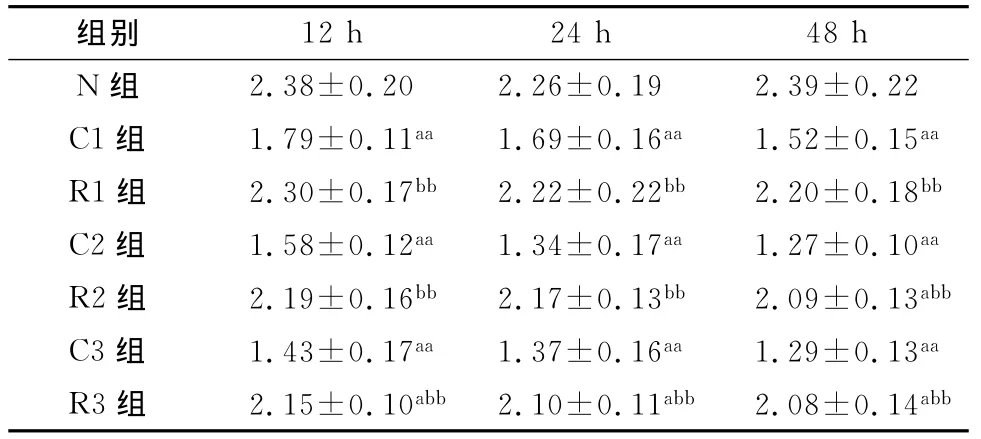
表3 线粒体细胞色素C氧化酶活性检测结果
2.5 ROS检测结果
不同时间点CSE组的细胞ROS水平随CSE浓度升高而升高(P<0.05),而白藜芦醇各组在不同浓度CSE作用下,细胞ROS水平低于CSE组,差异有统计学意义(P<0.05)。白藜芦醇在12、24和48h均能改善CSE诱导的内皮细胞ROS水平的升高(表4)。

表4 ROS检测结果
3 讨论
吸烟对人体心血管系统危害严重,它通过损害血管内皮细胞、减少NO生物合成、诱导黏附分子表达异常、促进炎症反应以及血脂代谢紊乱等,独立增加动脉粥样硬化风险,甚至引发脑卒中等急性临床事件[3]。吸烟与动脉粥样硬化的关系虽有众多研究报道,但其精确机制目前尚未阐明[4]。
细胞衰老(cellular senescence)是细胞停止增殖而处于细胞周期阻滞的一种状态,与周围组织衰老密切相关。内皮细胞生理活动的维持依赖正常的线粒体结构和功能。血管内皮细胞生长、增殖、凋亡、衰老及死亡等细胞过程均参与了动脉粥样硬化的发生与病理演变。近年有研究[5]指出,内皮细胞早衰是动脉粥样硬化等心血管病变的重要风险因子,而细胞早衰与线粒体功能密切相关。其中,β-半乳糖苷酶染色是公认的鉴定内皮细胞衰老的生物学标志;线粒体细胞色素C氧化酶活性、端粒酶活性、细胞内ATP水平和细胞内ROS水平是目前常用的反映线粒体功能的指标[6]。内皮细胞衰老是血管整体老化的重要病理改变之一,也是血管老化与心血管疾病之间的重要交互环节[7]。因此,内皮细胞早衰一直是血管老化研究的重点领域,深入探讨其发生机制,寻找有效干预措施,对心脑血管疾病的防治具有重要意义。
白藜芦醇是一种天然活性成分,虎杖、花生和桑椹等植物中含有此种成分,它能以游离态和糖苷结合态两种形式存在,具有抗氧化效能,其中反式异构体的生物活性强于顺式,是一种重要的植物抗毒素。近年来,白藜芦醇的潜在抗衰老及心血管保护作用备受关注[8-9]。白藜芦醇具有调节血脂、抑制血小板凝集、抗血栓形成、保护血管内皮及平滑机细胞、舒张血管、抑制血管炎症反应和抗氧化应激等作用。近期研究发现,白藜芦醇还具有显著的调节血管内皮细胞凋亡的作用[10],但目前对白藜芦醇抗内皮细胞衰老的作用机制研究较少。
本研究通过设计对照实验,探讨白藜芦醇对吸烟诱导的血管内皮细胞早衰的干预作用。结果表明:白藜芦醇在12、24和48h均能改善不同浓度CSE诱导的内皮细胞增殖抑制,说明白藜芦醇可干预CSE导致的内皮细胞早衰。同时白藜芦醇在12、24和48h均能改善CSE诱导的内皮细胞端粒酶活性和细胞色素C氧化酶活性的降低,并能降低β-半乳糖苷酶染色阳性细胞率和细胞内ROS水平。表明白藜芦醇可改善吸烟诱导的血管内皮细胞线粒体功能紊乱、减缓内皮细胞衰老,从而降低发生心血管病变的风险。
综上所述,白藜芦醇以内皮细胞线粒体功能为标靶,抑制吸烟引起的血管内皮细胞线粒体功能异常及细胞早衰,有效预防动脉粥样硬化的发生,有望为动脉粥样硬化引起的心血管疾病的临床防治提供新的方向与循证医学证据,具有一定的应用前景和临床价值。
[1]Tanriverdi H,Evrengul H,Kuru O,et al.Cigarette smoking induced oxidative stress may impair endothelial function and coronary blood flow in angiographically normal coronary arteries[J].Circ J,2006,70(5):593-599.
[2]Hewitt SC,Korach KS.Estrogen receptors:structure,mechanisms and function[J].Rev Endocr Metab Disord,2002,3(3):193-200.
[3]Werner C,Gensch C,Poss J,et al.Pioglitazone activates aortic telomerase and prevents stress-induced endothelial apoptosis[J].Atherosclerosis,2011,216(1):23-34.
[4]Ou HC,Lee WJ,Wu CM,et al.Aspirin prevents resistininduced endothelial dysfunction by modulating AMPK-ROS and Akt/eNOS signaling[J].J Vasc Surg,2012,55(4):1104-1115.
[5]Ksiazek K,Breborowicz A,Jorres A,et al.Oxidative stress contributes to accelerated development of the senescent phenotype in human peritoneal mesothelial cells exposed to high glucose[J].Free Radical Biology and Medicine,2007,42(5):636-641.
[6]Chen B,Zhao J,Zhang S,et al.Aspirin inhibits the production of reactive oxygen species by downregulating Nox4and inducible nitric oxide synthase in human endothelial cells exposed to oxidized low-lensity lipoprotein [J].J Cardiovasc Pharmacol,2012,59(5):405-412.
[7]Zhao J,Li L,Pei Z,et al.Peroxisome proliferator activated receptor(PPAR)-y co-activator 1-a and hypoxia induced factor-1amediate neuro-and vascular protection by hypoxic preconditioning in vitro[J].Brain Res,2012,1447:1-8.
[8]Magri CJ,Gatt N,Xuereb RG,et al.Peroxisome proliferatoractivated receptor-y and the endothelium:implications in cardiovascular disease[J].Expert Rev Cardiovasc Ther,2011,9(10):1279-1294.
[9]Yenugonda VM,KongY,Deb TB,et al.Trans-resveratrol boronic acid exhibits enhanced anti-proliferative activity on estrogen-dependent MCF-7breast cancercells[J].CancerBiol Ther,2012,13(10):925-934.
[10]申新,赵鸽,王瑞,等.异丙酚和白藜芦醇预处理对大鼠肝脏缺血再灌注损伤时细胞凋亡的影响及机制[J].南方医科大学学报,2013,33(1):80-85.
