金银花绿原酸和木犀草苷的提取*
2015-11-20杨彬罗磊朱文学康新艳屈政
杨彬,罗磊,朱文学,康新艳,屈政
(河南科技大学食品与生物工程学院,河南洛阳,471023)
金银花为忍冬科植物忍冬(Lonicera japonica Thunb)的干燥花蕾或带初开的花,具有清热解毒、疏散风热之功效[1]。金银花中主要含有挥发油、有机酸类、黄酮类和三萜皂苷类等化学成分[2-3],主要功能性成分是以绿原酸为代表的酚酸类和以木犀草苷为代表的黄酮类物质。研究发现,绿原酸具有抗菌抗病毒[4]、抗氧化[5-6]、降血脂血糖[7]等作用,木犀草苷具有很强的抗呼吸道合胞体病毒活性[8-9],被广泛应用于医药、食品和日用品工业中。但实际生产中通常以绿原酸的含量来评价金银花质量[10],忽略了木犀草苷的作用。2005年版《中国药典》开始新增了对木犀草苷含量的规定,木犀草苷也是金银花质量控制指标之一。
多年来,在关于金银花有效成分的提取工艺优化研究中,基本是以绿原酸含量为考察指标[11-13],涉及木犀草苷的研究较少。游本刚[14]等人采用正交试验比较金银花中绿原酸与木犀草苷的醇提、水提工艺;何小珍[15]等人采用正交试验优化野菊花中绿原酸与木犀草苷的超声提取条件;Cui[16]等人采用响应面法仅对金银花中绿原酸的超声辅助提取进行了优化。但运用响应面法同时优化金银花中绿原酸和木犀草苷的提取工艺还未见报道。本实验采用HPLC法同时测定金银花中绿原酸与木犀草苷的含量,以两者得率为指标,通过Box-Behnken Design试验方案,运用响应面法优化提取工艺参数,得到了绿原酸和木犀草苷得率均高的最佳提取条件。
1 材料与方法
1.1 材料与试剂
金银花:购于河南封丘县陈桥金银花生产基地,品种为豫丰一号。
甲醇、乙醇、H3PO4,均为分析纯;色谱纯甲醇,超纯水、绿原酸对照品(中国食品药品检定研究院,批号110753-201314)、木犀草苷对照品(上海圻明生物科技有限公司,批号MUST-13060908)。
1.2 仪器与设备
Agilent 1260型高效液相色谱仪(色谱柱:agilent ZORBAX SB-C18反相柱、4.6 mm ×250 mm、5 μm,UV检测器),美国安捷伦公司;TGL-18C型高速台式离心机,上海安亭科学仪器厂;KQ3200DE型数控超声波清洗器,昆山市超声仪器有限公司;HH-S6数显恒温水浴锅,金坛市医疗仪器厂;塞多利斯200S电子分析天平。
1.3 实验方法
1.3.1 绿原酸和木犀草苷含量的测定
1.3.1.1 对照品溶液的制备
精密称取绿原酸对照品48.3 mg、木犀草苷对照品1.5 mg,分别用甲醇溶解并定容至50 mL,制得质量浓度为966 μg/mL的绿原酸对照品溶液和30 μg/mL的木犀草苷对照品溶液。
1.3.1.2 供试液制备
准确称取金银花2 g,按照要求加到50 mL提取溶剂中,在一定温度下提取一定时间,过滤。重复操作一次,合并滤液并定容至100 mL。量取5 mL提取液,8 000 r/min离心10 min,经0.45 μm 微孔过滤膜过滤,HPLC测定提取液中绿原酸和木犀草苷含量。
1.3.1.3 色谱条件[17-19]
流速:1 mL/min;检测波长:327、350 nm;柱温:25℃;进样量10 μL;流动相:A:1%磷酸溶液;B:1%H3PO4-甲醇溶液(体积比=10∶90);梯度洗脱:0~25~30 min,30%~59%~100%B。
1.3.1.4 公式
绿原酸和木犀草苷得率计算公式:

式中:m,根据标准曲线计算所得绿原酸/木犀草苷的质量(μg);V,提取液体积(mL);m1,金银花质量(g)。
绿原酸和木犀草苷百分含量计算公式:
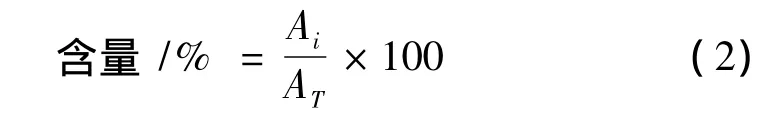
式中:Ai,第i次提取样品中绿原酸/木犀草苷的峰面积(mAU·S);AT,4次提取样品中绿原酸/木犀草苷的峰面积之和(mAU·S)。
1.3.2 单因素试验设计
以提取方法、提取次数、提取时间、料液比、提取温度、乙醇浓度为试验因素,以金银花中绿原酸和木犀草苷得率为试验指标,分别做单因素试验,分析各因素对绿原酸和木犀草苷得率的影响。其中,提取方法单因素试验过程中,共分析了5种提取方法对绿原酸和木犀草苷得率的影响,方法编号见表1。
1.3.3 响应面优化试验设计
根据单因素试验结果,选择提取时间(X1)、提取温度(X2)、醇浓度(X3)、料液比(X4)4个因素进行响应面优化试验。采用Box-Behnken Design进行响应面试验设计,因素水平编码如表2。

表1 试验方法编号表Table 1 Number table of test methods

表2 因素水平编码表Table 2 Coding of factors and levels
2 结果与分析
2.1 线性关系
精密量取绿原酸对照品 2、4、6、8、10 μL 进样,以对照品进样量X(μg)对峰面积Y进行线性拟合,得绿原酸的标准曲线为 Y=3 970.32X-12.75,R=0.999 96,线性区间为:1.932~9.66 μg。精密量取木犀草苷对照品 2、4、6、8、10 μL 进样,以对照品进样量X(μg)对峰面积Y进行线性拟合,得木犀草苷的标准曲线为Y=4 162.93X-2.28,R=0.999 99,线性区间为:0.06~0.3 μg。绿原酸和木犀草苷的标准曲线如图1所示。

图1 绿原酸(A)和木犀草苷(B)的标准曲线Fig.1 The standard curve of Chlorogenic acid and cynaroside chromatographic
按1.3.1.3色谱条件进样,得到对照品和金银花供试液色谱图,见图2。
2.2 单因素试验结果
2.2.1 提取方法对指标的影响
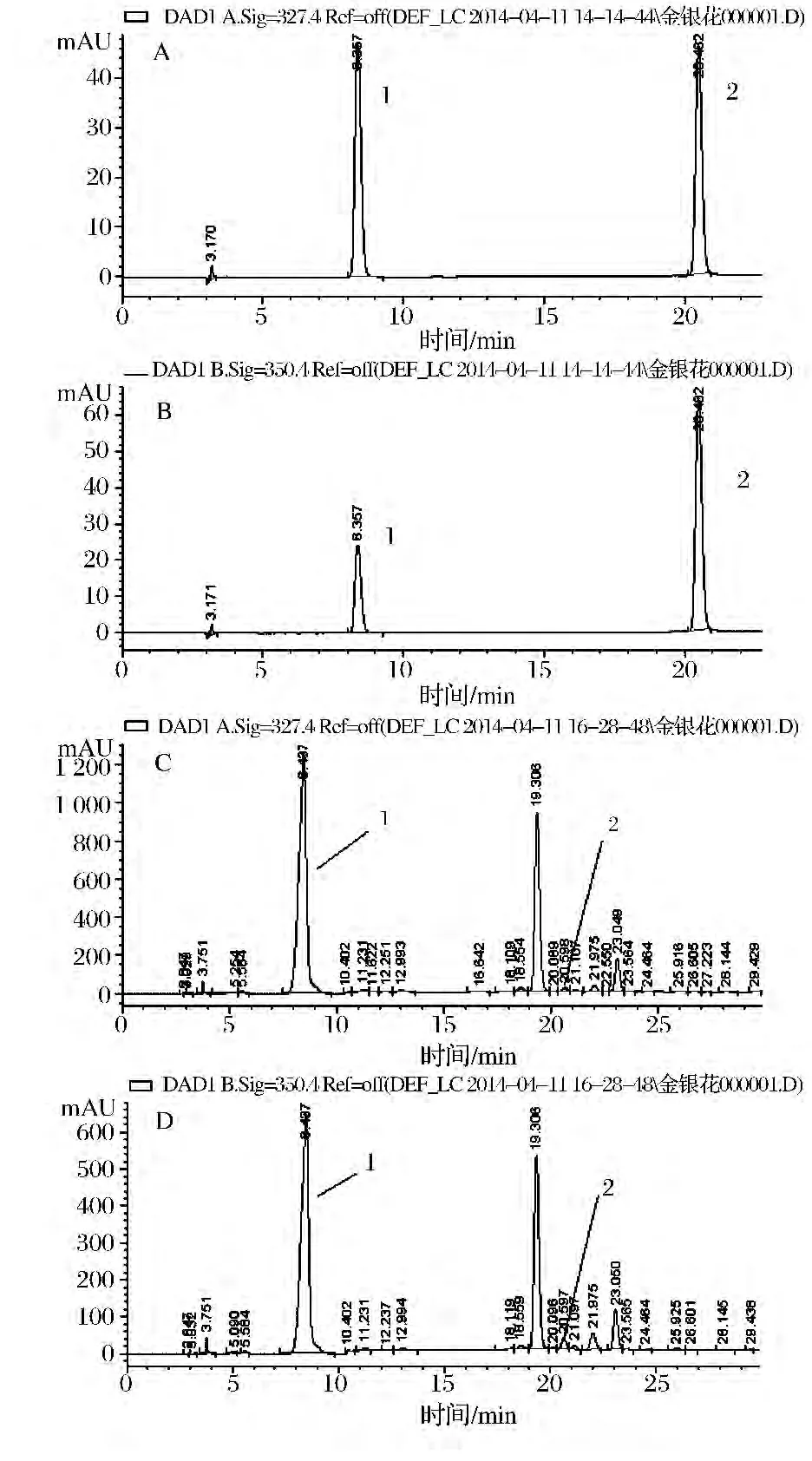
图2 对照品在327 nm(A)和350 nm(B)的色谱图和供试液在327 nm(C)和350nnl(D)的色谱图Fig.2 Chlorogenic acid and cynaroside chromatographic spectrum of standard and examine probational liquid at 327nm and 350 nm
按表1安排试验,考察不同提取方法对绿原酸和木犀草苷得率的影响,结果见图3。对比1、2、5号试验结果可知,醇提法优于水提法。这可能是由于绿原酸和木犀草苷在醇溶液中的溶解度更大,易溶于甲醇、乙醇及丙酮等有机溶剂,所以其提取得率更高。且水提过程中,蛋白质、多糖和鞣质等水溶性杂质含量增加[20],分离、纯化等后续工艺的难度较大。乙醇提比甲醇提的效果好,且乙醇毒性较小,故选乙醇为提取溶剂。对比2和3号、4和5号可知,低温超声辅助提取时,绿原酸和木犀草苷的得率较低。这可能是因为,虽然超声波具有空化作用[21],能够加速细胞膜膜壁的破裂,使绿原酸和木犀草苷快速从金银花中扩散到提取溶剂中,但低温条件下,绿原酸和木犀草苷在溶剂中的溶解度较小,金银花中的绿原酸和木犀草苷只有少部分被溶解出来,所以其得率较低,同时也说明提取温度对两者得率有重要影响。
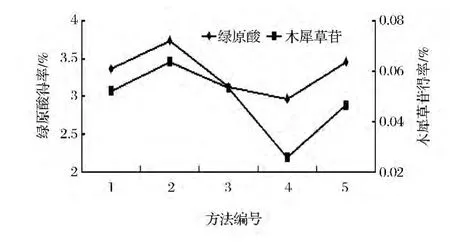
图3 提取方法对绿原酸和木犀草苷得率的影响Fig.3 Effection of extraction method on chlorogenic acid and cynaroside yield
2.2.2 提取次数的确定
固定料液比1∶25、乙醇体积分数70%、提取温度70℃、提取时间1h,共提取4次,HPLC测定每次提取液中绿原酸和木犀草苷的含量,结果见表3、表4。结果表明,经过2次提取,绿原酸和木犀草苷已基本被提取完全,因此提取次数定为2次。
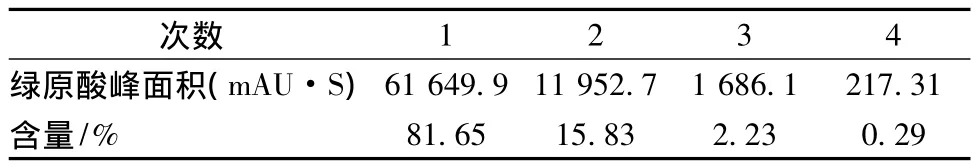
表3 不同提取次数绿原酸的含量Table 3 Percent content ofchlorogenic acid in different extraction times
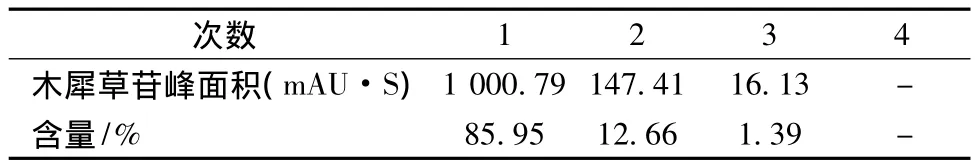
表4 不同提取次数木犀草苷的百分含量Table 4 Percent content of cynaroside in different extraction times
2.2.3 提取时间对指标的影响
固定料液比1∶25,乙醇体积分数70%、提取温度70℃、提取 2 次,分别于提取 0.5、1、1.5、2、2.5、3 h时取样,考察不同提取时间对金银花绿原酸和木犀草苷得率的影响,结果见图4。由图4可知,浸提0.5~2 h时,随着时间的延长,提取液中绿原酸和木犀草苷的含量不断增加,超过2 h时,绿原酸和木犀草苷的含量基本保持不变。这可能是因为在提取初期,金银花中的绿原酸和木犀草苷未被完全溶解出来。随着提取时间的延长,绿原酸和木犀草苷逐渐被全部溶解并扩散到提取溶剂中,直至达到平衡。同时为了缩短周期,选取1、1.5、2 h继续对绿原酸和木犀草苷的提取做响应面分析,以确定最佳的提取时间。

图4 提取时间对绿原酸和木犀草苷得率的影响Fig.4 Effection of extraction time on chlorogenic acid and cynaroside yield
2.2.4 料液比对指标的影响
固定乙醇体积分数70%、提取温度70℃、提取时间2 h、提取2次,考察不同浸提时间料液比,对金银花绿原酸和木犀草苷得率的影响,结果见图5。由图5可知,绿原酸和木犀草苷的得率随料液比的变化基本上呈现相同的变化趋势,先升高后又下降,但两者的最适料液比不同。当料液比为1∶15时,绿原酸的得率最高;当料液比为1∶25时,木犀草苷的得率最高。两者相比,料液比在1∶15~1∶25内,绿原酸得率的变化程度较小。提取溶剂量过少时,金银花中的绿原酸和木犀草苷提取不完全,故得率较低。提取溶剂过量时,溶剂消耗增加,且增加后序蒸发浓缩的工作量。综合考虑,选取料液比 1∶15、1∶20、1∶25 继续对绿原酸和木犀草苷的提取做响应面分析,以确定最佳的料液比。
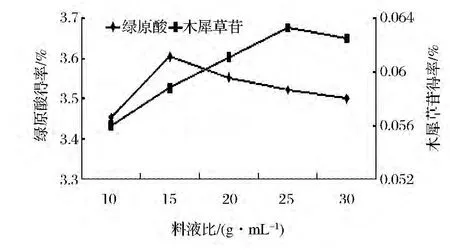
图5 料液比对绿原酸和木犀草苷得率的影响Fig.5 Effection of liquid-to-material ratio on chlorogenic acid and cynaroside yield
2.2.5 提取温度对指标的影响
固定料液比1∶25、乙醇体积分数70%、提取时间2 h、提取2次,考察不同提取温度对金银花绿原酸和木犀草苷得率的影响,结果见图6。由图6可知,绿原酸和木犀草苷的得率随温度的升高不断增加,当温度达到70℃时,温度再升高,绿原酸和木犀草苷的得率降低,但降低程度较小。这可能是由于温度过高时,绿原酸和木犀草苷的邻苯酚结构不稳定,易氧化或变性,故得率下降[22],因此提取温度选择70℃左右。
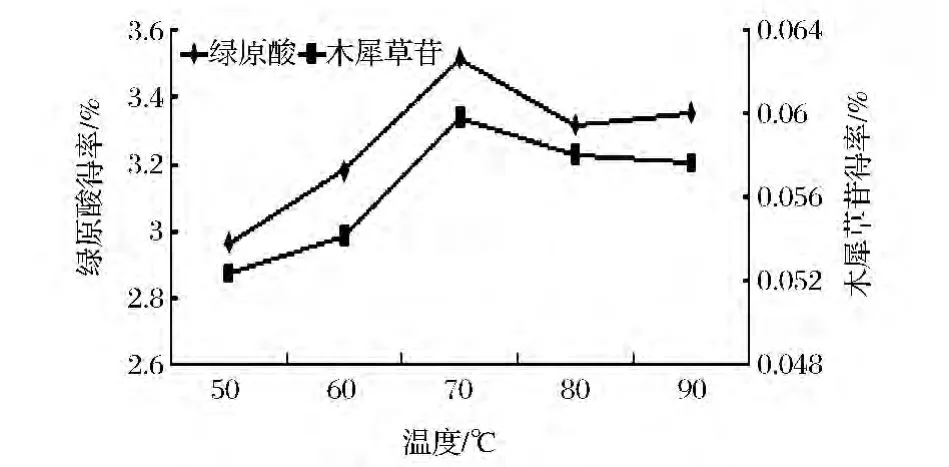
图6 提取温度对绿原酸和木犀草苷得率的影响Fig.6 Effection of extraction temperature on chlorogenic acid and cynaroside yield
2.2.6 乙醇浓度对指标的影响
固定料液比1∶25、提取温度70℃、提取时间2 h、提取2次,考察不同乙醇浓度对金银花绿原酸和木犀草苷得率的影响,结果见图7。

图7 乙醇浓度对绿原酸和木犀草苷得率的影响Fig.7 Effection of alcohol concentration on chlorogenic acid and cynaroside yield
由图7可知,绿原酸和木犀草苷的得率随乙醇浓度的变化基本上呈现相同的变化趋势,先升高后又下降,但两者的最适醇浓度不同。当乙醇体积分数为70%时,绿原酸的得率最高;当乙醇体积分数为80%时,木犀草苷的得率最高。这可能是因为,根据相似相溶原理,绿原酸的极性与70%乙醇溶液的极性相近,木犀草苷的极性与80%乙醇溶液的极性相近[23],因此在极性相近的溶液中溶解性较好,得率也高。当醇浓度超过最适浓度时,绿原酸和木犀草苷的得率会明显下降。综合考虑,选取乙醇浓度60、70、80%继续对绿原酸和木犀草苷的提取做响应面分析,以确定最佳的乙醇浓度。
2.3 响应面优化
2.3.1 回归模型的建立与系数显著性检验

表5 试验设计与结果Table 5 Experimental design and results
2.3.1.1 绿原酸得率回归模型的建立与系数显著性检验
将试验结果采用Design Expert 7.0.0软件进行多元回归拟合,得绿原酸得率对提取时间(X1)、温度(X2)、醇浓度(X3)和料液比(X4)的二次多项式回归方程为:
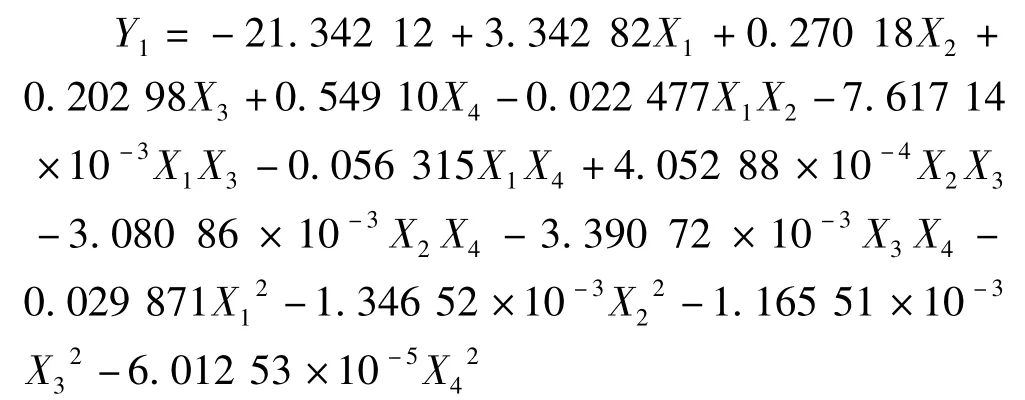
对回归模型进行方差分析和系数显著性检验,结果如下。由表6可以看出,模型显著性极高,方程不失拟,R2=0.921 9,表明所建立的二次多项式回归模型成立。对金银花绿原酸得率影响极显著,X1X2影响显著,X1、X4、X1影响不显著。对金银花绿原酸得率影响主次关系依次为提取温度>乙醇浓度>料液比>提取时间。
2.3.1.2 木犀草苷得率回归模型的建立与系数显著性检验
将试验结果采用Design Expert 7.0.0软件进行多元回归拟合,得木犀草苷得率对提取时间(X1)、温度(X2),醇浓度(X3)和料液比(X4)的二次多项式回归方程为:
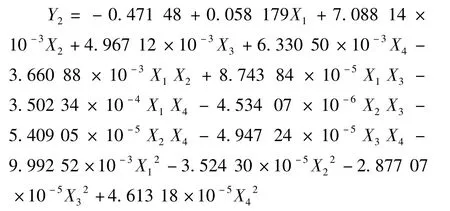
对回归模型进行方差分析和系数显著性检验,结果如下。从表7可以看出,模型显著性极高,方程不失拟,R2=0.918 1,表明所建立的二次多项式回归模型成立。X2、X3、X4、X2X4、X3X4、X12、X22、X32对金银花木犀草苷得率影响极显著,X1X2影响显著,X1、X1X3、X1X4、X2X3、X42影响不显著。对金银花木犀草苷得率影响主次关系依次为乙醇浓度>提取温度>料液比>提取时间。
2.3.2 交互作用分析
将2个因素固定在0水平,经 Design Expert 7.0.0软件统计分析,观察余下2个因素的交互作用。
2.3.2.1 交互作用对绿原酸得率的影响
由表6可知,有4个交互项作用显著。由图8可知,在各因素选取的水平范围内,当提取时间(X1)较短、乙醇浓度(X3)较低、提取温度(X2)适当、料液比(X4)较高时,绿原酸得率最高。这可能是因为,料液比较大时,不需要高浓度的乙醇,金银花中的绿原酸就能快速的从原料中溶解并扩散到提取溶剂中。当温度过高、时间延长时,得率下降,周期延长。提高乙醇浓度时,增加成本,且后序工作难度加大。仅以绿原酸得率为指标时,经Design Expert 7.0.0软件优化,得最佳提取工艺条件:提取时间为1h,温度为72.43℃,乙醇浓度为60.02%,液料比为1∶25。此条 件下绿原酸得率为3.752%。
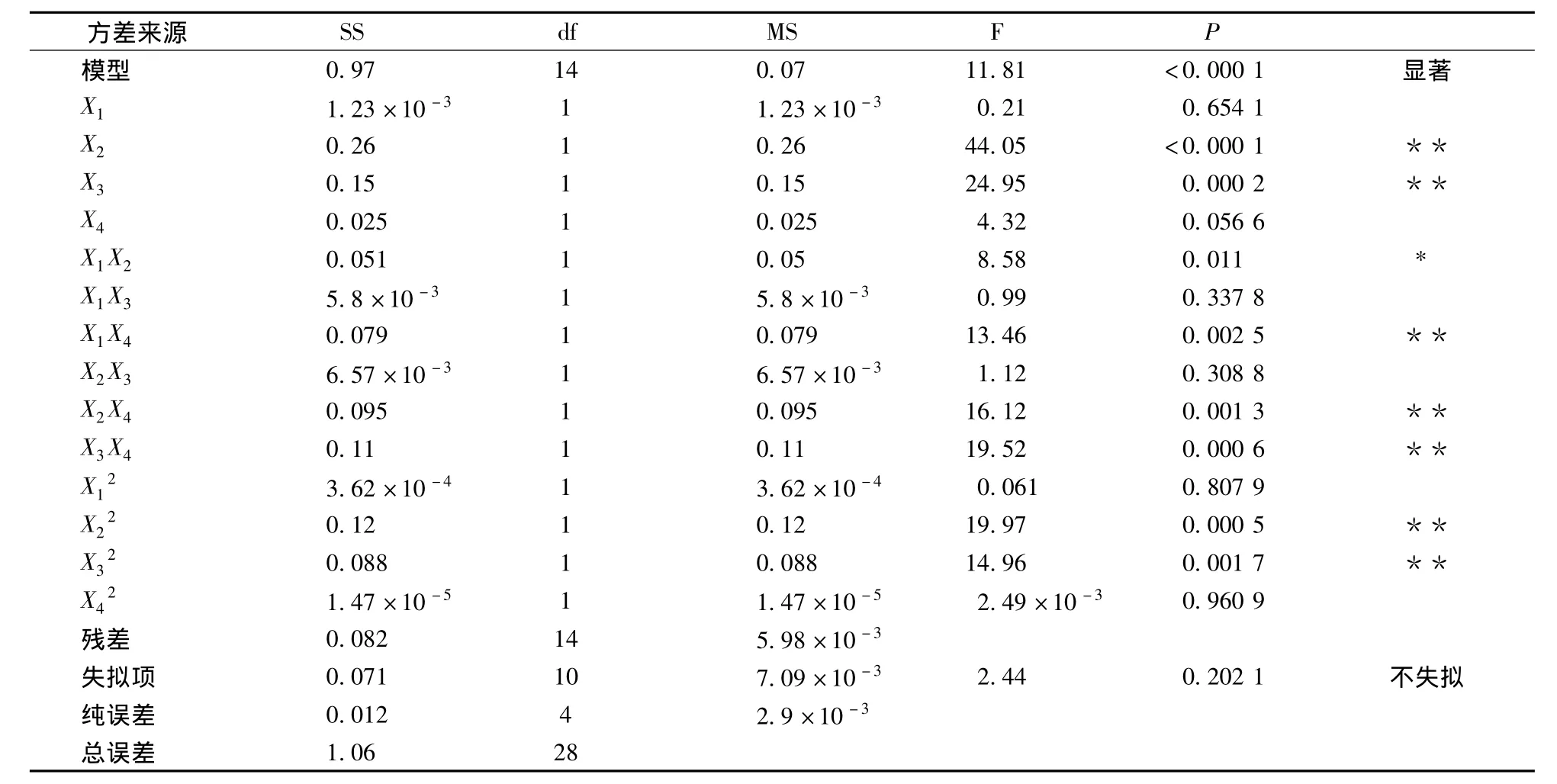
表6 二次多项式回归模型的方差分析Table 6 Analysis of variance table for quadratic model
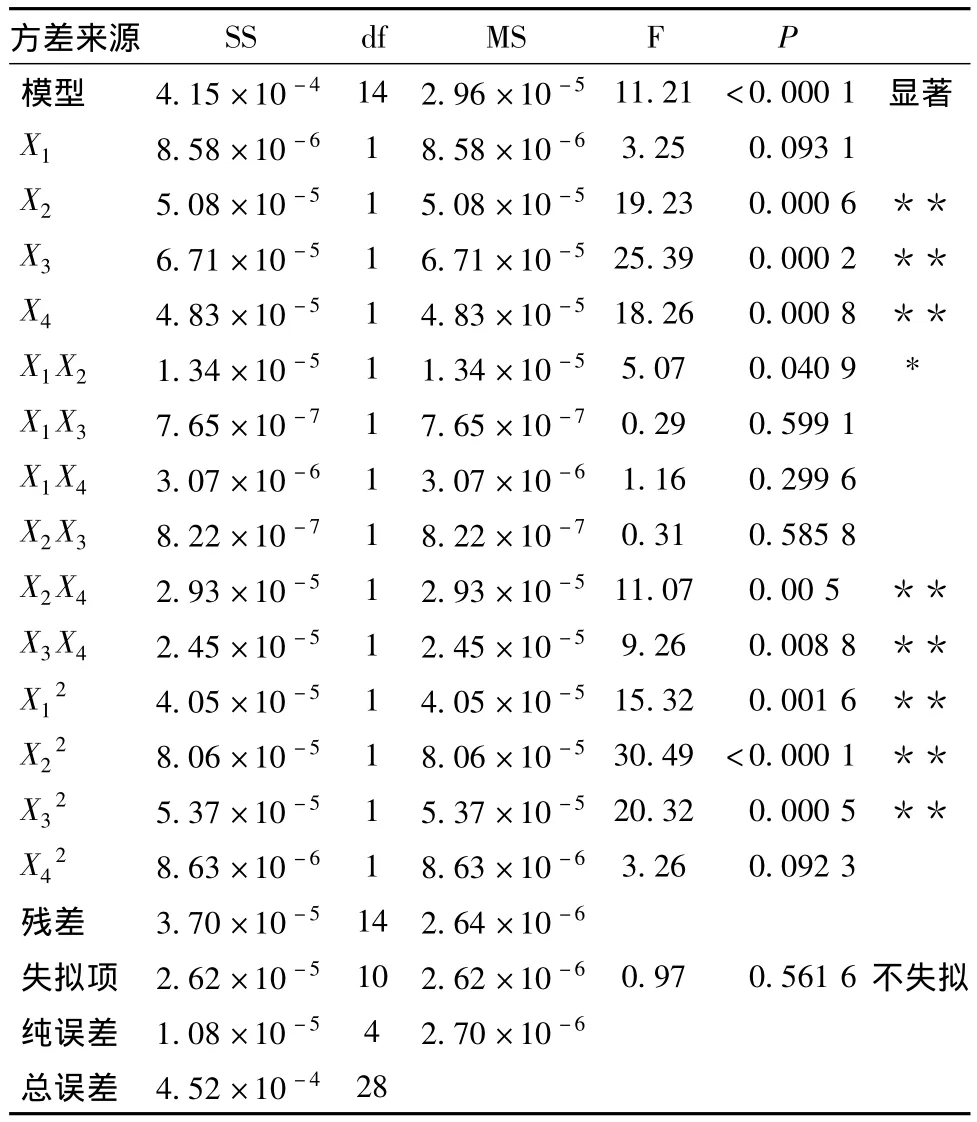
表7 二次多项式回归模型的方差分析Table 7 Analysis of variance table for quadratic model
2.3.2.2 交互作用对木犀草苷得率的影响
由表7可知,有3个交互项作用显著。由图9可知,在各因素选取的水平范围内,当乙醇体积分数(X3)较低、提取时间(X1)和温度(X2)适当、料液比(X4)较高时,木犀草苷得率最高。这可能是因为与绿原酸相比,木犀草苷的溶解速度较慢,需延长时间才能完全浸提出来。仅以木犀草苷得率为指标时,经Design Expert 7.0.0软件优化,得最佳提取工艺条件:提取时间为1.46 h,温度为69.83℃,乙醇体积分数为61.56%,液料比为1∶25。此条件下木犀草苷得率为0.068%。
以绿原酸和木犀草苷的得率为指标,经Design Expert 7.0.0软件组合优化得到,同时提取金银花中绿原酸和木犀草苷的最佳工艺条件为提取时间为1.25 h,温度为70.74℃,乙醇体积分数为60.14%,料液比为1∶25,在此条件下绿原酸得率为3.703%,木犀草苷得率为0.066%。
2.3.3 验证试验
为验证回归模型的可靠性,响应面法优化金银花中绿原酸和木犀草苷同时提取工艺的可行性,在模型所得最优工艺条件下进行试验。实际操作中,采用浸提时间为 1.25h,温度为 71℃,乙醇体积分数为60%,料液比为1∶25,3次重复实验得到的实际值为绿原酸得率为3.741%,木犀草苷得率为0.067%,与理论值偏差较小,重复性好,没有显著差异,说明此模型参数准确可靠。
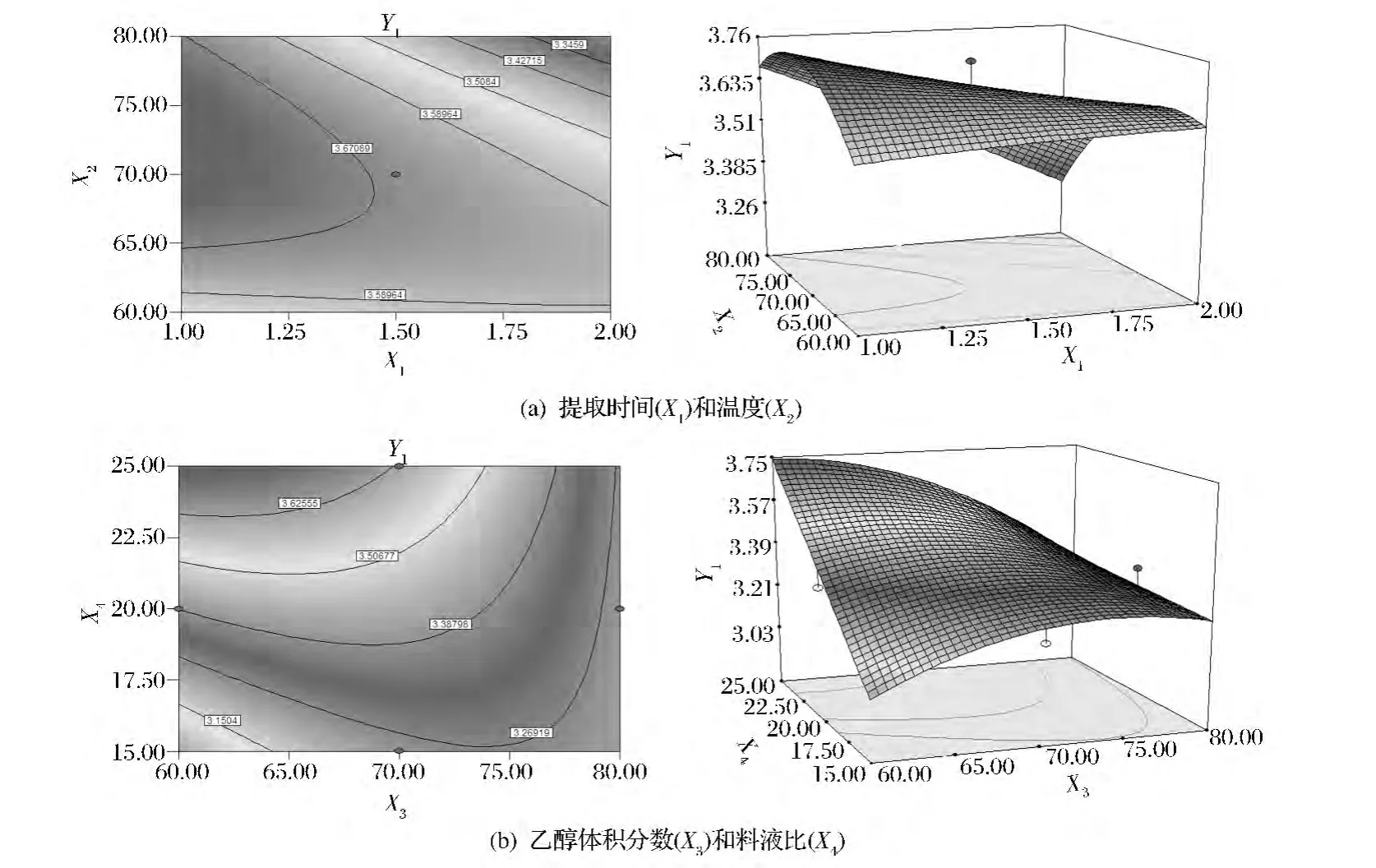
图8 交互项对绿原酸得率(Y1)影响的等高线图和响应面图Fig.8 Contour plots and response surface showing the effects of interaction terms on yield(Y1)of chlorogenic acid

图9 交互项对木犀草苷得率(Y2)影响的等高线图和响应面图Fig.9 Contour plots and response surface showing the effects of interaction terms on yield(Y2)of cynaroside
3 结论
(1)通过Box-Behnken设计试验,建立了金银花中绿原酸和木犀草苷提取工艺参数的二次多项式回归模型。方差分析结果表明,该模型准确可靠,可用于金银花绿原酸和木犀草苷提取得率的预测和分析。
(2)优化得到金银花中绿原酸和木犀草苷的最佳工艺条件为:浸提时间为1.25 h,温度为71℃,乙醇体积分数为60%,料液比为1∶25,此条件下绿原酸得率为3.741%,木犀草苷得率为0.067%。
[1]国家药典委员会.中华人民共和国药典(2010年版 一部)[S].北京:中国医药科技出版社,2010:205-206.
[2]王海军.浅析金银花在药理学中的应用研究[J].医学信息,2011,24(4):1 644.
[3]黄喜茹,刘伟娜,曹冬.金银花的化学成分药理作用研究评析[J].中医药学刊,2005,23(3):418-419.
[4]LOU Zai-xiang,WANG Hon-gxin,ZHU Song,et al.Antibacterial activity and mechanism of action of chlorogenic acid[J].Journal of Food Science,2011,76(6):398 -403.
[5]WU Lan,ZHANG Zhao-jun,ZHANG Ze-sheng.Characterization of antioxidant activity of extracts from Flos Lonicerae[J].Drug Development and Industrial Pharmacy,2007,33(8):841-847.
[6]WU Lan.Effect of chlorogenic acid on antioxidant activity of Flos Lonicerae extracts[J].Journal of Zhejiang University-Science B,2007,8(9):673-679.
[7]LI Shu-yuan,CHANG Cui-qing,MA Fu-qing,et al.Modulating effects of chlorogenic acid on lipids and glucose metabolism and expression of hepatic peroxisome proliferatoractivated receptor-α in golden hamsters fed on high fat diet[J].Biomedical and Environmental Sciences,2009,22(2):122-129.
[8]马双成,刘燕,牛培曦,等.金银花药材中抗呼吸道病毒感染的黄酮类成分的定量研究[J].药物分析杂志,2006,26(4):426 -430.
[9]Alcaraz L E,Puig O N,Tomas F,et al.Antibacterial activity of flavonoids against methicillin-resistant Staphylococcus aureus strains[J].Journal of Theoretical Biology,2000,205(2):231-240.
[10]朱胜春,胡嘉奇.浅析金银花的化学成份及药理作用[J].黑龙江医药,2006,19(4):299-300.
[11]史克莉,许蜡英.不同提取方法对金银花中绿原酸含量测定的影响[J].中华中医药学刊,2007,25(4):820-822.
[12]阎巧娟,韩鲁佳,江正强.金银花中绿原酸提取纯化工艺的优化[J].中国农业大学学报,2002,7(2):22-26.
[13]段晓颖.金银花水提工艺中绿原酸变化的研究[J].中草药,2007,38(8):1 189 -1 190.
[14]闵春艳,游本刚,许琼明,等.正交试验比较金银花药材中绿原酸与木犀草苷的乙醇提取工艺[J].中成药,2011,33(10):1 815 -1 818.
[15]何小珍,蒋军辉,徐小娜,等.野菊花中绿原酸与木犀草苷同时超声提取条件优化[J].广州化工,2012,40(5):8-16.
[16]CUI Ting-ting,WANG Chao,SHAN Chang-song,et al.Optimization of the extraction technology of chlorogenic acid in honeysuckle by response surface method[J].Open Access Library Journal,2014,1:1 -9.
[17]郭晓园.金银花中绿原酸的提取分离及抗氧化作用研究[D].洛阳:河南科技大学,2009.
[18]李学鹏,励建荣,杨建荣.苹果中多酚类物质HPLC检测方法的建立[J].中国食品学报,2008,8(6):116-121.
[19]王海侠,汪玮鑫,时维静.金银花中绿原酸和木犀草苷的同时提取及测定研究[J].安徽科技学院学报,2011,25(5):37 -41.
[20]徐晓伟.金银花绿原酸的提取纯化研究[D].安徽:合肥工业大学,2010.
[21]艾心灵.烟草绿原酸的提取纯化工艺研究[D].无锡:江南大学,2007.
[22]张伟敏.灰毡毛忍冬中绿原酸的分离纯化及功能性研究[D].重庆:西南大学,2006.
[23]许晖,孙兰萍,张斌,等.响应面法优化花生壳黄酮提取工艺的研究[J].中国粮油学报,2009,24(1):107-111.
