黄海南部野生银鲳和鮸鱼的耳石元素微化学研究
2015-10-22熊瑛刘洪波姜涛刘培廷汤建华仲霞铭杨健吴磊高银生
熊瑛,刘洪波,姜涛,刘培廷,汤建华,仲霞铭,杨健,*,吴磊,高银生
(1.江苏省海洋水产研究所,江苏南通226007;2.南京农业大学无锡渔业学院,江苏无锡214081;3.中国水产科学研究院淡水渔业研究中心长江中下游渔业生态环境评价和资源养护重点实验室,江苏无锡214081)
黄海南部野生银鲳和鮸鱼的耳石元素微化学研究
熊瑛1,2,刘洪波3,姜涛2,刘培廷1,汤建华1,仲霞铭1,杨健2,3*,吴磊1,高银生1
(1.江苏省海洋水产研究所,江苏南通226007;2.南京农业大学无锡渔业学院,江苏无锡214081;3.中国水产科学研究院淡水渔业研究中心长江中下游渔业生态环境评价和资源养护重点实验室,江苏无锡214081)
利用电子显微探针元素分析技术(EP M A)对黄海南部野生银鲳和鮸鱼的耳石进行了锶和钙沉积特征的初步分析。定量线分析结果表明,两种鱼类耳石的Sr/Ca之间存在显著的种间差异。银鲳耳石Sr/Ca比,在耳石核心及相邻处为低值区(5.86±0.92);3段Sr/Ca高值区分别为近核心部(7.88 ±1.28)、第1龄处(9.44±1.82)及耳石边缘(7.91±1.38);揭示银鲳孵化和早期发育应需要盐度适中的生境,当龄鱼在后期的生长中需洄游经过两段高盐生境(其中之一在第1龄时)。鮸鱼耳石Sr/Ca比波动表现为耳石核心处(7.72±0.97)高于其余部分,反映了鮸鱼孵化及初期发育阶段可能生活在高盐度生境,而当龄鱼随后阶段的生长和发育过程则会洄游至盐度有所降低的生境中进行。
耳石;银鲳;鮸鱼;电子显微探针分析;黄海南部
熊瑛,刘洪波,姜涛,等.黄海南部野生银鲳和鮸鱼的耳石元素微化学研究[J].海洋学报,2015,37(2):36—43,doi:10.3969/j. issn.0253-4193.2015.02.004
Xiong Ying,Liu H ongbo,Jiang Tao,et al.Investigation on otol ith microchemistry of wi ldPam pus argenteusandMiichthys miiuyin the southern Yellow Sea,China[J].Haiyang Xuebao,2015,37(2):36—43,doi:10.3969/j.issn.0253-4193.2015.02.004
1 引言
银鲳和鮸鱼是我国重要的海洋经济种类,黄海南部吕四渔场为银鲳和鮸鱼等经济鱼类传统的产卵场。银鲳(Pa m pus argenteus)属鲈形目鲳科鲳属,是一种暖水性中下层鱼类,在黄海南部和东海北部分布较为集中;鮸鱼(Miichthys miiuy)属鲈形目石首鱼科鮸鱼属,为近海暖温性底层鱼类,在我国海域广泛分布。近年来我国鮸鱼的人工繁育与养殖已在南方沿海取得显著的进展,银鲳的人工繁育刚刚起步,但两种鱼类人工育苗技术至今尚未成熟,早期发育过程中的仔稚鱼存活率仍然较低[1—2],其中盐度被认为是影响海洋鱼类早期生活史中存活率的重要环境因子之一。
耳石是一种双晶体结构。随着鱼体生长的过程,水环境中的元素被吸收进入耳石。从耳石核心到外缘区按生长时间序列记录的环境元素变化形成一种指纹,这种指纹对应着鱼类从出生到被捕获所经历的生境。耳石微化学方法在重建生活史方面具有独特的优势,其中耳石Sr和Ca比常用作反演不同盐度生境的特征指标[3—7]。由于耳石元素微化学研究结果独特的生境相关性及客观性的优势,即使仅有1至数尾鱼样本,也能有效把握鱼类生境“履历”。鄱阳湖溯河洄游和淡水定居的刀鲚(Coilia nasus)[8]、长江口鲻(M ugilcephalus)[9]、日本褐鳟(Salmo trutta)[10]、俄罗斯鲟(Acipenser gueldenstaedti)[11]等研究上均有成功的实例。
迄今,有关盐度对海产鱼类胚胎和仔鱼发育影响的研究已有许多报道[12—15],为经济鱼类的人工繁育提供了宝贵的基础资料。然而,不同种类间盐度适应性不同,且同一种类生活史不同阶段对盐度的要求不同。关于两种鱼类的研究主要集中繁殖特性[1,12,16—17]、人工孵化及苗种培育[2,18]等诸多方面,从耳石微化学角度来探讨鮸鱼和银鲳生活史的研究尚未见报道。本文研究了黄海南部野生经济鱼类银鲳和鮸鱼的耳石微化学特征,以期直观揭示其生活史履历;并基于此,从满足生境需求的新角度对今后可能开展的两种鱼类人工繁育和养殖工作提供理论支撑。
2 材料与方法
2.1实验材料
本研究的实验材料银鲳和鮸鱼,于2012年5月采自吕四渔场小黄鱼银鲳国家级水产种质资源保护区海域。银鲳(B H Q Y C0501,叉长163 m m,体质量132.7 g,1+龄),鮸鱼(B H Q M Y0901,体长51 m m,体质量1.2 g,0+龄;B H Q M Y1901,体长208 m m,体质量155.2 g,0+龄)。鱼体解剖取出矢耳石,清除耳石表面的有机质后,去离子水清洗后,室温下干燥备用。2种鱼类的矢耳石形态特征见图1。
图1 矢耳石形态特征Eig.1 Sagittal otol ith morphology
2.2耳石微化学分析
耳石样品使用环氧树脂(Epofix,丹麦Struers公司)包埋固定后,用500目和1 200目砂纸磨至核心暴露。换用装有机织布抛光盘的磨抛机(Roto Pol-35,丹麦Struers公司)配合抛光液抛光至核心完全暴露且表面无明显刮痕。将处理完的包有耳石的树脂块放入M Q水中超声清洗5 min,然后自然凉干24 h。待完全晾干后,将样品置于真空镀膜机(JEE-420,日本电子株式会社)中蒸镀碳膜(36 A,25S)。
耳石微化学分析方法参考Yang等[19]、杨健和刘洪波[9],使用电子探针微区分析仪(JX A-8100型EPM A,日本电子株式会社)分析耳石样品。自耳石核心沿最长径至耳石边缘的直线进行Sr和Ca定量线分析,线分析时EP M A加速电压和电子束电流分别设为15 kV,2.0×10-8A,束斑直径为5μm,连续打点测定,点间间隔(银鲳B H Q Y C0501:20μm;鮸鱼B H Q M Y1901:20μm;鮸鱼B H Q M Y0901:10μm)。使用碳酸钙(CaC O3)和钛酸锶(SrTiO3)作为标准样品。定量线分析完后,再对耳石样品进行Sr和Ca含量的面分布分析,面分析时EP M A加速电压和电子束电流分别设为15 kV,5.0×10-7A,束斑直径为5 μm,像素(银鲳B H Q Y C0501:7×7μm),每点驻留时间为30 ms。
2.3数据分析
定量线分析用由上述电子探针显微分析仪沿耳石标本矢状面,从核心顺最长轴向边缘测定,获得各测定点Sr和Ca的含量数据。每个测定点到耳石核心的轴距离定义为“耳石径”。由于耳石中Sr含量远小于Ca的含量,按国际惯例将Sr/Ca比值标准化,即统一用Sr含量和Ca含量×103的比值表示(简称Sr/ Ca比值)。耳石不同区域Sr/Ca比值的趋势用平均值±标准差表示。
本研究采用SPSS19.0软件进行统计分析。差异的显著水平判定用M ann-W hitneyU测验进行。
3 结果与分析
银鲳B H Q Y C0501耳石Sr/Ca比值从核心至边缘出现3段高值区和3段低值区(见图2),将整个Sr/Ca比值变化过程分为6个阶段(表1):第一阶段0~660μm、第三阶段1 200~1 500μm、第五阶段2 120~2 600μm为低值区,Sr/Ca比值依次为(5.86 ±0.92)、(5.41±0.56)和(5.49±0.77);第二阶段680~1 180μm[Sr/Ca值(7.88±1.28)]、第四阶段1 520~2 100μm(9.44±1.82)及第六阶段2 620~2 760μm(7.91±1.38)为高值区。银鲳耳石的第一、第三与第五阶段Sr/Ca比值间无显著差异,但上述3个阶段与第二、四、六阶段间均存在极显著差异(P<0.01,Mann-W hitneyUtest);第二阶段与第六阶段无显著差异,但与第四阶段Sr/Ca比值间存在显著差异(P<0.05,M ann-W hitneyUtest)。
2尾鮸鱼耳石核心处Sr/Ca均值为(7.72± 0.97),均表现出耳石核心处要稍高于其余部分的趋势。B H Q M Y0901,第一阶段从核心至70μm处共8个测定点,Sr/Ca比值为(7.11±0.53);第二阶段从距离核心80μm至耳石边缘为(6.23±0.88);二者之间差异极显著(P<0.01,M ann-W hitneyUtest)(表1)。B H Q M Y1901,耳石离核心100μm处Sr/Ca比值出现急剧下降,此后Sr/Ca比值在4~6间波动(见图2);从核心至100μm的Sr/Ca比值为(8.54±0.81),离核心120μm处至耳石边缘的Sr/Ca比值为(4.77 ±0.98),二者之间差异极显著(P<0.01,Mann-W hitneyUtest)(表1)。
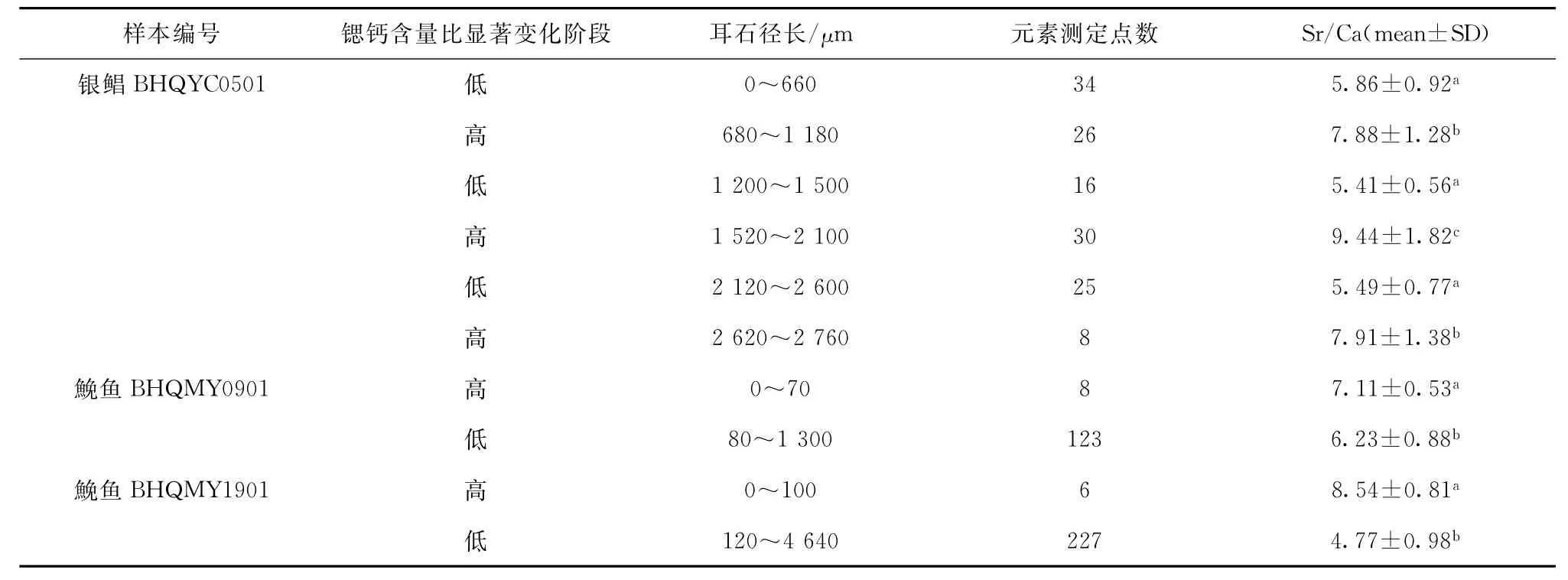
表1 银鲳和鮸鱼耳石中锶和钙的微化学变化Tab.1 Fluctuation of Sr and Ca microchemistry in otoliths ofPampus argenteusandMiichthys miiuy
银鲳B H Q Y C0501耳石从核心向外可以明显分为6个同心环,从颜色上划分为黄绿色、黄红色及红色同心环(包括耳石边缘的黄红色环),黄绿色区域对应Sr值较高的区域,黄红色(对应于近耳石核心部及耳石边缘)为高Sr值,红色(对应1龄)则为Sr值极高区域(见图3)。这种耳石上Sr分布规律与定量线分析的Sr/Ca比值差异性(见图2)的结果相印证。
4 讨论
由于不同天然水体中Sr含量与分布方式存在明显差异(淡水区低,海水高,河口区介于二者之间),耳石内Sr/Ca比的分布特征直接标记了鱼类的生活履历,能有效表征鱼类不同生长阶段所经历的不同生境。天然水体中,Sr含量一般与盐度呈正相关,鱼类的耳石Sr/Ca比通常随盐度升高而增大[20]。日本鳗鲡耳石Sr/Ca与水体盐度正相关,但与饵料水平无明显相关性[21]。W alther和Thorrold[22]认为海洋鱼类耳石中沉积的Sr大部分来源于海水,而非饵料。洄游性鱼类,如欧洲鳗鲡、美洲鳗鲡及香鱼,其海水生活履历耳石Sr/Ca比均显著高于其河口或淡水履历的平均水平[23—24]。窦硕增等[25]证实了“鱼类耳石中Sr含量与水环境的Sr的背景浓度值或盐度值呈正相关”,阐明了洄游性鱼类、河口性鱼类及淡水鱼类之间的Sr沉积量水平存在明显的差异。海水鱼类耳石中Sr/Ca比常有相当大的种间差异[26—27]。鮸鱼和银鲳均为暖水性海洋鱼类,但Sr/Ca比值线分布和Sr面分布结果表明了种间差异特征:鮸鱼为近海性鱼类,B H Q M Y1901的Sr/Ca比值线分布表明其生长后期Sr/Ca值为4.77;银鲳是一种长距离洄游性鱼类,B H Q Y C0501的Sr/Ca比线分布和Sr面分布中出现的高Sr值及红色同心环对应于该生长阶段生活于高盐水域。
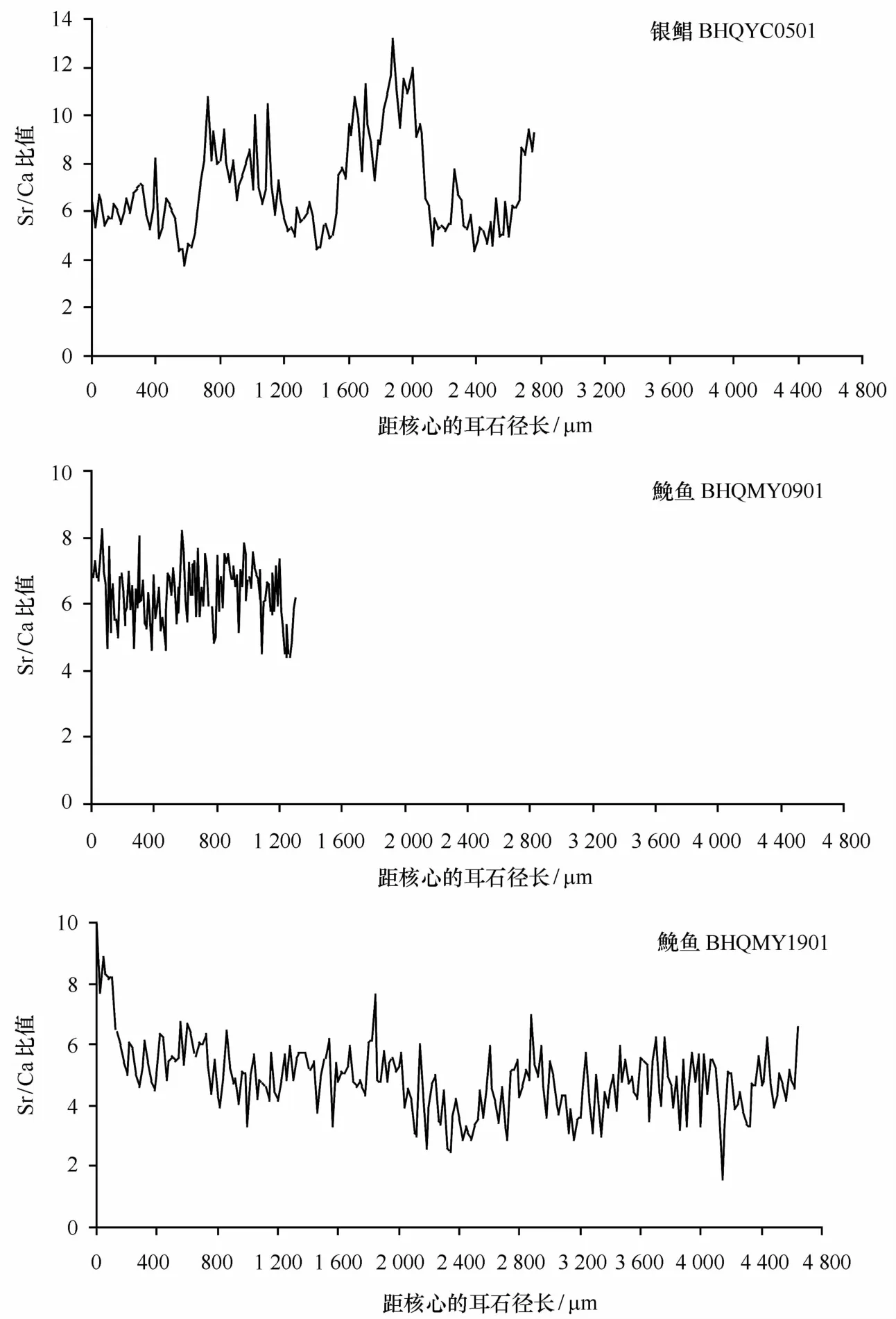
图2 耳石从核心(0μm)到边缘定量线分析所获Sr/Ca比值Eig.2 The ratios of Sr/Ca concentration along l ine transects from the core(0μm)to the edge in otol iths
海水鱼类人工繁殖中常研究盐度对海洋生物繁殖和生长的影响,王涵生等[13]、张海发等[14]研究了盐度对赤点石斑鱼、斜带石斑鱼等受精率、胚胎和早期仔鱼发育的影响,这有助于选择适合的环境或选择适当的季节来进行种苗的生产。罗海忠等[12]研究了在盐度10.0~50.0范围内,人工培养条件下的舟山近海鮸鱼胚胎都能孵化出仔鱼,但不同盐度对孵化后仔鱼成活及畸形率影响较大:盐度高于50.0时初孵仔鱼存活时间不超过24 h,畸形率100%;盐度40.0时畸形率达40%;盐度低于20.0时畸形率随盐度下降而明显增高。本研究中鮸鱼推定为0+龄[18]。B H Q M Y0901和B H Q M Y1901的耳石核心Sr/Ca比分别为7.11和8.54,尽管二者之间有一定差值,但依据本研究室所建立的不同盐度水域所对应的耳石Sr/Ca比标准,即淡水、半咸水和海水的Sr/Ca比平均值一般分别具有“≤3,3~7,>7”的趋势,2尾鮸鱼耳石微化学结果客观且一致地反映了鮸鱼孵化期处于高盐生境(即典型的海水[28],34为典型海水盐度[29])。同类研究见石首鱼科小黄鱼耳石核心Sr/Ca值与孵化期高盐生境的对应关系分析,并取得一些突破[30]。并且该观点与罗海忠等[12]的研究所述“鮸鱼在盐度26~40孵化率最高,畸形率相对较低”吻合,不存在因样本量少而引起的不确定性。这一结论为今后鮸鱼人工繁育水环境条件的优化提供了切实的依据。
2尾鮸鱼在早期发育阶段的Sr/Ca比值,B H Q M Y0901均值为6.23(离耳石核心80~1 300 μm),B H Q M Y1901均值为5.32(离耳石核心120~1 360μm),说明黄海南部自然条件下的鮸鱼在盐度高的海水中孵化后会短期内即过渡到盐度有所降低的水域中生活。夏季,黄海南部近海盐度约26~28,且长江口邻近海域盐度低至24~26[31]。黄海南部近海海域夏季出现大量的鮸鱼幼体(体长范围为21~88 m m)[32],45日龄鮸鱼稚鱼体长为13.2 m m[1],结合有关鮸鱼胚胎和早期发育的研究[1,12,33],认为黄海南部近海自然条件下生长的鮸鱼幼鱼,可能因其孵化所需的盐度环境适宜,且早期发育阶段饵料充足,顺利度过稚鱼期,避免了人工繁育的鮸鱼早期发育过程中的高死亡率现象。
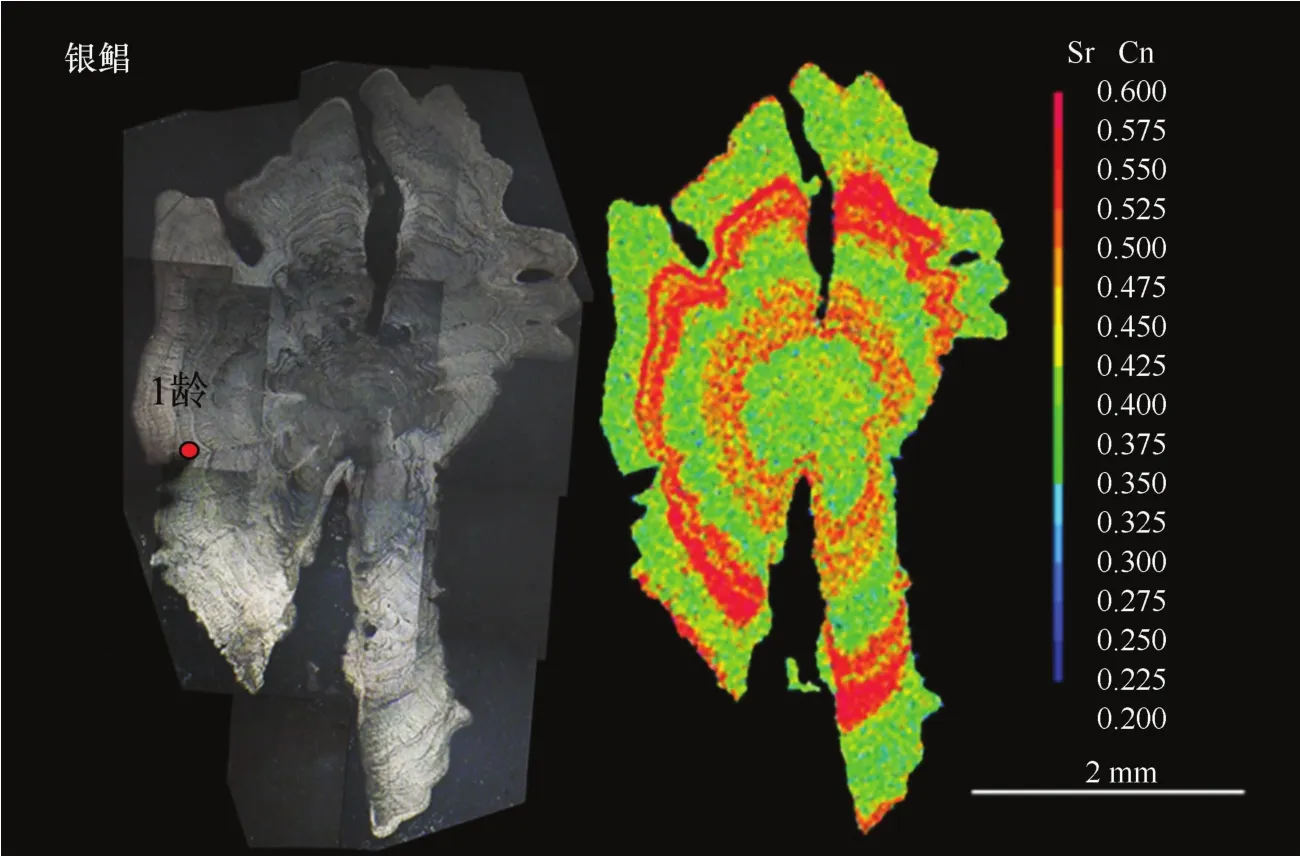
图3 银鲳耳石Sr的面分布和耳石年轮特征(红点示年轮)Eig.3 The Sr concentration mapped by X-ray electron microprobe analysis and the annul iin the sagittal plane ofPam pus argenteus(red dot represents the annul i)
关于银鲳受精卵孵化的环境因子,不同海域群体结果各异:科威特海域孵化水温为26.0~32.8℃,盐度为39.0[34];日本海域孵化水温为25.2~26.4℃[35];中国浙江北部银鲳产卵场的水温在14~22℃,盐度在26~31之间[36]。Dadzie等[37]发现从初孵化银鲳仔鱼到幼鱼阶段的存活率只有1.5%,大批死亡主要集中在孵化后10天内。郭勤单等[15]认为银鲳早期仔鱼能够适应较广的养殖水体盐度变化,在10~30盐度范围内存活较好,低盐(盐度5)和高盐(盐度50以上)对银鲳仔鱼有害。本研究银鲳B H Q Y C0501的定量线分析数据和Sr面分布表明,黄海南部海域银鲳孵化和早期发育阶段可能生活于Sr值中等的半咸水中。在人工育苗中,海水鱼类受精卵孵化盐度的确定应以胚胎发育的最适盐度为依据,随后的早期发育也要求一定的盐度条件,自然海域银鲳孵化的盐度生境的探索可为黄海南部海域银鲳人工育苗提供一定的参考。
钱世勤[38]确认东海银鲳的年轮形成周期为一年一轮。根据生长方程推断本研究中银鲳为1.8龄,耳石磨片特征表明银鲳B H Q Y C0501为1+龄。银鲳耳石离核心680~1 180μm区域的Sr/Ca比值为7.88,在1 520~2 100μm区域(对应1龄)的Sr/Ca比值为9.44,2 620~2 760μm区域(对应耳石边缘)的Sr/Ca比值为7.91,以及图3所示的Sr含量面分布中具有高Sr值特征的3个黄红色或红色同心环,均说明当龄银鲳在生长阶段会洄游经过两段高盐生境。但有关银鲳渔场、渔获量及其与海洋学特征的研究较少,尚未揭示银鲳时空分布与环境要素如盐度、温度等之间的关联性,本文首次从耳石微化学角度直观地显示了银鲳在周年的洄游过程中成鱼产卵期盐度生境不同于仔鱼,该生活史阶段需要高盐度水的生境,这可能有助于性腺的发育成熟。然而,在人工养殖过程中,尤其在鱼类养成养殖期,一般只注重对饲料成分和饲养方法的调整,往往忽视养殖水环境的盐度调节[39],耳石微化学所反映的生境条件可作为鱼类养殖时盐度环境因子调控的重要参考依据。由于银鲳地理群体较为复杂[40],今后有必要结合不同地理群体的各种规格银鲳的耳石日/年龄和洄游生境的盐度变化规律的调查,进一步较为精确地重建银鲳洄游的时间和空间模式,以为银鲳资源养护和人工繁育工作提供进一步的基础资料。
因缺乏两种鱼类洄游分布与盐度环境的对应关系的研究,本文基于耳石微化学对自然海域中银鲳和鮸鱼生境履历的初步分析结果对这些鱼类的人工繁养具有更为重要的意义;今后可通过建立不同生长阶段(尤其是早期生活史)养殖水体盐度与鱼类耳石Sr/ Ca的相关性,结合耳石微结构的分析,精准地回推自然海域鱼类各生长阶段的盐度履历,通过主动调控盐度环境来达到更为有效人工繁养的目的。
[1]钟俊生,楼宝,袁锦丰.鮸鱼仔稚鱼早期发育的研究[J].上海水产大学学报,2005,14(3):231-237.
Zhong Junsheng,Lou Bao,Yuan Jinfeng.Study on the early developmentin larvae and juveni les ofMiichthys miiuy[J].Journal of Shanghai Eisheries U niversity,2005,14(3):231-237.
[2]施兆鸿,赵峰,王建钢,等.舟山渔场银鲳人工授精及孵化[J].渔业现代化,2009,36(1):18-21.
Shi Zhaohong,Zhao Eeng,Wang Jiangang,et al.Artificialinsemination andincubation of si lver pomfret(Pam pusargenteus)from Zhoushan fishing ground[J].Eishery M odernization,2009,36(1):18-21.
[3]Kal ish J M.Use of otol ith microchemistry to distinguish the progeny of sympatric anadromous and non-anadromous salmonids[J].Eishery Bul letin,1990,88(4):657-666.
[4]Secor D H,Rooker J R,Zlokovitz E,et al.Identification of riverine,estuarine,and coastal contingents of H udson River striped bass based upon otol ith elementalfingerprints[J].M arine Ecology Progress Series,2001,211:245-253.
[5]Thorrold S R,Latkoczy C,Swart P K,et al.Natal homing in a marine fish metapopulation[J].Science,2001,291(5502):297-299.
[6]W alther B D,Thorrold S R.Limited diversityin natal origins ofim mature anadromousfish during ocean residency[J].Canadian Journal of Eisheries and Aquatic Sciences,2010,67(10):1699-1707.
[7]Panfi l i J,Darnaude A M,Lin Y J,et al.Habitat residence during continentall ife ofthe European eelAnguilla Anguillainvestigated using l inear discriminant analysis appl ied to otol ith Sr∶Ca ratios[J].Aquatic Biology,2012,15(2):175-185.
[8]姜涛,周昕期,刘洪波,等.鄱阳湖刀鲚耳石的两种微化学特征[J].水产学报,2013,37(2):239-244.
Jiang Tao,Zhou Xinqi,Liu H ongbo,et al.Two microchemistry patterns in otol iths ofCoilica nasusfrom Poyang Lake,China[J].Journal of Eisheries of China,2013,37(2):239-244.
[9]杨健,刘洪波.长江口崇明水域鲻鱼耳石元素微化学分析[J].中国水产科学,2010,17(4):853-858.
Yang Jian,Liu Hongbo.Otol ith microchemistry of grey mul letM ugilcephalusfrom Chongming water in the Yangtze River estuary,China[J]. Journal of Eishery Sciences of China,2010,17(4):853-858.
[10]Arai T,Kotake A,Aoyama T,et al.Identifying sea-run brown trout,Salmo trutta,using Sr∶Ca ratios of otol ith[J].Ichthyological Research,2002,49(4):380-383.
[11]Arai T,Miyazaki N.Use of otol ith microchemistry to estimate the migratory history ofthe Russian sturgeon,Acipenser guldenstadti[J].Journal of the Marine Biological Association of the U K,2001,81(4):709-710.
[12]罗海忠,傅荣兵,陈波,等.舟山近海鮸鱼胚胎和早期仔鱼的发生及与盐度的关系[J].浙江海洋学院学报(自然科学版),2006,25(1):15-22.
Luo Haizhong,Eu Rongbing,Chen Bo,et al.E mbryos and earlylarvae occurrence ofMiichthys miiuyoff Zhoushan and the relationship to sal inity.Journal of Zhej iang Ocean U niversity(Natural Science),2006,25(1):15-22.
[13]王涵生,方琼珊,郑乐云.盐度对赤点石斑鱼受精卵发育的影响及仔鱼活力的判断[J].水产学报,2002,26(4):344-350.
Wang Hansheng,Eang Qiongshan,Zheng Leyun.Effects of sal inity on hatching rates and survival activity index of the larvae of Epinephelus akaara[J].Journal of Eisheries of China,2002,26(4):344-350.
[14]张海发,刘晓春,王云新,等.温度、盐度及p H对斜带石斑鱼受精卵孵化和仔鱼活力的影响[J].热带海洋学报,2006,25(2):31-36.
Zhang Haifa,Liu Xiaochun,Wang Yunxin,et al.Effects oftemperature,sal inity and p H on hatch andlarvalactivity ofEpinepheluscoioides[J]. Journal of Tropical Oceanography,2006,25(2):31-36.
[15]郭勤单,徐国成,王有基,等.银鲳仔鱼对不同盐度的耐受力及其耗氧量的研究[J].水产学报,2013,37(5):719-726.
Guo Qindan,Xu Guocheng,Wang Youj i,et al.Study on sal inity tolerance and oxygen consumption of si lver pomfret(Pam pusargenteus)larvae[J].Journal of fisheries of China,2013,37(5):719-726.
[16]施兆鸿,彭士明,王建钢,等.人工养殖银鲳子代胚胎发育及仔稚幼鱼形态观察[J].中国水产科学,2011,18(2):267-274.
Shi Zhaohong,Peng Shiming,Wang Jiangang,et al.Observation of embryonic,larval and juveni le development inPam pus argenteusoffspring[J].Journal of Eishery Sciences of China,2011,18(2):267-274.
[17]孙鹏,尹飞,施兆鸿,等.养殖银鲳卵巢发育的组织学观察[J].中国水产科学,2013,20(2):293-298.
Sun Peng,Yin Eei,Shi Zhaohong,et al.Histologicalanalysis of ovary developmentin the cultured si lver pomfret,Pam pusargenteus[J].Journal of Eishery Sciences of China,2013,20(2):293-298.
[18]楼宝.鮸鱼的渔业生物学和人工繁养技术[J].渔业现代化,2004(6):11-13.
Lou Bao.Eishery biology and aquaculture technology ofMiichthys miiuy[J].Eishery M odernization,2004(6):11-13.
[19]Yang J,Arai T,Liu H,et al.Reconstructing habitat use ofCoilia mystusandCoilia ectenesofthe Yangtze River estuary,and ofCoilia ectenesof Taihu Lake,based on otol ith strontium and calciu m[J].Journal of Eish Biology,2006,69(4):1120-1135.
[20]Secor D H,Rooker J R.Is otol ith strontiu m a useful scalar ofl ife cyclesin estuarine fishes?[J].Eisheries Research,2000,46(1/3):359-371.
[21]Lin S H,Chang C W,Iizuka Y,et al.Sal inities,not diets,affect strontium/calcium ratios in otol iths ofAnguilla japonica[J].Journal of Experimental Marine Biology and Ecology,2007,341(2):254-263.
[22]W alther B D,Thorrold S R.W ater,notfood,contributesthe majority ofstrontiu m and bariu m depositedin the otol iths of a marinefish[J].M arine Ecology Progress Series,2006,311:125-130.
[23]Kuroki M,Ma T,Ishida R,et al.Migratory history of wi ld and released ayu(Plecoglossus altivelis)in the Kurobe River,Japan[J].Coastal M arine Sciences,2006,30(2):425-431.
[24]Kuroki M,Kawai M,Jónsson B,et al.Inshore migration and otol ith microstructure/microchemistry of angui l l id glass eels recruited to Iceland[J]. Environ mental Biology of Eishes,2008,83(3):309-325.
[25]窦硕增,横内一樹,于鑫,等.基于EP M A的耳石Sr∶Ca比分析及其在鱼类生活履历反演中的应用实例研究[J].海洋与湖沼,2011,42(4):512-520.
Dou Shuozeng,Yokouchi K,Yu Xin,et al.Reconstructing migratory history of fish using otol ith strontium∶calciums ratios by EP M A:a case study[J].Oceanologia et Limnologia Sinica,2011,42(4):512-520.
[26]Kal ish J M.Otol ith microchemistry:val idation ofthe effects of physiology,age and environment on otol ith composition[J].Journal of Experimental M arine Biology and Ecology,1989,132(3):151-178.
[27]Hamer P A,Jenkins G P.Comparison of spatial variation in otol ith chemistry oftwo fish species and relationships with water chemistry and otol ith growth[J].Journal of Eish Biology,2007,71(4):1035-1055.
[28]Yang J,Jiang T,Liu H B.Are there habitat sal inity markers ofthe Sr:Ca ratio in the otol ith of wi ld diadromous fishes?A l iterature survey[J]. Ichthyological Research,2011,58(3):291-294.
[29]Surge D M,Lohmann K C.Temporal and spatial differences in sal inity and water chemistry in S W Elorida estuaries:effects of hu man-impacted watersheds[J].Estuaries,2002,25(3):393-408.
[30]熊瑛,刘洪波,刘培廷,等.基于耳石元素微化学的江苏吕泗近岸小黄鱼生境履历重建[J].应用生态学报,2014,25(3):836-842.
Xiong Ying,Liu H ongbo,Liu Peiting,et al.Reconstructing habitat history of Larimichthys polyactis in Lvsi coastal waters of Jiangsu[J].Chinese Journal of Appl ied Ecology,2014,25(3):836-842.
[31]何小燕,胡挺,汪亚平,等.江苏近岸海域水文气象要素的时空分布特征[J].海洋科学,2010,34(9):44-54.
He Xiaoyan,H u Ting,Wang Yaping,et al.Seasonal distributions of hydrometeor parametersin the offshore sea of Jiangsu[J].M arine Sciences,2010,34(9):44-54.
[32]仲霞铭,汤建华,张虎,等.江苏近岸海域鮸时空分布特征研究[J].海洋学报,2010,32(3):95-106.
Zhong Xiaming,Tang Jianhua,Zhang H u,et al.Temporal and spatial distribution ofMiichthys miiuyin Jiangsu coastal waters[J].Haiyang Xuebao,2010,32(3):95-106.
[33]单秀娟,窦硕增.饥饿胁迫条件下黑鮸(Miichthys miiuy)仔鱼的生长与存活过程研究[J].海洋与湖沼,2008,39(1):14-23.
Shan Xiujuan,Dou Shuozeng.Effects of delayed firstfeeding on growth,survival and biochemical composition of CroakerMiichthys miiuylarvae[J].Oceanologia et Limnologia Sinica,2008,39(1):14-23.
[34]Almatar S M,Lone K P,Abu-Rezq T S,et al.Spawning frequency,fecundity,egg weight and spawning type of si lver pomfret,Pam pus argenteus(Euphrasen)(Stromateidae),in Kuwait waters[J].Journal of Appl ied Ichthyology,2004,20(3):176-188.
[35]水戸敏,千田哲資.マナガツオの卵発生,仔魚前期および瀬戸内海における產卵について[J].日本水產学会誌,1967,33(10):948-951.
Mito S,Senta T.On the egg development and prelarvalstages of si lver pomfret with reference toits spawningin the Seto Inland Sea[J].Japanese Society of Eisheries Science,1967,33(10):948-951.
[36]赵传絪.中国海洋渔业资源[M].杭州:浙江科学技术出版社,1990:111-115.
Zhao Chuanyin.China M arine Eishery Resources[M].Hangzhou:Zhej iang Science&Technology Press,1990:111-115.
[37]Dadzie S,Abou-Seedo E,A1-Qattan E.The food and feeding habits of the si lver pomfret,Pam pus argenteus(Euphrasen),in Kuwait waters[J]. Journal of Appl ied Ichthyology,2000,16(2):61-67.
[38]钱世勤,胡雅竹.银鲳年龄和生长的研究[J].水产科技情报,1985(5):1-5.
Qian Shiqin,H u Yazhu.Research ofPam pus argenteusage and growth[J].Eisheries Science&Technology Information,1985(5):1-5.
[39]李明华.科威特开发银鲳养殖技术[J].海洋与渔业,2006(9):28-29.
Li Minghua.The development ofPam pus argenteusaquaculture technology in Kuwait[J].Ocean and Eishery,2006(9):28-29.
[40]赵峰,庄平,章龙珍,等.渤海、黄海及东海近海五个银鲳地理群体的形态变异[J].海洋学报,2011,33(1):104-110.
Zhao Eeng,Zhuang Ping,Zhang Longzhen,et al.M orphological variation ofPam pus argenteusamong five samples near the coastal area of the Bohai Sea,H uanghai Sea and East China Sea[J].Haiyang Xuebao,2011,33(1):104-110.
Investigation on otol ith microchemistry of wi ldPampus argenteus andMiichthys miiuyin the southern Yellow Sea,China
Xiong Ying1,2,Liu H ongbo3,Jiang Tao2,Liu Peiting1,Tang Jianhua1,Zhong Xiaming1,Yang Jian2,3,W u Lei1,Gao Yinsheng1
(1.M arineand Eisheries Research Institutein Jiangsu Province,N antong226007,China;2.W uxi Eisheries College,N anjing Agricultural University,W uxi214081,China;3.Key Laboratory of Eishery Ecological Environment Assessment and Resource Conservation in Middle and Lower Reaches of the Yangtze River,Ereshwater Eisheries Research Center,Chinese Academy of Eishery Sciences,W uxi214081,China)
An electron probe microanalyzer(EP M A)was used to analyze the profile of otol ith Sr and Ca microchemistry of wi ldPam pusargenteusandMiichthys miiuyin the Southern Yellow Sea,China.Results ofl ine transect analysis clearly indicated thatinter-species differencesin the otol ith Sr∶Ca concentration ratios were remarkable.In P.argenteus,the otol ith core showed low Sr/Ca ratios(5.86±0.92),while the areas around core,1-year ring and edge of otol ith presented the high Sr/Ca ratios[(7.88±1.28),(9.44±1.82)and(7.91±1.38),respectively].A moderate sal inity habitat seemed to be necessary for the hatching and early ontogenetic develop ment ofP.argenteus.H owever,in development stages of Y O Y(young ofthe year),P.argenteusmay need two phases of high sal inity habitats,one of which was at age 1 year.Eor theM.miiuy,Sr/Ca ratios(7.72±0.97)in otol ith core were higher than those in the remaining areas.The high sal inity habitat seemed to be required at the stages of hatching and post-hatching develop ment ofM.miiuy,whi le reduced sal inity habitat might be preferable for the develop ment and growth at the remaining stages of the Y O Y l ife history.
otol ith;Pam pus argenteus;Miichthys miiuy;electron probe microanalyzer;the southern Yellow Sea
Q176;S917.4
A
0253-4193(2015)02-0036-08
2014-05-17;
2014-06-23。
国家908专项(JS-908-01-01,JS-908-02-08);江苏省自然科学基金(B K20140438);江苏省研究生培养创新工程(CXZZ13_0275);江苏省科技支撑计划(BE2012422);江苏省科技基础设施建设计划(B M 2012059)。
熊瑛(1979—),女,湖北省天门市人,高级工程师,从事水生生物资源保护与利用研究。E-mai l:yxiongshfu@126.com
杨健(1965—),男,博士,研究员,主要从事渔业生态环境研究。E-mai l:j iany@ffrc.cn
